El objetivo de este estudio ha sido analizar las características clínicas de los pacientes con EPOC vistos en las consultas generales de neumología, el seguimiento de las guías clínicas y la adecuación en la categorización y en el manejo terapéutico.
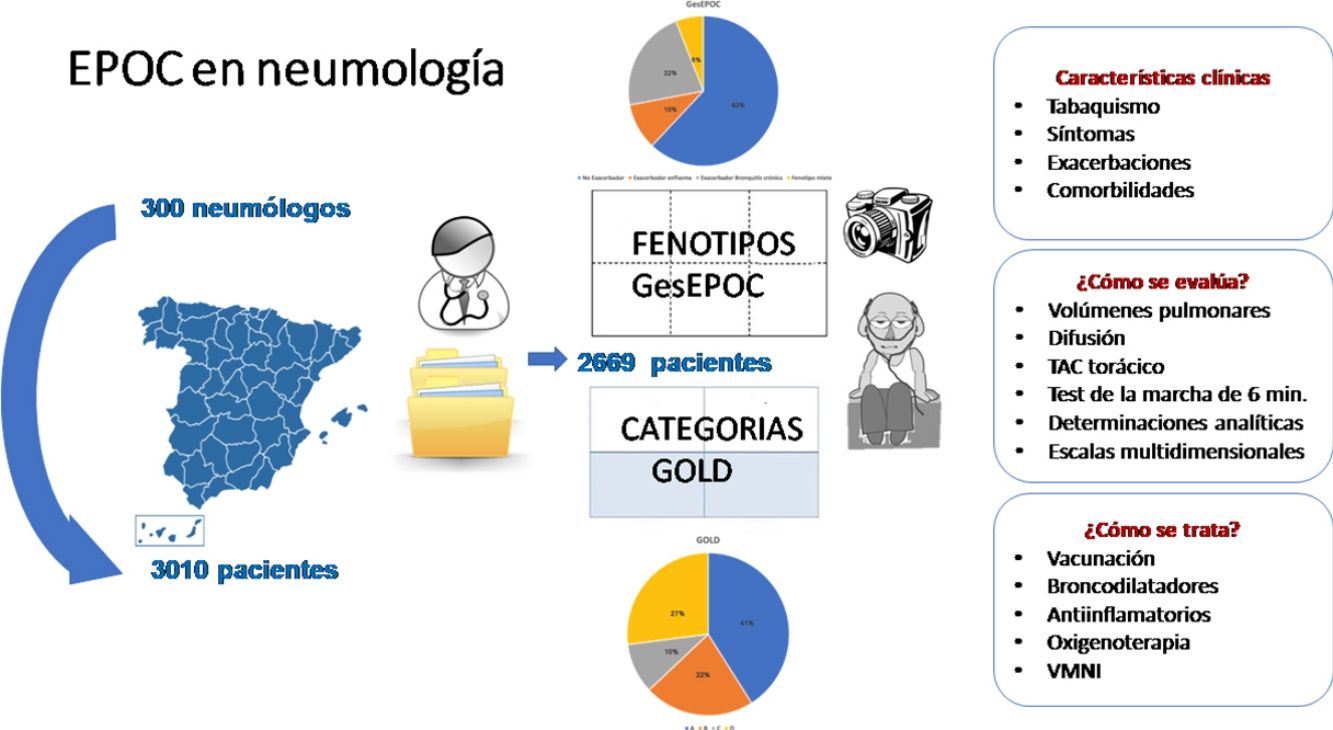
MétodoEstudio multicéntrico, transversal, cuyo objetivo primario es describir el número, intensidad y variabilidad de los síntomas en los pacientes con EPOC. La recogida de los datos fue realizada en 2015 por 300 neumólogos que evaluaron un total de 3.010 pacientes, de los cuales 2.669 (88,6%) fueron válidos para el análisis.
ResultadosEl 22% eran fumadores activos, destacando un 21 y 17% en los grupos C y D de GOLD y un 17 y 19% en los pacientes exacerbadores de GesEPOC. El 62,3% presentaba comorbilidades asociadas. En el proceso diagnóstico destaca el bajo uso de pruebas como el test de difusión o la medición de volúmenes pulmonares, incluso en los grupos más graves de GOLD o en los fenotipos exacerbadores de GesEPOC. También es minoritario el uso de escalas multidimensionales como BODE (12%) o programas específicos de rehabilitación. El tratamiento se basa en el uso de broncodilatadores y corticoides inhalados, en diferentes combinaciones. El uso de metilxantinas fue minoritario (7%).
ConclusionesEn consultas de neumología existe una elevada proporción de pacientes EPOC con baja complejidad y un escaso uso de pruebas neumológicas. Se constata un leve cambio en las pautas terapéuticas y la frecuente asociación con comorbilidades que pueden modificar la presentación clínica del paciente.
The objective of this study was to analyze the clinical characteristics of COPD patients attending general respiratory clinics, adherence to clinical guidelines, classification accuracy, and therapeutic management.
MethodMulticenter, cross-sectional study, with the primary objective of describing the number, intensity, and variability of symptoms in COPD patients. Data were collected in 2015 by 300 pulmonologists who evaluated a total of 3,010 patients, of which 2,669 (88.6%) were eligible for analysis.
ResultsA total of 22% were active smokers, notably 21% and 17% of GOLD groups C and D, and 17% and 19% of exacerbators in the GesEPOC classification; 62.3% had associated comorbidities. The diagnostic process was characterized by limited use of tests such as diffusion capacity or lung volumes, even in the more severe GOLD groups or the GesEPOC exacerbator phenotypes. The use of multidimensional scales, such as BODE (12%), and specific rehabilitation protocols was also rare. Treatment was based on different combinations of bronchodilators and inhaled corticosteroids. Methylxanthines were used in very few patients (7%).
ConclusionsA large proportion of COPD patients seen in respiratory clinics have non-complex disease and pulmonology tests are rarely performed. Our study confirms a slight change in treatments and the frequent association with comorbidities that can modify the clinical presentation of the patient.
La EPOC es una de las principales causas de morbimortalidad en nuestro medio. Actualmente sabemos que, aunque tiene un componente irreversible, un adecuado diagnóstico y tratamiento puede modificar su historia natural. De hecho, datos recientes de nuestro entorno confirman una reducción de los ingresos hospitalarios por exacerbaciones y de la mortalidad por EPOC1–3. Además, posiblemente por la disponibilidad de mejores tratamientos, es posible observar una estabilización de la función pulmonar en una elevada proporción de pacientes, rompiendo el mito de que la EPOC es una enfermedad que irremediablemente tiene una evolución progresiva4.
A pesar de estos datos favorables, han surgido mensajes de alerta sobre los problemas de calidad en el diagnóstico y tratamiento del paciente con EPOC, con pautas de diagnóstico y tratamiento que frecuentemente se alejan de las recomendaciones de las guías clínicas5,6. Por otro lado, la EPOC tiene una presentación clínica heterogénea, por lo que guías clínicas como GesEPOC7 proponen que los pacientes sean clasificados por fenotipos. Esta complejidad aumenta con la presencia de comorbilidades que modifican la expresión clínica de la enfermedad. Como resultado de esta complejidad se pueden generar situaciones que inducen una gran variabilidad en el manejo de la EPOC y que lo alejan de las recomendaciones basadas en la mejor evidencia disponible.
Aunque la EPOC suele ser manejada por diversos especialistas, en la mayoría de las áreas sanitarias, el neumólogo suele ser el médico de referencia sobre quien se sustentan las directrices clínicas del manejo de la enfermedad. Un análisis de las herramientas usadas por los especialistas en el proceso diagnóstico, de las características clínicas de los pacientes con base en los criterios actuales de clasificación, y del tratamiento en este entorno asistencial, es clave para conocer cuáles son las características de la EPOC en un entorno de vida real, pudiendo identificar áreas de mejora que ayuden a implementar planes estratégicos en diferentes áreas sanitarias.
El objetivo de este estudio ha sido analizar las características clínicas de los pacientes con EPOC vistos en las consultas de neumología, el seguimiento de las guías clínicas en el proceso diagnóstico, y la adecuación en la categorización y en el manejo terapéutico.
MétodoLos datos presentados proceden del estudio ConEPOC, estudio multicéntrico, transversal, realizado en consultas de neumología, cuyo objetivo primario es describir el número, intensidad y variabilidad de los síntomas en los pacientes con EPOC8. La recogida de los datos fue realizada en 2015 por 300 neumólogos que evaluaron un total de 3.010 pacientes, de los cuales 2.669 (88,6%) fueron válidos para el análisis.
Los investigadores participantes cumplimentaron el cuaderno de recogida de datos electrónico (CRDe), registrando la información actual y retrospectiva previamente definida. Los datos se obtuvieron de las historias clínicas de los pacientes y de los propios pacientes en la visita del estudio.
Para ser incluidos en el estudio todos los pacientes tenían que ser mayores de 40 años, fumadores o exfumadores con una historia de al menos 10 paquetes-año. En todos los casos el estudio se hizo con pacientes ambulantes, en fase estable, siendo requisito para su inclusión, además de la historia previa de tabaquismo, que tuvieran una espirometría con test broncodilatador, con un cociente FEV1/FVC menor del 70%. Los criterios de exclusión fueron la existencia de otros trastornos pulmonares crónicos, incluyendo un diagnóstico reciente de asma, o haber presentado una agudización en el mes previo a la consulta. La selección de los pacientes fue secuencial, con un total de 10 pacientes por centro. Además de recoger los datos previos de diagnóstico, estadificación y tratamiento, el investigador realizó su propia clasificación y fenotipado si este no se había realizado previamente. Los pacientes fueron clasificados siguiendo las recomendaciones de GOLD 20139, que incluía 4 grupos (A, B, C, D) en función de los síntomas, exacerbaciones durante el año previo a la consulta y función pulmonar. También se realizó la categorización siguiendo las recomendaciones de GesEPOC en función del perfil clínico del paciente: ACO, no exacerbador, exacerbador no bronquitis (enfisema) y exacerbador con bronquitis. Los síntomas se recogieron mediante cuestionarios y escalas validadas. La disnea se evaluó mediante la escala modificada del Medical Research Council (mMRC). El impacto que la EPOC tenía en el bienestar y vida diaria del paciente se evalúo con el cuestionario CAT (COPD Assessment Test). Para analizar el impacto de los síntomas nocturnos se utilizó el cuestionario del sueño (CASIS)10,11 que tiene en cuenta el efecto de los problemas respiratorios, por EPOC/asma, en el sueño durante los últimos 7 días. Los síntomas nocturnos y en las primeras horas del día se analizaron específicamente con los cuestionarios NiSCI y EM-SCI (Night-time and Early Morning Symptoms of COPD Instruments), cuyas puntuaciones van desde 0 (no síntomas) hasta 4 (síntomas muy graves)12–14.
Para evaluar la variabilidad de los síntomas, los pacientes tuvieron que completar un cuestionario que recogía la sintomatología diaria durante 7 días. Se consideró que el paciente tenía una variabilidad en su sintomatología si un síntoma nuevo aparecía o desaparecía en algún momento durante este periodo de seguimiento y se consideró que existía una variabilidad en la intensidad de los síntomas (mañana/noche) cuando 2 o más síntomas pasaban de leve/moderado a intenso/muy intenso durante el seguimiento. La variabilidad total se calculó sumando los pacientes que eran variables en síntomas y/o intensidad8. Para evaluar las exacerbaciones el criterio utilizado fue el incremento de los síntomas respiratorios que requirió un cambio en la medicación habitual a criterio del investigador durante el año previo a la inclusión en el estudio. La información fue recogida de forma retrospectiva y se clasificaron en graves las que requirieron ingreso y moderadas las que no requirieron ingreso.
Inicialmente se estimó un tamaño de la muestra de 2.400 pacientes, con un error estándar máximo del 2% para cambios en la variable principal, que fue la prevalencia y gravedad de los síntomas de la EPOC, tanto nocturnos como diurnos. Este tamaño de la muestra y la amplia distribución geográfica de los centros participantes, que incluyó todo el territorio nacional, garantizan una adecuada representatividad del manejo de la EPOC en atención especializada en España.
Para el análisis, se utilizaron pruebas de comparación de variables según la naturaleza de las mismas. Para variables cualitativas se utilizó el test de Chi-cuadrado; en el supuesto de muestras pequeñas (más de un 20% de celdas de la tabla de contingencia con frecuencia esperada inferior a 5) se utilizó el test de Fisher o la corrección de Yates según el número de categorías. Para variables continuas se realizó un test de bondad de ajuste a la distribución normal; en los casos en los que se cumplían los supuestos de normalidad, se utilizaron test paramétricos (t-test de Student o ANOVA), y test no paramétricos apropiados si las distribuciones de datos no eran normales (U de Mann-Whitney o Kruskal-Wallis). El nivel de significación que se adoptó para todas las pruebas fue de 0,05 bilateral. Todos los análisis estadísticos se realizaron con el paquete estadístico SPSS (V23). Este estudio fue diseñado e implementado de acuerdo con las directrices para una «buena práctica epidemiológica» (Guidelines for Good Pharmacoepidemiology Practices [GPP]) de la Sociedad Internacional de Farmacoepidemiología (http://www.pharmacoepi.org/resources/guidelines_08027.cfm), las directrices STROBE (Strengthening the Reporting of Observational studies in Epidemiology) (http://www.strobe-statement.org/index.php?id=available-checklists) y con los principios éticos establecidos en la Declaración de Helsinki (http://www.wma.net/en/30publications/10policies/b3/index.html).
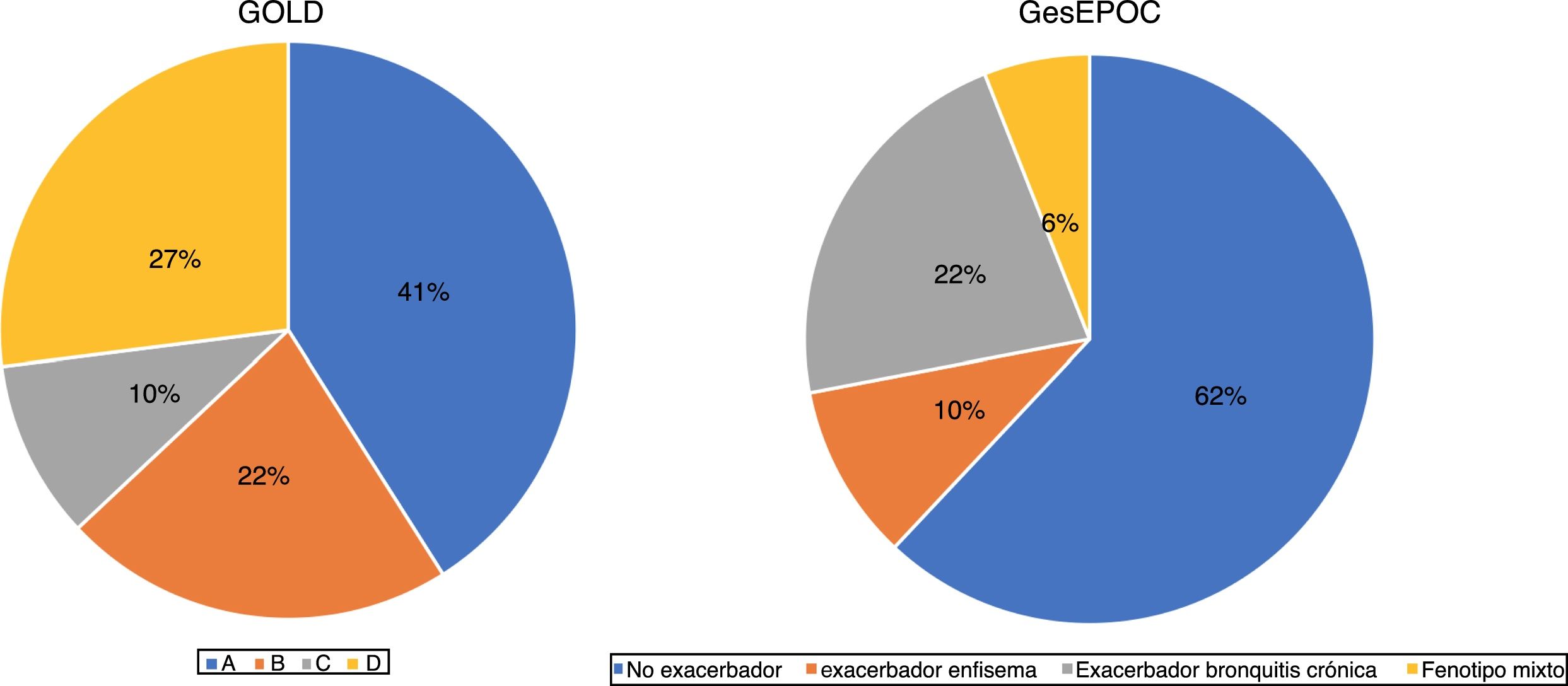
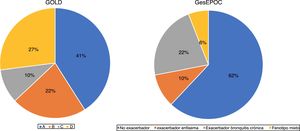
ResultadosDe un total de 3.010 pacientes, 2.669 (88.6%) fueron válidos para el análisis. El resto fue excluido por información incompleta de los cuestionarios. Un 46,9% tenía un fenotipo de GesEPOC registrado previamente al estudio, en un 94,4% de los casos determinado por un neumólogo. Aquellos que no tenían el fenotipo registrado, se pudo establecer en la mayoría de ellos en el momento de la visita, no generando ninguna duda en el 80% de los casos. El 38,5% tenía establecida una clasificación por grupos de GOLD. No se generó ninguna duda en la clasificación final en el 73% de los pacientes. Finalmente, fue posible asignar a 2.629 pacientes a un grupo según los criterios GesEPOC y GOLD (fig. 1). La clasificación GOLD se hizo por CAT en el 32% de los pacientes en el grupo A, en el 48% en el grupo B, en el 25% en el grupo C y en el 55% en el grupo D, y por mMRC en el 28, 37, 22 y 45%, respectivamente. En el resto se cumplían ambos criterios.
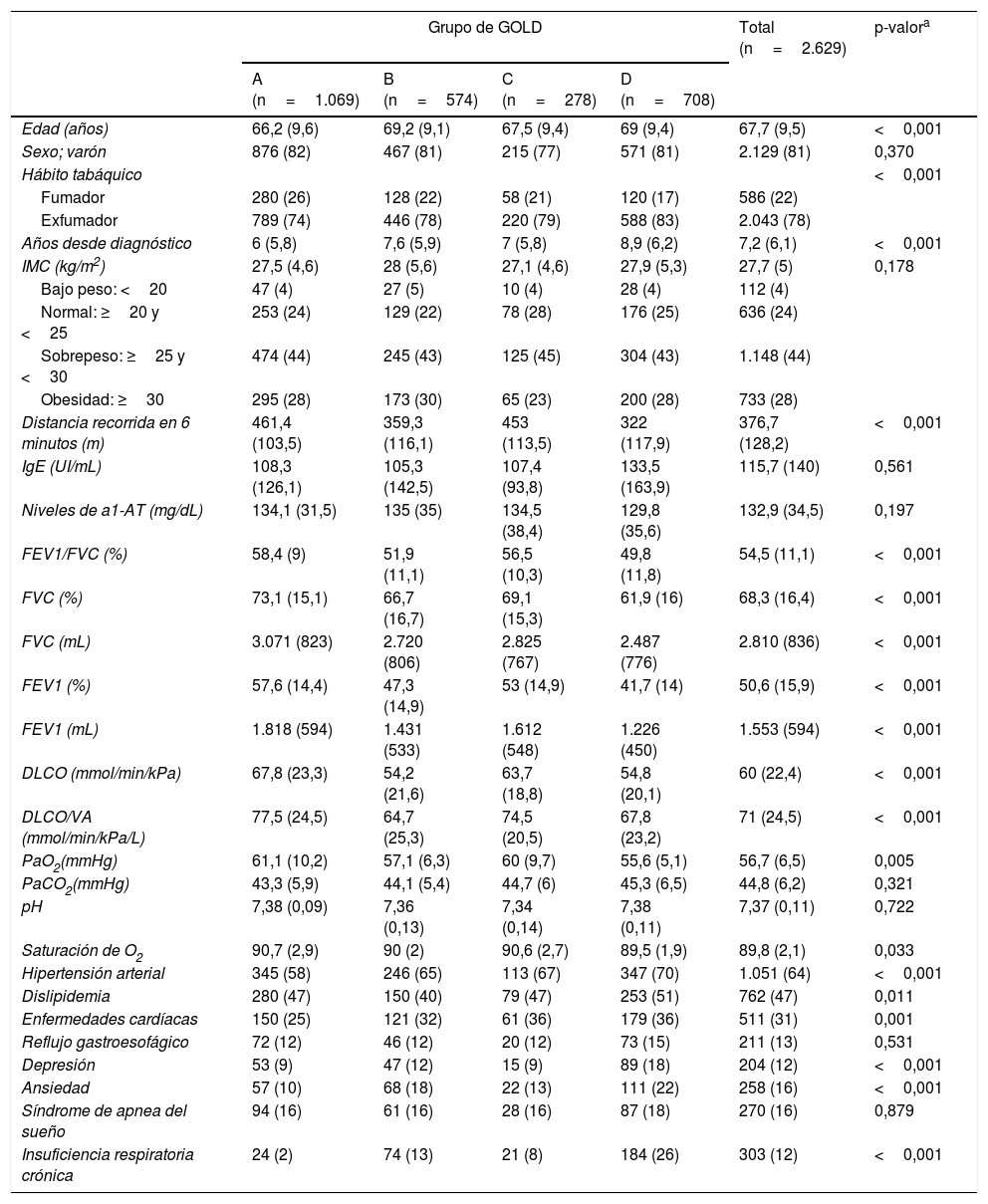
En la tabla 1 se recogen los datos demográficos, antropométricos, analíticos, funcionales y las comorbilidades más relevantes de la población estudiada, con un análisis individualizado en cada grupo de GOLD (tabla 1a) y GesEPOC (tabla 1b). Un 81% de la muestra eran varones, con una edad media de 68 años. El 22% eran fumadores activos, destacando un 21 y 17% en los grupos C y D de GOLD, respectivamente, y un 17 y 19% en los pacientes exacerbadores de GesEPOC. La mayoría presentaban peso normal o sobrepeso (IMC de 27,3) y un FEV1 promedio de alrededor del 50%. Solo el 4% de los pacientes presentaron un IMC por debajo de 20.
Características basales según el grupo GOLD
| Grupo de GOLD | Total (n=2.629) | p-valora | ||||
|---|---|---|---|---|---|---|
| A (n=1.069) | B (n=574) | C (n=278) | D (n=708) | |||
| Edad (años) | 66,2 (9,6) | 69,2 (9,1) | 67,5 (9,4) | 69 (9,4) | 67,7 (9,5) | <0,001 |
| Sexo; varón | 876 (82) | 467 (81) | 215 (77) | 571 (81) | 2.129 (81) | 0,370 |
| Hábito tabáquico | <0,001 | |||||
| Fumador | 280 (26) | 128 (22) | 58 (21) | 120 (17) | 586 (22) | |
| Exfumador | 789 (74) | 446 (78) | 220 (79) | 588 (83) | 2.043 (78) | |
| Años desde diagnóstico | 6 (5,8) | 7,6 (5,9) | 7 (5,8) | 8,9 (6,2) | 7,2 (6,1) | <0,001 |
| IMC (kg/m2) | 27,5 (4,6) | 28 (5,6) | 27,1 (4,6) | 27,9 (5,3) | 27,7 (5) | 0,178 |
| Bajo peso: <20 | 47 (4) | 27 (5) | 10 (4) | 28 (4) | 112 (4) | |
| Normal: ≥20 y <25 | 253 (24) | 129 (22) | 78 (28) | 176 (25) | 636 (24) | |
| Sobrepeso: ≥25 y <30 | 474 (44) | 245 (43) | 125 (45) | 304 (43) | 1.148 (44) | |
| Obesidad: ≥30 | 295 (28) | 173 (30) | 65 (23) | 200 (28) | 733 (28) | |
| Distancia recorrida en 6 minutos (m) | 461,4 (103,5) | 359,3 (116,1) | 453 (113,5) | 322 (117,9) | 376,7 (128,2) | <0,001 |
| IgE (UI/mL) | 108,3 (126,1) | 105,3 (142,5) | 107,4 (93,8) | 133,5 (163,9) | 115,7 (140) | 0,561 |
| Niveles de a1-AT (mg/dL) | 134,1 (31,5) | 135 (35) | 134,5 (38,4) | 129,8 (35,6) | 132,9 (34,5) | 0,197 |
| FEV1/FVC (%) | 58,4 (9) | 51,9 (11,1) | 56,5 (10,3) | 49,8 (11,8) | 54,5 (11,1) | <0,001 |
| FVC (%) | 73,1 (15,1) | 66,7 (16,7) | 69,1 (15,3) | 61,9 (16) | 68,3 (16,4) | <0,001 |
| FVC (mL) | 3.071 (823) | 2.720 (806) | 2.825 (767) | 2.487 (776) | 2.810 (836) | <0,001 |
| FEV1 (%) | 57,6 (14,4) | 47,3 (14,9) | 53 (14,9) | 41,7 (14) | 50,6 (15,9) | <0,001 |
| FEV1 (mL) | 1.818 (594) | 1.431 (533) | 1.612 (548) | 1.226 (450) | 1.553 (594) | <0,001 |
| DLCO (mmol/min/kPa) | 67,8 (23,3) | 54,2 (21,6) | 63,7 (18,8) | 54,8 (20,1) | 60 (22,4) | <0,001 |
| DLCO/VA (mmol/min/kPa/L) | 77,5 (24,5) | 64,7 (25,3) | 74,5 (20,5) | 67,8 (23,2) | 71 (24,5) | <0,001 |
| PaO2(mmHg) | 61,1 (10,2) | 57,1 (6,3) | 60 (9,7) | 55,6 (5,1) | 56,7 (6,5) | 0,005 |
| PaCO2(mmHg) | 43,3 (5,9) | 44,1 (5,4) | 44,7 (6) | 45,3 (6,5) | 44,8 (6,2) | 0,321 |
| pH | 7,38 (0,09) | 7,36 (0,13) | 7,34 (0,14) | 7,38 (0,11) | 7,37 (0,11) | 0,722 |
| Saturación de O2 | 90,7 (2,9) | 90 (2) | 90,6 (2,7) | 89,5 (1,9) | 89,8 (2,1) | 0,033 |
| Hipertensión arterial | 345 (58) | 246 (65) | 113 (67) | 347 (70) | 1.051 (64) | <0,001 |
| Dislipidemia | 280 (47) | 150 (40) | 79 (47) | 253 (51) | 762 (47) | 0,011 |
| Enfermedades cardíacas | 150 (25) | 121 (32) | 61 (36) | 179 (36) | 511 (31) | 0,001 |
| Reflujo gastroesofágico | 72 (12) | 46 (12) | 20 (12) | 73 (15) | 211 (13) | 0,531 |
| Depresión | 53 (9) | 47 (12) | 15 (9) | 89 (18) | 204 (12) | <0,001 |
| Ansiedad | 57 (10) | 68 (18) | 22 (13) | 111 (22) | 258 (16) | <0,001 |
| Síndrome de apnea del sueño | 94 (16) | 61 (16) | 28 (16) | 87 (18) | 270 (16) | 0,879 |
| Insuficiencia respiratoria crónica | 24 (2) | 74 (13) | 21 (8) | 184 (26) | 303 (12) | <0,001 |
| Tabla 1.b Características basales según fenotipo de GesEPOC | ||||||
|---|---|---|---|---|---|---|
| Fenotipo de GesEPOC | Total (n=2.628) | p-valora | ||||
| ACO (n=169) | No agudizador (n=1.639) | Agudizador bronquitis (n=567) | Agudizador no bronquitis (n=253) | |||
| Edad (años) | 66,1 (9,6) | 67,3 (9,4) | 69,3 (9,7) | 68,3 (9,1) | 67,7 (9,5) | <0,001 |
| Sexo; varón | 121 (72) | 1.338 (82) | 470 (83) | 200 (79) | 2.129 (81) | 0,007 |
| Hábito tabáquico | <0,001 | |||||
| Fumador | 38 (22) | 405 (25) | 94 (17) | 47 (19) | 584 (22) | |
| Exfumador | 131 (78) | 1.234 (75) | 473 (83) | 206 (81) | 2.044 (78) | |
| Años desde diagnóstico | 6,8 (5,8) | 6,6 (5,9) | 9 (6,1) | 8,2 (6,4) | 7,2 (6,1) | <0,001 |
| IMC (kg/m2) | 28,2 (4,8) | 27,7 (5) | 27,8 (5,4) | 27,2 (4,9) | 27,7 (5,1) | 0,116 |
| Bajo peso: <20 | 2 (1) | 75 (5) | 24 (4) | 11 (4) | 112 (4) | 0,147 |
| Normal: ≥20 y <25 | 33 (19) | 388 (24) | 147 (26) | 70 (28) | 638 (24) | |
| Sobrepeso: ≥25 y <30 | 84 (50) | 710 (43) | 233 (41) | 115 (45) | 1.142 (43) | |
| Obesidad: ≥30 | 50 (30) | 466 (28) | 163 (29) | 57 (23) | 736 (28) | |
| Distancia recorrida en 6 minutos (m) | 409,8 (94,3) | 406,4 (123,1) | 320 (119,9) | 366,1 (138,3) | 376,5 (128,2) | <0,001 |
| IgE (UI/mL) | 185,7 (186,7) | 91,2 (110,6) | 107,8 (138,8) | 105,5 (113,5) | 115,4 (139,7) | <0,001 |
| Niveles de a1-AT (mg/dL) | 126,1 (23,1) | 135,5 (33,4) | 127,4 (35,4) | 139,4 (42,7) | 133 (34,6) | 0,016 |
| FEV1/FVC (%) | 56,2 (10,3) | 55,8 (10,4) | 51,2 (11,7) | 52 (12,2) | 54,5 (11) | <0,001 |
| FVC (%) | 70,8 (14,9) | 70,6 (16) | 62,3 (16,1) | 65,3 (16) | 68,3 (16,4) | <0,001 |
| FVC (mL) | 2.850 (864) | 2.934 (830) | 2.522 (796) | 2.668 (759) | 2.813 (835) | <0,001 |
| FEV1 (%) | 54,5 (15,2) | 53,5 (15,4) | 43,1 (15) | 46,2 (14,6) | 50,6 (15,9) | <0,001 |
| FEV1 (mL) | 1.639 (615) | 1.666 (598) | 1.285 (507) | 1.391 (489) | 1.556 (593) | <0,001 |
| DLCO (mmol/min/kPa) | 71,8 (20,1) | 61,2 (23,3) | 54,9 (20,1) | 56,1 (19,2) | 60 (22,4) | <0,001 |
| DLCO/VA (mmol/min/kPa/L) | 84 (21,8) | 71,2 (25,2) | 67,6 (24,1) | 68,4 (20,1) | 71 (24,5) | 0,001 |
| PaO2(mmHg) | 58 (9,4) | 58,1 (7,6) | 56,1 (5,7) | 55,1 (4) | 56,8 (6,5) | 0,051 |
| PaCO2(mmHg) | 45,8 (5,3) | 43,7 (5,5) | 45,8 (6,4) | 44,3 (7) | 44,9 (6,2) | 0,016 |
| pH | 7,4 (0,03) | 7,36 (0,13) | 7,37 (0,11) | 7,39 (0,08) | 7,37 (0,11) | 0,498 |
| Saturación de O2 | 90,1 (2,4) | 90,2 (2,3) | 89,7 (2) | 89 (1,6) | 89,8 (2,1) | 0,018 |
| Hipertensión arterial | 64 (59) | 601 (61) | 269 (72) | 121 (70) | 1.055 (64) | <0,001 |
| Dislipidemia | 47 (43) | 437 (44) | 195 (52) | 82 (47) | 761 (46) | 0,064 |
| Enfermedades cardíacas | 31 (28) | 275 (28) | 141 (38) | 65 (37) | 512 (31) | 0,001 |
| Reflujo gastroesofágico | 14 (13) | 123 (13) | 58 (16) | 20 (11) | 215 (13) | 0,447 |
| Depresión | 13 (12) | 105 (11) | 58 (16) | 30 (17) | 206 (13) | 0,021 |
| Ansiedad | 17 (16) | 131 (13) | 72 (19) | 40 (23) | 260 (16) | 0,002 |
| Síndrome de apnea del sueño | 12 (11) | 157 (16) | 72 (19) | 31 (18) | 272 (17) | 0,178 |
| Insuficiencia respiratoria crónica | 15 (9) | 108 (7) | 132 (23) | 44 (17) | 299 (11) | <0,001 |
Datos descritos mediante media (DE) o n (%).
DLCO: capacidad de difusión de monóxido de carbono; DLCO/VA: capacidad de difusión de monóxido de carbono para volumen alveolar.
El 62,3% de los pacientes presentaban antecedentes médicos relevantes y/o patologías concomitantes actuales. La enfermedad concomitante activa más prevalente fue la hipertensión arterial, que afectaba al 40% de la muestra total, seguida de la dislipidemia (29%). En la tabla 1 se recogen las comorbilidades asociadas a la EPOC que pueden participar directamente en modular la expresión clínica del paciente. Es de destacar la elevada coexistencia de trastornos cardíacos asociados (31%), con una mayor prevalencia en los grupos más graves de GOLD (p<0,001) y los fenotipos agudizadores de GesEPOC (p<0,001).
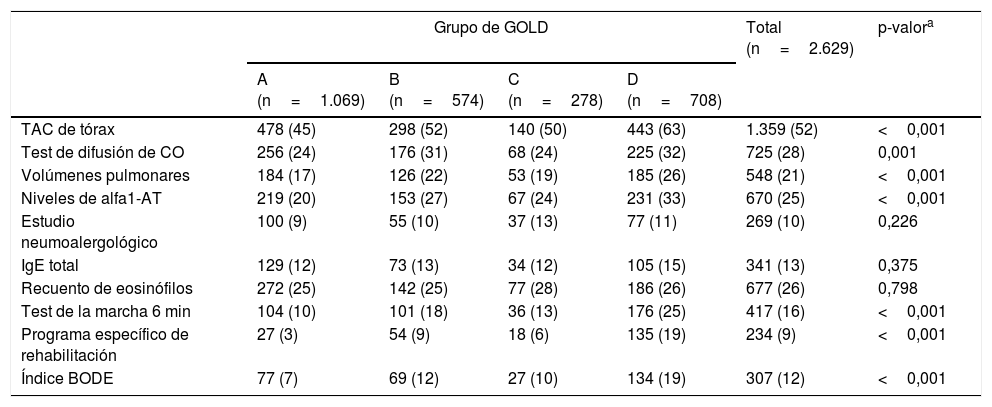
En la tabla 2 se recogen las pruebas realizadas en consultas de neumología dentro del proceso diagnóstico de la enfermedad. Destaca el bajo uso de pruebas fundamentales en la evaluación clínica de la enfermedad, como el test de difusión o la medición de volúmenes pulmonares, incluso en los grupos más graves de GOLD o en los fenotipos exacerbadores de GesEPOC. También es minoritario el uso de escalas multidimensionales como BODE (12%) o programas específicos de rehabilitación (9%), incluso en pacientes graves y/o exacerbadores. Determinaciones como la alfa1-antitripsina, que debería ser obligatoria al menos una vez en todos los pacientes, solo se realizó en el 25%.
Pruebas realizadas según el grupo GOLD
| Grupo de GOLD | Total (n=2.629) | p-valora | ||||
|---|---|---|---|---|---|---|
| A (n=1.069) | B (n=574) | C (n=278) | D (n=708) | |||
| TAC de tórax | 478 (45) | 298 (52) | 140 (50) | 443 (63) | 1.359 (52) | <0,001 |
| Test de difusión de CO | 256 (24) | 176 (31) | 68 (24) | 225 (32) | 725 (28) | 0,001 |
| Volúmenes pulmonares | 184 (17) | 126 (22) | 53 (19) | 185 (26) | 548 (21) | <0,001 |
| Niveles de alfa1-AT | 219 (20) | 153 (27) | 67 (24) | 231 (33) | 670 (25) | <0,001 |
| Estudio neumoalergológico | 100 (9) | 55 (10) | 37 (13) | 77 (11) | 269 (10) | 0,226 |
| IgE total | 129 (12) | 73 (13) | 34 (12) | 105 (15) | 341 (13) | 0,375 |
| Recuento de eosinófilos | 272 (25) | 142 (25) | 77 (28) | 186 (26) | 677 (26) | 0,798 |
| Test de la marcha 6 min | 104 (10) | 101 (18) | 36 (13) | 176 (25) | 417 (16) | <0,001 |
| Programa específico de rehabilitación | 27 (3) | 54 (9) | 18 (6) | 135 (19) | 234 (9) | <0,001 |
| Índice BODE | 77 (7) | 69 (12) | 27 (10) | 134 (19) | 307 (12) | <0,001 |
| Tabla 2.b Pruebas realizadas según el grupo GesEPOC | ||||||
|---|---|---|---|---|---|---|
| Fenotipo de GesEPOC | Total (n=2.628) | p-valora | ||||
| ACO (n=169) | No agudizador (n=1.639) | Agudizador bronquitis (n=567) | Agudizador no bronquitis (n=253) | |||
| TAC de tórax | 78 (46) | 785 (48) | 349 (62) | 148 (58) | 1.360 (52) | <0,001 |
| Test de difusión de CO | 48 (28) | 438 (27) | 158 (28) | 79 (31) | 723 (28) | 0,501 |
| Volúmenes pulmonares | 42 (25) | 317 (19) | 129 (23) | 58 (23) | 546 (21) | 0,121 |
| Niveles de alfa1-AT | 50 (30) | 372 (23) | 181 (32) | 66 (26) | 669 (25) | <0,001 |
| Estudio neumoalergológico | 77 (46) | 123 (8) | 45 (8) | 28 (11) | 273 (10) | <0,001 |
| IgE total | 71 (42) | 172 (10) | 67 (12) | 35 (14) | 345 (13) | <0,001 |
| Recuento de eosinófilos | 60 (36) | 412 (25) | 132 (23) | 70 (28) | 674 (26) | 0,012 |
| Test de la marcha 6 min | 24 (14) | 216 (13) | 122 (22) | 55 (22) | 417 (16) | <0,001 |
| Programa específico de rehabilitación | 16 (9) | 85 (5) | 95 (17) | 41 (16) | 237 (9) | <0,001 |
| Índice BODE | 20 (12) | 155 (9) | 95 (17) | 37 (15) | 307 (12) | <0,001 |
Datos descritos mediante media (DE) o n (%).
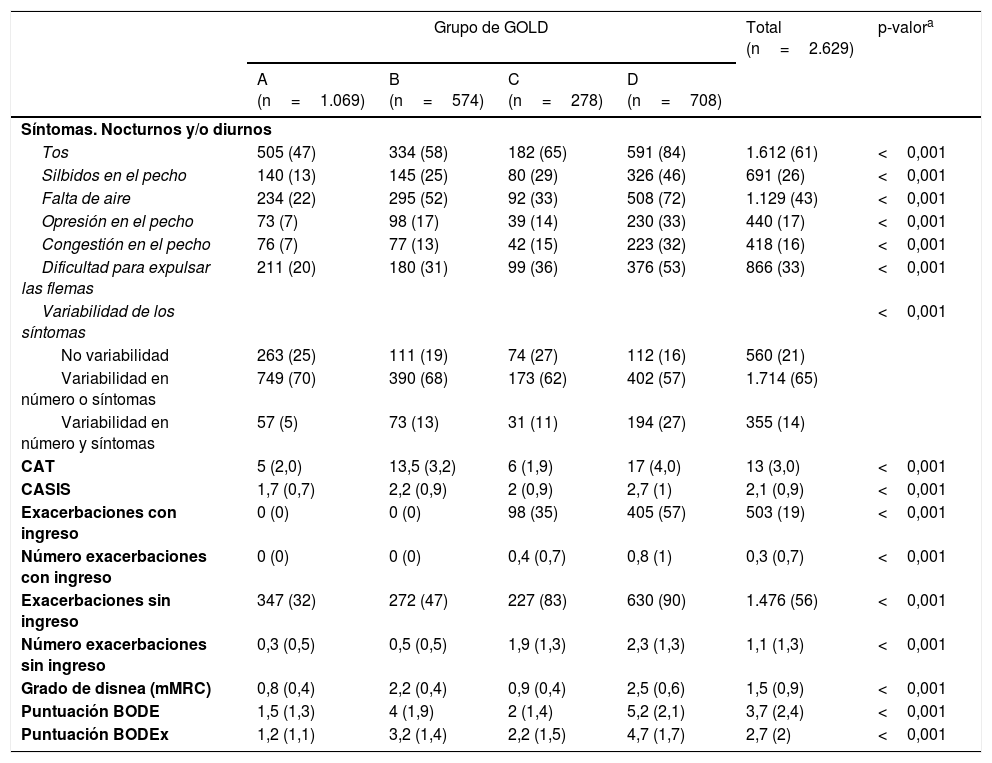
En la tabla 3 se analiza el impacto clínico (síntomas y exacerbaciones) en las diferentes poblaciones de estudio. Los pacientes de los grupos B y D de GOLD presentaron una mayor frecuencia de síntomas respiratorios y peores puntuaciones del CAT y CASIS; como era previsible (tabla 3a). En relación con los fenotipos, destacó que los pacientes más sintomáticos fueron aquellos con ACO o con un fenotipo agudizador con bronquitis crónica. También estos fenotipos presentaron puntuaciones significativamente más graves del CAT y el CASIS (tabla 3b). Algunas diferencias en exacerbaciones también son previsibles por los propios criterios usados para establecer los grupos. Destaca la baja incidencia de exacerbaciones, especialmente de las que cursan con ingreso hospitalario. De toda la muestra, solo el 34% presentó 2 o más exacerbaciones y el 19% al menos una hospitalización.
Exacerbaciones y síntomas según el grupo GOLD
| Grupo de GOLD | Total (n=2.629) | p-valora | ||||
|---|---|---|---|---|---|---|
| A (n=1.069) | B (n=574) | C (n=278) | D (n=708) | |||
| Síntomas. Nocturnos y/o diurnos | ||||||
| Tos | 505 (47) | 334 (58) | 182 (65) | 591 (84) | 1.612 (61) | <0,001 |
| Silbidos en el pecho | 140 (13) | 145 (25) | 80 (29) | 326 (46) | 691 (26) | <0,001 |
| Falta de aire | 234 (22) | 295 (52) | 92 (33) | 508 (72) | 1.129 (43) | <0,001 |
| Opresión en el pecho | 73 (7) | 98 (17) | 39 (14) | 230 (33) | 440 (17) | <0,001 |
| Congestión en el pecho | 76 (7) | 77 (13) | 42 (15) | 223 (32) | 418 (16) | <0,001 |
| Dificultad para expulsar las flemas | 211 (20) | 180 (31) | 99 (36) | 376 (53) | 866 (33) | <0,001 |
| Variabilidad de los síntomas | <0,001 | |||||
| No variabilidad | 263 (25) | 111 (19) | 74 (27) | 112 (16) | 560 (21) | |
| Variabilidad en número o síntomas | 749 (70) | 390 (68) | 173 (62) | 402 (57) | 1.714 (65) | |
| Variabilidad en número y síntomas | 57 (5) | 73 (13) | 31 (11) | 194 (27) | 355 (14) | |
| CAT | 5 (2,0) | 13,5 (3,2) | 6 (1,9) | 17 (4,0) | 13 (3,0) | <0,001 |
| CASIS | 1,7 (0,7) | 2,2 (0,9) | 2 (0,9) | 2,7 (1) | 2,1 (0,9) | <0,001 |
| Exacerbaciones con ingreso | 0 (0) | 0 (0) | 98 (35) | 405 (57) | 503 (19) | <0,001 |
| Número exacerbaciones con ingreso | 0 (0) | 0 (0) | 0,4 (0,7) | 0,8 (1) | 0,3 (0,7) | <0,001 |
| Exacerbaciones sin ingreso | 347 (32) | 272 (47) | 227 (83) | 630 (90) | 1.476 (56) | <0,001 |
| Número exacerbaciones sin ingreso | 0,3 (0,5) | 0,5 (0,5) | 1,9 (1,3) | 2,3 (1,3) | 1,1 (1,3) | <0,001 |
| Grado de disnea (mMRC) | 0,8 (0,4) | 2,2 (0,4) | 0,9 (0,4) | 2,5 (0,6) | 1,5 (0,9) | <0,001 |
| Puntuación BODE | 1,5 (1,3) | 4 (1,9) | 2 (1,4) | 5,2 (2,1) | 3,7 (2,4) | <0,001 |
| Puntuación BODEx | 1,2 (1,1) | 3,2 (1,4) | 2,2 (1,5) | 4,7 (1,7) | 2,7 (2) | <0,001 |
| Tabla 3.b Exacerbaciones y síntomas según el grupo GesEPOC | ||||||
|---|---|---|---|---|---|---|
| Fenotipo de GesEPOC | Total (n=2.628) | p-valora | ||||
| ACO (n=169) | No agudizador (n=1.639) | Agudizador bronquitis (n=567) | Agudizador no bronquitis (n=253) | |||
| Síntomas. Nocturnos y/o diurnos | ||||||
| Tos | 116 (69) | 828 (51) | 499 (88) | 162 (65) | 1.605 (61) | <0,001 |
| Silbidos en el pecho | 76 (45) | 264 (16) | 281 (50) | 68 (27) | 689 (26) | <0,001 |
| Falta de aire | 68 (40) | 527 (32) | 385 (68) | 143 (58) | 1.123 (43) | <0,001 |
| Opresión en el pecho | 34 (20) | 165 (10) | 193 (34) | 46 (19) | 438 (17) | <0,001 |
| Congestión en el pecho | 13 (8) | 159 (10) | 223 (39) | 23 (9) | 418 (16) | <0,001 |
| Dificultad para expulsar las flemas | 65 (38) | 378 (23) | 377 (66) | 45 (18) | 865 (33) | <0,001 |
| Variabilidad de los síntomas | <0,001 | |||||
| No variabilidad | 34 (20) | 382 (23) | 93 (16) | 53 (21) | 562 (21) | |
| Variabilidad en número o síntomas | 118 (70) | 1.126 (69) | 295 (52) | 173 (68) | 1.712 (65) | |
| Variabilidad en número y síntomas | 17 (10) | 131 (8) | 179 (32) | 27 (11) | 354 (13) | |
| CAT | 13 (3,1) | 10 (2,2) | 20 (4,3) | 12 (2,1) | 12 (2,0) | <0,001 |
| CASIS | 2,2 (0,9) | 1,9 (0,8) | 2,8 (1) | 2,2 (0,9) | 2,1 (0,9) | <0,001 |
| Exacerbaciones con ingreso | 34 (20) | 87 (5) | 265 (47) | 109 (43) | 495 (19) | <0,001 |
| Número exacerbaciones con ingreso | 0,3 (0,5) | 0,1 (0,2) | 0,7 (1) | 0,6 (0,9) | 0,3 (0,7) | <0,001 |
| Exacerbaciones sin ingreso | 115 (68) | 575 (35) | 554 (98) | 238 (94) | 1.482 (56) | <0,001 |
| Número exacerbaciones sin ingreso | 1,3 (1,2) | 0,4 (0,5) | 2,6 (1,2) | 2,2 (1,2) | 1,1 (1,3) | <0,001 |
| Grado de disnea (mMRC) | 1,6 (0,8) | 1,3 (0,8) | 2,2 (0,9) | 1,8 (0,9) | 1,5 (0,9) | <0,001 |
| Puntuación BODE | 2,9 (1,7) | 2,8 (2,1) | 5,2 (2,2) | 4,1 (2,3) | 3,7 (2,4) | <0,001 |
| Puntuación BODEx | 2,9 (1,7) | 1,9 (1,6) | 4,4 (2,1) | 3,5 (1,9) | 2,7 (2) | <0,001 |
CAT: COPD Assessment Test.
Datos descritos mediante media (DE) o n (%).
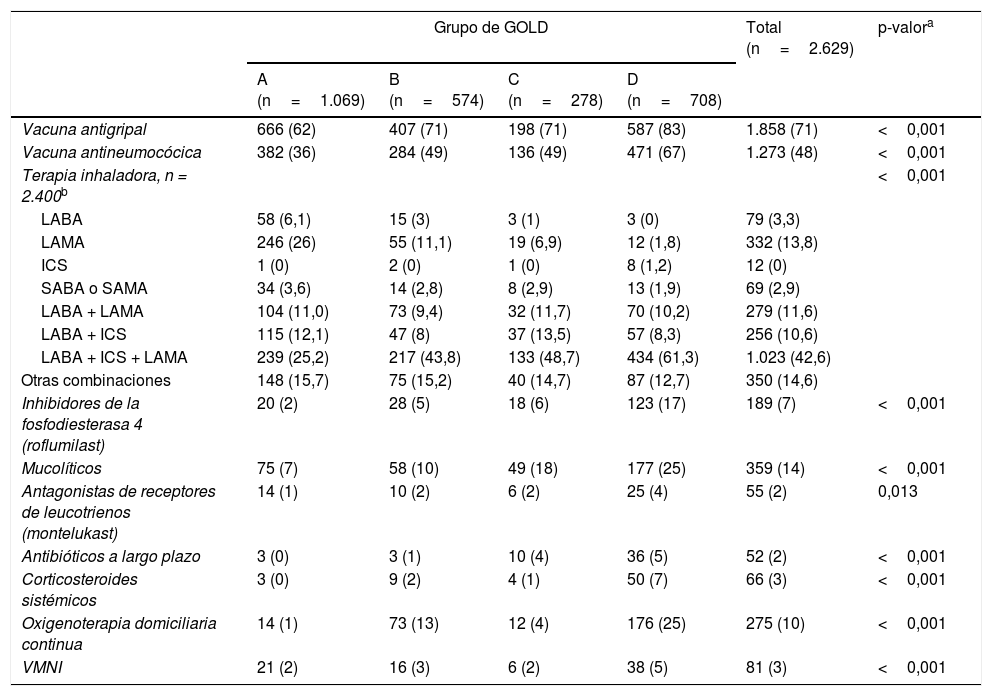
En la tabla 4 se muestran los tratamientos activos para la EPOC en el momento de la visita. Destaca una buena cobertura frente al virus de la gripe, superior al 70% en la población de estudio y superior al 80% en poblaciones de mayor riesgo. El tratamiento se basa en el uso de broncodilatadores y corticoides inhalados, en diferentes combinaciones, destacando respecto a series previas un mayor uso de LABA y LAMA en combinación fija y un menor uso de corticoides inhalados. Destaca el amplio uso de corticoides inhalados en los grupos A y B de GOLD y no exacerbador de GesEPOC.
Tratamientos según el grupo GOLD
| Grupo de GOLD | Total (n=2.629) | p-valora | ||||
|---|---|---|---|---|---|---|
| A (n=1.069) | B (n=574) | C (n=278) | D (n=708) | |||
| Vacuna antigripal | 666 (62) | 407 (71) | 198 (71) | 587 (83) | 1.858 (71) | <0,001 |
| Vacuna antineumocócica | 382 (36) | 284 (49) | 136 (49) | 471 (67) | 1.273 (48) | <0,001 |
| Terapia inhaladora, n = 2.400b | <0,001 | |||||
| LABA | 58 (6,1) | 15 (3) | 3 (1) | 3 (0) | 79 (3,3) | |
| LAMA | 246 (26) | 55 (11,1) | 19 (6,9) | 12 (1,8) | 332 (13,8) | |
| ICS | 1 (0) | 2 (0) | 1 (0) | 8 (1,2) | 12 (0) | |
| SABA o SAMA | 34 (3,6) | 14 (2,8) | 8 (2,9) | 13 (1,9) | 69 (2,9) | |
| LABA + LAMA | 104 (11,0) | 73 (9,4) | 32 (11,7) | 70 (10,2) | 279 (11,6) | |
| LABA + ICS | 115 (12,1) | 47 (8) | 37 (13,5) | 57 (8,3) | 256 (10,6) | |
| LABA + ICS + LAMA | 239 (25,2) | 217 (43,8) | 133 (48,7) | 434 (61,3) | 1.023 (42,6) | |
| Otras combinaciones | 148 (15,7) | 75 (15,2) | 40 (14,7) | 87 (12,7) | 350 (14,6) | |
| Inhibidores de la fosfodiesterasa 4 (roflumilast) | 20 (2) | 28 (5) | 18 (6) | 123 (17) | 189 (7) | <0,001 |
| Mucolíticos | 75 (7) | 58 (10) | 49 (18) | 177 (25) | 359 (14) | <0,001 |
| Antagonistas de receptores de leucotrienos (montelukast) | 14 (1) | 10 (2) | 6 (2) | 25 (4) | 55 (2) | 0,013 |
| Antibióticos a largo plazo | 3 (0) | 3 (1) | 10 (4) | 36 (5) | 52 (2) | <0,001 |
| Corticosteroides sistémicos | 3 (0) | 9 (2) | 4 (1) | 50 (7) | 66 (3) | <0,001 |
| Oxigenoterapia domiciliaria continua | 14 (1) | 73 (13) | 12 (4) | 176 (25) | 275 (10) | <0,001 |
| VMNI | 21 (2) | 16 (3) | 6 (2) | 38 (5) | 81 (3) | <0,001 |
| Tabla 4.b. Tratamientos según el grupo GesEPOC | ||||||
|---|---|---|---|---|---|---|
| Fenotipo de GesEPOC | Total (n=2.628) | p-valora | ||||
| ACO (n=169) | No agudizador (n=1.639) | Agudizador bronquitis (n=567) | Agudizador no bronquitis (n=253) | |||
| Vacuna antigripal | 132 (78) | 1.066 (65) | 469 (83) | 195 (77) | 1.862 (71) | <0,001 |
| Vacuna antineumocócica | 90 (53) | 663 (40) | 372 (66) | 148 (58) | 1.273 (48) | <0,001 |
| Terapia inhaladora, n = 2.400b | <0,001 | |||||
| LABA | 5 (2,4) | 73 (5,2) | 2 (0) | 1 (0) | 81 (3,3) | |
| LAMA | 4 (2) | 305 (21,8) | 12 (2,2) | 11 (4,5) | 332 (13,8) | |
| ICS | 0 (0) | 4 (0) | 3 (0) | 5 (2,1) | 12 (0) | |
| SABA o SAMA | 2 (0) | 50 (3) | 12 (2,1) | 4 (2) | 68 (2,8) | |
| LABA + LAMA | 11 (5,4) | 190 (13,7) | 61 (11) | 18 (7,4) | 280 (11,7) | |
| LABA + ICS | 46 (22,7) | 132 (13,5) | 46 (8,2) | 34 (14,0) | 258 (10,8) | |
| LABA + ICS + LAMA | 94 (46,5) | 452 (32,3) | 349 (62,8) | 122 (50,4) | 1.017 (42,4) | |
| Otras combinaciones | 40 (19,8) | 195 (13,9) | 70 (12,5) | 47 (19,4) | 352 (14,7) | |
| Inhibidores de la fosfodiesterasa 4 (roflumilast) | 8 (5) | 45 (3) | 106 (19) | 30 (12) | 189 (7) | <0,001 |
| Mucolíticos | 14 (8) | 136 (8) | 171 (30) | 37 (15) | 358 (14) | <0,001 |
| Antagonistas de receptores de leucotrienos (montelukast) | 33 (20) | 13 (1) | 9 (2) | 2 (1) | 57 (2) | <0,001 |
| Antibióticos a largo plazo | 1 (1) | 7 (0) | 35 (6) | 9 (4) | 52 (2) | <0,001 |
| Corticosteroides sistémicos | 10 (6) | 12 (1) | 31 (5) | 13 (5) | 66 (3) | <0,001 |
| Oxigenoterapia domiciliaria continua | 14 (8) | 97 (6) | 120 (21) | 42 (17) | 273 (10) | <0,001 |
| VMNI | 8 (5) | 38 (2) | 24 (4) | 13 (5) | 83 (3) | 0,015 |
Datos descritos mediante n (%).
ICS: corticosteroides inhalados; LABA: agonistas ß2 de acción prolongada; LAMA: anticolinérgicos de acción prolongada; SABA: agonistas ß2 de acción corta; SAMA: anticolinérgicos de acción corta.
El uso de metilxantinas fue minoritario (7%), al igual que el uso de antagonistas de los receptores de leucotrienos, que quedaron relegados en su mayoría al fenotipo ACO.
DiscusiónEste estudio transversal confirma que las características demográficas de los pacientes EPOC atendidos en consultas de neumología en España no han variado sustancialmente en la última década6. La mayoría siguen siendo varones con edades medias entre los 65 y 70 años, con sobrepeso (IMC de 27,3) y un FEV1 promedio de alrededor del 50%. Con respecto al hábito tabáquico, en nuestro estudio una historia previa de tabaquismo fue un requisito de inclusión, por lo que los resultados no pueden compararse con los comunicados en otras series en las que se incluyen pacientes con obstrucción crónica al flujo aéreo, independientemente de su historia previa de tabaquismo, y/o atendidos en diferentes niveles asistenciales15. Sí podemos destacar que en el momento de la evaluación el 22% de los pacientes seguían siendo fumadores activos, con porcentajes muy similares en los grupos más graves de GOLD o en los exacerbadores de GesEPOC. Aunque preocupantes estos datos, son notablemente mejores que los observados en un estudio reciente realizado en diferentes niveles asistenciales de España, en el que se ha descrito una prevalencia de fumadores activos en el 55% de los pacientes con EPOC. A pesar de esta discrepancia, nuestros datos son consistentes con otras series, también recientes, en las que la prevalencia de tabaquismo activo osciló alrededor del 25% en una población analizada en atención primaria y neumología16 y en consultas exclusivamente de neumología17.
Diversos estudios transversales, tanto observacionales como de casos y controles, han descrito que los pacientes con EPOC tienen una elevada prevalencia de enfermedades asociadas, habiéndose descrito la presencia de al menos una enfermedad asociada en el 88%18. Independientemente de si hay una relación causal entre la EPOC y algunas de estas comorbilidades, o si son enfermedades coincidentes, algunas en especial, no solo aumentan la complejidad y la carga económica de la enfermedad, sino que también se asocian con una mayor tasa de exacerbaciones y son un factor pronóstico de mortalidad19. Aunque las comorbilidades más frecuentes fueron la hipertensión y la dislipidemia, es necesario destacar la elevada prevalencia de cardiopatías asociadas (principalmente cardiopatía isquémica y arritmias), y ansiedad y/o depresión, especialmente en los grupos más graves de GOLD y en los exacerbadores con bronquitis crónica de GesEPOC. Es bien conocida la relevancia de las cardiopatías en los síntomas y en el riesgo del paciente con EPOC20, pero no debemos olvidar que tanto la ansiedad como la depresión, presentes en casi el 30% de los pacientes, pueden modular de forma muy relevante la expresión de la enfermedad, cuya categorización en ocasiones se realiza con escalas subjetivas. Tanto GOLD como GesEPOC basan sus clasificaciones en la presencia de exacerbaciones; sin embargo, aunque se ha descrito una relación entre reflujo gastroesofágico y exacerbaciones en nuestra serie, no hubo diferencias entre grupos.
Pese a que la mayoría de los pacientes pudieron ser estratificados y tipificados, de acuerdo tanto con GOLD como con GESEPOC, llama la atención el bajo porcentaje de pacientes cuya historia previa recogía estas características, un aspecto fundamental si tenemos en cuenta el impacto en el tratamiento que esto comporta.
Con respecto al fenotipo, casi dos tercios de los pacientes incluidos eran no agudizadores. Esta es una proporción prácticamente idéntica a la descrita con anterioridad en otras series en España11,14,21, así como en otros países22. Llama la atención el bajo porcentaje de pacientes en el grupo ACO (6,4%). Aunque se acepta que este porcentaje oscila alrededor del 15%21,23, la ausencia de criterios bien establecidos hace que, cuando no se predefinen específicamente, la variabilidad en la literatura pueda ser muy elevada24,25. Los pacientes no agudizadores presentaron una menor incidencia de síntomas y menor variabilidad. La EPOC es una enfermedad caracterizada por síntomas respiratorios crónicos; sin embargo, resultados previos de nuestro estudio demostraron que existía una gran variabilidad en la percepción de los síntomas8. En el presente análisis hemos observado que los pacientes más sintomáticos (grupos B y D de GOLD) son los que también presentan mayor variabilidad y, según los fenotipos de GesEPOC, también los pacientes agudizadores con bronquitis crónica mostraron mayor variabilidad. La relación entre intensidad de los síntomas y mayor variabilidad ha sido observada en estudios previos, que también señalaron una relación entre la variabilidad y una mayor frecuencia de agudizaciones26,27.
Un cambio muy relevante de GesEPOC en su última revisión ha sido establecer niveles de complejidad, diferenciando las recomendaciones en el primer nivel asistencial y en consultas especializadas de neumología. Parece lógico que cuando un paciente es remitido a la consulta de un especialista es porque requiere una evaluación más precisa, con un tratamiento posterior individualizado28. Esta caracterización, frecuentemente requiere de técnicas no disponibles en atención primaria. Sin embargo, en nuestro estudio, cuando los pacientes se agrupan por criterios GOLD 2013 y GesEPOC, se observa un elevado porcentaje de pacientes con EPOC de «baja complejidad» atendidos en consultas de neumología (un 41% en grupo A de GOLD y un 62% de no exacerbadores de GesEPOC). Hay que señalar, no obstante, que estudios transversales como el nuestro no permiten establecer si el paciente es poco complejo desde el inicio o ha dejado de ser complejo por un correcto manejo clínico previo.
Llama la atención el bajo uso en neumología de pruebas de gran valor clínico como el test de difusión o volúmenes pulmonares, mientras que el uso de otras pruebas sobre las que las guías clínicas han basado estrategias de actuación, como el test de la marcha de 6 minutos y el índice BODE, es marginal (16 y 15%, respectivamente). Es necesario analizar cuál es el motivo del bajo uso de estas técnicas, observar si la nueva estratificación de GesEPOC revierte esta situación o si simplemente los especialistas no perciben el valor clínico de estas exploraciones. En la misma dirección, resulta sorprendente que solo al 25% de los pacientes se les haya determinado los niveles de alfa1-antitripsina. Estos resultados coinciden con la baja frecuencia de determinación de la alfa1-antitripsina en estudios poblacionales29, a pesar de que las normativas existentes recomiendan su análisis en todos los pacientes con EPOC en al menos una ocasión7,30.
Tanto GesEPOC como GOLD recomiendan un tratamiento escalonado y ajustado a las características del paciente7,30. Durante muchos años el tratamiento de la EPOC se limitó a medidas sintomáticas. La introducción de los corticoides inhalados y otros fármacos antinflamatorios se planteó sobre la necesidad de reducir el riesgo, especialmente de exacerbaciones. Este abordaje conjunto, de síntomas y riesgo, popularizó el uso combinado de broncodilatadores y corticoides inhalados, que durante muchos años ha sido el tratamiento de base de una gran mayoría de pacientes con EPOC31. Sin embargo, datos recientes han apoyado el papel de los broncodilatadores, especialmente de los anticolinérgicos de acción prolongada, en la reducción de exacerbaciones32. Este hecho y la necesidad de optimizar el uso de corticoides inhalados, evitando dosis elevadas y seleccionando adecuadamente el paciente que más se va a beneficiar de este u otros tratamientos, actualmente más minoritarios, han creado una corriente de opinión hacia una optimización de la broncodilatación y una selección individualizada de otros tratamientos en función de su perfil clínico33. Los datos de este estudio detectan este cambio de tendencia respecto a series previas, recogidas en atención primaria de España34 o países de nuestro entorno, como Reino Unido35, aunque persistiendo un amplio uso de corticoides inhalados (53%). Hay que señalar que, de acuerdo con las recomendaciones, prácticamente el 100% de los pacientes ACO reciben tratamiento con corticoides inhalados. También debe ser destacado que, si bien existe un tratamiento escalonado, en cuanto que los pacientes más graves son los que reciben mayor tratamiento, más de un 30% de pacientes del grupo A de GOLD continúan siendo tratados con corticoides inhalados y casi el 25% reciben tratamiento con doble broncodilatación, si bien esto último es actualmente objeto de consensos.
Un hallazgo positivo de este estudio es el relacionado con el uso de medidas preventivas establecidas en las normativas sobre EPOC, que destacan de forma específica la necesidad de acometer un plan de vacunación como medida universal en todos los pacientes con EPOC. En esta serie destaca una buena cobertura frente al virus de la gripe, superior al 70% en la población de estudio y superior al 80% en poblaciones de mayor riesgo. Lo contrario ocurre con otras recomendaciones como los programas específicos de rehabilitación cuyo grado de implementación actual es muy bajo, incluso en pacientes graves.
La principal limitación de nuestro trabajo es que se trata de un estudio transversal con análisis retrospectivo de algunas variables. Cuando la calidad de los datos haya podido estar limitada por este motivo (número y tipo de exacerbaciones), la información presentada no incluye un análisis detallado. Otra limitación es la potencial variabilidad en la asignación de los grupos de pacientes, especialmente con los criterios GOLD. Poco después de publicarse la clasificación GOLD con el esquema A-D, surgieron múltiples estudios evidenciando las limitaciones de esta clasificación y las incongruencias que surgían cuando se usaban distintos criterios para evaluar los síntomas. Lo mismo ocurría en el grupo D con función pulmonar y exacerbaciones. El objetivo de nuestro estudio no es abordar este problema, por lo que la clasificación se hizo usando indistintamente los criterios establecidos por GOLD, tal como estaba recomendado en el momento del estudio. Finalmente, es necesario tener presente que la población seleccionada procede exclusivamente de pacientes vistos en consultas de neumología, por lo que los resultados no son necesariamente extrapolables a pacientes EPOC vistos en otros entornos asistenciales.
ConclusiónLos resultados de este estudio, realizado exclusivamente en consultas generales de neumología, muestran que existe una elevada proporción de pacientes no estratificados de forma previa de acuerdo con las guías, tanto GOLD como GesEPOC, a pesar de que la mayoría pudieron serlo en el contexto de estudio. Se observa también una elevada proporción de pacientes con baja complejidad tratados en dichas consultas y un escaso uso de pruebas neumológicas, más allá de la espirometría forzada. Respecto a series previas se constata un leve cambio en las pautas terapéuticas y se confirma la frecuente asociación con comorbilidades que pueden modificar la presentación clínica del paciente. Estos hallazgos permiten identificar áreas de mejora y sirven como punto de partida para conocer el impacto de las guías clínicas en el manejo de la EPOC tras su publicación.
Conflicto de interesesJosé Luis Izquierdo ha recibido remuneración por ponencias o asesoramiento de AstraZeneca, Bayer, Boehringer-Ingelheim, Chiesi, Glaxo Smith Kline, Menarini, Novartis, Pfizer, Sandoz and Teva.
Marc Miravitlles ha recibido honorarios por impartir conferencias de Boehringer Ingelheim, Chiesi, Cipla, Menarini, Rovi, Bial, CSL Behring, Grifols y Novartis; honorarios por asesoría científica de Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Bial, Gebro Pharma, CSL Behring, Laboratorios Esteve, Mereo Biopharma, Verona Pharma, pH Pharma, Novartis y Grifols, y fondos para investigación de GlaxoSmithKline and Grifols.
Cristina Esquinas asesorías y colaboraciones científicas para Bayer y conferencias para CSL Behring.
Maite Pérez es empleada de AstraZeneca.
Myriam Calle ha recibido honorarios por impartir conferencias de Boehringer Ingelheim, AstraZeneca, GlaxoSmithKline, Menarini, y Novartis, y asesoria científica de GlaxoSmithKline, Chiesi y Novartis.
José Luis López-Campos ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): Almirall, AstraZeneca, Bayer, Boehringer Ingelheim, Cantabria Pharma, Chiesi, Esteve, Faes, Ferrer, Gebro, GlaxoSmithKline, Grifols, Menarini, MSD, Novartis, Pfizer, Rovi, Teva y Takeda.
José Miguel Rodríguez González-Moro asesorías y colaboraciones científicas para Boehringer Ingelheim, GSK, Rovi, Menarini, Orión, Teva, Ferrer y Grifols.
Ciro Casanova en los últimos tres años ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicoso redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Gebro, GlaxoSmithKline, Menarini, Novartis, Rovi y Teva.
Cristóbal Esteban asesoramiento y colaboraciones científicas con AstraZeneca, Boehringer Ingelheim, Chiesi, Gebro, GlaxoSmithKline.
Pilar de Lucas no tiene conflictos de interés.