La aparición de la inmunoterapia en el tratamiento del cáncer ha revolucionado en los últimos años el manejo de algunas neoplasias, entre ellas el cáncer de pulmón1, introduciéndose progresivamente en las guías en los distintos niveles de tratamiento. El pembrolizumab es un anticuerpo monoclonal humanizado anti-PD1, aprobado en España para el tratamiento del carcinoma pulmonar de célula no pequeña, tanto en primera como segunda línea en pacientes seleccionados2, y en el melanoma metastásico. Se presenta el caso de un varón diagnosticado de melanoma metastásico, tratado con pembrolizumab, que desarrolló una reacción granulomatosa sarcoidosis-like asociada al tratamiento, un efecto adverso poco conocido y apenas descrito en la literatura.
Varón de 72 años, exfumador de 50 paquetes/año, sin antecedentes neumológicos, diagnosticado tras la exéresis de una verruga de un melanoma de extensión superficial en el miembro inferior izquierdo en 2014, con ampliación posterior de los márgenes de resección. Tras 2años libre de enfermedad, se detectaron metástasis ganglionares inguinales izquierdas, y se realizó vaciamiento ganglionar a ese nivel. Posteriormente, aparecieron adenopatías mesentéricas irresecables, por lo que se decidió iniciar tratamiento con pembrolizumab cada 3 semanas.
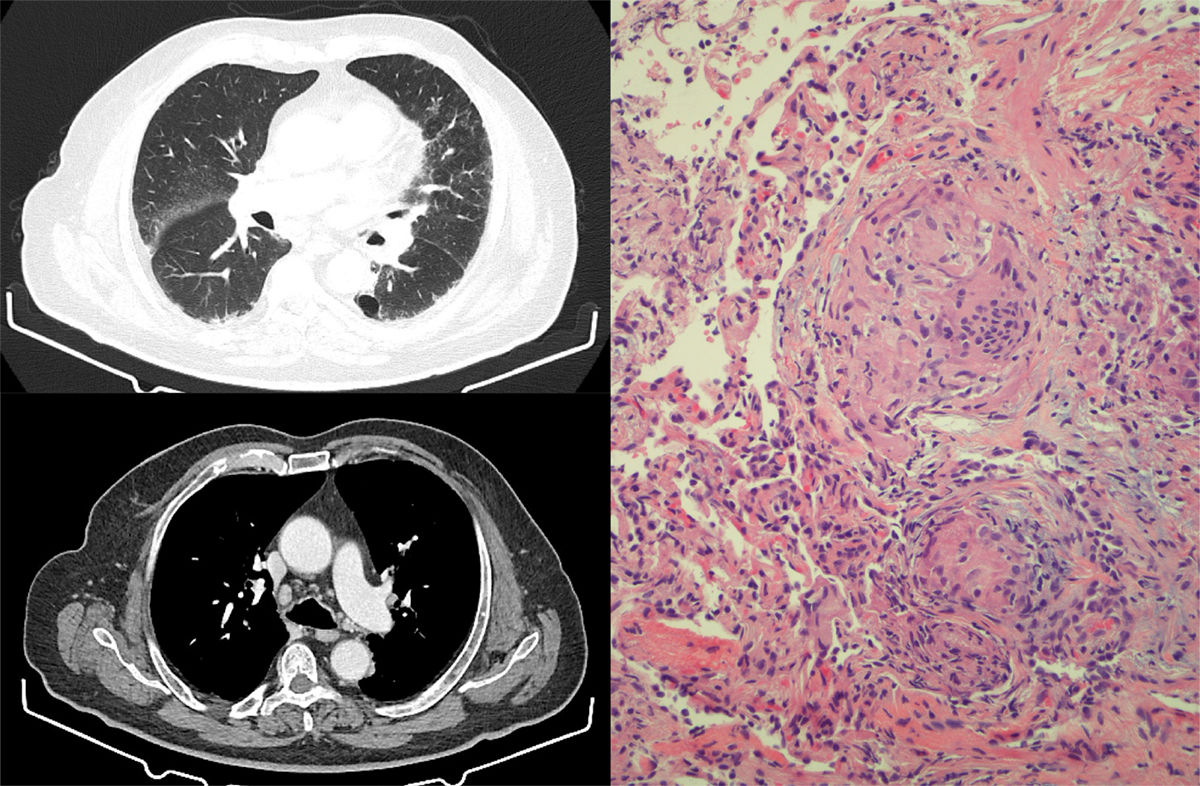
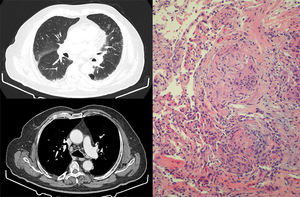
Tras 6 meses de tratamiento, con respuesta parcial de las adenopatías, se consultó con Neumología por la aparición en la TAC torácica de control de engrosamiento septal, nodulillos de predominio subpleural y alrededor de cisuras, y de adenopatías hiliares y mediastínicas de hasta 15mm, alteraciones altamente indicativas de reacción granulomatosa sarcoidosis-like (fig. 1). La TAC torácica previa al inicio del tratamiento no presentaba alteraciones en el parénquima pulmonar ni adenopatías mediastínicas.
Izquierda: cortes de TACAR torácica que muestran engrosamiento septal, con nodulillos de predominio subpleural y alrededor de cisuras. En mediastino, presencia de adenopatías hiliares y mediastínicas de hasta 15mm. Derecha: muestra de biopsia transbronquial con presencia de granulomas epitelioides no caseificantes. Se identifican células gigantes multinucleadas que se agrupan formando granulomas con escasa celularidad linfocítica acompañante. No se identifica necrosis.
El paciente permaneció en todo momento asintomático desde el punto de vista respiratorio, sin tos, disnea o fiebre, y tampoco presentó aparición de nuevas lesiones cutáneas. En la exploración destacaban crepitantes bibasales y edemas en miembros inferiores (secundarios al vaciamiento ganglionar), manteniendo una pulsioximetría basal del 95%. La enzima conversora de angiotensina era de 54 U/l y las pruebas funcionales respiratorias eran normales. Se realizó fibrobroncoscopia, sin encontrar alteraciones endobronquiales, y con lavado broncoalveolar compatible con alveolitis linfocitaria, con cociente CD4/CD8 de 1,1. Se realizaron 5 tomas de biopsia transbronquial, que mostraron granulomas epitelioides no caseificantes (fig. 1). Todos los análisis microbiológicos fueron negativos, incluyendo el análisis de micobacterias, tanto en el lavado como en las muestras de biopsia.
Ante los hallazgos radiológicos e histológicos compatibles y la correlación temporal con el tratamiento, se diagnosticó al paciente de reacción granulomatosa sarcoidosis-like con relación al pembrolizumab. Dado que el paciente se encontraba asintomático y sin afectación funcional respiratoria, se decidió conjuntamente con Oncología la suspensión del fármaco y seguimiento. En la TAC torácica al mes de la retirada del tratamiento se objetivó mejoría radiológica parcial, tanto de la afectación del parénquima como del tamaño de las adenopatías, por lo que se mantuvo la misma actitud. Tras 6 meses de la interrupción del fármaco, en la TAC de control las alteraciones radiológicas se habían resuelto casi por completo. La buena evolución únicamente suspendiendo el pembrolizumab apoya que la reacción sarcoidea estaba directamente relacionada con el tratamiento.
La inmunoterapia se define como el conjunto de tratamientos destinados a potenciar el sistema inmunológico para que sea este el que desarrolle la actividad antitumoral. Estos fármacos actúan desbloqueando vías inhibitorias clave de los linfocitos, como la del CTLA-4 o la vía PD-1/PDL-1, dando como resultado la estimulación de la actividad de los linfocitos T3. Esta activación favorecerá el ataque del sistema inmunitario contra las células tumorales, aunque también aumentará la posibilidad de reacciones contra el tejido propio. Por esta razón, los efectos adversos que se asocian a estos tratamientos están relacionados con eventos autoinmunes, siendo los más frecuentes: erupciones cutáneas, colitis, hepatopatía, neumonitis o endocrinopatías. Entre los efectos adversos respiratorios, en los ensayos se describen tos, disnea, bronquitis, neumonía organizada, ronquera, fibrosis pulmonar y el más destacado, la neumonitis, ya que es potencialmente el más grave4,5. Un metaanálisis que incluye a 653 pacientes tratados con pembrolizumab estima una frecuencia de neumonitis del 6%, describiendo 5 patrones radiológicos característicos: neumonía organizada criptogénica, vidrio deslustrado, «tipo hipersensibilidad», intersticial y no específica6.
En cuanto a las reacciones granulomatosas sarcoidosis-like, ya han sido descritas asociadas a otros tratamientos oncológicos, como el interferón alfa o el cisplatino7, o a anticuerpos monoclonales, como los antifactor de necrosis tumoral o anti-CD20. Recientemente, también han sido descritos algunos casos relacionados con la inmunoterapia. En 2008 se publicó el primer caso de reacción granulomatosa sarcoidosis-like asociada a tratamiento con ipilimumab (anti-CTLA-4) en un caso de melanoma metastásico8 y posteriormente han sido publicados otros 13 casos con este fármaco (12 en el tratamiento del melanoma y uno en adenocarcinoma de próstata). También han sido publicados 3casos asociados a nivolumab (anti-PD1), también en melanoma, el primero en 20169. Con respecto al tratamiento con pembrolizumab, únicamente se han descrito 5casos confirmados, 4en melanoma10-12 y uno en leiomiosarcoma metastásico13. Existen también 3casos publicados de reactivación de una enfermedad granulomatosa previa al iniciar tratamiento con inmunoterapia (2 con tratamiento con pembrolizumab14 y uno con una combinación de ipilimumab y nivolumab).
En cuanto al tratamiento de estas reacciones, se basa en la suspensión del fármaco y el uso de corticoides, en función del grado de afectación. Según las guías de manejo de efectos adversos inmunomediados5,15, los casos asintomáticos pueden ser manejados únicamente con monitorización estrecha, y los corticoides quedarían reservados para la aparición de síntomas o progresión, añadiendo inmunosupresores en el caso de afectación grave. En todos los casos publicados, la evolución de la afectación sarcoidea fue la regresión de las lesiones, independientemente del uso de corticoides o de la suspensión del fármaco, como sucedió en nuestro caso, que presentó resolución prácticamente completa de las alteraciones únicamente con la retirada del pembrolizumab.
En conclusión, es importante conocer la existencia de este efecto adverso, ya que, aunque actualmente existen muy pocos casos descritos, debido al auge de la inmunoterapia y al uso extendido de estos fármacos cada vez en más tipos de neoplasias, la frecuencia de este tipo de reacciones puede aumentar considerablemente en los próximos años. Además, se debe ser cauto en pacientes tratados con estos fármacos a la hora de asumir que la aparición de adenopatías mediastínicas se deba a una progresión tumoral, ya que podría tratarse de una reacción granulomatosa, por lo que el diagnóstico deberá confirmarse tomando muestras de biopsia.