Puntos clave:
- •
La demostración de una limitación al flujo aéreo no completamente reversible es imprescindible para el diagnóstico de la EPOC.
- •
Es preciso diagnosticar la EPOC en fases precoces de la enfermedad.
- •
La determinación del nivel de riesgo permite una racionalización de los recursos en la atención al paciente con EPOC.
- •
La determinación del fenotipo en pacientes de alto riesgo permite una aproximación personalizada al tratamiento.
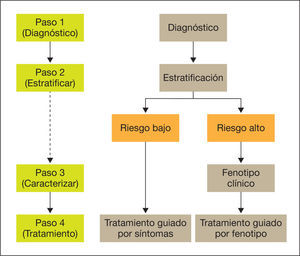
El proceso de atención inicial al paciente con EPOC debe seguir cuatro pasos:
- •
Paso 1: diagnóstico de la EPOC.
- •
Paso 2: estratificación del riesgo en bajo o alto.
- •
Paso 3: determinación del fenotipo en pacientes de alto riesgo.
- •
Paso 4: tratamiento guiado por síntomas (bajo riesgo) o por fenotipo (alto riesgo).
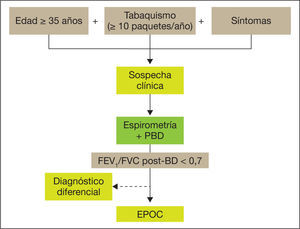
Los cuatro pasos del proceso diagnóstico se resumen en la figura 1. El diagnóstico clínico de sospecha de EPOC ha de considerarse en todas las personas adultas con exposición a factores de riesgo, básicamente el hábito tabáquico (con una exposición de al menos 10 paquetes/año) que presentan tos crónica, con o sin producción de esputo o disnea. Habitualmente el paciente con EPOC es o ha sido fumador durante un tiempo prolongado y refiere el comienzo de sus síntomas a partir de los 35 años.
Las manifestaciones clínicas de la EPOC son inespecíficas y en las etapas tempranas de la enfermedad la sintomatología puede ser mínima y la progresión e intensidad de los síntomas, muy variable en cada individuo. Con cierta frecuencia, los pacientes con EPOC pueden permanecer asintomáticos hasta estadios avanzados de la enfermedad. La presencia de tos crónica y expectoración suele preceder en varios años a la obstrucción de la vía aérea, y no todos los individuos que presenten estos síntomas acabarán desarrollando la enfermedad.
La disnea es el síntoma principal de la EPOC y el que mayor pérdida de calidad de vida produce, especialmente en los pacientes de mayor edad, aunque no todos los pacientes la aprecian de la misma forma. Aparece en fases avanzadas y es persistente, empeora con el ejercicio y se desarrolla de forma progresiva hasta limitar las actividades de la vida diaria1. Cuando se consulta por este motivo, es frecuente que ya tenga una evolución de años y que el paciente haya ido adaptándose a la limitación de sus actividades.
La tos crónica se caracterizada por su inicio insidioso, aunque más tarde aparece a diario; es de predominio matutino, suele ser productiva y puede no tener relación con el grado de obstrucción al flujo aéreo ni con la gravedad de la enfermedad.
La expectoración suele ser mucoide y, por su utilidad clínica, siempre deben valorarse sus características. Así, el cambio de color o de volumen del esputo puede ser indicativo de una exacerbación; un volumen excesivo (> 30 ml/día) sugiere la presencia de bronquiectasias, y la expectoración hemoptoica obliga a descartar otros diagnósticos: principalmente carcinoma broncopulmonar.
También pueden presentarse otros síntomas inespecíficos, como sibilancias u opresión torácica, y en los estadios avanzados de la enfermedad son comunes la pérdida de peso, la anorexia y los síntomas de depresión y ansiedad.
Se ha observado una relación estrecha entre la afectación respiratoria de la EPOC y la afectación de diversa índole en otro órganos, así como con una mayor prevalencia de diversas enfermedades crónicas —ya sean respiratorias o no— en pacientes con EPOC respecto a la población general2,3. Los diversos efectos asociados a la enfermedad que afectan a otros órganos se han denominado efectos sistémicos. Entre estos efectos sistémicos figuran como más relevantes la pérdida de peso, la disfunción muscular, la osteoporosis, la depresión y la inflamación sistémica.
La sospecha clínica debe confirmarse por medio de una espirometría forzada con prueba broncodilatadora realizada en la fase estable de la enfermedad, imprescindible para establecer el diagnóstico de EPOC (fig. 2).
EspirometríaLa espirometría forzada es la prueba que permite el diagnóstico de la EPOC, ya que define la limitación al flujo aéreo. La espirometría es una prueba no invasiva, sencilla, barata, estandarizada, reproducible y objetiva que mide la limitación al flujo aéreo. Para que los resultados tengan valor clínico, la técnica requiere unas condiciones que garanticen su calidad. Estas condiciones están bien establecidas, tanto para el instrumental como para la técnica, y es imprescindible que el profesional que la realice esté formado y entrenado4.
En el ámbito de la atención primaria (donde se atiende a la gran mayoría de los pacientes con EPOC) se debe realizar una espirometría de buena calidad, para lo cual se debe proporcionar una formación adecuada y continuada que garantice la calidad5,6.
El diagnóstico de la EPOC se basa en la disminución del flujo espiratorio, medido a través del volumen espiratorio forzado en el primer segundo (FEV1) y su cociente con la capacidad vital forzada (FVC). Se considera que existe obstrucción al flujo aéreo si al dividir el FEV1 entre la FVC tras broncodilatación el resultado es inferior a 0,7. Los objetivos de la espirometría en la evaluación inicial del paciente son la confirmación del diagnóstico de sospecha y evaluar la gravedad de la obstrucción al flujo aéreo (tabla 1).
La utilización del cociente FEV1/FVC tras broncodilatación en el diagnóstico de la EPOC comporta un riesgo de infradiagnóstico en edades jóvenes y de sobrediagnóstico en edades avanzadas7,8. Esta consideración es particularmente importante para evitar el sobrediagnóstico de EPOC en individuos de edad avanzada (> 70 años) que no tengan exposición significativa al tabaco, con síntomas respiratorios poco importantes o con un FEV1 tras broncodilatación normal7.
La prueba broncodilatadora, que consiste en repetir la espirometría después de administrar un broncodilatador de forma estandarizada, permite objetivar la reversibilidad de la obstrucción. Se considera positiva si se confirma un aumento en el FEV1 > 200 ml y al 12% del valor anterior a la broncodilatación. La reversibilidad de la obstrucción después de la prueba broncodilatadora es muy variable en la EPOC y con frecuencia se observan cambios a lo largo del tiempo. Por este motivo, en la actualidad, la existencia de una prueba broncodilatadora significativa no excluye diagnóstico de EPOC ni confirma el de asma. Los pacientes con solapamiento asma-EPOC o ACO (asthma-COPD overlap) se caracterizan, entre otros síntomas, por manifestar una gran reversibilidad de su obstrucción9.
Otras pruebas diagnósticasRadiografía simple de tóraxLa radiografía de tórax puede ser normal en la mayoría de los casos o mostrar signos de hiperinsuflación pulmonar, atenuación vascular y radiotransparencia, que sugieren la presencia de enfisema. También pueden detectarse bullas, zonas radiolucentes o signos de hipertensión arterial pulmonar. La sensibilidad para detectar la EPOC es baja (del 50% en los pacientes moderados-graves)10,11, pero una lectura sistemática de la radiografía de tórax es muy útil para la detección de enfisema12. Se debe solicitar para la valoración inicial y para descartar complicaciones: disnea inexplicada de origen brusco (neumotórax), cambio en el patrón de la tos o esputo hemoptoico (neoplasia) o sospecha de neumonía.
Tomografía computarizada de tóraxLa tomografía computarizada (TC) de tórax permite evaluar los cambios patológicos en la estructura pulmonar asociados a la EPOC y separar los diversos fenotipos de la EPOC según la contribución de la enfermedad de la vía aérea o del enfisema. La gravedad de la disnea se correlaciona con la medida cuantitativa del enfisema y con el grosor de la vía aérea en la TC; la tos y las sibilancias, con el grosor de la vía aérea13. Asimismo, las vías aéreas engrosadas también se asocian con síntomas de bronquitis crónica y agudizaciones frecuentes14. Por último, la extensión del enfisema medido por TC cuantitativa se correlaciona con la pérdida de función pulmonar15 y con mayor mortalidad16.
La TC es muy útil en el diagnóstico de los pacientes con fenotipo agudizador, ya que puede demostrar la presencia de bronquiectasias, su gravedad y extensión17. La presencia de bronquiectasias en un paciente con EPOC y agudizaciones infecciosas frecuentes implicará la necesidad de adoptar pautas de tratamiento similares a las recomendadas para pacientes con bronquiectasias de cualquier otra etiología18.
La TC de tórax es recomendable realizarla en el segundo nivel asistencial: en pacientes con fenotipo enfisema si se plantea algún tipo de tratamiento quirúrgico y en pacientes con fenotipo agudizador, ya sea enfisematoso o bronquítico crónico.
Análisis de sangreEl hemograma no suele presentar alteraciones a menos que se presenten complicaciones. La leucocitosis con neutrofilia puede aparecer en las exacerbaciones de causa infecciosa. Una leucocitosis leve puede deberse al tabaquismo activo o al tratamiento con corticosteroides. La eosinofilia puede hacer pensar en la posibilidad de un ACO, al igual que una concentración elevada de IgE. La poliglobulia es proporcional a la gravedad y a la antigüedad de la insuficiencia respiratoria. Aproximadamente un 12,6% de los varones y un 18,5% de las mujeres con EPOC pueden presentar anemia, de predominio normocítico-normo-crómico. Esta anemia se ha relacionado con la presencia de inflamación sistémica y comporta un peor pronóstico19.
En todo paciente con EPOC se determinará la concentración plasmática de alfa-1 antitripsina, al menos en una ocasión20,21.
PulsioximetríaEs la medida no invasiva de la saturación de oxígeno de la hemoglobina en sangre arterial. No sustituye a la gasometría arterial. Es útil en la valoración de la sospecha de hipoxemia, ya sea en los pacientes muy graves o en el manejo de las exacerbaciones.
Prueba de marcha de 6 minutosConsiste en que el paciente recorra la mayor distancia posible en 6 min, en terreno llano y siguiendo un protocolo estandarizado. El paciente deberá ir en compañía del examinador, quien previamente le habrá informado de las características de la prueba22. Es una prueba de referencia de la capacidad de tolerancia a esfuerzos submáximos que ha demostrado ser un buen predictor de supervivencia y de la tasa de reingresos hospitalarios por exacerbación23 y además es un componente del índice BODE.
Otras pruebas complementariasEn la tabla 2 se relacionan diversas pruebas complementarias en el estudio del paciente con EPOC.
Adecuación de las pruebas diagnósticas a los niveles de riesgo.
| Nivel de riesgo | Pruebas diagnósticas |
|---|---|
| N1: bajo riesgo | Espirometría forzada |
| Pruebas complementarias básicas: | |
| • Radiografía de tórax | |
| • Analítica básica con alfa-1 antitripsina | |
| • Saturación arterial de oxígeno | |
| N2: alto riesgo | Añadir las siguientes pruebas: |
| • Volúmenes pulmonares, DLCO | |
| • Prueba de esfuerzo: 6MWT | |
| • TC torácica | |
| Caracterización fenotípica: | |
| • Identificar fenotipo clínico | |
| Precisar riesgo pronóstico: | |
| • Índices multidimensionales: BODE o BODEx |
6MWT: prueba de marcha de 6 minutos; DLCO: capacidad de difusión del monóxido de carbono; TC: tomografía computarizada.
P3. Estrategias para reducir el infradiagnóstico y mejorar la detección precoz. ¿Qué estrategia es eficiente para mejorar la detección precoz de la EPOC?
Puntos clave:
- •
La EPOC es una enfermedad con un elevado infradiagnóstico.
- •
El infradiagnóstico suele ser superior en mujeres.
- •
Existen cuestionarios de cribado de la EPOC y herramientas como el COPD 6 o el medidor de pico de flujo que son útiles para identificar los individuos que deben realizar una espirometría diagnóstica.
Cualquiera que sea la enfermedad, la prevalencia poblacional estimada depende de la definición que se utilice para el diagnóstico. En el caso de la EPOC, históricamente se han tomado diferentes enfoques, entre los que se incluyen los siguientes: diagnóstico médico, diagnóstico basado en la presencia de síntomas respiratorios y un diagnóstico basado en la presencia de limitación al flujo aéreo (con o sin una prueba broncodilatadora). Cada uno de estos métodos producirá resultados muy diversos en el infradiagnóstico o porcentaje de individuos con una enfermedad que aún no han sido diagnosticados y sufren innecesariamente los síntomas y consecuencias de dicha enfermedad.
Recientemente, un estudio realizado con datos de atención primaria del Reino Unido concluía que existían muchas oportunidades desaprovechadas para el diagnóstico de la EPOC en atención primaria y que se podría mejorar la detección de casos en pacientes que presentan síntomas de vías respiratorias inferiores y ciertas comorbilidades entre 2 y hasta 20 años antes de su diagnóstico24. Por ejemplo, en los 2 años antes del diagnóstico, entre los 6.897 pacientes a quienes se les había realizado una radiografía de tórax, solamente a 2.296 (33%) se les había hecho también una espirometría.
Hasta el año 2000, las guías internacionales de EPOC —como las de la European Respiratory Society25— recomendaban diferentes umbrales espirométricos para definir la EPOC en la mujer: como el cociente FEV1/FVC < 88% en varones y < 89% en mujeres. Actualmente, el uso de nuevas ecuaciones de referencia específicas por sexo26 ha eliminado esta diferenciación.
Los principales factores de riesgo de la EPOC son la historia de exposición tabáquica y el envejecimiento27. En España, las proyecciones actuales indican que el envejecimiento de la población —con un especial efecto en las mujeres por su mayor longevidad— y la incorporación masiva de la mujer al hábito tabáquico que tuvo lugar entre 1960 y 1970 están ya produciendo un cambio epidemiológico y un incremento de las enfermedades crónicas asociadas al tabaco, en particular la EPOC28.
En 2007, el estudio EPI-SCAN (EPIdemiologic Study of COPD in SpAiN) determinó que la prevalencia de la EPOC en España era del 10,2% (15,1% en varones y 5,7% en mujeres) de la población de 40 a 80 años29. Anteriormente, en 1997, el estudio IBERPOC (Estudio Epidemiológico de la EPOC en España) determinó una prevalencia de EPOC del 9,1% (14,3% en varones y 3,9% en mujeres)30. En ambos estudios se utilizaron definiciones espirométricas diferentes y hubo algunas modificaciones en la metodología de muestreo31, pero en ambos se mantuvo el diferencial de la prevalencia de EPOC por sexo y se demostró una importante variabilidad geográfica de la distribución de la EPOC32.
Los determinantes del infradiagnóstico de EPOC según el sexo han recibido relativamente escasa atención hasta la fecha, pues la mayoría de iniciativas internacionales en EPOC, como el Proyecto Latinoamericano de Investigación en Obstrucción Pulmonar (PLATINO)33 y el Burden of Obstructive Lung Disease (BOLD)34, solo describen la prevalencia por sexo, sin referirse aún al infradiagnóstico o al infratratamiento.
El 78% de los participantes en IBERPOC y el 73% de los participantes en EPI-SCAN con criterios de EPOC no habían sido previamente diagnosticados35,36. En particular, según EPI-SCAN, en España la EPOC está más infradiagnosticada en mujeres que en varones y es 1,27 veces más frecuente en mujeres (86,0%) que en varones (67,6%) (p < 0,05).
En la actualidad, extrapolando las tasas de prevalencia e infradiagnóstico de EPOC a la población, se estima que entre los 21,4 millones de españoles con una edad entre 40 y 80 años hay 2.185.764 que presentan EPOC. Por sexos, las cifras corresponden a 1.571.868 varones y 628.102 mujeres. En consecuencia, puesto que el 73% de la población todavía no se ha diagnosticado, puede decirse que más de 1.595.000 españoles aún no lo saben y, por tanto, no reciben ningún tratamiento para la EPOC36. El mismo estudio identifica una importante variabilidad geográfica en el infradiagnóstico de la EPOC, aunque con un marcado predominio en mujeres.
Aunque la EPOC todavía se diagnostica clínicamente más en varones que en mujeres, debido fundamentalmente a los efectos seculares de la exposición tabáquica en la población occidental, en España se empieza a observar un cambio epidemiológico. Debido al retraso (durante el siglo xx) de hasta 20 años en la iniciación masiva de la mujer en el hábito de fumar —aunque la transición ocurrió de manera variable en diferentes países37— puede anticiparse un incremento de todas las enfermedades crónicas asociadas al envejecimiento y al consumo de tabaco, que será desproporcionalmente mayor en mujeres que en varones. La utilización de herramientas como el medidor de pico de flujo o el COPD 6 aportan mayor fiabilidad a la detección de la EPOC en fumadores, pero, en caso de no disponer de ellos, los cuestionarios de cribado pueden también proporcionar información valiosa para identificar a los individuos que precisan una espirometría diagnóstica38.
El uso e interpretación de la espirometría como herramienta para definir la EPOC es diferente a nivel poblacional que individual. Es fundamental realizar estudios epidemiológicos y espirometrías a la población para establecer la magnitud del problema y comparar la EPOC con otras enfermedades crónicas, para posteriormente asignar recursos y políticas sanitarias. A nivel clínico, un médico de atención primaria o un neumólogo, por ejemplo, exploraría cuál es la causa de una limitación al flujo aéreo (tabaquismo pasivo, otras exposiciones laborales, comorbilidades, etc.) y empezaría la tipificación de su sintomatología para diagnosticar la enfermedad y, si se da el caso, iniciar un tratamiento. Desgraciadamente, utilizando la terminología anglo-sajona, parece ser que las iniciativas epidemiológicas poblacionales —o las de búsqueda de casos en subpoblaciones de riesgo— para el cribado de EPOC hasta la fecha solo han aportado soluciones parciales al todavía elevado porcentaje de infradiagnóstico de la EPOC, que sigue siendo un problema relevante de salud pública39.
Siguiendo la propuesta de un estudio anterior de la iniciativa PLATINO40, el estudio BOLD ha ampliado recientemente la opción de utilizar el flujo espiratorio máximo (FEM) para el cribado de la EPOC. Así, en un sofisticado análisis realizado en participantes del estudio BOLD de 14 países, se proponen 2,2 l/m2/s como el umbral de FEM anterior a la broncodilatación expresado en unidades de litros por segundo por la altura en metros al cuadrado para identificar EPOC de moderada a grave41. El valor anterior se obtiene dividiendo el mejor FEM (en litros/segundo) entre la altura del individuo al cuadrado (en metros).
Se ha propuesto este umbral de 2,2 l/m2/s porque tiene la mejor sensibilidad frente al valor predictivo positivo y la mejor relación coste-beneficio entre los cinco diferentes escenarios de la combinación del FEM, cuestionarios y espirometría. En definitiva, BOLD concluye que la medición del FEM en todo el mundo —sin broncodilatación y dentro del contexto de cualquier sistema de salud— es un paso hacia adelante rápido, barato y cómodo para mejorar la detección de casos de EPOC, y sus autores recomiendan la medición y registro del FEM como un signo vital estándar, al igual que la presión arterial y el peso; aunque su efectividad real, particularmente en el ámbito de la atención primaria y sin control de calidad, todavía debe demostrarse42.
Otra opción válida es utilizar dispositivos como el medidor portátil Vitalograph-COPD 6 y el cociente FEV1/FEV6, que facilita la espirometría al no requerir la maniobra de máxima expiración forzada y su FVC, con una aceptable fiabilidad de sensibilidad y especificidad para la detección de obstrucción de la vía aérea43.
Hasta que haya más evidencia, las guías GesEPOC siguen recomendando la aplicación del cuestionario de cribado COPD-PS y la realización de la espirometría en adultos mayores de 35 años, fumadores o exfumadores con síntomas respiratorios para la detección de casos con EPOC44.
Como colofón, debe recordarse que la Estrategia en EPOC del Sistema Nacional de Salud establece en su “Objetivo general 2” los objetivos específicos de detección precoz y las recomendaciones para “mejorar el diagnóstico precoz de las personas con EPOC” (tabla 3)45.
Objetivos específicos y recomendaciones para mejorar el diagnóstico precoz de las personas con EPOC de la Estrategia en EPOC del Sistema Nacional de Salud (2009)43
| Objetivos específicos de detección precoz: |
| 2.1. Disponer en los centros de salud de los medios estructurales, materiales y organizativos adecuados para el diagnóstico de la EPOC |
| 2.2. Realizar, dentro de las actividades preventivas del adulto, la detección precoz de la EPOC dirigida a personas mayores de 40 años que presenten una historia de tabaquismo (actual o pasada) superior a los 10 paquetes/añoa (equivale a fumar 20 cigarrillos al día durante 10 años) y con síntomas respiratorios |
| 2.3. Establecer sistemas de monitorización para que las espirometrías forzadas sean accesibles y se realicen con la calidad adecuada según los criterios establecidosb |
| Recomendaciones: |
| • Realizar intervenciones dirigidas a la captación de población de riesgo, especialmente si presentan síntomas respiratorios (tos, disnea y expectoración crónicas) |
| • Realizar experiencias piloto para evaluar la eficiencia de los programas de detección precoz en personas fumadoras sin síntomas respiratorios |
| • Valorar la puesta en marcha en determinadas áreas geográficas de iniciativas alternativas tales como unidades móviles o telemedicina |
| • Disponer de criterios de derivación desde los servicios de urgencias a los centros de salud para pacientes que acuden con procesos compatibles con EPOC y que no han sido diagnosticados previamente |
| • Utilizar/fomentar el uso de sistemas de alerta informáticos que faciliten al profesional la identificación de las personas que deben ser incluidas en el cribado |
| • Incluir la detección de la EPOC en las actividades preventivas de los programas de salud laboral |
| • Los protocolos, vías clínicas o guías de actuación sobre EPOC incluirán las actividades de prevención y detección precoz |
En la actualidad se utiliza como medida de la intensidad del consumo de tabaco la unidad paquete/año, que en un solo dato da información sobre el tiempo que un fumador lleva fumando y la intensidad de su consumo durante la mayor parte de ese tiempo. Un paquete/año equivale a fumar un paquete de cigarrillos cada día desde hace un año. Ejemplo: fumador de 66 paquetes/año. Este paciente ha fumado el equivalente a 2 paquetes al día durante 33 años.
P4. ¿Cuál es el mejor sistema de estratificación del riesgo en la EPOC?
Puntos clave:
- •
La estratificación del riesgo se realizará en dos niveles de riesgo (bajo y alto).
- •
La estratificación se basa esencialmente en criterios funcionales (porcentaje de FEV1 tras broncodilatación) y clínicos (grado de disnea y exacerbaciones).
- •
El nivel de actuación diagnóstica, el plan terapéutico y el tipo de seguimiento deberán ajustarse a estos niveles de riesgo, de tal forma que para los pacientes de bajo riesgo la gestión se simplifica, mientras que para los pacientes de mayor riesgo se requiere una mayor precisión diagnóstica y plan terapéutico.
Uno de los apartados más relevantes que debe incluirse en la valoración multidimensional de la EPOC es la evaluación del riesgo. Se entiende como tal la probabilidad de que el paciente pueda presentar exacerbaciones (con o sin ingreso hospitalario), progresión de la enfermedad, futuras complicaciones, mayor consumo de recursos sanitarios o mayor mortalidad. Tradicionalmente, las guías de práctica clínica (GPC) han propuesto el uso de diversos criterios para clasificar a los pacientes según niveles de riesgo (también denominados niveles de gravedad), especialmente atendiendo al riesgo de muerte. Durante años, el criterio más utilizado fue el FEV146. Sin embargo, diversas escalas multidimensionales han demostrado ser superiores al criterio aislado de la función pulmonar no solo como factor pronóstico, sino también para identificar el riesgo de exacerbaciones y de hospitalizaciones47–50.
La anterior edición de GesEPOC44 propuso una clasificación en cinco niveles de gravedad (o de riesgo) basados esencialmente en el uso del índice BODE o, en su defecto, el índice BODEx47,48. Mientras que el fenotipo clínico servía para identificar el tratamiento más adecuado, el nivel de gravedad se propuso como una medida que guiaba la intensidad del tratamiento. Sin embargo, y a pesar de su mayor capacidad pronóstica, estos índices multidimensionales no han llegado a generalizarse en la práctica clínica51. Además, la intensidad de la intervención no solo depende del nivel de riesgo, sino que en él influyen otros determinantes del impacto clínico (concepto transversal que hace referencia a la situación actual del individuo y no al riesgo futuro)52. Entre estos determinantes destacan el grado de disnea, la tolerancia al ejercicio, el nivel de actividad física, el uso de medicación de rescate, la calidad de vida relacionada con la salud o la presencia de otras enfermedades concomitantes.
Desde una perspectiva centrada en el paciente, conviene reseñar que la EPOC es una enfermedad crónica que con frecuencia se acompaña de otras enfermedades concomitantes, lo que obliga a una aproximación integral y multidisciplinar tanto en la fase estable como durante una exacerbación grave que requiere un ingreso hospitalario. Este aspecto añade complejidad, especialmente para las organizaciones sanitarias que deben estructurar su asistencia en función de la morbilidad poblacional atendida. Esta necesidad de estratificar a la población en grupos de riesgo ha contribuido a desarrollar diversos sistemas de clasificación de pacientes. Entre los más conocidos se encuentran los ACG (adjusted clinical groups), los DCG (diagnostic cost groups) y los CRG (clinical risk groups)53. En líneas generales, estos sistemas permiten clasificar a las personas en categorías clínicas mutuamente excluyentes a partir de la información de todos los contactos en cualquier ámbito asistencial. La estratificación va unida a una valoración integral de las necesidades médicas, de cuidados funcionales y sociales de las personas, y a la planificación de intervenciones individualizadas. Se trata de ofrecer al paciente el mejor recurso disponible y por los mejores profesionales que puedan dar respuesta a sus necesidades en un momento determinado. Los servicios deben ser seguros, proporcionados a tiempo, efectivos, eficientes, equitativos y centrados en el paciente. Por ello, es necesario efectuar una evaluación multidimensional teniendo en cuenta las comorbilidades para proponer servicios ajustados al nivel de riesgo del paciente. A pesar de que estos sistemas de estratificación poblacional son de gran utilidad para organizar la asistencia de enfermedades crónicas, no son tan precisos para valorar el riesgo desde la perspectiva de cada enfermedad.
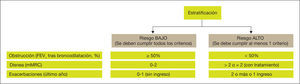
Atendiendo a la necesidad de simplificar la estratificación de riesgo y adecuar los niveles de intervención (tanto diagnóstica como terapéutica), GesEPOC propone una nueva clasificación en dos niveles de riesgo (fig. 3). Aunque la clasificación no ha sido validada prospectivamente, todos los componentes que definen al paciente de bajo riesgo quedan englobados dentro del cuartil 1 de los índices multidimensional BODE o BODEx, que sí han demostrado contrastada capacidad predictiva de riesgo47,48. A mayor nivel de riesgo, mayor será la necesidad de intervenciones diagnósticas y/o terapéuticas. Esta aproximación permite simplificar la atención para pacientes de bajo riesgo y dedicar una mayor intervención a los pacientes de alto riesgo (tablas 2 y 4). Esta clasificación de riesgo no implica derivación entre niveles asistenciales.
Adecuación del nivel de intervención asistencial a los niveles de riesgo.
| Nivel de riesgo | Intervenciones terapéuticas | |
|---|---|---|
| N1: bajo riesgo | • Deshabituación tabáquica | • Consejo |
| • Tratamiento específico | ||
| • Educación sanitaria | • Programa estructurado de educación terapéutica orientado a: | |
| – Fomentar el autocuidado | ||
| – Adherencia terapéutica | ||
| – Técnica inhalatoria | ||
| • Actividad física | • Ejercicio regular | |
| • Vacunación | • Antigripal | |
| • Antineumocócica | ||
| • Tratamiento farmacológico | • Broncodilatadores | |
| • Comorbilidad | • Tratamiento de la comorbilidad | |
| N2: alto riesgo | Añadir al tratamiento previo: | |
| • Tratamiento farmacológico | • Guiado por fenotipo | |
| • Tratamiento no farmacológico | • Rehabilitación pulmonar | |
| • Valorar oxigenoterapia continua domiciliara | ||
| • Valorar ventilación no invasiva | ||
Los factores considerados para la evaluación del riesgo son el grado de obstrucción medido por el porcentaje de FEV1 tras broncodilatación, el grado de disnea medido por la escala modificada del Medical Research Council (mMRC) y la presencia de agudizaciones. Los puntos de corte establecidos son los recomendados por la Global Initiative for Obstructive Lung Disease (GOLD)54. El punto de corte del 50% del FEV1 es el sugerido para diferenciar la EPOC con obstrucción grave-muy grave de la leve-moderada; el grado de disnea 2 o superior se considera un alto nivel de disnea en pacientes en tratamiento para su EPOC, mientras que en pacientes no tratados debe ser superior a 2; y los pacientes con dos o más agudizaciones moderadas (que requieran tratamiento con corticosteroides sistémicos y/o antibióticos) o con un ingreso hospitalario por agudización son los considerados con mayor riesgo de agudización en el futuro54.
Dentro del grupo de pacientes de alto riesgo existe un subgrupo de pacientes de alta complejidad (también denominados pacientes frágiles), definido no solo por un elevado riesgo de complicaciones, sino también por condicionantes sociales y/o funcionales que precisan una aproximación mucho más individualizada y pueden necesitar tratamientos complejos a domicilio, a través de lo que se ha venido denominando la gestión de casos55. Aunque esta aproximación es de enorme interés, las recomendaciones para una buena gestión de casos quedan fuera del objetivo de la presente GPC.
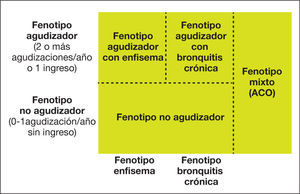
Paso 3: caracterización del fenotipoPara orientar el tratamiento más adecuado en pacientes de alto riesgo, es preciso conocer el fenotipo clínico. GesEPOC reconoce cuatro fenotipos con características clínicas, pronósticas y de respuesta al tratamiento diferentes. Estos fenotipos son: no agudizador; mixto asma-EPOC o ACO (asthma-COPD overlap); agudizador con enfisema, y agudizador con bronquitis crónica9,56.
Las denominaciones de ACO, enfisema y bronquitis crónica son excluyentes y el diagnóstico se basa en las manifestaciones clínicas predominantes y en el cumplimiento de los criterios diagnósticos. Cualquiera de estos tres tipos de pacientes puede ser un agudizador frecuente, de manera que estas características se combinan para formar los cuatro fenotipos clínicos con tratamiento diferenciado (fig. 4):
- •
Fenotipo no agudizador.
- •
Fenotipo mixto asma-EPOC o ACO.
- •
Fenotipo agudizador con enfisema.
- •
Fenotipo agudizador con bronquitis crónica.
El fenotipo no agudizador se caracteriza por presentar como máximo un episodio de agudización ambulatoria durante el año previo. Es un paciente de menor riesgo de deterioro de su calidad de vida, de pérdida de función pulmonar o de mortalidad que el agudizador y presenta unas peculiaridades en su tratamiento. Entre otros criterios, los fármacos antiinflamatorios disponibles actualmente para el tratamiento de la EPOC (corticosteroides inhalados, roflumilast y macrólidos) están indicados para pacientes con agudizaciones, por lo que no se recomienda utilizarlos en este tipo de pacientes, sean bronquíticos crónicos o enfisematosos.
Fenotipo mixto asma-EPOC o ACOLos pacientes con EPOC que presentan características de asma o cumplen a su vez criterios diagnósticos de asma se clasificarán como fenotipo mixto asma-EPOC o ACO. En el apartado anterior se ha explicado con detalle el diagnóstico de ACO. Par resumir, se puede diagnosticar de ACO a un paciente con EPOC que cumpla los criterios diagnósticos de asma según las guías actuales o que presente rasgos considerados asmáticos como tener una prueba broncodilatadora muy positiva (incremento en el FEV1 > 400 ml y 15%) y/o una eosinofilia en sangre periférica > 300 células/μl57.
Fenotipo agudizador con enfisemaLos pacientes con fenotipo agudizador tienen mayor riesgo de hospitalización y de mortalidad. Debido a la diferente respuesta a los tratamientos farmacológicos, es importante diferenciar los que tienen un fenotipo enfisematoso o bronquítico crónico.
En el primer nivel asistencial, el diagnóstico de enfisema será clínico/funcional y radiológico. Serán pacientes con escasa o sin expectoración crónica, con disnea de esfuerzo y “hábito enfisematoso” definido por tendencia a presentar bajo índice de masa corporal, debilidad muscular periférica y respiratoria, y signos de atrapamiento aéreo a la inspección o en la radiología de tórax (aplanamiento diafragmático y aumento del espacio aéreo retroesternal).
Para caracterizar mejor el enfisema en un segundo nivel asistencial nos podemos ayudar de la medición del atrapamiento aéreo mediante los volúmenes estáticos pulmonares y la prueba de transferencia de DLCO. La realización de una TC de tórax de forma habitual para diagnosticar el enfisema no suele ser necesaria y no se recomienda. En cambio, en los pacientes con enfisema será necesaria la TC de tórax cuando se piense en la posibilidad de un tratamiento quirúrgico o si presentan agudizaciones frecuentes58.
Fenotipo agudizador con bronquitis crónicaEn el caso de un paciente con fenotipo agudizador es necesario saber si coexiste con el fenotipo bronquitis crónica, por lo que preguntaremos por la presencia de tos con expectoración al menos tres meses al año durante dos años consecutivos.
En el caso de paciente de fenotipo agudizador con bronquitis crónica debemos realizar una TC de tórax de alta resolución para comprobar si el paciente tiene bronquiectasias17, ya que —como se expone en las normativas de tratamiento de las bronquiectasias— puede requerir un tratamiento diferenciado.
En pacientes agudizadores con bronquitis crónica y bronquiectasias se debe realizar un cultivo de esputo en fase estable, en especial si la expectoración es amarillenta u oscura59. Si el cultivo es positivo, se trata de una infección bronquial crónica que requiere un tratamiento específico y especializado60.
Casos de fenotipo no aclaradoPuede haber casos de difícil clasificación, que compartan características propias de más de un fenotipo. En este caso, hay que prestar atención al problema más importante para el paciente. En primer lugar, si presenta agudizaciones frecuentes se debe dirigir el tratamiento a su prevención; en segundo lugar, si presenta signos de ACO, se debe tratar el componente inflamatorio específico. En pacientes con bronquitis crónica es posible descubrir lesiones de enfisema si se realiza una TC de tórax, pero la presencia de tos con expectoración seguirá siendo el síntoma principal que clasifica a estos pacientes como fenotipo bronquitis crónica. Por otra parte, no existe tratamiento farmacológico específico para el enfisema.
¿Se puede cambiar de fenotipo?A pesar de que los fenotipos suelen ser estables, es posible que cambien su expresión espontáneamente o por acción del tratamiento (p. ej., un paciente agudizador puede dejar de presentar agudizaciones o un paciente con ACO puede dar negativo en la prueba broncodilatadora y reducirse la inflamación eosinofílica gracias al tratamiento). En los casos en que los cambios se deben al tratamiento es recomendable continuar con la misma pauta. Excepto para el caso de los corticosteroides inhalados, no hay estudios acerca de la retirada de fármacos en la EPOC estable.