La osificación pulmonar difusa es una enfermedad rara, que se caracteriza por una osificación heterotópica (OH) del parénquima pulmonar. Debido a la ausencia de síntomas específicos y a la posibilidad de infraestimar los hallazgos de la tomografía axial computarizada (TAC), el diagnóstico de la mayoría de los casos se hace durante la necropsia. Se han descrito 2 formas de osificación difusa: la nodular y la dendrítica. La osificación pulmonar nodular se explica por el estancamiento y la organización celular que se da tras un proceso congestivo como, por ejemplo, las enfermedades valvulares cardíacas, y que conduce a la formación de masas calcificadas u osificadas en el interior de los espacios alveolares. La osificación pulmonar dendriforme (OPD) se origina en los septos alveolares y se disemina hacia los espacios alveolares siguiendo un patrón denominado «dendrítico». Este tipo de osificación suele contener grasa o elementos medulares y se ha descrito mayoritariamente en pacientes que padecen enfermedades pulmonares obstructivas crónicas o alguna enfermedad pulmonar intersticial (EPI) fibrótica, siendo un signo inespecífico de una fase avanzada de la enfermedad1.
Comunicamos el caso de un paciente con fibrosis pulmonar familiar (FPF) subclínica identificado durante el programa de cribado de familiares de primer grado de pacientes con fibrosis pulmonar idiopática (FPI) con acortamiento telomérico. Se le pudo diagnosticar tras practicarle una biopsia pulmonar quirúrgica que reveló la presencia de un patrón de OPD y de neumonía intersticial usual (NIU).
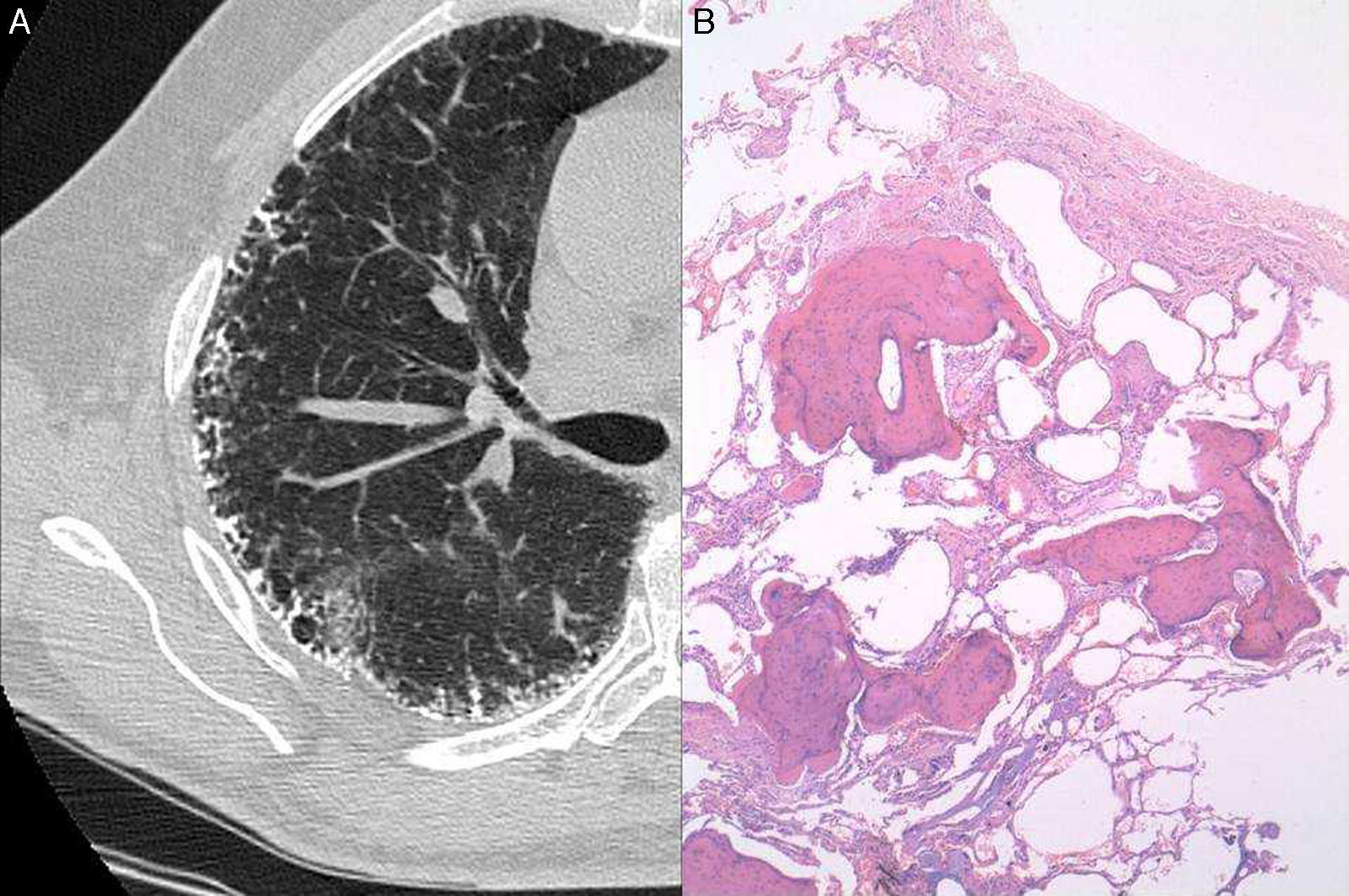
Un varón de 63 años de edad con antecedentes de tabaquismo leve, ninguna enfermedad relevante, y familiar de primer grado de un paciente con FPI, se sometió a un estudio en nuestra unidad de enfermedades pulmonares intersticiales para descartar la presencia de acortamiento telomérico. El hermano del paciente padecía FPI y se había diagnosticado acortamiento telomérico (<1%) en ambos pacientes tras el procesamiento genético de una muestra obtenida mediante frotis oral. El paciente no presentaba síntomas respiratorios y la radiografía de tórax mostró un patrón retículo-nodular periférico bilateral. Las pruebas de función pulmonar revelaron un leve patrón restrictivo, con capacidad vital forzada (FVC) de 3,83l (79%), capacidad pulmonar total (TLC) de 6,43l (85%) y coeficiente de transferencia de monóxido de carbono (KCO) de 4,82 (125%). En la prueba de la marcha de 6min no se observó desaturación de oxígeno. La analítica, que incluyó hematología, parámetros de coagulación y pruebas de función renal y hepática, fue normal. Los resultados de las precipitinas séricas para diversos antígenos comunes (aviares y fúngicos) fueron negativos, al igual que las pruebas inmunológicas, que incluyeron factor reumatoide, anticuerpos antinucleares y anticuerpos antineutrofílicos citoplasmáticos. La TAC torácica de alta resolución mostró la presencia de una calcificación profusa de las líneas reticulares (septales) (fig. 1A). El paciente se sometió a una biopsia pulmonar quirúrgica de los lóbulos superior e inferior del pulmón izquierdo. El examen histológico mostró numerosos focos de tejido óseo ramificado, en ocasiones con elementos medulares, y una marcada fibrosis del intersticio circundante con abundantes focos fibroblásticos, compatible con un patrón de OPD y NIU probable (fig. 1B).
El caso clínico se debatió tras efectuar una búsqueda en PubMed de los términos OPD y fibrosis pulmonar, hasta fecha 6 de enero de 2016, que incluyó citas publicadas entre 2003-2013.
A partir de revisiones necrópsicas, se ha estimado que la incidencia de OPD en pacientes con enfermedades respiratorias es del orden de un 0,6-1,63%, observándose, principalmente, en las últimas etapas de la EPOC y de algunas EPI1. También se ha descrito agrupación familiar en un caso de un paciente de 29 años de edad que presentó un neumotórax espontáneo, y su padre, que no presenta otros problemas de salud2. La incidencia de OPD en la EPI fibrótica parece ser alta, pero se desconoce su significación clínico-patogénica. Kim et al. efectuaron una revisión retrospectiva de 75 casos de NIU, observando una incidencia de OPD del 6,7% en TAC y muestras de biopsias pulmonares abiertas, si bien estos autores no observaron ningún caso de OPD en un grupo de 44 pacientes con neumonía intersticial inespecífica (NII), lo que sugiere que la presencia de OPD podría ser útil para diferenciar la NIU y la NII3. No obstante, la relevancia de este hallazgo para el diagnóstico diferencial continúa siendo motivo de controversia.
El presente caso demuestra que, en fases muy tempranas de la EPI fibrótica, también se puede observar OPD. La observación en la OPD de células germinales mesenquimatosas (CGM) de la médula ósea, que podrían ser una fuente de diferentes mediadores profibróticos, podría ser relevante para el desarrollo y/o la progresión de la fibrosis. A diferencia del mecanismo de formación ósea durante el desarrollo normal, que es bien conocido, la formación de hueso en lugares no habituales, en particular en los pulmones, no se conoce bien. Se cree que posiblemente no existen diferencias sustanciales entre estos 2 mecanismos, puesto que el aspecto morfológico del hueso heterotópico es el mismo que el que se observa en el esqueleto normal. En este caso, la asociación entre la FPF o FPI y la OH, apoya la teoría de un vínculo genético. Dicho vínculo ha sido descrito en función de las secuencias homólogas en los genes del factor de crecimiento transformante-β (TGF-β) y de la proteína morfogénica ósea (BMP). Otra explicación podría guardar relación con la vía de la Wnt/β-catenina, que controla la función osteoblástica y la formación de hueso, y también regula la diferenciación de las CGM en miofibroblastos y la producción de osteopontina, la cual está implicada en la inducción de la migración y la proliferación de fibroblastos y en la diferenciación de las CGM en osteoblastos4. Además, en la patogenia de la fibrosis pulmonar también podrían estar involucradas las recientemente descritas CGM progenitoras, que expresan el transportador de glutamato y aspartato (GLAST), y que han demostrado ser uno de los principales contribuidores de la OH5.
Uno de los focos actuales del debate entre los médicos especialistas en EPI es la necesidad de efectuar biopsias pulmonares a los pacientes con FPF, en particular en los casos subclínicos. El presente caso ejemplifica que la biopsia pulmonar permite precisar el diagnóstico final del paciente desde las etapas iniciales de la enfermedad, y puede revelar hallazgos histológicos interesantes que aportan información relevante para comprender mejor el proceso patogénico de la fibrosis pulmonar.
Para concluir, este caso sugiere que la OH podría estar involucrada en la progresión del proceso fibrótico pulmonar, en lugar de ser una consecuencia de dicho proceso. La cuestión radica en conocer la patogenia de la fibrosis heterogénea para poder identificar los objetivos terapéuticos apropiados para los diferentes casos de FPI o FPF.