Introducción
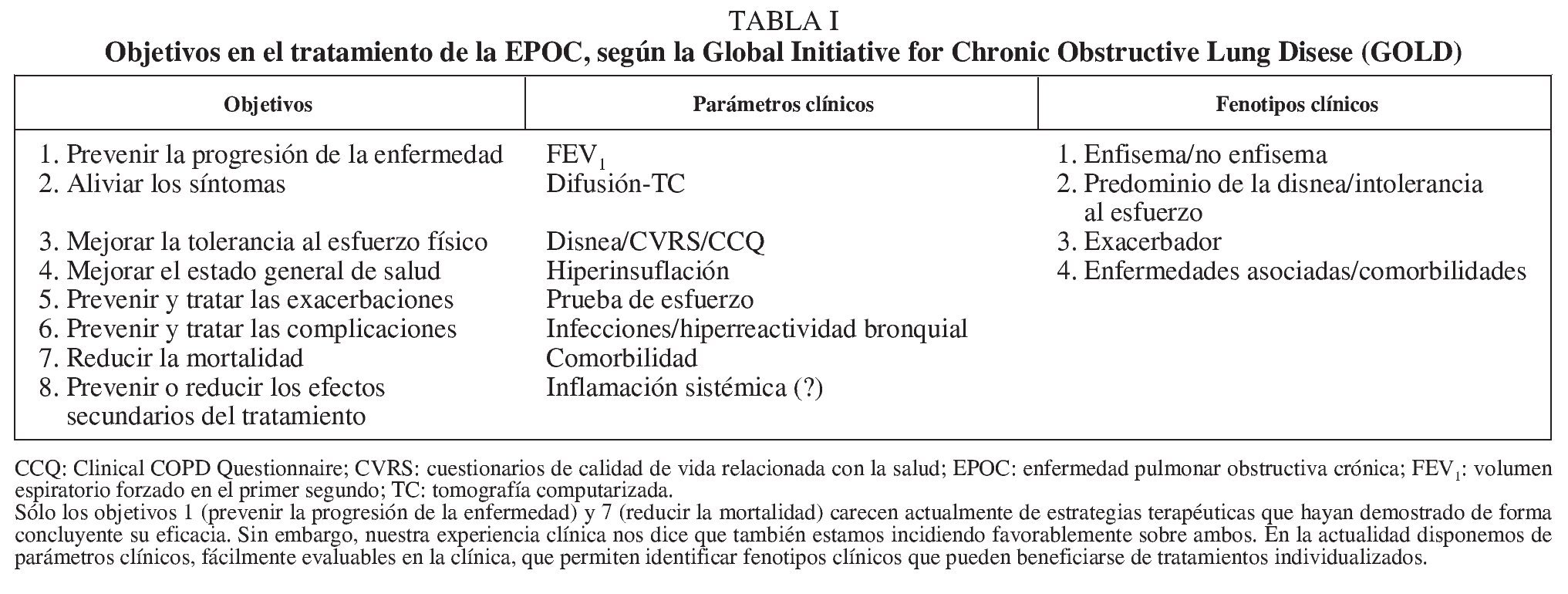
Durante décadas sólo se ha prestado atención al paciente con enfermedad pulmonar obstructiva crónica (EPOC) cuando presentaba síntomas. Incluso en estos casos, el primer objetivo del tratamiento no se ha centrado en el paciente, sino que hemos asistido a prácticas cuya obsesión era mejorar la función respiratoria, valorada de forma casi exclusiva con el volumen espiratorio forzado en el primer segundo (FEV1). Más recientemente se ha producido un importante salto cualitativo, ya que los nuevos enfoques terapéuticos, sin abandonar el FEV1, tienen en cuenta otros aspectos de la mecánica respiratoria, variables clínicas como la disnea y las exacerbaciones, el grado de tolerancia al esfuerzo y el impacto de la enfermedad y del tratamiento en la calidad de vida. Este cambio conceptual nos ha hecho pensar que, para obtener el mayor beneficio posible en un determinado paciente, puede ser necesario actuar sobre objetivos aparentemente no relacionados entre sí, algunos de los cuales ha enumerado recientemente la Global Initiative for Chronic Obstructive Lung Disease (GOLD) (tabla I)1.
Al definir la EPOC como un trastorno prevenible y tratable2, parece lógico pensar que el diagnóstico debe realizarse en las fases iniciales de su historia natural y que debería actuarse lo antes posible sobre todos los trastornos cuyo tratamiento tenga un impacto positivo en el paciente. Para poder aplicar este planteamiento en la práctica clínica, antes es necesario disponer de parámetros que nos permitan detectar y cuantificar de forma objetiva todos los efectos nocivos de la enfermedad y el impacto de nuestras intervenciones no sólo en los síntomas, sino también en la progresión de la enfermedad y en su mortalidad.
¿Cuál es el estándar actual en la valoración clínica de la EPOC?
Síntomas
Los síntomas (tos, expectoración y disnea) y signos de la EPOC son inespecíficos y comunes a otras enfermedades tanto respiratorias como no respiratorias, por lo que tienen escasa sensibilidad para realizar el diagnóstico y establecer la gravedad. La disnea limita las actividades que requieren esfuerzo físico y, cuando es intensa, produce incapacidad funcional, hasta el punto de que la disnea de esfuerzo es el parámetro que mejor se relaciona de forma individual con la percepción de la calidad de vida3. Además, en la EPOC es, en sí misma, un determinante independiente de la mortalidad4. Este síntoma siempre está presente en etapas avanzadas de la enfermedad y su carácter incapacitante hace que una de las principales finalidades del tratamiento farmacológico y rehabilitador sea buscar estrategias para aliviarla. La cuantificación de la disnea debe figurar en la valoración clínica de cualquier paciente con EPOC. Aunque se trata de una sensación subjetiva, puede estimarse mediante escalas o cuestionarios específicos que pueden ser unidimensionales (la del Medical Research Council, analógicas visuales, etc.) o multidimensionales. Los multidimensionales, como el índice basal/transicional de disnea de Mahler, analizan la disnea desde una triple óptica: dificultad de la tarea, magnitud del esfuerzo y deterioro funcional5.
Capacidad de ejercicio
La tolerancia al esfuerzo depende no sólo del sistema cardiorrespiratorio, sino también del grado de afectación muscular. Actualmente se da por supuesto que la EPOC no es sólo una enfermedad limitada a los pulmones, sino que tiene un componente sistémico6. Las complicaciones musculoesqueléticas están entre ellas, y el descenso de la capacidad de ejercicio es actualmente un marcador del pronóstico de la EPOC. La capacidad máxima de ejercicio se reduce con el descenso funcional de la EPOC, pero no existe una buena relación con el FEV1. La prueba de la marcha de 6 min es útil en la EPOC con sospecha de desaturación al ejercicio y permite conocer la tolerancia al ejercicio del paciente. Esta tolerancia al esfuerzo será clave, ya que de ella dependerá que el paciente esté o no limitado en múltiples actividades de la vida diaria. La ergometría respiratoria con medida del consumo de oxígeno (pruebas de ejercicio submáximo) es útil en los programas de rehabilitación, en la valoración del riesgo quirúrgico y en el estudio de la disnea7,8.
Función respiratoria
Las principales guías clínicas definen la EPOC con criterios funcionales, por la existencia de un cociente FEV1/capacidad vital forzada tras la administración de broncodilatador inferior al 70%. La espirometría debe realizarse siempre tras la broncodilatación, pero es necesario saber que, salvo que se normalice la función pulmonar, la prueba broncodilatadora estándar no permite establecer el diagnóstico diferencial con el asma. Además, esta prueba carece de valor pronóstico y no debe servir como referencia para introducir o retirar un tratamiento broncodilatador o antiinflamatorio.
El valor del FEV1 posbroncodilatador, expresado como porcentaje del valor de referencia, es el mejor indicador de la gravedad de la obstrucción al flujo aéreo9. En los años setenta del siglo pasado Fletcher y Peto publicaron una estimación de la supervivencia de la EPOC basada en la reducción del FEV1. Desde entonces el descenso anual del valor del FEV1 ha constituido una referencia estándar en la valoración de la progresión de la enfermedad. Posteriormente esta estimación se confirmó en un estudio multicéntrico realizado por el Instituto de Salud de EE.UU. con casi 6.000 fumadores, de entre 35 y 60 años de edad, diagnosticados de EPOC por espirometría y seguidos de forma prospectiva durante 14,5 años10,11. A través de estas series sabemos que el descenso anual del FEV1 es de 20-30 ml/año en personas sanas y que puede llegar hasta 60-100 ml/año en pacientes con EPOC. Dejar de fumar conlleva un menor deterioro de la función pulmonar.
Para que un adulto tenga una función pulmonar normal hay que evitar una pérdida acelerada de ésta, pero también es importante alcanzar los valores normales tras el período de desarrollo del pulmón. Analizándolo desde esta perspectiva, Anthonisen et al12 demostraron que es importante la tasa de descenso anual del FEV1, pero también el valor inicial de partida, ya que está claramente relacionado con la función pulmonar que un paciente tiene después en la edad adulta. Todo esto es relevante, pues los pacientes con peores valores de FEV1 tienen mayor mortalidad.
Implicaciones clínicas: disnea, volumen espiratorio forzado en el primer segundo, ejercicio y calidad de vida
Como ya se ha comentado, las diferentes guías clínicas establecen una clasificación de la EPOC según los valores del FEV1 posbroncodilatador9. Sin embargo, en muchos casos esta clasificación estrictamente funcional no refleja de manera adecuada el deterioro clínico de los pacientes. Desde las fases iniciales de la EPOC, la caída del FEV1 puede condicionar disnea y deterioro de la calidad de vida del paciente. No obstante, es a partir de un valor por debajo del 50% cuando se detecta un mayor descenso en las puntuaciones obtenidas en los cuestionarios de calidad de vida y de disnea13,14.
La disnea es capaz de afectar a todas las dimensiones que se valoran en los cuestionarios de calidad de vida, ya que afecta al bienestar físico, mental y social del individuo15. Tanto la disnea como la fatiga muscular van a condicionar una escasa utilización de la musculatura esquelética (desentrenamiento), que introduce al paciente en un círculo vicioso, agravado ocasionalmente por las exacerbaciones. Por otro lado, las exacerbaciones, complicaciones y comorbilidades son causa de una elevada demanda de los servicios de salud y de hospitalizaciones. Esto lleva al paciente a una disminución de su autoestima y a problemas en el mundo familiar y laboral.
Dado que la disnea es el principal síntoma que afecta al estado de salud del paciente con EPOC y que varía considerablemente para un mismo grado de obstrucción al flujo aéreo, se han desarrollado otras medidas que intentan obtener, de forma objetiva, una valoración global del impacto de la enfermedad en el paciente. Con este fin se han elaborado diversos cuestionarios de calidad de vida relacionada con la salud, que pueden ser genéricos o específicos para la EPOC. Por múltiples razones, en la práctica su uso ha quedado limitado a ensayos clínicos y a estudios de poblaciones, pues su aplicabilidad clínica es limitada15.
Para simplificar esta valoración y evaluar la carga de la EPOC desde el punto de vista del paciente se ha desarrollado y validado el Clinical COPD Questionnaire (CCQ). Este cuestionario consta de 10 apartados agrupados en 3 dominios (síntomas, estado funcional y estado mental). Su principal ventaja frente a los cuestionarios de calidad de vida es que depende menos del entorno del paciente, que es autoadministrado y que puede rellenarse fácilmente en 2 min16,17.
¿Debemos cambiar nuestra forma de valorar al paciente con EPOC?
Uno de los principales retos a corto plazo en el manejo de la EPOC será la identificación de fenotipos diferentes que puedan beneficiarse de pautas terapéuticas más adaptadas a las características de cada paciente. Desde el punto de clínico hay varias áreas de trabajo que pueden aportar información en este sentido.
Función pulmonar
Hiperinsuflación. Aunque frecuentemente se equipara a atrapamiento aéreo (aumento del cociente volumen residual/capacidad pulmonar total), la hiperinsuflación refleja un incremento de la capacidad residual funcional, que puede ser mayor o menor dependiendo de los flujos espiratorios del paciente (dinámica) o manifestarse en reposo (estática). La medición de los volúmenes pulmonares es imprescindible para valorar el grado de hiperinsuflación y/o atrapamiento aéreo, hallazgos que guardan una buena relación con la disnea y la limitación al esfuerzo. El principal inconveniente es que su variabilidad entre centros puede ser elevada y sólo puede realizarse en un laboratorio de función pulmonar. Para superar esta limitación puede determinarse la capacidad inspiratoria, que permite valorar de forma sencilla el grado de hiperinsuflación pulmonar tanto en reposo como en el ejercicio18.
Recientemente se ha publicado que el cociente entre la capacidad inspiratoria y la capacidad pulmonar total tiene un valor predictivo independiente de mortalidad. Tomando como valor de referencia el 25%, por debajo de éste la mortalidad es claramente mayor. Además, permite valorar la respuesta al tratamiento al margen de las variaciones en el FEV119,20.
Test de difusión de monóxido de carbono. El test de transferencia para el monóxido de carbono es el parámetro de función pulmonar que mejor se ha correlacionado con la gravedad del enfisema pulmonar. En la clínica ayuda a identificar la presencia de cambios destructivos en el parénquima, mejorando la caracterización fenotípica de la enfermedad21, lo cual puede ser útil a la hora de predecir el grado de respuesta a diferentes fármacos22 o el grado de tolerancia al esfuerzo. Apoyando este concepto, diversos estudios han descrito peores resultados en las pruebas de broncodilatación si los pacientes presentan valores reducidos de difusión, aunque la presencia de lesiones muy heterogéneas entre pacientes hace difícil predecir respuestas individuales23,24.
Desafortunadamente, el test de difusión, además de no diferenciar el tipo de lesión parenquimatosa, tiene una serie de limitaciones a la hora de evaluar la presencia de enfisema, ya que analiza de forma global todo el pulmón, mientras que las técnicas de imagen como la tomografía computarizada (TC) son capaces de detectar cambios destructivos localizados. Sin embargo, esto no significa que la utilidad clínica de la TC (excluyendo la valoración de pacientes para cirugía de reducción de volumen) sea superior a la del test de difusión. Otra limitación, como ocurría con la medición de la hiperinsuflación, es el problema de reproducibilidad, especialmente cuando la determinación se realiza en laboratorios diferentes.
Gasometría arterial. Permite conocer la existencia de insuficiencia respiratoria. Para un mismo valor de FEV1, la presencia de insuficiencia respiratoria modifica el grado de gravedad y en muchos casos suele ser el dato que alerta sobre la presencia de otra enfermedad asociada que puede requerir un enfoque terapéutico diferenciado25.
Estudios de imagen
Las técnicas radiológicas forman parte de una valoración complementaria del paciente, pero nunca deben usarse para establecer el diagnóstico. La radiografía convencional de tórax proporciona una escasa resolución en los detalles del parénquima pulmonar, el cual, a capacidad pulmonar total, sólo constituye el 10%, siendo el 90% restante aire. La atenuación vascular y la evidencia de atrapamiento aéreo son datos difíciles de valorar, especialmente si se presentan de forma difusa en ambos campos pulmonares, sin que se alcancen una especificidad y sensibilidad suficientes para diferenciar el enfisema de otras entidades que cursan con limitación al flujo aéreo.
La TC permite detectar el enfisema con mejores sensibilidad y especificidad que la radiografía simple, especialmente cuando se utilizan técnicas de alta resolución (1-1,5 mm de colimación). En la TC el enfisema se presenta como áreas de baja atenuación. En el enfisema centroacinar pueden verse áreas de baja atenuación localizadas cerca de los vasos, en el centro del lóbulo secundario. En el enfisema panacinar, la destrucción es uniforme, con una tendencia a localizarse en las regiones basales.
La mayor disponibilidad de la TC ha hecho que su uso se esté popularizando para la detección del enfisema pulmonar. Sin embargo, la correlación entre los hallazgos de la TC y el FEV1 es baja26. Para poner en perspectiva estos hallazgos es necesario tener en mente que, aunque en muchos textos se asimila el término EPOC al de enfisema pulmonar, Thurlbeck ya observó hace más de 3 décadas que aproximadamente el 20% de los pacientes que presentaban lesiones enfisematosas en más de un 30% del tejido pulmonar no tenían EPOC. Este mismo autor observó que parámetros funcionales como el FEV1 pueden estar en intervalos de referencia en pacientes con enfisema moderado, e incluso grave, desde el punto de vista macroscópico. Igualmente, Hogg et al27 observaron que la extensión y la gravedad del enfisema macroscópico no se correlacionan con el grado de obstrucción medido en 407 pacientes a quienes se realizó resección pulmonar. Como ocurre con el test de difusión, los hallazgos de la TC aportan información complementaria. El problema es que aún no sabemos cómo aplicar adecuadamente esta información en la práctica clínica. Aunque hay autores que señalan que la cuantificación de la magnitud del enfisema pulmonar mediante parámetros densitométricos podría ser una exploración sensible y específica en la evaluación del progreso de la enfermedad, la evidencia disponible no permite recomendar la TC como parámetro de progresión del enfisema en el ámbito clínico28. Sin embargo, la TC sí ha demostrado su utilidad en la selección de pacientes para cirugía de reducción de volumen, independientemente de su tipo histológico29.
Aunque el enfisema, incluso sin deterioro espirométrico, podría abordarse en un futuro como una enfermedad diferenciada, el grado de solapamiento de las lesiones que pueden observarse en los pacientes no hace de momento viable este planteamiento en la clínica.
Cambios vasculares pulmonares en la EPOC
Las arterias pulmonares de los pacientes con EPOC presentan diversos grados de disfunción endotelial y cambios estructurales, especialmente hiperplasia de la íntima y proliferación muscular en las arteriolas. Barberá et al30,31 han descrito que las alteraciones vasculares son un hallazgo frecuente en pacientes con EPOC y que pueden presentarse incluso en fases poco avanzadas de la enfermedad. En la mayor parte de los pacientes los cambios vasculares tienen un origen multifactorial, y son especialmente relevantes la pérdida de vasos que acompaña a la destrucción enfisematosa del parénquima, la vasoconstricción pulmonar hipóxica y la remodelación vascular.
En pacientes con grave deterioro ventilatorio (FEV1 < 30%) es posible encontrar presiones medias en la arteria pulmonar por encima de 25 mmHg hasta en un 50% de los casos. Sin embargo, en la mayoría de los pacientes con EPOC, a diferencia de lo que ocurre en otras enfermedades vasculares pulmonares, el aumento de presión en la arteria pulmonar suele ser leve o moderado en fases de estabilidad clínica. A pesar de ello, es posible identificar a un subgrupo de pacientes que presentan unas características especiales, con hipoxemia desproporcionada para su grado de deterioro ventilatorio, gran descenso de la transferencia para el monóxido de carbono y mayor disnea. Una vez que se han excluido otras causas de hipertensión pulmonar, el porcentaje de pacientes que presentan estas características es pequeño, pero deben identificarse, ya que pueden ser subsidiarios de un tratamiento específico25,32,33.
Efecto de las exacerbaciones
Los pacientes con EPOC tienen como media 2 exacerbaciones al año (la mayor parte presenta entre una y 4 anuales). Además de su gran impacto económico34, pueden requerir un período de recuperación largo, y un porcentaje significativo de los pacientes no se recuperan por completo. Varios estudios han demostrado que existe una asociación entre las exacerbaciones, en especial las que cursan con hospitalizaciones, y el aumento de la mortalidad. En un estudio de Connors et al35 en el que se incluyó a pacientes ingresados con hipercapnia, un 11% falleció durante el ingreso y el 50% durante los 2 años posteriores al alta hospitalaria. La mortalidad se relacionaba de forma independiente con la edad, el índice de masa corporal, el estado funcional previo y la presencia de insuficiencia cardíaca derecha. En un trabajo de Senneff et al36 la mortalidad fue del 60% un año después del ingreso de los pacientes mayores de 65 años que requerían ingreso en la unidad de cuidados intensivos. En un estudio de cohortes realizado en España37, la mortalidad durante el primer año después de un ingreso hospitalario por exacerbación ascendió al 22% y se identificaron como factores pronósticos la depresión, la comorbilidad, el mal estado de salud y los reingresos hospitalarios. La mayor parte de estos estudios incluyó a pacientes que ya presentaban grave deterioro funcional, por lo que no resulta extraño que el FEV1 careciera de valor pronóstico. Recientemente Soler-Cataluña et al38 han demostrado que existe una asociación entre las exacerbaciones y la mortalidad de los pacientes con EPOC. Como ocurría en estudios previos, esta relación se observó especialmente cuando las exacerbaciones eran graves. Este aspecto es relevante, ya que no todas las exacerbaciones afectan en la misma medida a la mortalidad. Dada su importancia en la historia natural de la enfermedad, cualquier factor modificador de su gravedad y de su frecuencia debería tener un efecto clínicamente muy relevante en la calidad de vida y, quizá también, en la reducción de la función pulmonar y la mortalidad.
Valoración multidimensional
En estudios longitudinales se han identificado múltiples variables que se comportan de forma independiente como predictoras de mortalidad. Por este motivo no resulta extraño que se haya intentado estudiarlas de forma conjunta con la intención de mejorar la capacidad predictiva de esta enfermedad. Sin duda el índice BODE es el que mayor interés ha generado en los últimos años. Este índice es una clasificación multidimensional que integra algunos de los aspectos más relevantes de la EPOC (índice de masa corporal, limitación al flujo aéreo, disnea y tolerancia al esfuerzo)39. El test de la marcha de 6 min proporciona información integrada sobre el impacto funcional de la enfermedad y un índice de masa corporal reducido tiene valor pronóstico. La espirometría y la medición de la disnea deben realizarse de forma sistemática en la valoración del paciente. La agrupación de estas 4 variables en un índice permite predecir mejor que el FEV1 el riesgo de muerte por cualquier causa y por causas respiratorias. Sin embargo, es un índice con valor poblacional y su utilidad en la práctica clínica en el paciente individual no está bien establecida. Otra limitación de este índice es que no valora aspectos muy importantes de la enfermedad como el grado de hiperinsuflación o el componente inflamatorio sistémico, y en nuestro medio algunos componentes como un bajo índice de masa corporal son poco relevantes en la mayoría de los pacientes40.
Parámetros bioquímicos
Una revisión reciente ha confirmado que la mayoría de los marcadores biológicos (citológicos y bioquímicos) no presenta una relación significativa con la gravedad de la EPOC, basada en el FEV141. Podríamos preguntarnos si estos resultados reflejan una limitación de los propios marcadores, de la valoración de la gravedad mediante el FEV1 o de ambos.
En la actualidad la única cuantificación bioquímica que modifica el manejo del paciente es la determinación de los valores de alfa-1-antitripsina. Recientemente se ha descrito que la EPOC cursa con inflamación local y sistémica. En un estudio con 4.803 pacientes procedentes del estudio de salud pulmonar norteamericano se ha observado que los valores elevados de proteína C reactiva de alta sensibilidad se asocian con mayor deterioro funcional, mayor mortalidad global, mayor mortalidad de causa cardiovascular y mayor mortalidad por cáncer. De hecho, las concentraciones elevadas de proteína C reactiva permiten predecir qué pacientes con displasia bronquial progresan a grados más avanzados42-44. Evidentemente la historia no finaliza con esta molécula, que por otro lado tiene importantes críticos que cuestionan el mensaje que se ha enviado en los últimos años de que la proteína C reactiva es un factor de riesgo vascular45. Otras moléculas menos conocidas (neopterina, moléculas de adherencia, etc.) también podrían intervenir en estos trastornos44.
La importancia de este concepto radica en que, como ha sucedido con otras enfermedades (p. ej., la diabetes mellitus), permite llamar la atención sobre la importancia de la EPOC leve como problema de salud. Dado que hay tratamientos capaces de actuar a este nivel, la confirmación de estos hallazgos podría identificar un fenotipo específico susceptible de tratamientos con actividad antiinflamatoria sistémica independientemente de los valores del FEV1.
¿Sólo EPOC en la EPOC?
La EPOC es una enfermedad que se presenta en edades medias y avanzadas, por lo que es frecuente que los pacientes puedan presentar enfermedades asociadas. Por este motivo, además de identificar diferentes fenotipos de EPOC, hay que valorar al paciente de forma global y diagnosticar procesos asociados que puedan condicionar cambios significativos en su situación clínica. Además de la comorbilidad clásica, que suele observarse en fases avanzadas de la enfermedad (osteoporosis, desnutrición, depresión, etc.), se ha descrito que estos pacientes tienen un riesgo mayor de presentar cáncer de pulmón y enfermedades cardiovasculares, incluso en fases iniciales del proceso. La gran cuestión, aún sin respuesta, es si las comorbilidades del paciente con EPOC son procesos independientes o si la EPOC, per se, puede favorecerlas.
Actualmente nadie discute que la EPOC tiene consecuencias sistémicas, aunque sí existen múltiples interrogantes sobre su importancia en la patogenia de la enfermedad y sobre el impacto en la morbimortalidad, especialmente en las formas menos graves. El hábito de fumar, prácticamente constante en estos pacientes, además de estar relacionado de forma independiente con la enfermedad cardiovascular, también se asocia con un incremento de las cifras de presión arterial. Por otra parte, la escasa actividad física que con frecuencia desarrollan los pacientes con EPOC puede condicionar una situación de sobrepeso. Son escasos los estudios que analizan la prevalencia de estos factores de riesgo clásicos en pacientes con EPOC, y los que lo hacen a menudo se basan en análisis retrospectivos de bases de datos poblacionales no diseñadas específicamente para este objeto. En un reciente estudio observacional realizado en España, los pacientes con EPOC presentaron una alta prevalencia de factores de riesgo cardiovascular y de cardiopatía isquémica. Esta última se relacionó con los primeros y con la edad, pero no se observó ninguna relación con la gravedad de la obstrucción. El estudio es sólo observacional y transversal, por lo que se necesitan estudios adicionales, tanto de casos y controles como longitudinales, para dilucidar si realmente hay una relación de causalidad entre la EPOC y la enfermedad cardiovascular46. Apoyando estos resultados, en otra serie reciente se observó que la asociación entre el deterioro funcional y los eventos cardiovasculares fue escasa cuando se ajustó para covariables como edad, sexo, raza, tabaquismo, hipertensión, diabetes, dislipemia y concentraciones de fibrinógeno47.
Evidentemente hay que tratar las comorbilidades cuando se presenten, pero estas series nos invitan a ser cautos a la hora de establecer estrategias terapéuticas basadas sólo en el papel potencial de la inflamación sistémica de la EPOC en la comorbilidad. Hasta que dispongamos de más información, debemos tener presente que una medida tan sencilla como mejorar la actividad física de los pacientes (probablemente actuando en los factores de riesgo vascular clásicos) puede incidir de manera muy favorable en su situación clínica, en las comorbilidades y en la mortalidad48.
Conclusión. Cómo incorporar lo nuevo a lo clásico
La EPOC se define como un trastorno prevenible y tratable. Según este principio, nuestro objetivo debe ser diagnosticar y tratar la EPOC en sus fases iniciales, para evitar complicaciones, que en su mayor parte acaban siendo irreversibles. Desafortunadamente hay recomendaciones oficiales que no apoyan estas medidas, con el argumento de que "la eficacia del tratamiento sólo está establecida en pacientes con FEV1 menor del 50%"49. Posiblemente muchos clínicos no compartan esta posición, del mismo modo que tampoco compartan que sólo hay un criterio uniforme de gravedad basado en el FEV1, lo que impide un abordaje correcto en muchos pacientes. Por este motivo, una vez establecido el diagnóstico, resulta imprescindible hacer una aproximación al fenotipo del paciente. El análisis de algunos parámetros, fácilmente evaluables en la clínica, como la presencia de enfisema, hiperinsuflación, grado disnea y número y características de las exacerbaciones, puede ayudarnos para orientar el manejo del paciente, sin olvidar que las comorbilidades pueden modular de forma decisiva la expresión clínica de la enfermedad. No hay información suficiente para establecer estrategias basadas en marcadores inflamatorios sistémicos50.
Declaración de conflicto de intereses
El autor ha declarado no tener ningún conflicto de intereses.
Correspondencia:
Dr. J.L. Izquierdo Alonso.
Servicio de Neumología. Hospital Universitario. Donantes de Sangre, s/n. 19002 Guadalajara. España.
Correo electrónico: jlizquierdo@sescam.org