En el cáncer de pulmón de célula no pequeña, las mutaciones del gen de EGFR identifican una subpoblación de pacientes con unas características clínicas y de respuesta al tratamiento diferente de aquellos que no presentan dichas mutaciones. Existen tanto mutaciones que derivan en un aumento de sensibilidad al tratamiento dirigido contra estas alteraciones génicas, como mutaciones que confieren resistencia a los mismos tratamientos. La determinación de las mutaciones de EGFR implica cambios en la actitud terapéutica de los pacientes con cáncer de pulmón en la práctica clínica habitual. En este artículo presentamos un caso de una paciente afecta de un adenocarcinoma pulmonar metastático con una mutación activadora al diagnóstico, inicialmente respondedora a tratamiento con erlotinib, que posteriormente desarrolla una resistencia secundaria mediante la adquisición de la mutación T790M en el exón 20 del gen EGFR.
In non-small cell lung cancer, the EGFR gene mutations identify a patient sub-population with different clinical characteristics and treatment responses to those that do not have these mutations. There are mutations that derive in increased sensitive to EGFR targeted therapy, as well as mutations that result in resistance. The determination of EGFR mutations involves a change in the therapeutic approach to lung cancer patients in current clinical practice. In this article we present a case of a patient suffering from a metastatic lung adenocarcinoma with an activating mutation on diagnosis, initially responding to treatment with erlotinib, who subsequently developed a secondary resistance due to acquiring the T790M mutation in exon 20 of the EGFR gene.
El cáncer de pulmón es un tumor con un mal pronóstico a pesar de los avances en el conocimiento de la enfermedad y en la aprobación de nuevos tratamientos en los últimos años1. Una de las mayores revoluciones en el tratamiento de cáncer en general y del cáncer de pulmón en particular, ha sido la identificación de alteraciones moleculares (mutaciones, amplificaciones génicas) que son responsables de la supervivencia tumoral. El pronóstico de los pacientes cuyos tumores expresan estas alteraciones moleculares y son tratados con terapias específicas, es más favorable al de la población general de cáncer de pulmón. Una de estas dianas en el cáncer de pulmón es el receptor del factor de crecimiento epidérmico (EGFR). EGFR forma parte de una red de señalización que es componente central de varios procesos celulares críticos, como el crecimiento, la proliferación y la motilidad celulares2.
Gefitinib (Iressa®) y erlotinib (Tarceva®) son 2 inhibidores tirosin-kinasa (TKI) utilizados en el tratamiento del cáncer de pulmón de célula no pequeña (CPCNP) que inhiben de forma reversible al EGFR, interrumpiendo la transducción de la señal de crecimiento y produciendo un efecto antitumoral. La mayoría de los tumores que responden a los TKI de EGFR presentan mutaciones activadoras en el dominio tirosin-kinasa del gen EGFR3–5. De forma global, la frecuencia de la mutación en los CPCNP es del 5–20% dependiendo de la población estudiada, siendo más frecuentes en mujeres, no fumadores, histología de adenocarcinoma y raza asiática6,7. En nuestro medio, la mutación del gen del EGFR se observa en aproximadamente el 15% de los CPCNP8,9. Alrededor de un 75% de los pacientes con mutación en el gen del EGFR responde al tratamiento con erlotinib/gefitinib, mientras que entre los no mutados solo responde un 10%5,6,10. A pesar de la buena y prolongada respuesta inicial, en prácticamente todos los casos se observa una adquisición de resistencia a los inhibidores tirosin-kinasa de EGFR (EGFR-TKI)11.
En este artículo presentamos un caso de una paciente afecta de un adenocarcinoma pulmonar metastásico, inicialmente respondedora a tratamiento con erlotinib, que posteriormente desarrolla una resistencia secundaria mediante la adquisición de la mutación T790M en el gen del EGFR.
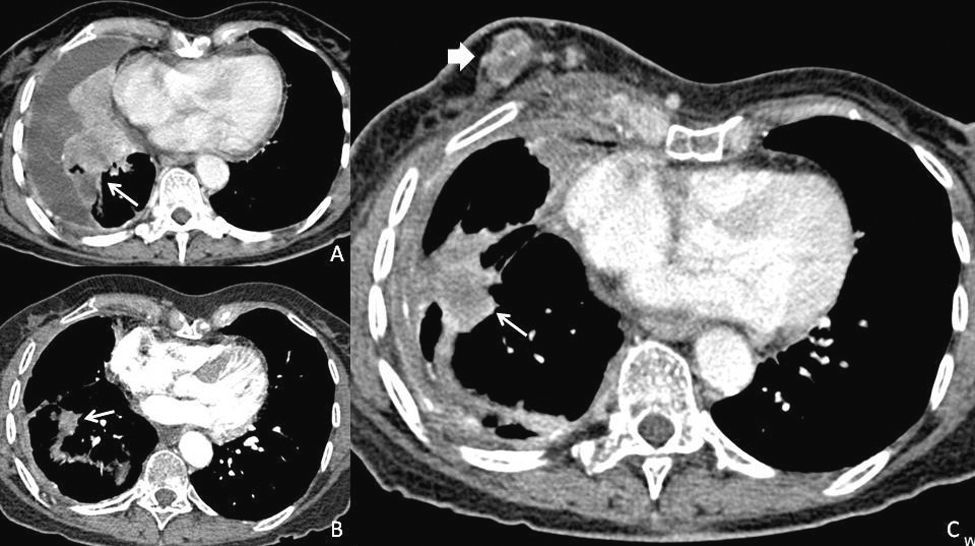
Caso clínicoPresentamos a una mujer no fumadora, caucásica, que se diagnosticó en mayo de 2007, a la edad de 78 años, de un adenocarcinoma pulmonar estadio IV con metástasis pulmonares bilaterales y pleurales (fig. 1A), factor de transcripción tiroideo 1 (TTF1) positivo, que presentaba la mutación L858R en el exón 21 del gen EGFR. En junio de 2007 inició tratamiento quimioterápico con un único fármaco (vinorelbina oral 60mg/m2 días 1, 8 y 15 cada 28 días) por deterioro del estado funcional (índice de Karnofsky del 60%). En agosto de 2007, se objetivó progresión de la enfermedad a nivel pulmonar, por lo que se inició tratamiento con erlotinib a dosis de 150mg/d, posteriormente reducida a 100mg/d por toxicidad cutánea. La paciente presentó una respuesta inicial clínica y radiológica (fig. 1B), y una estabilidad de la enfermedad durante 20 meses, manteniendo una calidad de vida óptima. En mayo de 2009, se palpó un nódulo mamario derecho que motivó la realización de una ecografía mamaria y axilar, que objetivó la presencia de un nódulo en cuadrante ínfero-interno de la mama derecha altamente sugestivo de malignidad, adenopatías de aspecto patológico a lo largo de toda la cadena mamaria interna, y de una adenopatía axilar derecha. Se realizó biopsia de la lesión mamaria y citología de la adenopatía axilar, que se informó como carcinoma infiltrarte de alto grado, TTF1 positivo compatible con diseminación de la neoplasia pulmonar. Se realizó la determinación de mutaciones en el gen del EGFR en la muestra, objetivándose la mutación ya conocida en el exón 21 y la presencia de una nueva mutación, T790M en el exón 20. En el estudio de extensión se objetivó también progresión pulmonar (fig. 1C) y cerebral. La paciente falleció en agosto de 2009 por progresión de su enfermedad oncológica.
Tomografía axial de tórax. A) Basal al diagnóstico, en la que se observan metástasis pulmonares múltiples y derrame pleural. B) Tras 15 meses de tratamiento con erlotinib, con marcada disminución tanto del derrame pleural como de las lesiones parenquimatosas pulmonares; y C) a la progresión a los 20 meses del inicio de erlotinib, con aumento de la afectación pulmonar y aparición de nódulo mamario (flechas).
El análisis de las muestras clínicas y de las líneas celulares con mutaciones de sensibilidad en el gen del EGFR tras tratamiento con gefitinib o erlotinib que adquieren resistencia al tratamiento, ha demostrado la presencia de una mutación secundaria en el exón 20 del gen del EGFR, que consiste en la sustitución de un residuo de metionina por uno de treonina en la posición 790 del dominio kinasa (T790M)12,13. Esta mutación está presente en aproximadamente el 50% de los tumores con resistencia adquirida al tratamiento con EGFR-TKI4,13,14. Existe un segundo mecanismo de resistencia conocido a los inhibidores de TK que es la amplificación del oncogén MET15.
Dado que la mutación T790M confiere resistencia frente a erlotinib/gefitinib aumentando la afinidad de EGFR por el ATP16, es posible vencer esta resistencia desarrollando nuevos EGFR-TKI con mayor afinidad por la kinasa T790M, en comparación con la afinidad del ATP por la kinasa mutada. Varios tipos de los llamados EGFR-TKI de segunda generación, se encuentran en fase de desarrollo. BIBW299217, PF0029980418 y HKI-27213 son ejemplos de las nuevas moléculas que inhiben de forma irreversible la unión del ATP al dominio tirosin-kinasa. La eficacia clínica de estos nuevos inhibidores es limitada, ya que no son capaces de inhibir EGFR T790M in vitro con las concentraciones clínicamente toleradas, siendo la diarrea y el rash cutáneo las toxicidades limitantes de dosis y por tanto, nuevos fármacos inhibidores con un potencial clínico mayor están en desarrollo19. Otra estrategia para vencer la resistencia a erlotinib/gefitinib consiste en atacar otras vías de señalización paralelas o convergentes. La vía de señalización mTOR regula la proliferación celular, supervivencia y mecanismos de angiogénesis, y ha sido implicada en la resistencia a los inhibidores de EGFR. Tanto en líneas celulares sensibles como en resistentes, el inhibidor de mTOR everolimus, reduce la expresión de EGFR y colabora con gefitinib para vencer la resistencia20.
El conocimiento de las alteraciones moleculares que definen subtipos de tumores dentro de la población general con cáncer de pulmón, ha conllevado un beneficio en supervivencia de los pacientes con dichas alteraciones. Esto pone de relevancia la importancia de poder determinar dichas alteraciones para ofrecer a los pacientes el mejor tratamiento disponible para cada caso. En este sentido, se está investigando el papel de otros biomarcadores como factores predictores de respuesta a diversos agentes cistostáticos o terapias dirigidas en el cáncer de pulmón, como son el gen BRCA1 (gen de la susceptibilidad al cáncer de mama 1) y RAP80 (receptor asociado a la proteína 80)21 con el objeto de individualizar el tratamiento de cada paciente concreto.
La aparición de nuevas estrategias terapéuticas para enfermedad resistente es prometedora, pero tenemos que ser capaces de identificar en la práctica clínica cuáles son las alteraciones moleculares que provocan esta resistencia y por tanto, poder ofrecer a los pacientes la participación en ensayos clínicos con fármacos que puedan ser eficaces, como por ejemplo los TKI irreversibles o inhibidores de MET. Una dificultad con la que nos encontramos, es que en pocos casos se llevan a cabo nuevas biopsias en el momento de la progresión tumoral, lo que impide la obtención de tejido tumoral para el análisis. Una opción sería buscar alternativas no invasivas a la biopsia, como el desarrollo de técnicas de detección de T790M en muestras de plasma mediante mutant-enriched PCR assay, que ha demostrado ser un método sensible y aplicable en la práctica clínica para la detección de las mutaciones del gen del EGFR22,23. Hay que tener en cuenta que la mutación EGFR-T790M puede coexistir con otras mutaciones de resistencia, como la amplificación del proto oncogén MET15, tanto en el mismo paciente en diferentes localizaciones metastásicas, como incluso dentro del mismo tumor14. Estos pacientes podrían requerir tratamiento combinado para cubrir los dos mecanismos de resistencia22.
ConclusiónEl tratamiento individualizado del cáncer de pulmón en el subgrupo de pacientes con mutaciones sensibilizadoras de EGFR ha conllevado un beneficio en supervivencia y calidad de vida de este subgrupo de pacientes, no obtenido hasta el momento con tratamiento quimioterápicos modernos. El caso presentado refleja dicha realidad, ya que una paciente de edad avanzada, con un cáncer de pulmón metastásico presentó una supervivencia superior a 2 años con una calidad de vida excelente recibiendo un tratamiento dirigido específicamente contra su tumor. Por lo tanto, es importante, incluir la evaluación genética del estado mutacional del gen del EGFR de cada paciente con CPCNP para identificar, de una forma eficaz, tanto a los pacientes que se pueden beneficiar del tratamiento con EGFR-TKI, como a aquellos que presentan mutaciones de resistencia y necesitarían terapias más específicas como los TKI irreversibles o tratamientos combinados. El estudio molecular del tejido tumoral, tanto al diagnostico como a la recidiva, es imprescindible para optimizar el manejo y mejorar el pronóstico de los pacientes diagnosticados de cáncer de pulmón.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.