Nuestro objetivo fue evaluar si el número y el volumen de las biopsias pulmonares quirúrgicas (BPQ) influyen en el diagnóstico de la enfermedad pulmonar intersticial difusa (EPID).
MétodosEstudio retrospectivo de BPQ por sospecha de EPID en los pacientes de la Clínica Mayo desde enero de 2002 hasta enero de 2010. Los datos se recogieron y analizaron en la institución.
ResultadosSe analizaron 311 pacientes. El número medio de biopsias fue de 2,05 (DE 0,6); una biopsia en 50 (16%), dos en 198 (63,7%), tres en 59 (19%) y cuatro en 4 (1,3%). El diagnóstico histopatológico fue: definitivo (específico) en 232 (74,6%), descriptivo (no específico) en 76 (24,4%) no hubo diagnóstico en 3 (1%). Tras excluir a los pacientes sin diagnóstico (n=3), hubo 50 pacientes con solo una biopsia, 196 con dos y 62 con tres o cuatro. El rendimiento de diagnóstico definitivo fue similar en los tres grupos (37/50 [74%], 150/196 [77%] y 45/62 [73%]). El valor p de Chi-cuadrado fue 0,8. El análisis del índice de propensión entre pacientes con una BPQ y pacientes con más de una BPQ tampoco mostró ninguna diferencia en el rendimiento diagnóstico. En cuanto al volumen de las biopsias, el volumen total medio fue 34,4cm3 (DE=46). En los pacientes sin diagnóstico, 41,2cm3 (3 casos), en pacientes con diagnóstico específico, 33,6cm3 (232 casos [DE=47]) y en pacientes con un diagnóstico descriptivo: 36,6cm3 (76 pacientes [DE=44]). El volumen de la biopsia no influyó en el rendimiento de la histopatología (ANOVA, p=0,8).
ConclusionesEl número o el volumen de las muestras de biopsia quirúrgica no parecen influir en el diagnóstico. Según nuestros resultados creemos que una sola muestra de un área representativa puede ser suficiente para el diagnóstico. Se deben realizar ensayos prospectivos aleatorizados para optimizar la BPQ en las EPID.
Our objective was to evaluate whether the number and volume of surgical lung biopsies (SLB) influence the diagnosis of diffuse interstitial lung disease (ILD).
MethodsRetrospective study of SLB for suspected ILD in patients from the Mayo Clinic from January 2002 to January 2010. Data were collected in the institution and analyzed.
Results311 patients were studied. Mean number of biopsies was 2.05 (SD 0.6); 1 biopsy in 50 (16%), 2 in 198 (63.7%), 3 in 59 (19%) and 4 in 4 (1.3%). Histopathologic diagnosis was: definitive (specific): 232 (74.6%), descriptive (non-specific): 76 (24.4%), no diagnosis: 3 (1%). After excluding patients without diagnosis (n=3), there were 50 patients with only 1 biopsy, 196 with 2 and 62 with 3 or 4; the definitive diagnostic yield was similar in all 3 groups (37/50; 74%, 150/196; 77%, and 45/62; 73%) (Chi-square, p value 0.8). The propensity score analysis between patients with 1 SLB and patients with more than 1 SLB also showed no difference in diagnostic yield. Regarding the volume of biopsies, mean total volume was 34.4cm3 (SD 46): 41.2cm3 (3 cases) in patients with no diagnosis; 33.6cm3 (232 cases, SD 47) in patients with specific diagnosis; and 36.6cm3 (76 cases, SD 44) in patients with descriptive diagnosis. Biopsy volume had no influence on histopathology yield (ANOVA, p value 0.8).
ConclusionsThe number and volume of the biopsy specimens in SLB did not seem to influence diagnosis. Based on our results, we believe a single sample from a representative area may be sufficient for diagnosis. Randomized prospective trials should be performed to optimize SLB for ILD.
La enfermedad pulmonar intersticial (EPID) es un término genérico aplicado a un grupo heterogéneo de enfermedades pulmonares que se clasifican juntas debido a varias características comunes1. La fibrosis pulmonar idiopática es la más común de todas las EPID2.
La clasificación actual de las EPID y las guías clínicas apoyan la realización de una biopsia quirúrgica de pulmón (BPQ) para el diagnóstico definitivo de la EPID, pero animan a los médicos a valorar cuidadosamente el beneficio frente a los riesgos de la realización de la cirugía3,4.
De hecho, la decisión de realizar una BPQ en estos pacientes se basa en la probabilidad de que el examen patológico del tejido obtenido proporcione características relevantes para un diagnóstico fiable o información específica acerca de la causa del proceso de la enfermedad5,6.
Por lo tanto, es crucial averiguar el número y el volumen óptimos de la BPQ para mejorar el rendimiento diagnóstico del procedimiento, y pocos estudios han tratado de identificar estos factores. Para responder a esta pregunta, realizamos un análisis del índice de propensión de nuestros pacientes de BPQ para parear pacientes con una biopsia y los que tenían más de una y averiguar el número de muestras óptimo para obtener un diagnóstico específico. También se analizó la influencia del volumen de muestra en el rendimiento diagnóstico.
MétodosEstudio retrospectivo de los datos obtenidos de la base de datos de BPQ de la Clínica Mayo entre el 1 de enero 2002 y el 31 de enero de 2010. Se siguieron los protocolos de la institución para acceder a los datos de los pacientes con el único fin de investigación y divulgación científicas. Los criterios de inclusión fueron sospecha radiológica de EPID y paciente candidato a BPQ para el diagnóstico. Los pacientes con una masa/nódulo pulmonar solitario u otros procesos pulmonares focales no se incluyeron. Todos los pacientes habían sido sometidos previamente a estudios de tomografía computarizada torácica de alta resolución (TACAR) y la mayoría de ellos a broncoscopia y pruebas de función pulmonar. No se llevaron a cabo pruebas de función pulmonar en los ingresados en la UCI y en aquellos pacientes cuyo estado clínico se consideró excelente. Se seleccionaron las muestras de BPQ en función de las imágenes de TACAR y la localización para la muestra de BPQ se seleccionó también según dichas imágenes.
Las variables recogidas fueron: edad, sexo, antecedentes de tabaquismo, comorbilidades, pruebas diagnósticas preoperatorias, pruebas de función pulmonar, características de ingreso, tipo de operación, complicaciones intraoperatorias, número de biopsias, volumen de las biopsias, duración del ingreso, complicaciones postoperatorias, morbilidad y mortalidad postoperatorias y diagnóstico histopatológico de cada muestra. Los grupos de rendimiento diagnóstico y no rendimiento diagnóstico se crearon basándose en el diagnóstico específico logrado con la BPQ.
Para minimizar el sesgo de selección, se incluyó el índice de propensión teniendo en cuenta varias características basales y quirúrgicas para crear dos grupos pareados de pacientes de los que se obtuvo una biopsia o más de una7. Con este procedimiento se crearon dos grupos bien pareados de 50 pacientes cada uno.
Las variables numéricas se compararon mediante la prueba de Mann Whitney y las variables categóricas mediante la prueba de Chi-cuadrado o la prueba exacta de Fisher según correspondía. Todas las pruebas fueron de dos colas con un nivel de significación del 0,05. El análisis se realizó con el software estadístico Stata 9.0 (Stata Corp College Station, TX, EE. UU.).
ResultadosSe analizaron un total de 311 pacientes. La edad media en el diagnóstico fue de 60,9 años (desviación estándar [DE]=14), rango de 18 a 91. La distribución por sexos fue de 164 varones (52,7%) y 147 mujeres (47,3%). Según antecedentes de tabaquismo había 143 no fumadores (46%), 30 fumadores activos (9,6%) y 138 exfumadores (44,4%). Había comorbilidades de importancia en 91 pacientes (29,3%): cardiopatía isquémica en 67 (21,5%), arritmia en 24 (7,7%) e insuficiencia renal crónica en 23 (7,4%). Diez pacientes (3,2%) se habían sometido previamente a un trasplante: 4 a trasplante de médula ósea y 6 a trasplante de órgano sólido. Setenta y ocho pacientes (25%) eran tratados con esteroides y 26 (8,4%) recibían tratamiento inmunosupresor en el momento de la BPQ. Se había realizado TACAR antes de BPQ a todos los pacientes analizados.
Se había realizado broncoscopia en 202 pacientes (65%), y pruebas de función pulmonar en 259 (83,3%). Los valores medios fueron los siguientes: %FEV1=70,2 (DE=16,3), %FVC=70,1 (DE=16), FEV1/FVC=79,8 (DE=8,8), %DLCO=52,1 (DE=14,7). En cuanto a las características del ingreso, 292 pacientes (93,9%) estaban hospitalizados y 19 (6,1%) estaban en la UCI antes de la biopsia.
Se realizó biopsia pulmonar abierta en 32 pacientes (10,3%) y VATS en 279 pacientes (89,7%). El motivo de la cirugía abierta fue la presencia de adherencias en 27 pacientes (84%) y la incapacidad del paciente para tolerar ventilación unipulmonar en 5 casos (16%). No se registraron complicaciones intraoperatorias.
La estancia media fue de 2,5 días. Veinticinco pacientes (8%) fueron transferidos a otro departamento después de la BPQ y se presentaron complicaciones postoperatorias en 36 pacientes (11,5%). Las complicaciones más frecuentes fueron la exacerbación aguda de la insuficiencia respiratoria (26,1%), precisar ingreso en UCI después de la BPQ, necesitar ingreso en UCI tras la cirugía –pacientes que no estaban en UCI previamente− (22,7%), necesitar intubación (pacientes no intubados previamente; 13,6%) y fuga aérea prolongada (> 7 días; 10,2%). La tasa de mortalidad a los 30 días de la biopsia de pulmón (BP) fue de 28 pacientes (9%) y de 33 pacientes (10,6%) a los 90 días.
El diagnóstico histopatológico fue definitivo (específico) en 232 casos (74,6%), descriptivo (no específico) en 76 (24,4%) y no hubo diagnóstico en 3 pacientes (1%). Los diagnósticos más frecuentes fueron neumonía intersticial usual (todos los casos con resultado de fibrosis pulmonar idiopática) en 122 pacientes (39%), neumonía organizada criptogénica en 31 casos (10%) y bronquiolitis respiratoria asociada a EPID en 16 (5%) (tabla 1).
Diagnóstico de los pacientes con diagnóstico histológico específico
| Fibrosis pulmonar idiopática/neumonía intersticial usual | 122 (39,2 52,6%) |
| Neumonía organizada criptogénica | 31 (9,9 13,4%) |
| Bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial | 16 (5,1 7%) |
| Neumonía intersticial no específica | 13 (4,2 5,6%) |
| Neumonitis por hipersensibilidad | 12 (3,8 5,2%) |
| Linfoma | 12 (3,8 5,2%) |
| Neumonía intersticial aguda | 10 (3,2 4,2%) |
| Sarcoidosis | 10 (3,2 4,2%) |
| Infección | 6 (1,9 2,6%) |
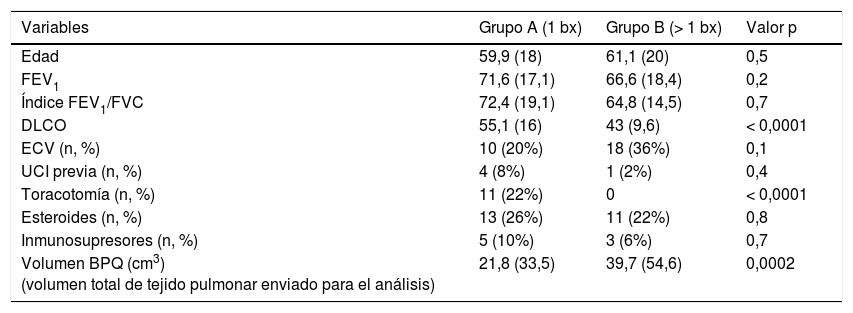
Tras excluir a los pacientes sin diagnóstico (n=3), se obtuvo una única biopsia en 50 pacientes, dos en 196 y se obtuvieron tres o cuatro en 62 pacientes. El rendimiento de diagnóstico definitivo fue similar en los tres grupos (37/50 [74%], 150/196 [77%] y 45/62 [73%]; p=0,8 en prueba de Chi-cuadrado). El análisis del índice de propensión para parear pacientes con una sola BPQ (Grupo A) y aquellos con más de una (Grupo B) resultó en 50 parejas. No hubo diferencia en el rendimiento diagnóstico entre estos dos grupos. No se observó tampoco ninguna diferencia en términos de morbilidad (Grupo A: 8, Grupo B: 5; p=0,6) o mortalidad a los 90 días (Grupo A: 5, Grupo B: 6; p=1,0). La comparación entre grupos pareados por propensión se puede ver en la tabla 2. En cuanto al volumen de las biopsias, el volumen medio total (suma de los volúmenes de todas las biopsias dividido por el número de pacientes) fue 34,4 cm3 (DE=46). El volumen de biopsia de los pacientes sin diagnóstico fue de 41,2 cm3 (3 casos), el de aquellos con diagnóstico específico 33,6 cm3 (232 casos [DE=47]) y en el caso de los pacientes con diagnóstico descriptivo 36,6 cm3 (76 pacientes [DE=44]). No hubo influencia del volumen de la biopsia en el rendimiento de la histopatología (p=0,8; ANOVA).
Comparación entre los grupos pareados según número de biopsias realizadas
| Variables | Grupo A (1 bx) | Grupo B (> 1 bx) | Valor p |
|---|---|---|---|
| Edad | 59,9 (18) | 61,1 (20) | 0,5 |
| FEV1 | 71,6 (17,1) | 66,6 (18,4) | 0,2 |
| Índice FEV1/FVC | 72,4 (19,1) | 64,8 (14,5) | 0,7 |
| DLCO | 55,1 (16) | 43 (9,6) | < 0,0001 |
| ECV (n, %) | 10 (20%) | 18 (36%) | 0,1 |
| UCI previa (n, %) | 4 (8%) | 1 (2%) | 0,4 |
| Toracotomía (n, %) | 11 (22%) | 0 | < 0,0001 |
| Esteroides (n, %) | 13 (26%) | 11 (22%) | 0,8 |
| Inmunosupresores (n, %) | 5 (10%) | 3 (6%) | 0,7 |
| Volumen BPQ (cm3) (volumen total de tejido pulmonar enviado para el análisis) | 21,8 (33,5) | 39,7 (54,6) | 0,0002 |
Resultados expresados como media y (desviación estándar) a menos que se indique lo contrario. Variables numéricas comparadas mediante el test de Mann-Whitney. Variables categóricas comparadas mediante la prueba exacta de Fisher.
BPQ: biopsia pulmonar quirúrgica; DLCO: capacidad de difusión de monóxido de carbono; ECV: enfermedad cardiovascular; FEV1: volumen espiratorio forzado en 1 segundo; FVC: capacidad vital forzada; UCI: Unidad de Cuidados Intensivos.
Las EPID son un grupo de enfermedades muy diversas en cuanto a opciones de tratamiento y pronóstico8. Generalmente, sigue siendo necesario analizar tejido pulmonar para diagnosticar la EPID en aproximadamente un tercio de los pacientes que no tienen una exposición ambiental claramente definida o una enfermedad sistémica evidente que afecte con frecuencia el pulmón.
Para obtener tejido pulmonar periférico para el análisis se ha usado biopsia pulmonar transbronquial y, recientemente, las criosondas para biopsia pulmonar transbronquial se han convertido en una técnica alternativa que aumenta el rendimiento diagnóstico, proporcionando muestras de biopsia de mejor calidad y mayor tamaño9. Sin embargo, mientras se espera la mejora de estas técnicas mínimamente invasivas, la BPQ sigue siendo necesaria en un buen número de casos, aunque el papel de BPQ sigue siendo controvertido. A pesar de los beneficios obtenidos con el paso de la BP abierta a la biopsia pulmonar videotoracoscópica (BP-VATS), muchos especialistas siguen siendo reacios a permitir que los pacientes se sometan a cirugía si no hay garantías de que los resultados lleven a un cambio en el tratamiento en un número significativo10. En este estudio de BPQ, se obtuvo diagnóstico específico en el 74,6% de los casos y creemos que esta tasa es aceptable, dado que las tasas de diagnóstico específico en la literatura varían entre 34 y 98%11,12. En nuestra opinión, es destacable que, aunque más del 25% de los casos recibió algún tratamiento antiinflamatorio, la tasa de rendimiento diagnóstico permaneció alta, lo que apoya la utilidad de la biopsia pulmonar quirúrgica para el diagnóstico de EPID.
Las tasas de morbilidad y de mortalidad fueron del 11,5% y el 10,6% (90 días), respectivamente. Estas tasas sufren grandes variaciones dependiendo de los estudios y esta discordancia refleja la diversidad de las características clínicas de los pacientes incluidos en las series quirúrgicas de EPID13. El diagnóstico patológico más frecuente fue la neumonía intersticial usual, llevando a fibrosis pulmonar idiopática en todos los casos (39%). Los estudios epidemiológicos de EPID indican que la fibrosis pulmonar idiopática es la forma más frecuente de EPID, con una frecuencia entre 25 y 38% dependiendo de la serie14.
La cuestión del número más apropiado de biopsias es controvertida, y varios autores proponen la realización de más de una biopsia. Monaghan et al.15 y Flaherty et al.16 alcanzaron en sus series de pacientes con varias muestras una concordancia del diagnóstico del 87,5 y del 74% respectivamente. Estas observaciones fueron una de las causas que indicaron la importancia de tomar más de una muestra para llegar a un diagnóstico fiable de la EPID. En el otro lado de la balanza, otros autores recomiendan realizar solo una biopsia de la zona más representativa. En este caso, Chechani et al.17 obtuvo un 100% de concordancia y Fibla et al.18, en un proyecto multicéntrico con 224 pacientes, observó un índice de concordancia del 97,2%. Estos dos estudios concluyeron que no eran necesarias varias muestras de biopsia cuando se podía muestrear con una biopsia una región radiográficamente representativa. Según los resultados de este estudio, también creemos que una biopsia de un área representativa que contenga parénquima patológico y también normal es suficiente para proporcionar un diagnóstico. Ambos estudios concluyeron que la concordancia patológica de las muestras observadas por los patólogos fue alta (100 y 97,2%). En este estudio también se ha observado una alta concordancia. Nuestros resultados proceden del análisis de 311 pacientes, sumados a los de estudios similares previos17,18 suponen un gran número de casos que muestran que tomar una sola muestra de una región representativa que contenga parénquima patológico y también normal podría ser suficiente para proporcionar un diagnóstico. Sin embargo, todos estos estudios (incluido el nuestro) son retrospectivos, por lo que deben realizarse estudios prospectivos aleatorizados para confirmar esta observación.
También existe diversidad de opiniones en cuanto al volumen necesario de las muestras tomadas. En este sentido, Qureshi et al.19 indicaron que una buena regla general es seleccionar dos o tres muestras de aproximadamente 3×2×1 cm3.
Sin embargo, Flint et al.20 llegaron a la conclusión de que una sola muestra de>2cm de diámetro obtenida de una región del lóbulo más afectado radiográficamente proporcionaba tejido adecuado para diagnóstico. En nuestra serie, aunque hay una considerable variación en los tamaños de biopsia, no hubo diferencias estadísticas en el volumen del grupo con diagnóstico específico y el grupo con diagnóstico no específico.
Las limitaciones de este estudio son su carácter retrospectivo utilizando datos que proceden de una sola institución y el hecho de que el diagnóstico específico no se analizó de acuerdo al número exacto de biopsias.
Los puntos fuertes de este estudio son que incluye a un subconjunto específico de pacientes, que son solo los pacientes con EPID y candidatos para BPQ. No incluyó a pacientes con masas o nódulos pulmonares que fueran candidatos a la realización de una resección en cuña para diagnóstico o tratamiento. Otro punto fuerte es que el procesamiento histopatológico y el análisis fueron estandarizados y dependieron de los mismos patólogos.
En conclusión, los pacientes con EPID son especialmente complejos y deberían ser llevados por equipos especializados compuestos por neumólogos, radiólogos, patólogos y cirujanos. La BP-VATS es una herramienta potente y segura para el diagnóstico en caso de sospecha de EPID, pues proporciona un diagnóstico definitivo con una tasa de morbilidad baja en la mayoría de los pacientes. El número y volumen de las muestras de biopsia no parecieron influir sobre el diagnóstico. Según nuestros resultados, creemos que una sola muestra de un área representativa puede ser suficiente para el diagnóstico, pero se deben realizar ensayos prospectivos aleatorizados, a ser posible centrados en entidades específicas, para optimizar la biopsia pulmonar quirúrgica para las EPID.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.