El derrame pleural maligno (DPM) es una de las complicaciones de la enfermedad neoplásica avanzada, con una incidencia estimada de 1/1.000 personas al año1. Se estima que la prevalencia del DPM irá en aumento en los próximos años debido a una mayor supervivencia de los pacientes con tumores activos.
En el DPM las tasas de curación son escasas, siendo, por tanto, en la mayoría de los casos un derrame recurrente. Este debuta con aumento de la disnea habitual, tos, dolor torácico y empeoramiento de la calidad de vida; por ello, se ha apostado por diferentes técnicas terapéuticas con intención paliativa. La pleurodesis era hace años la técnica de elección, sin embargo, el drenaje tunelizado (DT) cada vez va cobrando más importancia en la práctica clínica2-4. Durante el seguimiento del catéter tunelizado, se puede observar hasta en el 14% de los pacientes, la formación de septos de fibrina en el interior del derrame5, como consecuencia de la actividad procoagulante y del descenso de la actividad fibrinolítica de los DPM, lo que contribuye al depósito de fibrina en el espacio pleural a la creación de septos que dificultan la evacuación del derrame pleural en el domicilio del paciente. El beneficio de la instilación de uroquinasa en estos casos ya ha sido sugerido por varios autores6,7, algunos de ellos, apuestan por dosis elevadas y prolongadas en el tiempo8. Así, Hsu et al., en 2006, recomiendan instilaciones repetidas de uroquinasa 100.000 UI al día durante 3días como mínimo (alcanzando un máximo de 9 días y 900.000 UI de uroquinasa)9; en cambio, otros autores como Mishra et al., en 201810, utilizan 3dosis de uroquinasa 100.000 UI instilada en intervalos de 12 h, con una dosis total de 300.000 UI y una revisión a las 24 h tras la última dosis, sin encontrar beneficio significativo en el grupo de la uroquinasa.
Presentamos a propósito de un caso clínico, el protocolo de actuación de nuestro hospital ante los DPM septados en los que no se consigue débito eficaz.
Varón de 61 años, remitido a la consulta externa de Neumología por síndrome general, disnea de mínimos esfuerzos y derrame pleural recidivante. En el Servicio de Urgencias se habían realizado 2toracocentesis diagnósticas y evacuadoras, objetivándose la existencia de un exudado linfocitario, con citologías negativas para malignidad y con un débito total de 2.700ml. En la consulta se realiza una ecografía torácica en la que se objetiva un engrosamiento pleural; se solicita tomografía computarizada de tórax, en la que se evidencia derrame pleural derecho grado iii/iv que condiciona una atelectasia del lóbulo inferior derecho, una imagen nodular de 2cm en el seno de esta y múltiples engrosamientos nodulares pleurales de aspecto tumoral. A nivel abdominal, destaca una adenopatía patológica retroperitoneal de 2cm de diámetro mayor. Se realizan una biopsia pleural derecha ecoguiada y nueva toracentesis evacuadora (la tercera en el plazo de una semana, con un débito 2.000ml). La anatomía patológica demostró una metástasis de carcinoma renal como neoplasia primaria.
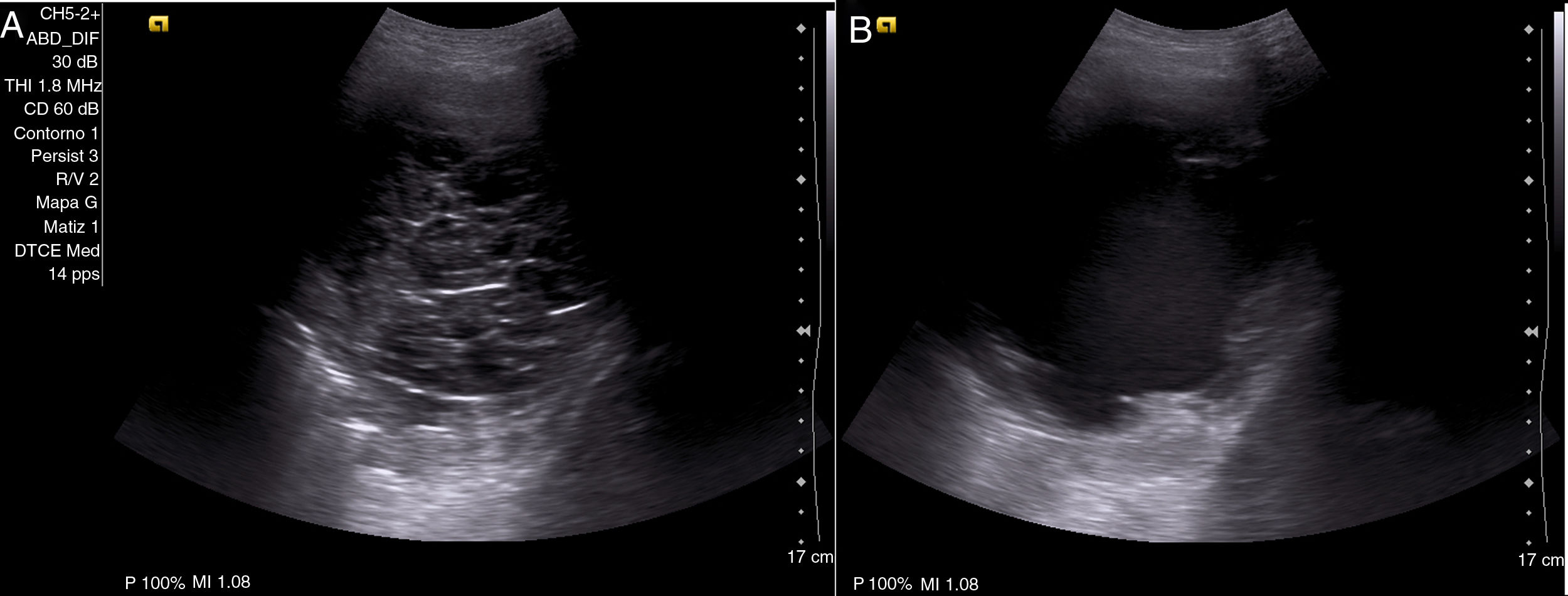
Con el diagnóstico de DPM secundario a neoplasia renal en estadio iv, y ante la persistencia de derrame pleural, se decide, tras explicarle las distintas alternativas terapéuticas al paciente, la colocación de un DT (IPC™ Pleural catheter, Rocket Medical©, Watford, Reino Unido), instruyendo tanto al paciente como a familiares para su drenaje en domicilio. A los 30 días, aproximadamente, de la colocación del DT, acude a la consulta con disnea de pequeños esfuerzos (escala visual analógica [EVA]: 8/10, disnea según el modified Medical Research Council: III) y sin presentar débito eficaz a través del DT. En la radiografía de tórax, se observa un derrame pleural derecho ii/iv, sin cambios respecto a estudios previos con catéter bien colocado en el hemitórax derecho. Se realiza una ecografía torácica en la que se objetiva un derrame ii/iv, con múltiples septos y detritus en su interior (fig. 1 A). Se realiza una instilación de uroquinasa intrapleural de 100.000 UI, se deja actuar durante 2h y se repite según protocolo una ecografía torácica; en ella se demuestra una lisis total de los septos, persistiendo el derrame pleural con detritus (fig. 1 B). Se procede al drenaje del mismo, obteniendo 750ml de líquido serohemático, sin complicaciones asociadas y con importante alivio sintomático.
Paciente de 61 años, con derrame pleural maligno secundario a neoplasia renal estadio iv, que acude por cese del drenaje a través de catéter tunelizado. Se realiza una ecografía torácica en la que se objetivan numerosos septos que impiden el drenaje del líquido pleural (A). Se procede a la instilación de una única dosis de uroquinasa 100.000 UI y se deja actuar durante 2h; posteriormente, se repite la ecografía torácica, en la que se observa un derrame pleural libre con detritus en su interior y una lisis de los septos (B). Se procede entonces a su drenaje con un débito de 750ml de líquido pleural serohemático y una mejoría sintomática posterior del paciente.
Iniciamos nuestro protocolo en octubre del 2017, en los DPM en los que no se consigue débito eficaz en el domicilio tras conexión del DT a la botella de vacío. Consiste en la realización inicialmente de una radiografía de tórax y una ecografía pleural y, si en esta última se objetivan septos intrapleurales, se procede a la instilación de una única dosis de uroquinasa 100.000 UI y revaluación del paciente a las 2h, repitiendo la ecografía para visualizar el efecto de la uroquinasa (lisis de los septos) y, realizando en ese momento, drenaje a través del catéter tunelizado11. Posteriormente, se realiza una tercera ecografía pleural para confirmar la disminución del derrame pleural y la ausencia de complicaciones inmediatas. El tiempo de realización del procedimiento, no supera los 10min desde la realización de la ecografía inicial hasta la administración del fibrinolítico intrapleural y otros tantos desde la visualización posterior de la lisis de los septos y el drenaje del derrame. Al alta, se le facilita al paciente un teléfono de contacto para avisar de posibles complicaciones (conversión hemorrágica del derrame fundamentalmente, aparición de disnea o dolor torácico).
En el momento actual, hemos incluido en este protocolo a 15 pacientes. Un 53,8% hombres, con una edad media y desviación estándar (DE): 68,5 (13,9) años, la cantidad promedio drenada (DE) es 584 (199) cc tras el procedimiento. Se obtuvo alivio sintomático evidente (reducción mayor de 2puntos en EVA) en el 73,3% de los casos, sin que hayamos evidenciado ninguna complicación hasta ahora.
La dosis de uroquinasa necesaria en el DPM no está claramente establecida, y en nuestra experiencia se consigue una alta tasa de éxito en la lisis de septos con una única dosis. Como se ha comentado anteriormente, en los últimos estudios publicados en la literatura se apoya a la instilación de fibrinolíticos en varios días consecutivos con revisiones posteriores; sin embargo, esto supone varias visitas y un aumento de los costes, así como del tiempo del paciente en el hospital12. Al tratarse en su mayoría de pacientes con enfermedad avanzada en estadios paliativos, uno de los principales objetivos debe ser priorizar el bienestar del paciente y reducir el número de visitas al hospital. Con esta sistemática de actuación, en una única visita, se consigue una fibrinólisis eficaz de los septos sin que se vea afectado el principal objetivo del procedimiento, que es optimizar la reexpansión pulmonar con disminución del derrame pleural y mejorar la disnea del paciente.