Control colinérgico de la vía aérea
El sistema nervioso parasimpático desempeña un papel esencial en la regulación del tono bronquial, ya que la principal inervación vegetativa de las vías aéreas en la especie humana es de tipo parasimpático. La estimulación del nervio vago produce la liberación de acetilcolina de las terminaciones nerviosas, que activa los receptores muscarínicos del músculo liso y de las glándulas produciendo broncoconstricción y secreción de moco1,2.
Las fibras nerviosas colinérgicas presinápticas parten del núcleo motor del nervio vago en el sistema nervioso central y discurren a través del nervio vago hasta los ganglios nerviosos periféricos localizados en las paredes de las vías aéreas inferiores. Desde estos ganglios, donde se produce la sinapsis neuronal, surgen fibras posganglionares cortas, que inervarán los diferentes tejidos diana, como la musculatura lisa o las glándulas submucosas. La estimulación del nervio vago provoca la liberación de acetilcolina de las fibras posganglionares. La inervación colinérgica es mayor en las grandes vías aéreas que en las periféricas, aunque en humanos se han encontrado receptores muscarínicos tanto en las vías aéreas grandes como en las pequeñas3-5. En condiciones normales existe una baja actividad tónica basal de la musculatura bronquial que depende del tono colinérgico. La actividad parasimpática aumenta a través de reflejos nerviosos vagales broncoconstrictores, que se desencadenan por la estimulación de las terminaciones sensoriales próximas a las células epiteliales. La broncoconstricción producida por estimulación vagal cumple una función fisiológica, ya que el aumento del tono de las vías aéreas ayuda a prevenir el colapso de aquellas vías aéreas que no tienen cartílago y mejora el tono de las vías cartilaginosas. Aunque la broncoconstricción produce obstrucción de la vía aérea, es necesario un pequeño aumento del tono del músculo para mantener las vías aéreas permeables, especialmente para evitar que se colapsen durante la espiración. No obstante, un tono vagal excesivo puede ser responsable de al menos parte de la obstrucción de la vía aérea que se observa en algunos pacientes6.
Subtipos de receptores muscarínicos
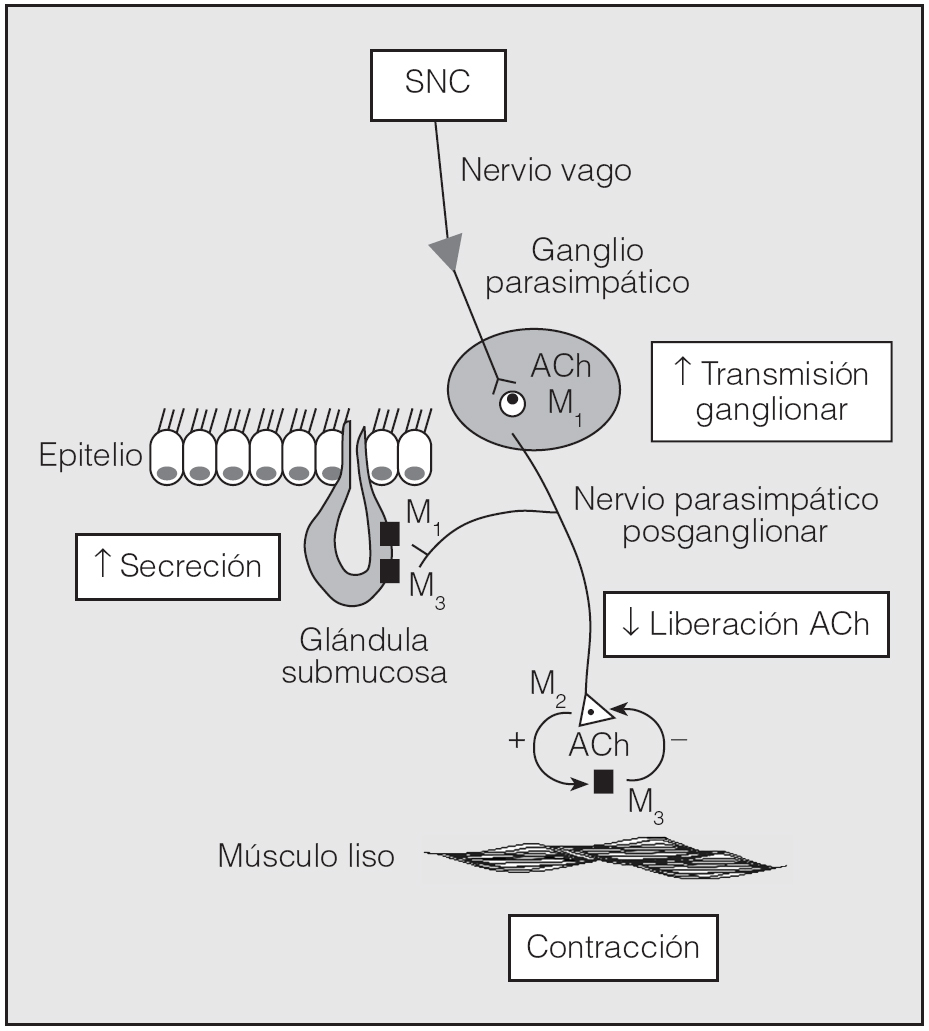
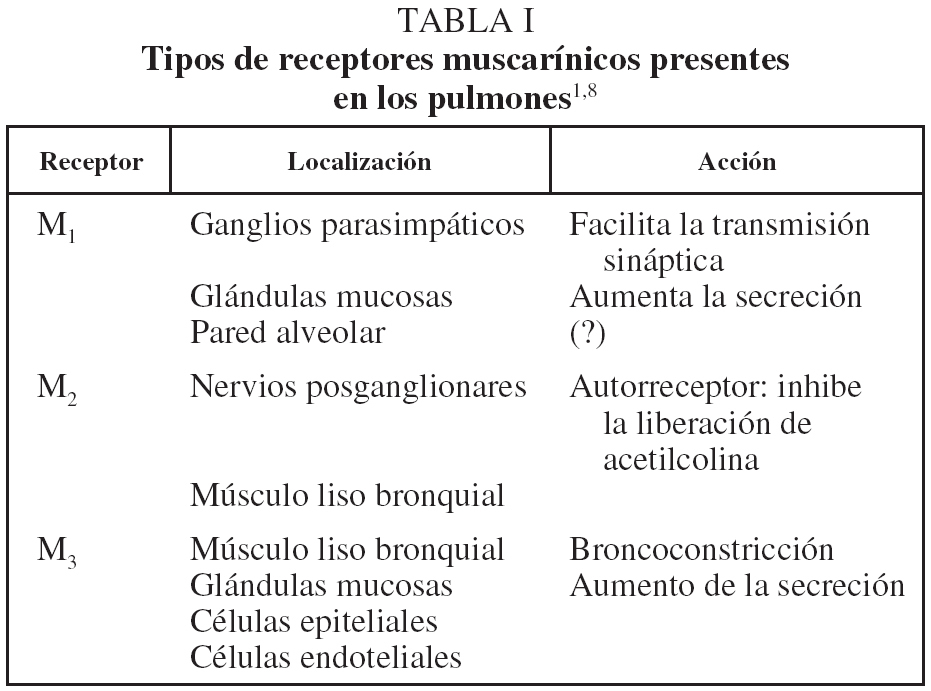
Se han reconocido al menos 5 subtipos de receptores muscarínicos. En las vías aéreas de humanos se han identificado 3 subtipos de estos receptores, que tienen diferentes funciones fisiológicas y que participan en el control del calibre de la vía aérea. Su localización y funciones7 se recogen en la figura 1 y tabla I1,8.
Fig. 1. Esquema de la inervación colinérgica en la vía aérea y localización de los receptores muscarínicos M1, M2 y M3. Receptores M1: en el ganglio parasimpático. Receptores M2: en las fibras presinápticas posganglionares de las vías aéreas. Receptores M3: de localización postsináptica en el músculo liso de la vía aérea, en las glándulas submucosas y en los vasos sanguíneos. ACh: acetilcolina; SNC: sistema nervioso central.
Mecanismo de acción de los fármacos anticolinérgicos
Los fármacos anticolinérgicos bloquean de forma competitiva el efecto de la acetilcolina sobre los receptores de la musculatura lisa del árbol bronquial produciendo broncodilatación. La eficacia broncodilatadora dependerá del grado en que el reflejo colinérgico broncoconstrictor contribuya al broncospasmo que presenta cada paciente, por lo que son especialmente útiles en la EPOC. La actividad anticolinérgica se manifiesta con independencia de cuál sea la causa de aumento del tono vagal. Se ha propuesto un potencial efecto inhibitorio de algunos mediadores inflamatorios en estudios in vitro, pero se desconoce su relevancia en la práctica clínica. A diferencia de lo que sucede en el asma, en que la obstrucción de la vía aérea se debe a múltiples factores, la inhibición del tono muscular de la vía aérea puede ser el principal, si no el único, medio farmacológico de aumentar el flujo aéreo en pacientes con EPOC. También hay evidencia de un tono colinérgico aumentado en la vía aérea de los pacientes con EPOC9. Este tono puede abolirse con los anticolinérgicos y, dado que la resistencia depende de la cuarta potencia del radio, puede tener un impacto clínicamente importante en estos pacientes. Por ello los anticolinérgicos pueden producir una broncodilatación igual o superior a la de los agonistas β2 en pacientes con EPOC. Por otro lado, tienen un efecto favorable adicional bloqueando la hipersecreción mucosa. De este modo, los anticolinérgicos en la EPOC pueden producir un efecto clínico favorable a través de diversos mecanismos que incluyen un efecto broncodilatador, reducción de la hipersecreción mucosa y protección de la vía aérea frente a estímulos broncoconstrictores. Paralelamente, la eficacia terapéutica no se valora sólo a partir del incremento de los valores del volumen espiratorio forzado en el primer segundo (FEV1), sino mediante la inclusión de otros parámetros, como la mejoría de los síntomas, de las actividades de la vida cotidiana y de la capacidad de ejercicio, además de la reducción de las exacerbaciones10,11.
Por último, la acetilcolina podría tener un papel importante en la remodelación del músculo liso in vivo, que se consideraba producido principalmente por factores de crecimiento y otros mediadores de la inflamación; este fenómeno sería inhibido por el tiotropio, lo que se traduciría en un efecto preventivo de la hiperreactividad crónica y en la prevención del declinar de la función pulmonar en el asma alérgica12.
Fármacos disponibles: bromuro de ipratropio, oxitropio y tiotropio
El fármaco antimuscarínico ideal para tratar las enfermedades de las vías aéreas debería bloquear los receptores muscarínicos M1 y los M3 del músculo liso bronquial, sin bloquear los receptores M2.
Los antagonistas muscarínicos derivados del amonio cuaternario, como el bromuro de ipratropio, presentan una serie de ventajas frente a los derivados del amonio terciario como la atropina, que los hace idóneos para su uso en las enfermedades respiratorias. Su principal ventaja radica en que carecen de efectos sistémicos al administrarse por vía inhalatoria, debido a que prácticamente no se absorben; no producen efectos sobre el sistema nervioso central porque no atraviesan la barrera hematoencefálica, y apenas producen efecto inhibidor del aclaramiento mucociliar.
Existen 3 fármacos estructuralmente similares a la atropina con efecto broncodilatador: el bromuro de ipratropio (1982), el bromuro de oxitropio (1990) y el bromuro de tiotropio (2002). Los 3 poseen unas propiedades farmacológicas similares a las de la atropina, pero con la ventaja de que, al tener una mínima absorción sistémica, cuando se administran por vía inhalada logran un efecto máximo sobre el aparato respiratorio, sin apenas efectos secundarios.
Bromuro de ipratropio
El bromuro de ipratropio antagoniza los efectos de la acetilcolina al bloquear los receptores muscarínicos colinérgicos. Este bloqueo ocasiona una reducción de la síntesis del guanosinmonofosfato cíclico, sustancia que en las vías aéreas reduce la contractilidad de los músculos lisos, por sus efectos sobre el calcio intracelular. El ipratropio no es selectivo para los diferentes subtipos de receptores muscarínicos, de manera que ejerce acciones farmacológicas parecidas a las de la atropina sobre los músculos lisos bronquiales, las glándulas salivares, el aparato digestivo y el corazón cuando se administra de forma sistémica. Sin embargo, administrado por inhalación, sus efectos se limitan al aparato respiratorio, y es 2 veces más potente que la atropina como broncodilatador. Por esta vía de administración sus efectos sistémicos son mínimos. El bromuro de ipratropio no posee efectos antiinflamatorios. La administración intranasal de ipratropio produce unos efectos parasimpaticolíticos locales que se traducen en una reducción de la hipersecreción de agua de las glándulas mucosas de la nariz. De esta manera, el ipratropio alivia la rinorrea asociada al resfriado común y a las rinitis, ya sean alérgicas o no. Su principal inconveniente es que su efecto es relativamente corto (de 4 a 6 h), por lo que son necesarias 2 o 3 administraciones al día. La dosis recomendada de bromuro de ipratropio en la EPOC es de 20 a 40 μg 3 o 4 veces al día.
Bromuro de oxitropio
Es un antagonista de la acetilcolina de acción similar al ipratropio. Sus propiedades farmacológicas son similares a las de éste, si bien se admite que su efecto es ligeramente más rápido. El efecto broncodilatador máximo se alcanza a los 15 min de la inhalación, pero igualmente son necesarias 3 o 4 administraciones al día.
Bromuro de tiotropio
El bromuro de tiotropio es un agente anticolinérgico sintético cuaternario de acción prolongada, con una gran afinidad hacia los receptores M1 y M3. En las vías respiratorias inhibe los receptores M3 de las células musculares lisas, lo que ocasiona una broncodilatación. En los estudios in vitro e in vivo previene los efectos broncoconstrictores de la metacolina de manera dependiente de la dosis, con una duración de la acción mayor de 24 h13. In vitro muestra una afinidad parecida hacia los 3 tipos de receptores muscarínicos (M1, M2 y M3), pero se disocia unas 100 veces más lentamente que el ipratropio de los receptores M1 (14,6 frente a 0,14 h) y M3 (34,7 frente a 0,26 h)14, mientras que la disociación de los receptores M2 es similar. En consecuencia, tiene una mayor duración broncodilatadora, lo que permite su administración en una sola dosis al día. En cambio, el inicio de su efecto es mucho más lento que el del bromuro de ipratropio y de oxitropio, por lo que es inadecuado para el tratamiento de una crisis.
El bromuro de tiotropio se utiliza por inhalación y actúa localmente. Por este motivo, en la mayor parte de los casos las concentraciones plasmáticas se encuentran por debajo de los límites de detección. Alrededor del 20% de una dosis inhalada se deposita en los pulmones; las concentraciones plasmáticas máximas se alcanzan en los primeros 5 min, disminuyen rápidamente hasta ser inapreciables al cabo de 1 h y desaparecen por completo en 5 días, con independencia de la dosis utilizada15. Sólo el 2-3% del tiotropio ingerido se absorbe en el tracto gastrointestinal; el 70% se une a las proteínas plasmáticas y no atraviesa la barrera hematoencefálica. En torno al 7% de la dosis de tiotropio administrado se elimina en la orina sin alterar. En el estado de equilibrio, la semivida de eliminación plasmática es de 5 a 6 días. En los estudios in vitro, el tiotropio es 10 veces más potente que el ipratropio y su efecto se produce más lentamente (se alcanza el 50% del efecto máximo a los 35 min, frente a los 8 min del ipratropio), pero dura 6-7 veces más (el 50% del efecto desaparece a los 540 min, frente a 81 min con ipratropio)16, por lo que es el primer broncodilatador colinérgico administrado por inhalación y de larga duración, que permite una sola administración al día. Los trabajos de Littner et al17,18 permitieron establecer la dosis de tiotropio en 18 µg, una vez al día, que se administra mediante la inhalación de polvo seco.
Eficacia clínica de los anticolinérgicos
El efecto beneficioso de los anticolinérgicos inhalados en el tratamiento de la EPOC se demostró para el ipratropio hace más de 20 años. Sin embargo, la aparición del tiotropio, con ventajas farmacodinámicas tales como la dosificación una vez al día y la ausencia de efectos sistémicos y adversos de importancia, ha hecho que se vuelva a plantear la eficacia clínica de estos fármacos.
Los trabajos de Littner et al17,18 permitieron establecer la dosis de tiotropio en 18 μg una vez al día, por su seguridad y eficacia. Además, observaron que al interrumpir la administración el FEV1 volvió lentamente, durante un período de 3 semanas, a los valores previos. Este hecho implica que olvidar una dosis no influye en el control de la broncodilatación que produce el tiotropio18.
El resumen de los trabajos que analizan la eficacia clínica del bromuro de tiotropio se recoge en la tabla II8,19-29.
Broncodilatación
Estudios comparados con placebo. Casaburi et al, en sendos estudios de 3 meses30 y un año de duración19, evaluaron el efecto broncodilatador del tiotropio comparado con placebo. En el primero30 encontraron una mejoría del FEV1, que se mantuvo durante los 3 meses del estudio, y una reducción en la dosis de salbutamol necesaria para el control adicional de los síntomas. En el segundo estudio19 estos efectos se mantuvieron a lo largo del período de tratamiento de 12 meses y no se observaron signos de taquifilaxia.
Estudios comparados con otros broncodilatadores:
Comparado con ipratropio. Los estudios comparativos entre tiotropio y otros broncodilatadores en la EPOC ofrecen una visión de la efectividad broncodilatadora relativa de este fármaco y de su valor añadido. Van Noord et al31 compararon, en 288 pacientes con EPOC, 18 μg de tiotropio en dosis única diaria frente a 40 μg de ipratropio cada 6 h. En este estudio el tiotropio produjo un incremento del pico de flujo espiratorio tanto matutino como nocturno, del FEV1 y de la capacidad vital forzada (FVC), y una menor necesidad de salbutamol de rescate, todo ello con una tasa de efectos secundarios similar. Posteriormente Vincken et al20, en un estudio de un año de duración, demostraron la superioridad del tiotropio tanto en la mejoría del FEV1 como de la FVC, que además se mantuvieron por encima de los valores basales (el 9,6 y el 11,6%, respectivamente), lo que no ocurrió con el ipratropio. La mejoría de la FVC puede indicar que, además del efecto broncodilatador de los anticolinérgicos sobre las vías respiratorias centrales, éstos podrían contribuir a la disminución del efecto de atrapamiento aéreo secundario al cierre tardío de las vías respiratorias de pequeño calibre. Dado que el efecto farmacológico de ambos fármacos es similar, las razones aducidas para justificar esta superioridad posiblemente haya que buscarlas en la vida media más prolongada del tiotropio y en la facilidad para cumplir con el tratamiento, de modo que los pacientes consiguen más fácilmente la dosis adecuada.
Comparado con salmeterol. Donohue et al21 demostraron que el tiotropio a dosis estándar consiguió una mejoría del FEV1 estadísticamente significativa frente al salmeterol (administrado a dosis de 50 μg cada 12 h), en un estudio de 6 meses. Posteriormente, Brusasco et al22 analizaron la eficacia y tolerabilidad del tiotropio comparado con salmeterol inhalado, y observaron que ambos fármacos fueron superiores al placebo y que el efecto del tiotropio fue significativamente mayor que el del salmeterol. La asociación de ambos fármacos también ha demostrado un efecto broncodilatador superior al de cada uno por separado cuando se administraban junto a fluticasona inhalada32.
Comparado con formoterol. El mismo efecto broncodilatador superior se ha demostrado frente al formoterol33. En 71 pacientes con EPOC, el tiotropio produjo una mejoría del FEV1 significativamente mayor que el formoterol en la media diurna y sin diferencias entre la media nocturna. Los mejores efectos se conseguían con la asociación de ambos fármacos administrados una y 2 veces al día, respectivamente, incluso sobre el efecto de cada uno administrado de forma individual. Posteriormente el mismo grupo de Van Noord et al25, en 95 pacientes con EPOC moderada-grave en fase estable, compararon la monoterapia con tiotropio frente a la asociación de tiotropio y formoterol (1-2 veces al día), y encontraron mayor beneficio con dicha asociación no sólo por lo que se refería al FEV1, sino también a la FVC y la capacidad inspiratoria, al tiempo que disminuía la necesidad del uso de broncodilatadores de rescate en estos pacientes. Estos hallazgos ya habían sido descritos en estudios previos de Cazolla et al34,35 .
Efecto sobre los volúmenes pulmonares y la tolerancia al ejercicio
Aunque el hecho fisiopatológico de la EPOC es la limitación del flujo espiratorio, el FEV1 no siempre está relacionado con la intensidad de la disnea y la tolerancia al ejercicio de los pacientes que la presentan36. El atrapamiento aéreo resultante del retraso en el vaciamiento del pulmón y el aumento del volumen pulmonar al final de la espiración se agravan con el ejercicio e impiden satisfacer las demandas ventilatorias incrementadas. La intensidad de la disnea aumenta y sólo puede alcanzarse un posterior incremento de la ventilación por medio de un incremento de la frecuencia respiratoria. Esto ocasiona un círculo vicioso al provocar mayor hiperinsuflación, que obliga a la reducción de la actividad física, que a su vez se traduce en discapacidad muscular y empeoramiento de la enfermedad. Se sabe que los broncodilatadores pueden reducir los volúmenes pulmonares estáticos en la EPOC, lo que ha llevado a diversos autores a analizar los volúmenes pulmonares como un parámetro de eficacia de estos fármacos37. En esta línea, Celli et al26 demostraron que en pacientes con EPOC estable e hiperinsuflación, tras 4 semanas de tratamiento con tiotropio, la capacidad inspiratoria aumentó significativamente frente a placebo. O'Donnell et al24 compararon tiotropio con placebo en 187 pacientes con EPOC moderada-grave e hiperinsuflación (capacidad residual funcional del 120%) evaluando múltiples variables: tolerancia al ejercicio, hiperinsuflación tanto estática como dinámica e intensidad de la disnea con el ejercicio. Se observó una reducción significativa de la capacidad residual funcional tanto en reposo como en ejercicio y una mejoría de la tolerancia al ejercicio, que persistió tras las 6 semanas de tratamiento. Esto se traduce en una mejora de la disnea, la tolerancia al ejercicio y el estado de salud38. Esta mejoría permitiría a los pacientes con EPOC aumentar sus actividades diarias y así revertir el ciclo de inactividad crónica y discapacidad muscular.
Efectos sobre el estado de salud y calidad de vida
Estudios comparados con placebo. La EPOC se considera una enfermedad sistémica. La pérdida de tolerancia al ejercicio y la disnea, junto a otros síntomas generales, determinan el estado de salud y la calidad de vida de estos pacientes. Los trabajos publicados19,27 hasta el momento han demostrado que el tiotropio se asocia con mejoras significativas y clínicamente relevantes de diversos parámetros, como son: la disnea valorada mediante cuestionarios, la tolerancia al ejercicio y el estado de salud. Tashkin y Kesten23 demostraron mejoras significativas en la disnea y el estado de salud incluso en pacientes con escasa reversibilidad inicial con el tiotropio, definida como un incremento del FEV1 menor del 12% o de 200 ml con respecto al valor basal tras la primera dosis de tiotropio.
Estudios comparados con otros broncodilatadores:
Comparados con ipratropio. Vincken et al20 encuentran que el tiotropio mejora significativamente la puntuación final del índice transicional de disnea y los dominios físicos del cuestionario SF-36 en comparación con el ipratropio, aunque esta mejoría no alcanzó el intervalo de relevancia clínica.
Comparados con salmeterol. En el estudio de Donohue et al21, donde se analizaron parámetros de calidad de vida y estado de salud, el tiotropio fue superior al salmeterol en la mejoría del índice transicional de disnea. Sin embargo, Brusasco et al22 encontraron que el tiotropio y el salmeterol producían mejorías significativas comparados con placebo, pero muy similares si se comparaban los 2 fármacos entre sí, según el índice transicional de disnea.
Exacerbaciones agudas de EPOC
Las exacerbaciones agudas (EA) de la EPOC son un factor negativo en la morbilidad y mortalidad de la enfermedad, además de suponer un coste económico importante, ya que la mayor carga económica que ocasionan los pacientes con EPOC deriva del uso hospitalario por EA de la enfermedad. Por tanto, las intervenciones que disminuyan la tasa de EA o su gravedad son esenciales en el manejo global de la enfermedad. Desde los primeros trabajos publicados, como los de Brusasco et al22 y Tashkin y Kesten23, se encontró una reducción del número de EA por paciente y año de hasta un 28% en los que utilizaban tiotropio, junto con un aumento significativo del tiempo hasta la primera EA, comparado con placebo, aunque la diferencia entre el tiotropio y el salmeterol no fue significativa. Estos resultados se han confirmado en las revisiones de los ensayos recientes más relevantes39-42 que comparan el tiotropio con placebo o ipratropio. Estos resultados se siguen confirmando en estudios cada vez de mayor duración, como el de Niewoehner et al28, de 6 meses, que corrobora la reducción significativa del porcentaje de pacientes con EA y de las hospitalizaciones ocasionadas por este motivo. Además, se retrasa la aparición de la primera EA y se reduce el uso de recursos sanitarios (hospitalización, visitas médicas no programadas y días de antibióticos). Por último, el grupo MISTRAL29 ha publicado los resultados de un amplio estudio aleatorizado con tiotropio controlado con placebo, de un año de duración. Encontraron que el uso del tiotropio producía un retraso de 100 días hasta la primera EA, una reducción del 17% en el grupo de pacientes con más de una EA, una disminución del 35% del número total de EA y una reducción del 35% de los días de exacerbación. Además, el uso de este fármaco se asoció a un menor empleo de medicación respiratoria concomitante (antibióticos y esteroides orales) y también disminuyó el número de visitas médicas no programadas, lo que implicaría un importante ahorro en los recursos sanitarios.
En general, se observa beneficio con el uso de anticolinérgicos inhalados, como indica un controvertido análisis conjunto de 22 ensayos, con un total de 15.276 participantes, que encontró que los anticolinérgicos inhalados en pacientes con EPOC reducían significativamente las EA graves (riesgo relativo = 0,67; intervalo de confianza del 95%, 0,53-0,86) y las muertes de causa respiratoria (riesgo realtivo = 0,27; intervalo de confianza del 95%, 0,09-0,81), comparados con placebo y agonistas β243.
Otras acciones
Quedan otras acciones prometedoras que deberán evaluarse en el futuro, tales como el posible efecto que el uso continuado de anticolinérgicos de acción prolongada podría tener sobre el desarrollo de la remodelación de las vías finas. Estos fármacos, al bloquear los receptores muscarínicos M344, impedirían la liberación de factores de crecimiento, lo que desembocaría en el desarrollo de enfermedad de vías finas, que se ha identificado como un precursor de la EPOC, aunque de momento esto sólo se ha demostrado en animales. Otro efecto sería la influencia sobre la caída del flujo aéreo en los pacientes tratados con tiotropio45, que sería un hecho que modificaría la historia natural de la enfermedad.
Seguridad y efectos secundarios
Tanto el tiotropio como el ipratropio se absorben escasamente a través del tracto gastrointestinal y tienen muy escasa biodisponibilidad, lo que permite un amplio margen terapéutico. El efecto adverso más frecuente en los ensayos19,20-22 ha sido la sequedad de boca, un típico efecto anticolinérgico; se presenta entre el 2% (con el oxitropio) y el 16% (con el tiotropio) de los pacientes, suele ser moderada y desaparece espontáneamente sin necesidad de interrumpir la medicación. En el caso del bromuro de ipratropio se observa tos en el 5% de los casos. Otros efectos anticolinérgicos observados ocasionalmente son retención urinaria, disuria, alteraciones prostáticas, mareos, somnolencia y estreñimiento. Los 3 fármacos pueden aumentar la presión intraocular y exacerbar una hipertensión ocular o el glaucoma de ángulo cerrado, por lo que es necesaria una estrecha vigilancia de estos pacientes. También pueden exacerbar los síntomas de hiperplasia prostática. Como ocurre con todos los fármacos que se administran por inhalación, los broncodilatores anticolinérgicos pueden inducir broncospasmo paradójico. No se han descrito interacciones desfavorables entre tiotropio y otros medicamentos o fármacos46. Son raras las reacciones alérgicas, que se manifiestan como urticaria, exantema, prurito o edema, y se deben a una hipersensibilidad a la atropina y derivados.
Un metaanálisis reciente a partir de 19 estudios aleatorizados a doble ciego de tiotropio con placebo en pacientes con EPOC47, que incluía a 4.435 personas tratadas con tiotropio y a 3.384 que recibieron placebo, encontró en el primer grupo mayor riesgo de sequedad bucal y retención urinaria, y menor riesgo de disnea y exacerbación de la EPOC, comparado con los que recibían placebo. Además, encontró que los efectos tras la aprobación y posterior comercialización del tiotropio son los mismos que en los ensayos clínicos previos, y concluye que es un fármaco seguro.
Estudios de farmacoeconomía
La EPOC es actualmente una de las enfermedades respiratorias que generan mayor morbilidad y mortalidad, lo que obliga a un elevado consumo de recursos sanitarios48 y, en consecuencia, a la necesidad de evaluar las opciones de tratamiento desde la perspectiva no sólo de la eficacia, sino también de la eficiencia. Hasta ahora, debido a las escasas opciones terapéuticas, no había estudios de farmacoeconomía en esta enfermedad, dado que no se disponía de opción comparativa. Sin embargo, tras la aparición de nuevos fármacos hay cada vez más información acerca de la idoneidad de cada medicamento. La valoración económica total incluye, además del coste económico del producto, análisis de minimización de costes, de coste-eficacia, de coste-utilidad y de coste-beneficio49.
Oostenbrink et al50 valoraron las consecuencias económicas de sustituir ipratropio por tiotropio en pacientes con EPOC mediante un análisis prospectivo de coste-eficacia de un año de duración en Holanda y Bélgica. Encontraron una reducción del número de exacerbaciones (0,74 en el grupo de tiotropio frente a 1,01 en el grupo del ipratropio); una mejoría del 51,2% en el St. George's Respiratory Questionnaire (SGRQ) frente al 34,6%, y una reducción del número de hospitalizaciones, días de estancia hospitalaria y visitas no programadas del 46, el 42 y el 36%, respectivamente, con un incremento de 180 € por paciente y año en el grupo tratado con tiotropio.
En EE.UU. Friedman et al51, que compararon a un grupo de pacientes con EPOC que recibían los cuidados habituales y a otro que además recibía tiotropio, encontraron que estos últimos presentaban una reducción significativa del 20% en las exacerbaciones, del 40% en las hospitalizaciones y del 50% en los días de estancia hospitalaria, sin variación en el uso de los otros recursos diferentes de la hospitalización entre ambos grupos. Dado que la hospitalización contribuye en gran medida al coste global de la EPOC, la adición de tiotropio a las medidas habituales podría reducir el gasto global de la EPOC, si bien los autores no consideran el coste de la adquisición del tiotropio.
D'Souza et al52 realizan una crítica metodológica de la evidencia farmacoeconómica en el tratamiento farmacológico de la EPOC analizando 7 estudios. Los resultados considerados en la EPOC fueron: a) medidas fisiológicas; b) medidas clínicas y síntomas; c) medidas de calidad de vida, y d) medidas de esperanza de vida. De los broncodilatadores, el tiotropio se consideró más coste-efectivo que el ipratropio, aunque no se alcanzó ninguna conclusión con respecto a los agonistas β2 de larga duración.
En España, 2 análisis realizados en pacientes con EPOC respaldan la mejor relación coste-eficacia del tiotropio, uno de ellos comparado con el ipratropio53 y el segundo realizado desde la perspectiva del Sistema Nacional de Salud54. En este último, que consideró únicamente los costes directos sanitarios, se encontró que el tiotropio era más efectivo que el ipratropio y el salmeterol tanto en parámetros clínicos objetivos (FEV1) y subjetivos (como el SGRQ y el índice transicional de disnea) como en la disminución de estancias hospitalarias y en la de exacerbaciones. En todos los casos resultó más coste-efectivo que sus alternativas, lo que supone un importante ahorro en el ámbito hospitalario.
Papel en el tratamiento de las guías clínicas de la EPOC
Los objetivos del tratamiento en la EPOC son: a) reducir la progresión y mortalidad de la enfermedad; b) mejorar los síntomas, la tolerancia al ejercicio y la calidad de vida relacionada con la salud, y c) prevenir las exacerbaciones y complicaciones. Los broncodilatadores son los fármacos más utilizados y eficaces para controlar los síntomas en la EPOC y constituyen el núcleo fundamental del tratamiento. Se administran a demanda para el alivio de síntomas persistentes o empeoramiento de éstos, o de forma reglada para prevenir o reducir los síntomas o las exacerbaciones. La vía inhalada es la preferida por su escasez de efectos secundarios y el rápido comienzo de acción. Desde que se elaboraron las primeras guías clínicas, los fármacos anticolinérgicos se han incluido como tratamiento farmacológico de primera línea. El tratamiento regular con broncodilatadores de acción prolongada es más efectivo y conveniente que el tratamiento con los broncodilatadores de acción corta. La combinación de broncodilatadores con diferente mecanismo de acción y duración de ésta puede aumentar el grado de broncodilatación con menos efectos secundarios, logrando lo que algunos autores han denominado "un efecto de reducción de volumen pulmonar farmacológico"55.
Recomendaciones clínicas
Las guías internacionales de práctica clínica56-58 recomiendan tiotropio o agonistas β2 de larga duración como tratamiento de primera línea en la EPOC8. Si bien en la elección del agente pueden influir las características individuales del paciente, debe considerarse la capacidad del tratamiento para mejorar no sólo la función pulmonar, sino también otros parámetros centrados en el paciente, como la disnea, la tolerancia al ejercicio, las exacerbaciones y la calidad de vida relacionada con la salud39. El tiotropio tiene 2 propiedades importantes: su selectividad funcional por los receptores muscarínicos que median la contracción del músculo liso de la vía aérea, y una duración de acción extremadamente larga, con lo cual es suficiente una dosis diaria19.
En definitiva, los anticolinérgicos de larga duración son el tratamiento de mantenimiento de elección en la EPOC estable, pues aúnan eficacia clínica y ventajas farmacológicas. Queda por comprobar si estos fármacos serán capaces de modificar la historia natural de la enfermedad mediante su efecto sobre la remodelación de las vías finas y sobre la caída del flujo aéreo a largo plazo.
Correspondencia: Dra. I. Alfageme Michavila. Bobby Deglané, 5, 3.º D. 41001 Sevilla. España.
Correo electrónico: ialfageme@separ.es