Introducción
Los avances surgidos en el conocimiento de la patogenia de la enfermedad pulmonar obstructiva crónica (EPOC), la consideración de objetivos terapéuticos integrales, la aparición de fármacos más eficaces y la introducción de nuevos elementos de valoración de resultados han dado lugar a un cambio fundamental en la visión de dicha enfermedad y en las estrategias para su control, estrategias que ya no sólo se dirigen al tratamiento sintomático, sino que buscan reducir las complicaciones, mejorar la calidad de vida de los pacientes y, lo que está siendo ya objetivo prioritario, disminuir la mortalidad asociada a la enfermedad.
La definición más reciente de EPOC, formulada por el grupo de expertos de la Global Initiative for Obstructive Lung Disease (GOLD) en la revisión de 2006, establece que se trata de una enfermedad prevenible con algunos efectos extrapulmonares significativos, los cuales pueden contribuir en algunos pacientes a la gravedad de la enfermedad. El componente pulmonar de ésta se caracteriza por la limitación no totalmente reversible al flujo aéreo, que por lo común es progresiva y se asocia a una respuesta inflamatoria pulmonar anormal ante partículas o gases nocivos1. De acuerdo con la definición, que por otra parte no ha cambiado de manera sustancial a lo largo de la presente década, el tratamiento de la EPOC habría de dirigirse a inhibir el mecanismo inflamatorio anormal, a revertir la obstrucción al flujo aéreo y a prevenir las consecuencias sistémicas de la enfermedad, aparte, por supuesto, de cubrir los objetivos clínicos fundamentales: controlar los síntomas, reducir las exacerbaciones, mejorar la calidad de vida e incrementar la supervivencia.
Sin embargo, aunque cada vez es mayor el número de datos que señalan que disponemos de fármacos capaces de reducir la progresión de la enfermedad e incluso mejorar la supervivencia de los pacientes, a fecha de hoy no existe evidencia científica suficiente para sostener estas afirmaciones. En consecuencia, en las recomendaciones GOLD 2006 se mantiene el uso de broncodilatadores de acción corta a demanda para pacientes con enfermedad leve, mientras que se recomienda la utilización de broncodilatadores de acción prolongada como fármacos de primera elección para el tratamiento regular de la enfermedad, si bien la utilización de corticoides inhalados se extiende a prácticamente cualquier paciente con un volumen espiratorio forzado en el primer segundo (FEV1) menor del 50%, puesto que la anterior condición de existencia de exacerbaciones repetidas queda reducida a algo tan vago como "por ejemplo tres en los últimos 3 años". A lo largo de este capítulo revisaremos los datos básicos y clínicos que sustentan estas recomendaciones.
Agonistas β2 en la EPOC
Aunque las alteraciones estructurales fundamentales en la EPOC son los cambios inflamatorios y el remodelado final de la vía aérea, así como la destrucción de los septos alveolares, hay también hiperplasia de músculo liso en las vías aéreas pequeñas, así como un incremento del tono colinérgico basal, alteraciones estas que justifican la utilización de los broncodilatadores, tanto los agonistas β2 como los anticolinérgicos. La acción broncodilatadora de los agonistas β2 se lleva a cabo estimulando los receptores beta de la vía aérea, lo que ocasiona un incremento del adenosín monofosfato cíclico intracelular, que al inhibir la fosforilación de la miosina y reducir el calcio iónico intracelular produce relajación del músculo liso, además de bloquear la broncoconstricción inducida por diferentes estímulos. Además, se han descrito la inhibición de la liberación de mediadores por las células inflamatorias, reducción de la permeabilidad vascular e incremento del aclaramiento mucociliar2. Esta acción antiinflamatoria podría estar detrás de algunos de los resultados asociados a su utilización. Por último, la reducción de las resistencias vasculares pulmonares puede desembocar en una mejoría de la función ventricular.
Disponemos de 2 tipos fundamentales de adrenérgicos β2: los de acción corta (salbutamol y terbutalina, fundamentalmente) y los de acción prolongada (formoterol y salmeterol). Existe evidencia de que la utilización regular de agonistas β2 de acción corta se asocia a una mejoría en las pruebas de función pulmonar inmediatamente después de la administración del fármaco, disminuye la sensación cotidiana de disnea y, aunque el número de estudios en que esto se ha evaluado es escaso, también incide de forma positiva en la calidad de vida3,4 . Estos datos justifican que, aunque no se disponga de datos concluyentes por lo que se refiere a tolerancia al ejercicio o exacerbaciones, en los ensayos clínicos aleatorizados los pacientes que reciben tratamiento de forma regular con estos fármacos muestren un grado de satisfacción superior al que manifiestan cuando son tratados con placebo y broncodilatadores a demanda.
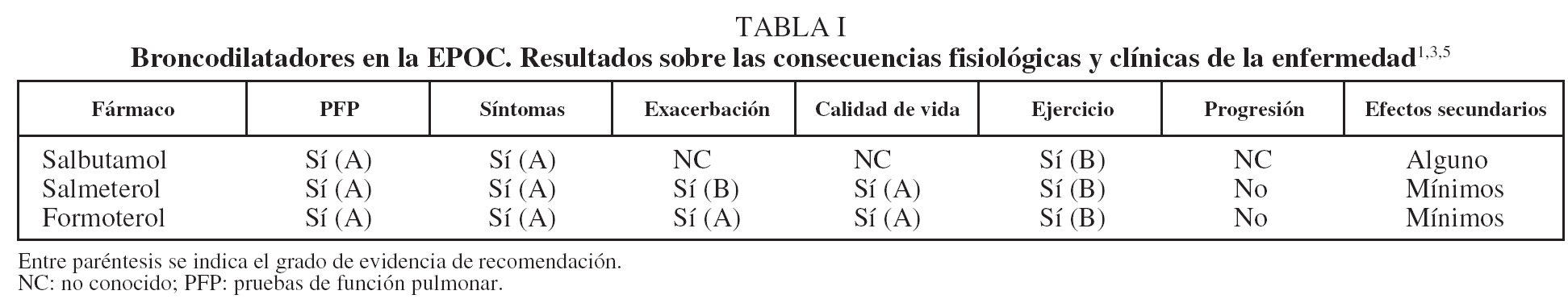
En la última década la introducción de los broncodilatadores agonistas β2 de acción prolongada ha significado un importante avance en el manejo de la EPOC, mejorando tanto los resultados como el cumplimiento del tratamiento. Ensayos clínicos aleatorizados y controlados con placebo han puesto de manifiesto la eficacia tanto del salmeterol como del formoterol en cuanto a la mejoría en las pruebas de función pulmonar, síntomas, calidad de vida y, más recientemente, tolerancia al ejercicio, si bien, como ya se ha señalado, no se han evidenciado cambios en la progresión de la enfermedad5-7 (tabla I).
Adrenérgicos β2 y función pulmonar
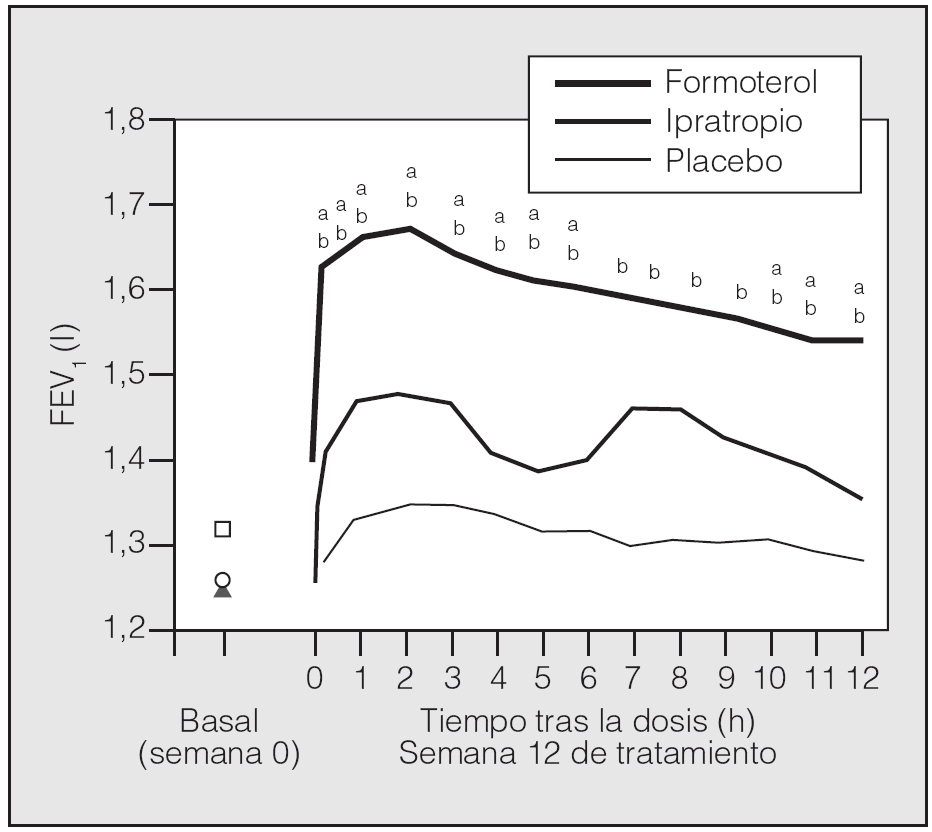
Tanto los broncodilatadores de acción corta como, sobre todo, los de acción prolongada han mostrado incrementos de los valores del FEV1 y de la capacidad vital forzada después de la inhalación del broncodilatador. Con los últimos se consigue una duración del efecto broncodilatador que alcanza las 12 h y el declinar de la acción se produce de manera menos abrupta, y se obtienen cambios significativos tanto cuando los resultados se comparan con placebo como con anticolinérgicos de acción corta (fig. 1). Los resultados son aún mejores cuando se consideran otros parámetros de la función pulmonar. La EPOC, además de por la obstrucción al flujo aéreo, se caracteriza por la presencia de hiperinsuflación pulmonar y atrapamiento aéreo, situación que se agrava durante el ejercicio. Se ha puesto de manifiesto que la administración de adrenérgicos β2, tanto de acción corta como de acción prolongada, se asocia a un incremento de la capacidad inspiratoria, lo que traduce una reducción de la hiperinsuflación. Aunque esta acción se ha observado con salbutamol, salmeterol y formoterol, los resultados parecen ser mejores con este último9.
Fig. 1. Cambios producidos en el volumen espiratorio forzado en el primer segundo (FEV1) tras la administración de un broncodilatador adrenérgico β2 de acción prolongada (formoterol)8. ap < 0,001 para formoterol frente a ipratropio; bp < 0,05 para formoterol frente a placebo.
Síntomas, calidad de vida relacionada con la salud y tolerancia al ejercicio
Los agonistas β2, ya sea de acción corta o prolongada, han demostrado reducir la sensación de disnea y mejorar la calidad de vida de los pacientes con EPOC, pero los resultados son superiores y más homogéneos con los fármacos de acción prolongada. En cuanto a la mejoría en la tolerancia al ejercicio, en un estudio en que se comparaba la tolerancia al ejercicio en cicloergómetro, con carga constante de intensidad moderada, se observó que la administración de salmeterol se acompañaba de un incremento significativo del tiempo de tolerancia. Por otra parte, también se puso de manifiesto que había una relación entre la mejoría en la capacidad inspiratoria, la reducción de la disnea y el incremento de la tolerancia al ejercicio, por lo que esta última podría estar en relación con una mayor eficacia de la ventilación secundaria a la reducción de la hiperinsuflación pulmonar. Resultados similares se han comunicado en relación con el uso de tiotropio10,11.
Exacerbaciones
No existe evidencia de que los broncodilatadores de acción corta reduzcan el número de exacerbaciones en los pacientes con EPOC, a pesar de que el hecho de que el número de pacientes que abandonan los ensayos clínicos sea mayor entre los que reciben placebo que entre los tratados con principio activo pueda estar relacionado con esta posibilidad. Por el contrario, sí puede afirmarse que el uso de adrenérgicos β2 de acción prolongada consigue disminuir el número de exacerbaciones y aumentar el intervalo de tiempo sin exacerbación en los pacientes con EPOC. Al menos un estudio llevado a cabo con salmeterol8 y 2 con formoterol12,13 han mostrado su capacidad para reducir las exacerbaciones. Más recientemente, y con un método distinto, ha podido observarse que la adición de salmeterol al tratamiento regular de los pacientes también redujo el número de exacerbaciones que presentaron14.
En resumen, aunque los broncodilatadores adrenérgicos β2 no modifican la progresión de la enfermedad, su uso determina cambios puntuales en las tasas de flujo aéreo espiratorio y, todavía más importante desde el punto de vista clínico, hay datos de que el mayor impacto en la función pulmonar conseguido con los broncodilatadores es el que se observa en otro aspecto fundamental de la fisiopatología de la EPOC: la hiperinsuflación pulmonar. En cuanto al control de los síntomas de la enfermedad, la efectividad de los agonistas β2 se manifiesta por la disminución de la disnea, la mejoría en la calidad de vida y la reducción del número de exacerbaciones. Además, también se ha mostrado asociación entre el tratamiento con agonistas β2 y una mayor tolerancia al ejercicio. De acuerdo con estos resultados, las recomendaciones actuales de tratamiento establecen el uso de los agonistas β2 de acción corta a demanda en los estadios leves y con escasos síntomas. Por el contrario, en los pacientes sintomáticos que requieren tratamiento de forma regular se recomienda la utilización de broncodilatadores de acción prolongada. También hay evidencia de que la asociación de broncodilatadores mejora los resultados obtenidos con cada uno de ellos por separado. Analizando estas 2 últimas frases, una opción de tratamiento que comienza a evaluarse, la combinación de adrenérgicos β2 de acción prolongada y tiotropio, podría resultar de elección en términos de eficacia y seguridad15.
Corticoides inhalados
El concepto de EPOC como enfermedad inflamatoria, unido a los resultados obtenidos con el empleo de corticoides inhalados (CI) en el asma, ha impulsado el desarrollo de la investigación enfocada a establecer el papel de estos fármacos en el tratamiento de la EPOC. No obstante, se debe tener en cuenta que el proceso inflamatorio de la EPOC no es igual al que subyace en el asma, y esto puede explicar los diferentes resultados. Mientras que en el asma los hallazgos en la mucosa bronquial incluyen un incremento de eosinófilos, mastocitos y linfocitos T CD4, en los pacientes con EPOC se observa un incremento de mastocitos, macrófagos, neutrófilos y linfocitos T CD8. Por otra parte, la creciente evidencia de la presencia de inflamación sistémica en la EPOC aboga también a favor del uso de CI en el tratamiento de la enfermedad.
Hasta ahora los resultados arrojados por los estudios encaminados a evaluar el impacto de los CI sobre el componente inflamatorio, tanto celular como humoral, presente en las vías aéreas de los pacientes con EPOC han sido escasos y poco concluyentes, lo que ha llevado a algunos autores a postular que la EPOC supondría una situación de corticorresistencia16. Recientemente, en un estudio controlado y aleatorizado, llevado a cabo sobre muestras de mucosa bronquial obtenidas mediante fibrobroncoscopia y biopsia, se puso de manifiesto que, comparado con placebo, el tratamiento con fluticasona en pacientes con EPOC se asociaba a una disminución del número de mastocitos y del cociente CD8/CD4. La reducción de mastocitos podría explicar la disminución de exacerbaciones que, como veremos, se asocia al tratamiento con CI17,18. Con respecto al impacto que éstos pueden tener sobre el componente inflamatorio sistémico, en un estudio reciente la supresión del tratamiento con fluticasona se asoció a un incremento de las concentraciones séricas de proteína C reactiva, mientras que la reintroducción del fármaco produjo un descenso de sus valores del 50%. Cambios paralelos, aunque menos espectaculares, se observaron en otros marcadores inflamatorios, concretamente en interleucina-619.
En cuanto a los resultados clínicos, 5 grandes estudios aleatorizados y controlados con placebo20-24 han analizado su eficacia en el tratamiento de pacientes con EPOC estable. Estos estudios han evaluado los resultados obtenidos con diferentes CI (triancinolona, budesonida y fluticasona), con datos concordantes. Aunque ninguno de ellos ha demostrado mejoría en las pruebas de función pulmonar ni modificaciones en la progresión de la enfermedad, cuando se llevó a cabo un análisis por subgrupos, en 2 de los estudios, EUROSCOP22 e ISOLDE23, se pudo comprobar que los pacientes con mayor gravedad inicial sí mostraban una mejor evolución cuando recibían tratamiento con corticoides. En cualquier caso, sí se ha encontrado que, sobre todo en los pacientes con enfermedad grave y exacerbaciones frecuentes, el uso de CI se asocia a una mejoría en los síntomas y en la calidad de vida, así como a una reducción del número de exacerbaciones23.
Estudios ulteriores a éstos, que podríamos considerar esenciales, confirman los resultados. Así, con un diseño diferente del utilizado en los ensayos clínicos antes mencionados, el estudio COPE25 puso de manifiesto que la interrupción del tratamiento con fluticasona se asociaba a un incremento significativo del número de exacerbaciones. Estos resultados han quedado confirmados en estudios posteriores publicados por el grupo de estudio COSMIC26. También los estudios encaminados a evaluar el tratamiento combinado con CI y adrenérgicos β2 de acción prolongada estudios que se comentarán más adelante confirman estos resultados.
Aunque se ha señalado que no existe evidencia respecto a la acción de los CI en la progresión de la enfermedad, probablemente esto deba ser objeto de estudios posteriores, ya que un metaanálisis elaborado en 2003 ponía de manifiesto una reducción significativa de la tasa de declive del FEV1 cuando se comparaban pacientes que habían o no recibido tratamiento con CI, aunque la magnitud de la diferencia encontrada entre los grupos (7,7 ml por año) no puede considerarse clínicamente relevante27.
El último aspecto que debe considerarse en relación con la utilización de CI es su posible impacto en la supervivencia. Sin embargo, este análisis debe forzosamente incluir el papel de las combinaciones de corticoides y agonistas β2, por lo que será expuesto de forma independiente.
Corticoides inhalados en combinación con agonistas β2
Se han postulado diferentes mecanismos de acción molecular que podrían explicar la existencia de una actividad sinérgica entre los adrenérgicos β2 y los CI. Así, en algunos estudios llevados a cabo en fibroblastos y células de músculo liso vascular, los agonistas β2 inducen una translocación nuclear de los receptores de CI. También se ha señalado la posibilidad de que los agonistas β2 induzcan una inhibición del factor de transcripción nuclear kappa, favoreciendo así la acción antiinflamatoria de los corticoides. En cultivos de células de músculo liso de la vía aérea humana la adición combinada de agonistas β2 y corticoides se asocia a una notable disminución de la producción de interleucina-8 inducida por el factor de necrosis tumoral alfa. En todo caso, los estudios disponibles son escasos y los resultados, contradictorios28.
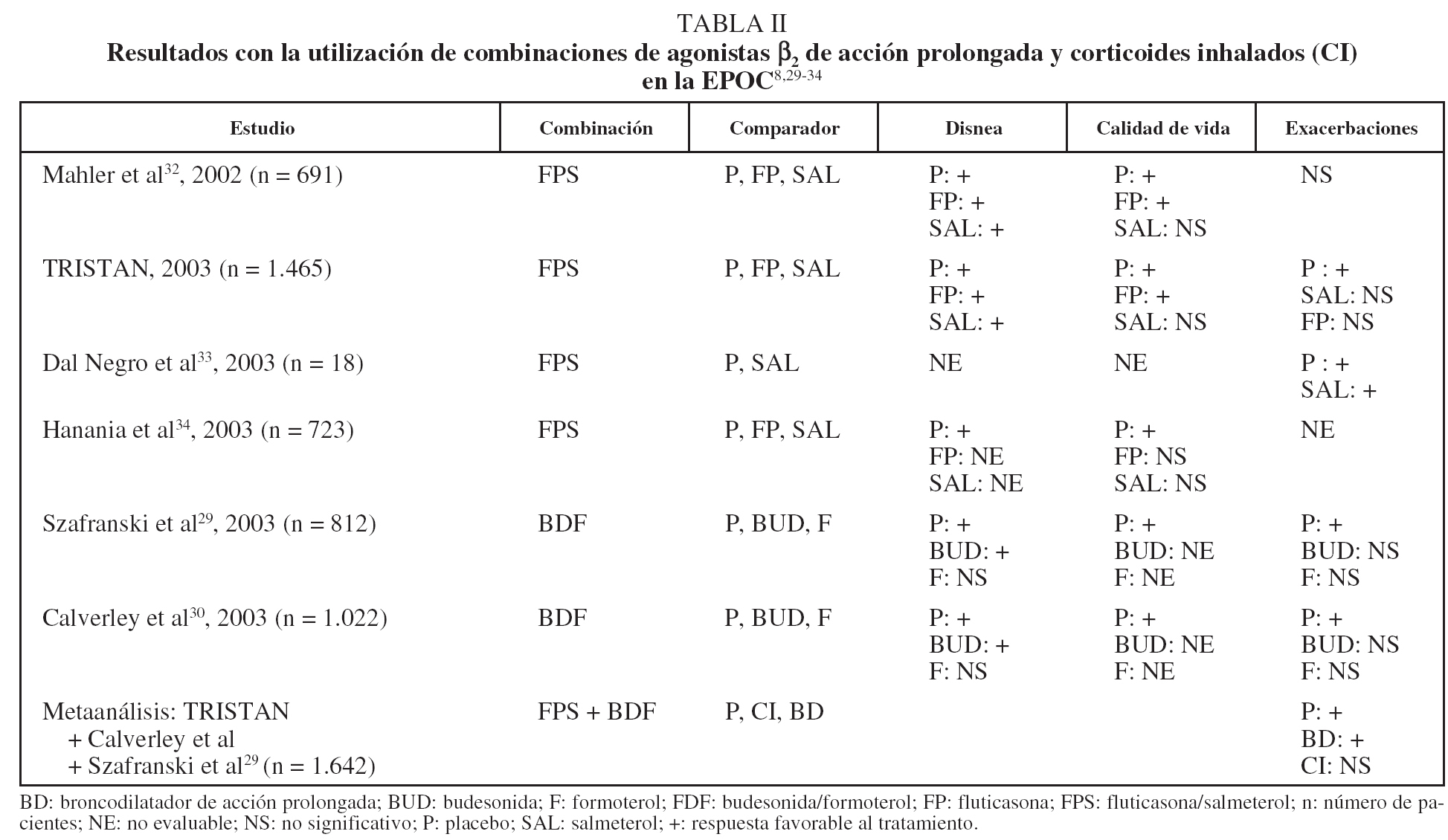
Tres grandes estudios aleatorizados y controlados con placebo, uno de ellos realizado con salmeterol-fluticasona8 y 2 con formoterol-budesonida29,30, han analizado los resultados clínicos obtenidos con estas asociaciones, comparándolos con los que se observan tanto con placebo como con cada uno de los componentes por separado. En estos estudios se ha puesto de manifiesto que el uso combinado de CI y agonistas β2 de acción prolongada en pacientes con EPOC determina una disminución del número de exacerbaciones y una mejora en la calidad de vida de los pacientes. Los resultados son favorables para el uso de la combinación no sólo cuando se compara con placebo, sino también cuando se enfrenta a cada uno de los componentes por separado. Como ocurría al analizar los efectos obtenidos con el uso de corticoides en monoterapia, los resultados son mejores cuando se analiza a pacientes que presentan tasas altas de exacerbación8,29. Con posterioridad a estos estudios fundamentales han aparecido otros trabajos que confirman estos resultados. En una revisión reciente de la Cochrane Library actualizada en 2005 se recogen 6 estudios en los que se ha aleatorizado a un total de 4.118 pacientes31 (tabla II). En 4 de los estudios se valora la combinación fluticasona-salmeterol8,32-34 y en los otros 2, budesonida-formoterol29,30. En todos los estudios el uso de la combinación mejora significativamente tanto los síntomas como la calidad de vida y disminuye el número de exacerbaciones, cuando se compara con placebo. Además, la combinación fluticasona-salmeterol consigue mejores resultados en síntomas que los obtenidos por salmeterol o fluticasona de forma aislada y mejores resultados en calidad de vida que los conseguido por fluticasona. Con respecto a los resultados obtenidos por cada uno de los componentes, la combinación de budesonida y formoterol consigue mejores resultados que ambos por separado en cuanto a la reducción de exacerbaciones. Cuando se agrupan los resultados obtenidos con ambas combinaciones, se observa una reducción significativa del número de exacerbaciones en relación con los resultados obtenidos con el agonista β2, aunque no con el placebo. El metaanálisis concluye que la utilización de agonistas β2 de acción prolongada y CI mejora los resultados obtenidos por los agonistas β2 en exacerbaciones y por los CI en síntomas y calidad de vida, apoyando su uso en pacientes con enfermedad moderada o grave que además presentan un número de exacerbaciones anuales igual o superior a 231. Esta conclusión sustenta las indicaciones actualmente establecidas por sociedades científicas y Administración sanitaria.
Corticoides inhalados, agonistas β2 y mortalidad en la EPOC
Hasta ahora sólo el abandono del tabaco y el uso de oxigenoterapia crónica domiciliaria en los pacientes con insuficiencia respiratoria se han asociado a un incremento de la supervivencia en los pacientes con EPOC. Sin embargo, en los últimos 5 años han aparecido varios estudios epidemiológicos de base poblacional que señalan un posible impacto del tratamiento con CI sobre la mortalidad observada en pacientes con EPOC. El primer estudio de este tipo que se realizó fue el de Sin y Tu35, que utilizaron una base de datos administrativa de Ontario. Este estudio canadiense de corte poblacional analizó la relación entre la utilización de CI en pacientes ancianos con EPOC y el riesgo posterior de ingreso hospitalario o de mortalidad. Se incluyó a 22.620 pacientes de 65 o más años de edad, que habían ingresado recientemente en un hospital por EPOC. Al 51% se le prescribió al menos un CI en los primeros 90 días después del alta. Tras un año de seguimiento, en el grupo de pacientes que habían recibido CI el número de hospitalizaciones por EPOC fue un 24% menor (intervalo de confianza del al 95%, 20-29%) y la probabilidad de morir durante el año siguiente, un 29% inferior (intervalo de confianza del 95%, 22-35%). Por el contrario, la utilización a largo plazo de corticoides orales se asoció a un aumento del riesgo de mortalidad y de reingreso. Resultados similares publicaron Soriano et al36 en un estudio posterior, basado en datos obtenidos de los registros de médicos de atención primaria de Gran Bretaña. Las principales críticas realizadas a estos estudios se basan en el denominado "sesgo de tiempo inmortal", es decir, la ventaja que supone para el grupo de tratamiento la necesidad de que los pacientes incluidos en él tienen forzosamente que sobrevivir, incluso cuando todavía no reciben tratamiento. Este sesgo se superpone con el denominado de "tiempo variable", expresión que hace referencia a que al computar el tiempo de supervivencia en ocasiones se incluyen períodos de no tratamiento. Pese a estas críticas, estudios epidemiológicos posteriores, cuyos diseños evitan los sesgos mencionados, corroboran los datos que apuntan al efecto de los corticoides en la mortalidad37.
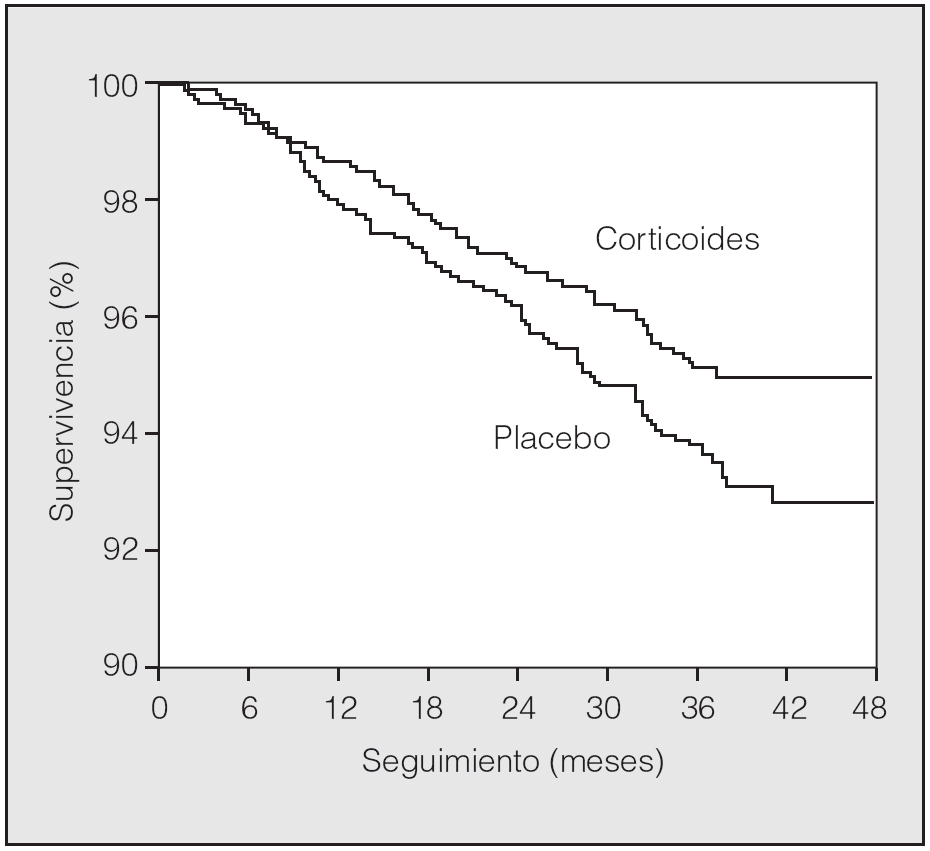
Un paso más en esta línea de estudio lo constituye el estudio elaborado a través de la base de datos ISEEC (Inhaled Steroid Effects Evaluation in COPD) y publicado por Sin et al38. Este estudio reúne datos procedentes de algunos de los estudios aleatorizados y controlados con placebo que se han realizado en los últimos años en pacientes con EPOC que han recibido tratamiento con CI. Con más de 5.000 pacientes incluidos (edad media: 59 años; FEV1: 59%), se concluye que los pacientes tratados con CI experimentan una mejoría significativa en la tasa de supervivencia a lo largo de los años, en comparación con los que recibieron placebo (fig. 2). En los pacientes con FEV1 inferior al 60% la administración de CI supuso un incremento de la supervivencia acumulada del 37%, en comparación con placebo, después de 2 años de seguimiento, aunque cuando los pacientes tenían un FEV1 superior al 60% no se apreciaron diferencias significativas.
Fig. 2. Tratamiento con corticoides inhalados y supervivencia en pacientes con EPOC. Resultados de grupo ISEEC (Inhaled Steroid Effects Evaluation in COPD). Se observó un incremento de la supervivencia del 37% en los pacientes que habían recibido tratamiento con corticoides inhalados, con o sin agonistas β2 asociados (p < 0,01)38.
Sin duda la mayor evidencia hasta ahora disponible corresponde a los resultados preliminares del estudio TORCH39, un ensayo clínico de 3 años de duración, controlado con placebo, en el que se incluyó a más de 6.000 pacientes diagnosticados de EPOC, con un FEV1 menor del 60%, que fueron aleatorizados a 4 grupos: placebo, salmeterol, fluticasona y salmeterol-fluticasona. La mortalidad de los pacientes tratados con corticoides fue un 2,7% menor que la de los pacientes de grupo control, lo que supone una reducción de la mortalidad del 17% en relación con el grupo placebo. Aunque de acuerdo con el análisis preestablecido de mayor robustez, la mortalidad bruta por todas las causas, esta reducción no llega a alcanzar la significación estadística (p = 0,052), un análisis de mortalidad secundario ajustado por grado de severidad, estado nutricional y características de exposición al tabaco, pone de manifiesto un riesgo de muerte significativamente menor para los pacientes tratados con combinación de corticoide y beta-2-agonista que para los que recibieron placebo.
En resumen, los CI determinan una reducción en el número de exacerbaciones y un incremento de la calidad de vida en los pacientes con EPOC sin que exista evidencia suficiente que permita establecer un posible impacto en la evolución y pronóstico de la enfermedad. De acuerdo con estos datos, las normativas actuales recomiendan su uso en pacientes con FEV1 menor del 50% y al menos una exacerbación anual.
Correspondencia: Dra. P. de Lucas Ramos.
Servicio de Neumología. Hospital General Universitario Gregorio Marañón.
Dr. Esquerdo, 46. 28007 Madrid. España.
Correo electrónico: plucasr.hgugm@salud.madrid.org