Introducción
El cáncer colorrectal es una de las neoplasias más frecuentes en los países desarrollados. Se estima que, sólo en EE.UU., durante el año 2006 se habrán diagnosticado más de 148.000 nuevos casos y que más de 55.000 pacientes habrán fallecido como consecuencia de dicha enfermedad1. Aproximadamente el 10% de los pacientes con cáncer colorrectal desarrollan metástasis pulmonares (MP), si bien sólo el 2-4% de todos los pacientes tienen MP como única localización de recidiva2. Aunque el tratamiento del cáncer colorrectal metastático con quimioterapia ha experimentado un gran avance durante la última década, consiguiendo medianas de supervivencia de unos 20-22 meses, la supervivencia a los 5 años de los pacientes no candidatos a cirugía de rescate sigue siendo menor del 5%3.
Durante las últimas 2 décadas se han publicado varias series retrospectivas de pacientes con MP de cáncer colorrectal. Las supervivencias globales a los 5 años descritas en esos estudios oscilan entre el 21 y el 56%4-18, probablemente debido a la heterogeneidad de los criterios de selección y a la variabilidad en el tratamiento multimodal realizado. A diferencia de lo que ocurre con las metástasis hepáticas de cáncer colorrectal19, no hay aún unos factores pronósticos universalmente aceptados, debido a la discordancia en los resultados de los distintos trabajos. Además, la gran mayoría de las series han omitido en su análisis factores pronósticos cuya relevancia en el cáncer colorrectal es conocida, como la administración de quimioterapia adyuvante (tras la resección), o factores patológicos derivados del tumor primario.
En este estudio analizamos datos de una serie de pacientes con MP de cáncer colorrectal resecadas en un solo centro, durante un período de 10 años, a los que se trató con criterios quirúrgicos y oncológicos homogéneos, y evaluamos los factores pronósticos de la supervivencia global.
Pacientes y métodos
Se ha realizado un estudio de cohortes retrospectivo de los pacientes a los que se habían extirpado MP de cáncer colorrectal en nuestro centro desde enero de 1993 hasta junio de 2004. Para la identificación de los casos se utilizó la base de datos informatizada de nuestro centro. Los criterios para considerar la resección de MP fueron los siguientes: a) las MP objetivadas radiológicamente parecían técnicamente resecables, con independencia de su número o localización; b) la función respiratoria estimada tras la resección era suficiente para no dificultar las actividades cotidianas; c) el tumor primario estaba controlado; d) no había evidencia de enfermedad extratorácica, salvo que estuviera limitada a un solo órgano y fuera también técnicamente resecable, y e) la situación funcional y comorbilidad no contraindicaban la cirugía torácica.
Antes de la cirugía, y en un plazo no superior a 6 semanas, se realizaban a todos los pacientes: radiografía de tórax, electrocardiograma, bioquímica general, hemograma, determinación de antígeno carcinoembrionario (CEA), espirometría, tomografía axial computarizada (TAC) de tórax y abdomen (y pelvis en caso de carcinoma primario rectosigmoideo) con contraste intravenoso y cortes separados como máximo 1 cm, valoración preanestésica y colonoscopia completa (salvo que se hubiera realizado una con resultado normal en un plazo no superior a 6 meses). En función de los síntomas de cada paciente y de los hallazgos encontrados en otras exploraciones se les podían realizar TAC cerebral, gammagrafía ósea y resonancia magnética pélvica y/o hepática. La tomografía por emisión de positrones (PET, con 18F-fluorodesoxiglucosa) se efectuaba según disponibilidad y criterio clínico. Antes de la intervención los pacientes eran valorados conjuntamente por un miembro de los Servicios de Cirugía Torácica, Radiología y Oncología Médica de nuestro centro, para determinar la indicación y comprobar que cumplían todos los requisitos establecidos.
En general, el procedimiento quirúrgico de elección fue la resección atípica, intentando preservar la máxima cantidad de parénquima pulmonar, aunque no se descartaban resecciones anatómicas mayores en el caso de que fueran necesarias para conseguir la erradicación total del tumor. No se contemplaba la disección ganglionar de forma sistemática, salvo que se evidenciara afectación macroscópica durante la intervención.
Si no había progresión precoz de la enfermedad, los pacientes recibían quimioterapia adyuvante antes de 10 semanas tras la resección, siempre que estuvieran recuperados de las posibles complicaciones quirúrgicas, no tuvieran ninguna contraindicación formal y hubiera fármacos activos con los que no hubieran progresado previamente. Tras la cirugía iniciaban un seguimiento periódico, al menos de forma trimestral los 2 primeros años y semestral tras el tercer año, realizándose en cada visita anamnesis, exploración física y analítica general con determinación de CEA y valoración radiológica mediante TAC, al menos cada 6 meses.
Se recogieron las siguientes variables clínicas para el análisis de factores pronósticos: edad, sexo, comorbilidad respiratoria y cardíaca, localización (recto, sigma, colon) y estadio TNM del tumor primario20, grado de diferenciación y subtipo histológico de adenocarcinoma, tratamiento complementario administrado tras la resección del primario, resección de metástasis extratorácicas previas o sincrónicas, realización de PET, valor de CEA preoperatorio, técnica de resección pulmonar, tamaño, número y localización de las MP extirpadas, presencia de invasión pleural o afectación de bordes en estudio anatomopatológico, complicaciones posquirúrgicas y tratamientos complementarios administrados.
Análisis estadístico
La supervivencia global (SG) se calculó desde la fecha de la cirugía de las MP hasta la muerte o último contacto. El intervalo libre de enfermedad (ILE) en el momento de la cirugía de MP se calculó desde la fecha de la última intervención quirúrgica realizada con intención curativa (del primario o de metástasis hepáticas previas) hasta la fecha de diagnóstico de las MP. Las variables cuantitativas continuas referentes a parámetros analíticos se categorizaron según los límites de referencia de nuestro laboratorio. Para el resto de variables continuas se escogió el valor de corte que conseguía una mejor discriminación. Se estableció a priori como límite de significación estadística un valor de p < 0,05. Las supervivencias medianas y actuariales se calcularon según el método de Kaplan-Meier. Para la comparación de curvas se utilizó la prueba de los rangos logarítmicos de Cox-Mantel. Se aplicó el modelo de riesgos proporcionales de Cox para analizar el efecto entre las covariables y la supervivencia, incluyéndose aquéllas con un valor de p ≤ 0,20 en el univariante. El criterio usado para la introducción de las covariables fue la prueba de la razón de verosimilitud por pasos hacia atrás. El análisis estadístico se realizó con el programa SPSS (Statistical Package for Social Science) para Windows, versión 12.0 (SPSS Inc., Chicago, IL, EE UU).
Resultados
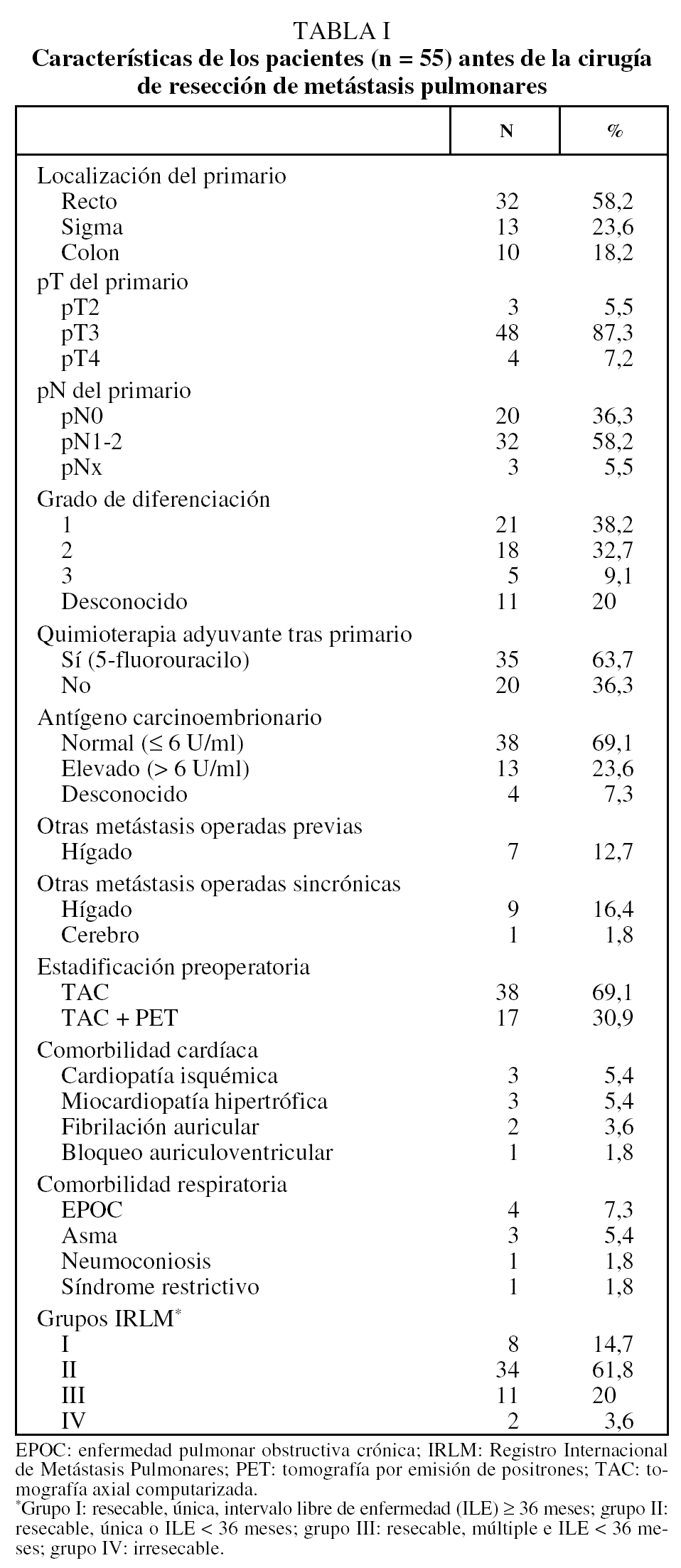
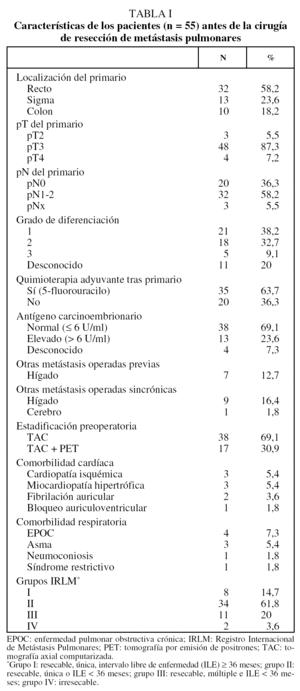
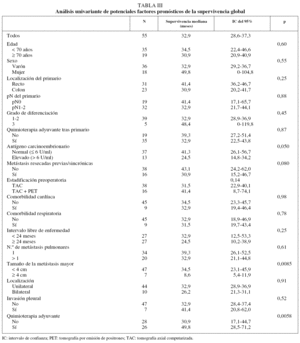
Se incluyó en el estudio a 55 pacientes a quienes se había practicado en nuestro centro resecciones pulmonares por metástasis de cáncer colorrectal, de los que 36 (65,5%) eran varones y 19 (34,5%) mujeres. La edad media ± desviación estándar fue de 64,5 ± 10,2 años (rango: 41-80). A 7 pacientes (12,7%) se les habían resecado metástasis hepáticas antes del diagnóstico de las MP. En el momento del diagnóstico de las MP 10 pacientes (18,2%) presentaban enfermedad extrapulmonar, que fue también resecada, uno en el cerebro y 9 en el hígado (uno de ellos con resección previa de metástasis hepáticas). La mediana de ILE en el momento de cirugía de MP fue de 21,2 meses (rango: 1,9-62,7). Las características de los pacientes y del tumor primario se recogen en la tabla I.
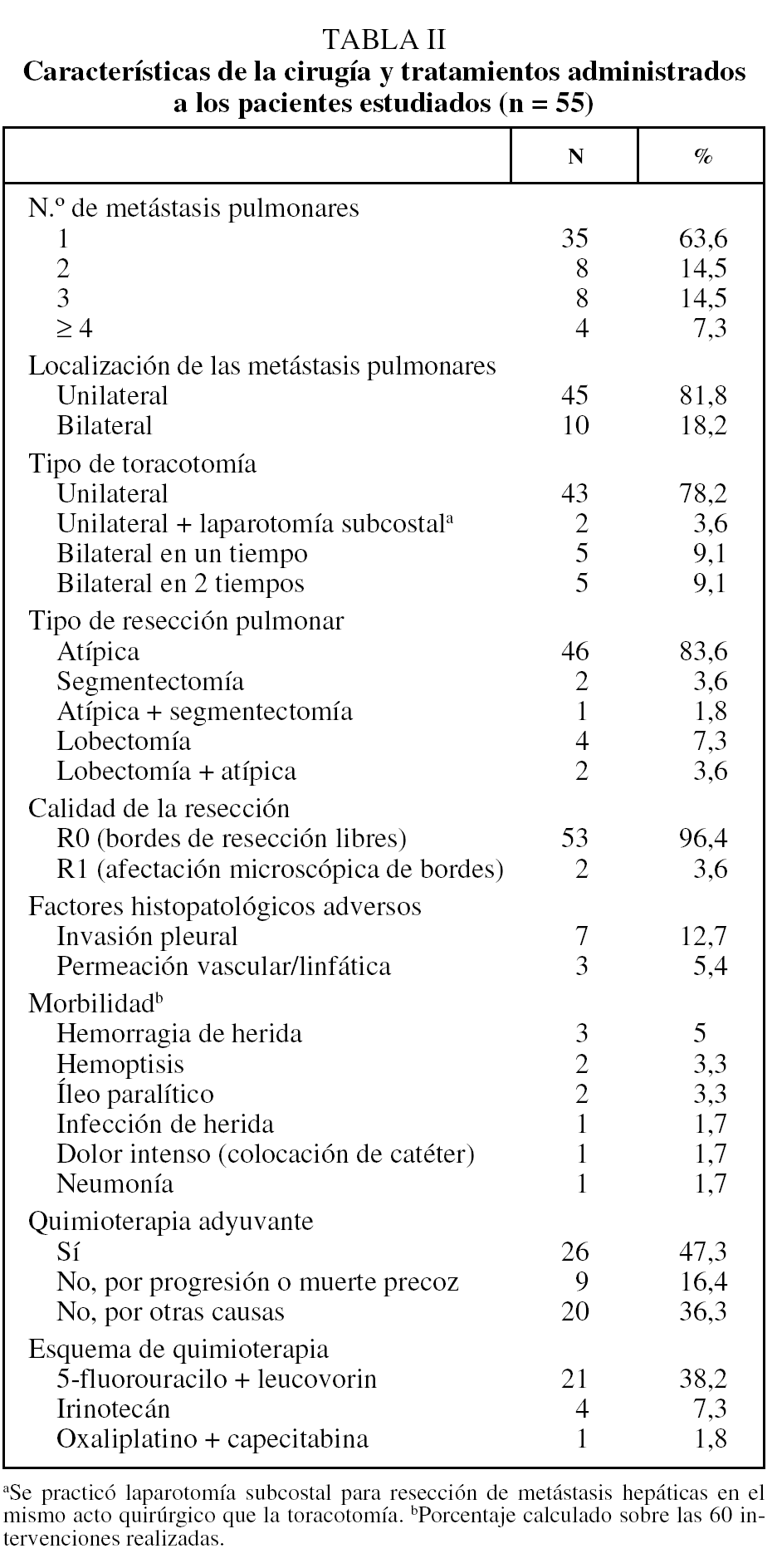
Se realizaron un total de 60 intervenciones en los 55 pacientes: 43 toracotomías unilaterales, 2 toracotomías unilaterales con laparotomía subcostal en el mismo acto quirúrgico para resección de metástasis hepáticas sincrónicas, 5 toracotomías bilaterales en un tiempo y 5 toracotomías bilaterales en 2 tiempos. En todas ellas se utilizó el abordaje posterolateral. Un paciente falleció a los 3 días de la cirugía por neumonía nosocomial, tras toracotomía unilateral por MP única, y se excluyó del análisis de factores pronósticos. La tasa de mortalidad postoperatoria (30 días) fue del 1,7%. El número medio de MP resecadas fue de 1,8 (rango: 1-9) y el tamaño medio de la MP mayor de 2,42 ± 1,58 cm (rango: 0,6-10). En 46 pacientes (83,6%) la técnica quirúrgica fue la resección atípica, y en 53 (96,4%) se consiguieron márgenes libres de afectación tumoral. En el 81,8% de los casos (n = 45) no se evidenció ningún factor patológico adverso (invasión pleural, permeación vascular o linfática) en el análisis histopatológico de la pieza. Tras la resección de las MP 26 pacientes (47%) recibieron quimioterapia adyuvante, con fármacos diversos en función de la fecha de la intervención quirúrgica y de los fármacos que habían recibido previamente. De los 29 pacientes que no recibieron quimioterapia, en 8 casos fue por progresión precoz, en uno por muerte postoperatoria y el resto por negativa del paciente o por ausencia de fármacos con eficacia probada en ese momento. En la tabla II se recogen las características de la cirugía y de los tratamientos administrados.
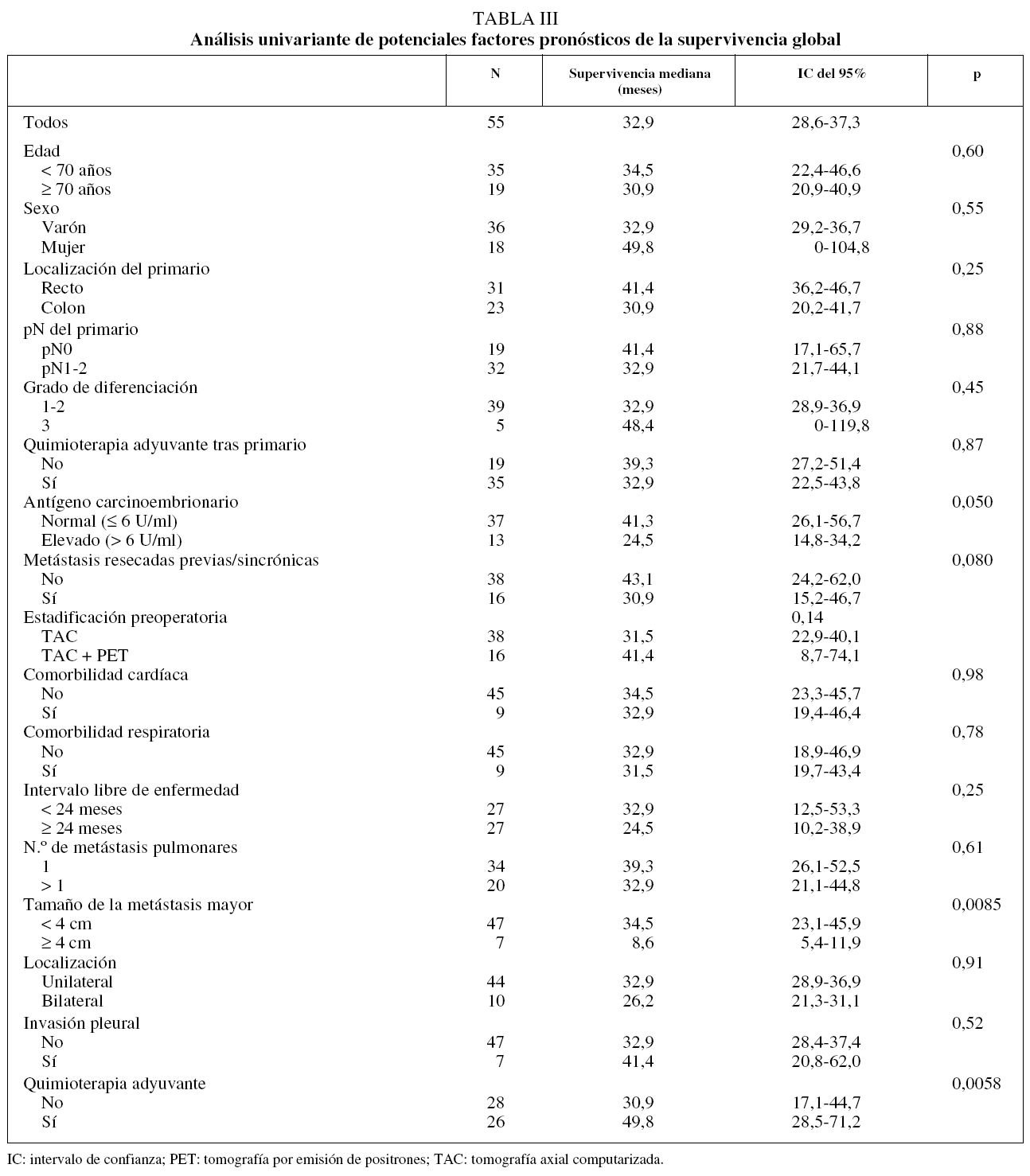
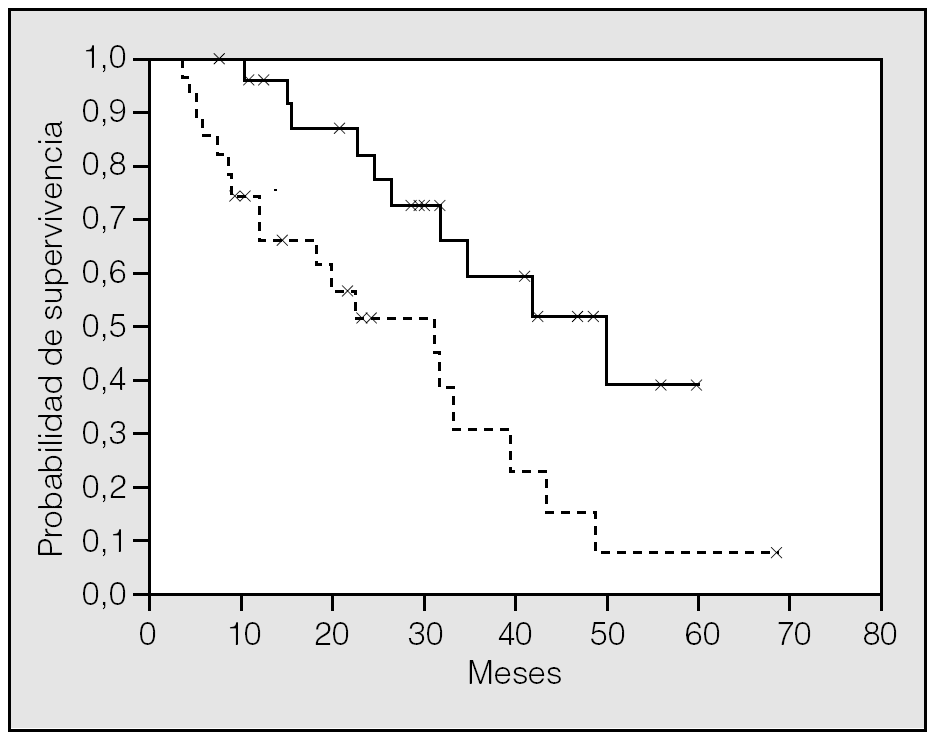
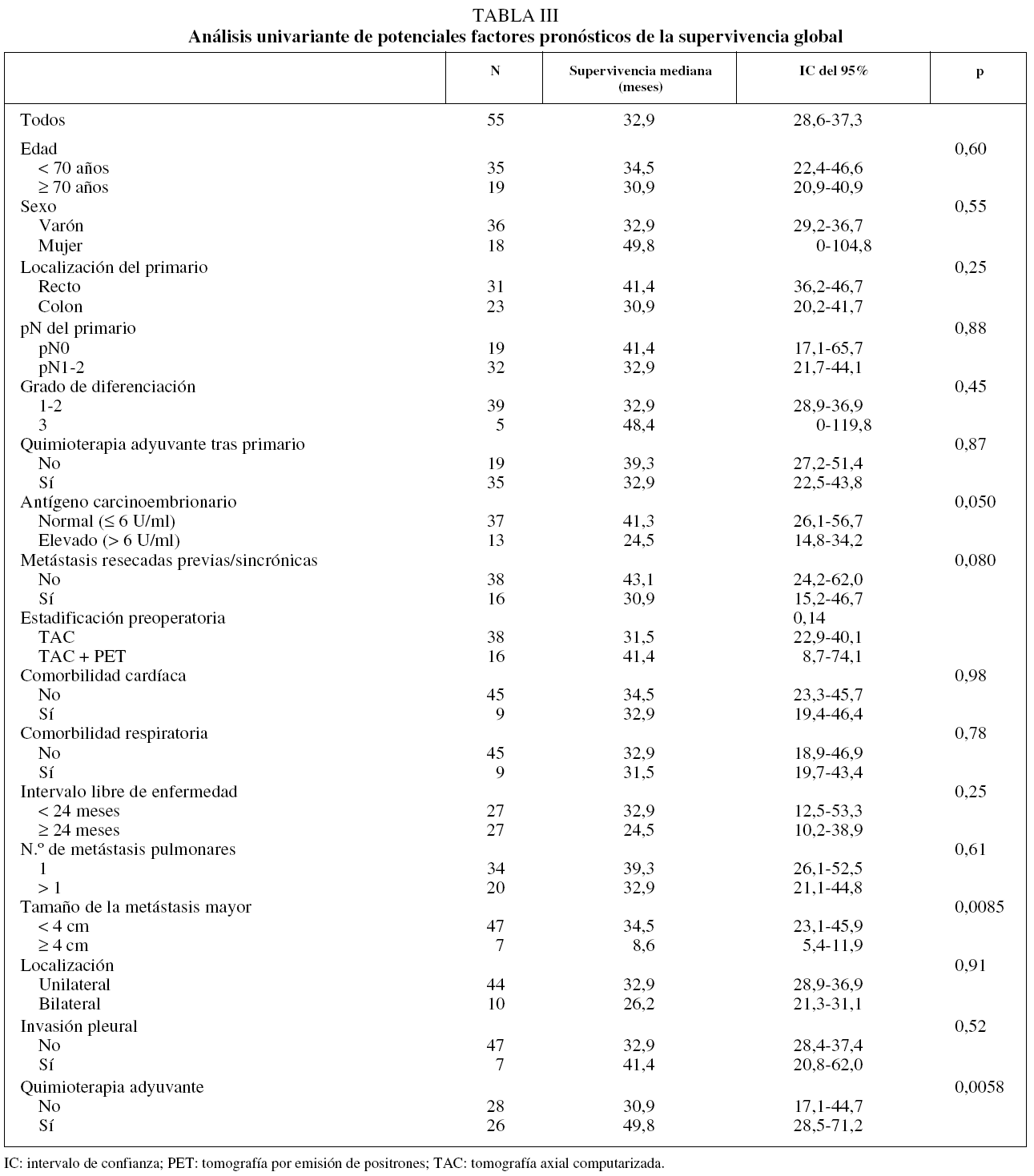
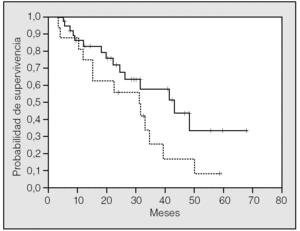
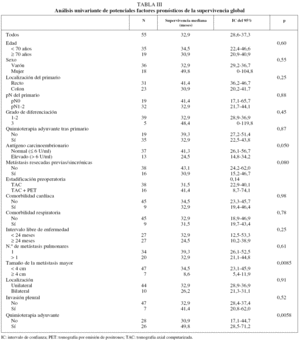
La SG mediana para todos los pacientes fue de 32,9 meses (intervalo de confianza [IC] del 95%, 28,6-37,3), con unas supervivencias actuariales estimadas a 1, 3 y 5 años del 79, el 44 y el 22%, respectivamente. Los pacientes en que el tamaño de la MP mayor era de 4 cm o más vivieron significativamente menos que el resto, con una SG mediana de 8,6 meses (IC del 95%, 5,4-11,9), frente a 34,5 meses (IC del 95%, 23,1-45,9) (p = 0,0085). Asimismo, los 13 pacientes (23,6%) que en el momento de la cirugía tenían un valor de CEA por encima del límite normal (6 U/ml) vivieron significativamente menos (24,5 meses; IC del 95%, 14,8-34,2) que aquéllos con títulos normales (41,4 meses; IC del 95%, 26,1-56,8) (p = 0,050). Los pacientes con metástasis hepáticas previas o sincrónicas resecadas mostraron una tendencia no significativa (p = 0,080) hacia una supervivencia peor (30,9 meses; IC del 95%, 15,2-46,6) que aquéllos con enfermedad pulmonar exclusiva (43,1 meses; IC del 95%, 24,2-62) (fig. 1). Lo mismo ocurrió con los pacientes que sólo tenían una TAC como estudio de extensión previo a la cirugía (31,5 meses; IC del 95%, 22,9-40,1) frente a los que se les había practicado además una PET (41,3 meses; IC del 95%, 8,8-74,1) (p = 0,14). El resto de las variables clínicas preoperatorias no mostraron ninguna relación con la probabilidad de supervivencia (tabla III).
Fig. 1. Supervivencia global para los pacientes con metástasis extrapulmonares resecadas previa o sincrónicamente (línea punteada) y aquéllos con sólo metástasis pulmonares como comienzo de enfermedad diseminada (línea continua) (p = 0,080).
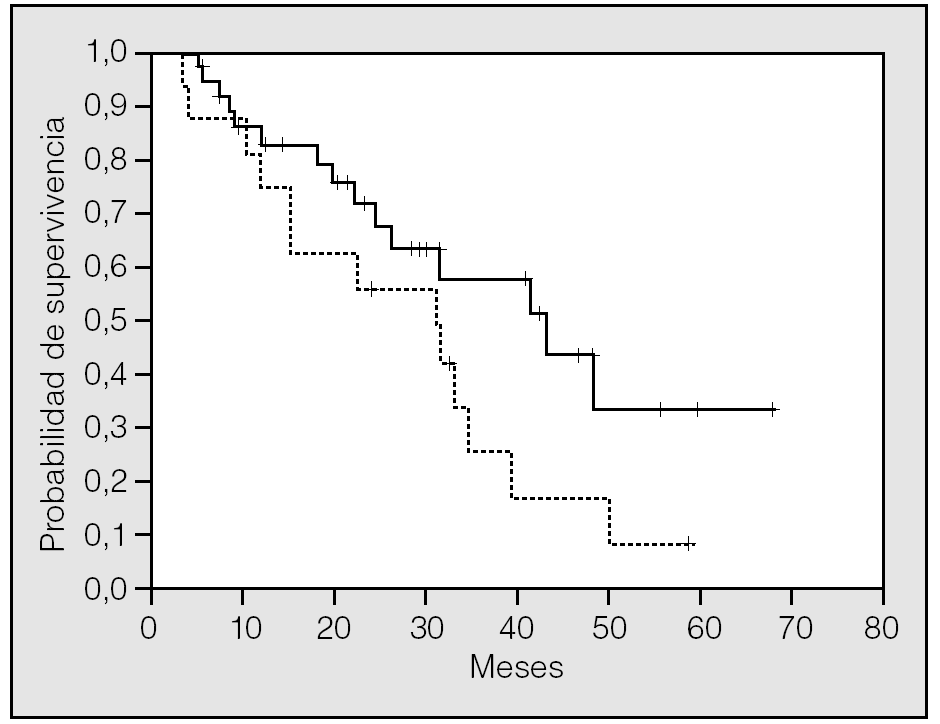
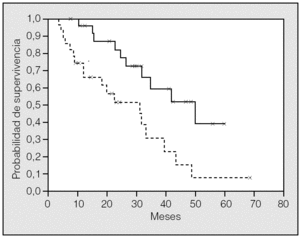
Con respecto a las variables postoperatorias, se observó que los pacientes que recibieron quimioterapia adyuvante tras la cirugía de MP vivieron significativamente más (49,8 meses; IC del 95%, 28,5-71,2) que aquellos a quienes no se administró ningún tratamiento complementario (30,9 meses; IC del 95%, 17,1-44,7), con un valor de p de 0,0058 (fig. 2). Esta diferencia mantuvo la significación estadística (p = 0,027) al excluir del análisis a los pacientes que no recibieron quimioterapia adyuvante por progresión precoz. Por otro lado, ninguna variable anatomopatológica analizada de las MP ni del tumor primario tuvo repercusión alguna en la supervivencia de nuestros pacientes.
Fig. 2. Supervivencia global para los pacientes que reciben quimioterapia adyuvante (línea continua) y los que no la reciben (línea punteada) (p = 0,0058).
En el análisis multivariante de factores pronósticos preoperatorios se incluyeron, de acuerdo con lo preestablecido, las siguientes variables dicotómicas: CEA, tamaño de la MP mayor, resección hepática previa o sincrónica y utilización de la PET. La única variable que quedó en el modelo de regresión con significación estadística (p = 0,036) fue el tamaño de la MP, con una odds ratio (OR) de 0,279 (IC del 95%, 0,084-0,921). Al realizar el análisis multivariante teniendo en cuenta no sólo las variables preoperatorias, el tamaño de la MP mayor confirmó su influencia en la supervivencia (OR = 0,11; IC del 95%, 0,021-0,577; p = 0,009), quedando la administración de quimioterapia adyuvante cercana al límite de la significación estadística (OR = 2,44; IC del 95%, 0,96-6,206; p = 0,06).
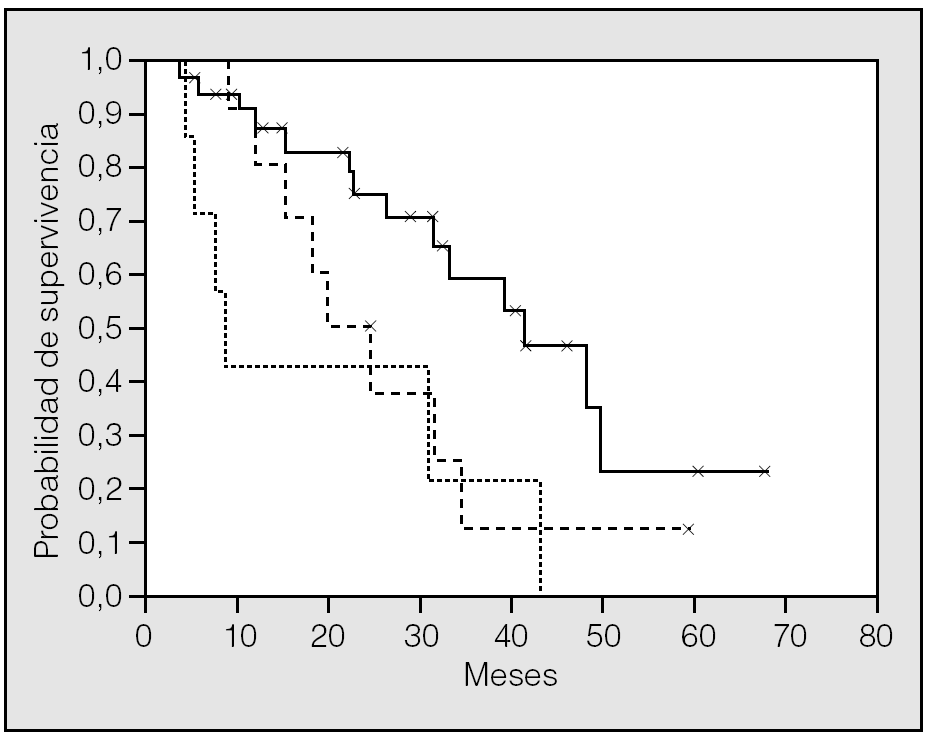
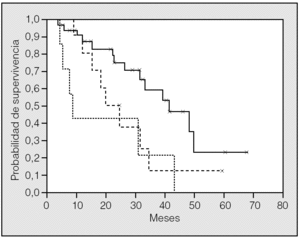
Con las 2 variables preoperatorias que se confirmaron como factores pronósticos en el análisis univariante pudieron distinguirse 3 grupos de pacientes (fig. 3) con una supervivencia mediana diferente (p = 0,012): a) tamaño de la MP de 4 cm o más (8,6 meses; IC del 95%, 5,4-11,9); b) tamaño de la MP menor de 4 cm y CEA elevado (24,5 meses; IC del 95%, 15,8-33,2), y c) tamaño de la MP menor de 4 cm y CEA normal (41,4 meses; IC del 95%, 27,1-55,8).
Fig. 3. Supervivencia global por subgrupos. Línea continua: pacientes con metástasis pulmonar (MP) mayor de tamaño inferior a 4 cm y antígeno carcinoembrionario (CEA) normal; línea discontinua: pacientes con MP menor de 4 cm y CEA elevado; línea punteada: pacientes con MP mayor de 4 cm (p = 0,012).
En el momento del análisis 41 pacientes (74,5%) habían recaído: 17 con recidiva sólo en el pulmón, 6 en pulmón e hígado y 5 en pulmón y otra localización. De estos 41 pacientes, 13 (31,7%) fueron reintervenidos a la progresión con intención curativa: 11 por MP aisladas, uno por metástasis hepáticas y otro por metástasis cerebral. La SG mediana, calculada desde la fecha de la segunda cirugía, de los pacientes con recidiva pulmonar aislada a quienes volvió a intervenirse fue de 17,9 meses (IC del 95%, 11,6-24,2), con una supervivencia estimada a los 2 y 3 años del 33 y el 17%, respectivamente. Calculando la SG desde la fecha de la primera toracotomía no se constató una diferencia significativa (p = 0,73) entre estos pacientes (34,5 meses; IC del 95%, 30,6-38,4) y el resto de la serie (31,5 meses; IC del 95%, 13,8-49,2).
Discusión
La resección quirúrgica de MP se considera un procedimiento estándar con una morbilidad y mortalidad relativamente bajas21,22. El IRLM (International Registry of Lung Metastases, Registro Internacional de Metástasis Pulmonares)23 recogió los datos de 5.206 pacientes operados durante un período de más de 4 décadas y estableció 4 grupos con distinta supervivencia en función de la calidad de la resección, el ILE y el número de metástasis. El principal inconveniente de este estudio es que no analizaba la influencia de factores pronósticos propios de cada tumor. Aunque este modelo ha sido validado en otras series con MP resecadas de diferente etiología24, nunca se ha valorado su aplicabilidad a series de pacientes con MP exclusivamente de cáncer colorrectal. Las series retrospectivas publicadas sobre cirugía de MP de cáncer colorrectal han seguido criterios heterogéneos de selección y de técnica quirúrgica preferida. Además, muchas de ellas han omitido del estudio factores pronósticos reconocidos que derivan del tumor primario y tratamientos posteriores, prescindiendo en ocasiones del análisis multivariante (tabla IV).
TABLA IV Resumen de los hallazgos en las principales series publicadas
En nuestra serie obtuvimos una mediana de supervivencia de 32,9 meses, en el rango medio de lo descrito en las series publicadas (19-41 meses)4-18. La supervivencia estimada a los 5 años, que es del 22%, puede considerarse baja si se compara con lo comunicado (21-56%), pero teniendo en cuenta que 26 pacientes (47,2%) estaban vivos en el momento del análisis, algunos de ellos con un seguimiento corto, la fiabilidad de este dato es más dudosa (IC del 95%, 0-47). De acuerdo con lo descrito, la edad, el sexo y la localización del tumor primario (colon o recto) no se relacionan con la supervivencia de nuestra serie. Como hallazgo más relevante, encontramos que el tamaño de la MP mayor supone el principal factor pronóstico para la supervivencia de nuestros pacientes y el único con significación estadística en el análisis multivariante. Los pacientes en que la MP mayor era de 4 cm o más tuvieron 9 veces más riesgo de morir y una probabilidad de permanecer vivos a los 2 años del 15% y a los 5 años del 0%. Un mayor volumen de enfermedad visible suele indicar una mayor probabilidad de presencia de enfermedad indetectable. De hecho el tamaño tumoral es un factor pronóstico en la gran mayoría de los tumores malignos y se admite como uno de los factores pronóstico en metástasis hepáticas operadas de cáncer colorrectal19. El tamaño se ha relacionado con la supervivencia en otras 2 series recientes, con límites de 2,8 cm10 y 3,75 cm18. Una explicación para que no se haya encontrado esta asociación en trabajos anteriores puede ser que, con la ampliación de los criterios de selección, el número de pacientes operados con metástasis grandes haya ido incrementándose con el tiempo. Asimismo, otras variables asociadas al volumen tumoral, como el número de metástasis o el valor del CEA, han podido desempeñar un papel como variables de confusión.
Los títulos de CEA por encima del límite normal (6 U/ml) resultaron también un factor de mal pronóstico en nuestra serie. Habitualmente el valor sérico de CEA se considera un indicador del volumen tumoral en cáncer colorrectal, aunque no todos los tumores lo expresan. Descrito inicialmente por McAffee et al5, es la variable que más se ha relacionado con la supervivencia de los pacientes con MP resecadas8,10,12-15, incluso con valor pronóstico independiente8,13-15. Por otro lado, valores elevados de CEA se asocian también con peor evolución en pacientes con cáncer colorrectal metastásico que reciben quimioterapia25 y en pacientes con resección de metástasis hepáticas19.
Con estos 2 parámetros clínicos tamaño de la MP mayor y valor de CEA, fácilmente accesibles en el momento preoperatorio, conseguimos definir en nuestra serie 3 grupos de pacientes con una supervivencia diferenciada. La definición de subgrupos de peor pronóstico puede permitir la realización de estudios con nuevas estrategias terapéuticas, como la administración de quimioterapia neoadyuvante, y la elaboración de protocolos de seguimiento más estrecho. Consideramos que, mientras no se establezcan unos criterios universalmente aceptados que permitan seleccionar a pacientes sin posibilidades de supervivencia a largo plazo con cirugía, estas variables no debieran utilizarse para excluir a pacientes de un tratamiento quirúrgico potencialmente curativo.
Es destacable también la posible relación entre la realización de la PET como estudio de extensión y la supervivencia. Aunque nuestro estudio no demostró una asociación significativa, sí se evidenció una tendencia positiva. Hay que tener en cuenta que la mayoría de los pacientes con PET de nuestra serie tenían un seguimiento más corto, lo cual ha podido influir en la ausencia de significación estadística. La PET puede descubrir focos metastáticos no identificados en la TAC y, por lo tanto, descartar la cirugía en pacientes en que la intervención quirúrgica no sería eficaz. En un estudio prospectivo reciente, 4 pacientes (12,5%) de 32 con MP de cáncer colorrectal fueron descartados para cirugía por presentar en la PET recidiva local o metástasis a distancia21. Aunque se necesitan más estudios que confirmen estos hallazgos, pensamos que la PET puede estar indicada como estudio de extensión previo a la cirugía, sobre todo en pacientes con factores de mal pronóstico.
El número de MP es uno de los factores pronósticos que suscitan más controversia. La mayoría de los estudios han encontrado supervivencias más favorables en pacientes con MP solitarias resecadas4-6,9-11,14-16, aunque rara vez se ha comunicado como factor pronóstico independiente10. Algo similar ocurre con el ILE, que sólo un trabajo ha conseguido relacionar con la supervivencia en el análisis multivariante13. En nuestra serie no hemos encontrado ninguna relación entre estas variables y la SG. Ni siquiera con la división en grupos pronósticos según el IRLM, que incluye ambas variables, se ha podido discriminar una evolución diferente en nuestros pacientes. Creemos su utilización como factor pronóstico es cuestionable en pacientes con MP de cáncer colorrectal.
En nuestra serie encontramos que la administración de quimioterapia tras metastasectomía parece influir en la supervivencia. Aunque no se han publicado ensayos aleatorizados que valoren la eficacia de la quimioterapia sistémica tras la resección de metástasis de cáncer colorrectal, su fundamento teórico parece razonable. La indicación de quimioterapia en la enfermedad avanzada está claramente demostrada3 y, por otro lado, el tratamiento adyuvante incrementa la SG tras resección de cáncer de colon en estadio II de alto riesgo y en estadio III3,26. En la gran mayoría de las series de MP resecadas no se ha analizado la administración de tratamientos tras cirugía como factor pronóstico, y en las pocas en que se ha hecho11,14,18 no se ha asociado significativamente con la supervivencia. Aunque la valoración de tratamientos ulteriores en series retrospectivas está sujeta a importantes sesgos de selección, en nuestra serie, aun excluyendo a los pacientes que no fueron tratados por progresión o muerte precoz, sigue siendo un factor significativo en el análisis univariante. La alta tasa de pacientes tratados y su uso individualizado en función de los tratamientos previos han podido influir en el resultado positivo en nuestros pacientes.
Un tema debatido es la indicación de cirugía de MP en pacientes con afectación hepática previa o sincrónica resecable. Aunque algunos autores han encontrado que el antecedente de metástasis hepáticas resecadas es un factor de mal pronóstico9, los trabajos que han analizado específicamente esta cuestión concluyen que no debe considerarse una contraindicación para la realización de la cirugía pulmonar27-30. En nuestros pacientes, aunque la presencia de metástasis hepáticas se asoció a una supervivencia mediana inferior, no resultó ser un factor pronóstico estadísticamente significativo. Además, los 30,9 meses de supervivencia mediana conseguida en estos pacientes es muy superior a las previsiones más optimistas con cualquier otra modalidad de tratamiento. Por ello consideramos que no debe contraindicarse la metastasectomía pulmonar por el antecedente de metástasis hepáticas extirpadas o por la presencia concomitante de lesiones hepáticas susceptibles de resección.
La recidiva pulmonar después de metastasectomía es un problema crucial durante el seguimiento, y la indicación de reintervención es objeto de discusión. En la serie de McAfee et al5 los pacientes reintervenidos por progresión pulmonar tuvieron una supervivencia a los 5 años del 30%. En nuestra serie, los 11 pacientes a quienes se realizó una segunda metastasectomía pulmonar presentaron una supervivencia menor, pero, lo que es más importante, ésta no difirió de la del conjunto de la serie.
En conclusión, creemos que todos los pacientes con MP de cáncer colorrectal potencialmente resecables según los criterios empleados en nuestro estudio deben considerarse candidatos a cirugía, dada la ausencia de factores pronósticos universalmente aceptados. En los pacientes con varios factores adversos, como valores elevados de CEA preoperatorio y el tamaño de la MP mayor, debería considerarse el uso de nuevas estrategias terapéuticas, como la quimioterapia neoadyuvante, la realización de un estudio de extensión más exhaustivo que incluya una PET y la inclusión en protocolos de seguimiento más estrecho. Aunque son necesarios más estudios, pensamos que, dados nuestros resultados y su eficacia demostrada en la enfermedad avanzada y tras la resección del carcinoma primario, debe considerarse la administración de quimioterapia adyuvante tras metastasectomía pulmonar.
Correspondencia: Dr. A. Muñoz Llarena.
Servicio de Oncología Médica. Hospital de Cruces.
Pza. de Cruces, s/n. 48903 Barakaldo. Bizkaia. España.
Correo electrónico: amunoz@hcru.osakidetza.net
Recibido: 7-2-2006; aceptado para su publicación: 27-6-2006.