El cáncer pulmonar es la primera causa de muerte por cáncer en el mundo, tanto en hombres como mujeres, dando cuenta de 1,6 millones de muertes anualmente, y en Chile representa la segunda causa de muerte por cáncer1,2. El cáncer pulmonar no microcítico (CPNM) corresponde al 85% de los cánceres pulmonares y desafortunadamente en hasta el 80% de los casos se diagnostica en etapas avanzadas, requiriendo terapia sistémica3. El tratamiento de estos pacientes ha tenido avances significativos en las últimas décadas con la aparición de terapias dirigidas contra mutaciones específicas de las células tumorales (conocidas como targeted therapies) y más recientemente con la inmunoterapia.
Una de las inmunoterapias más utilizadas son los anticuerpos monoclonales contra PD-1 o PD-L1. Su acción se basa en la capacidad de algunos tumores de evadir el sistema inmune mediante la expresión de PD-L1, ligando para una proteína llamada PD-1 (programmed cell death protein 1). Al producirse la unión entre PD-1 y PD-L1 se inhibe la activación del linfocito T y por tanto se inhibe la respuesta inmune normal contra células tumorales. Algunas de estas terapias ya están aprobadas en el tratamiento de cáncer pulmonar, con sobrevidas globales mayores que las obtenidas con quimioterapia tradicional4.
Uno de los desafíos más importantes del uso de inhibidores de PD-L1 radica en la capacidad de identificar a los pacientes adecuados. Entre los marcadores más utilizados están la expresión de PD-L1 en las células tumorales, expresión que se evalúa con técnicas de inmunohistoquímica. Pembrolizumab, por ejemplo, es un anticuerpo monoclonal anti-PD-1 aprobado para el tratamiento del CPNM que en terapia de primera línea requiere que al menos el 50% de las células tumorales expresen PD-L1, y en el caso de segunda línea, al menos el 1%5.
Los estudios que han permitido aprobar las terapias anti-PD-L1 se han realizado todos utilizando muestras grandes de tejido, ya sea biopsias excisionales o las llamadas core biopsy5-7. Esta no está siempre disponible en pacientes con CPNM, puesto que frecuentemente el diagnóstico se realiza con muestras más pequeñas obtenidas a través de punción por aguja asistida por endosonografía de vía aérea (EBUS-TBNA). Esta es una técnica mínimamente invasiva, que ha sido recomendada por múltiples sociedades como la técnica diagnóstica de elección en lesiones de vía aérea central o que requieren estadificación mediastínica8,9. La utilidad de este tipo de biopsias para medir la expresión de PD-L1 no está clara y pudiera ser diferente en términos de precisión diagnóstica, fundamentalmente el número de células tumorales en estas muestras. El objetivo de la presente comunicación es reportar la factibilidad de la determinación de la expresión de PD-L1 en muestras de CPNM obtenidas mediante EBUS-TBNA.
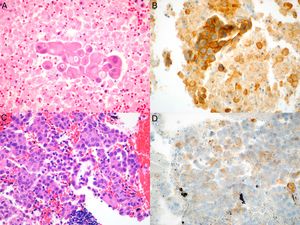
Realizamos una revisión retrospectiva de todos los casos de CPNM en los cuales se solicitó estudio de PD-L1. Los casos fueron identificados a partir de la base de datos de Anatomía Patológica, e incluyó a todos los pacientes desde el 1 de julio de 2015, fecha desde la cual la técnica está disponible en nuestro centro, y hasta el 1 de junio de 2017. Este estudio fue aprobado por el comité de ética de nuestra institución. El diagnóstico histopatológico y el análisis de la expresión de PD-L1 fueron realizados por un patólogo experto en patología pulmonar. Se consideró que las muestras eran adecuadas para tinción de PD-L1 si presentaban más de 100 células neoplásicas evaluables. Las muestras que estaban fijadas en formaldehído al 4%, tamponadas e incluidas en parafina, se cortaron en fracciones de tejido de 4μm de espesor y fueron teñidas con hematoxilina-eosina e incubadas con el anticuerpo monoclonal anti-PD-L1 (E1L3N®) XP® RabbitmAb en sistema automatizado Benchmark ULTRA de Ventana (Roche), de acuerdo con las recomendaciones del fabricante. La evaluación de la expresión de PD-L1 se realizó en base a un recuento manual del porcentaje de células neoplásicas con tinción de membrana, fuese parcial o completa, independiente de su intensidad (fig. 1A-D).
Imágenes microscópicas del tumor en muestras obtenidas por EBUS-TBNA y de las respectivas tinciones inmunohistoquímicas con anticuerpo anti-PD-L1 E1L3N. A) Adenocarcinoma (hematoxilina-eosina, 40×). B) Tinción de membrana >50% de las células neoplásicas (PD-L1 E1L3N XP Rabbit mAb, 40×). C) Adenocarcinoma (hematoxilina-eosina, 40×). D) Tinción de membrana >1% de las células neoplásicas (PD-L1 E1L3N XP Rabbit mAb, 40×).
De un total de 23 solicitudes de PD-L1, todas las muestras fueron adecuadas para estudio de PDL-1. De estos 23 casos, 18 correspondían a adenocarcinomas, 3 a escamosos, uno a adenoescamoso y uno a carcinoma no microcítico no especificado.
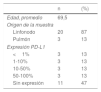
El promedio de edad fue de 70 años (rango 41-88), con mayoría de los pacientes (12/23, 52%) de sexo femenino. Las muestras correspondían a aspirados de linfonodos en 20 de 23 pacientes (87%) y el resto provenían de lesiones adyacentes a vía aérea central.
En los 23 casos analizados, se observaron 3 (13,04%) muestras que presentaban tinción de PD-L1 en >50% de las células neoplásicas, 6 (26,08%) presentaban tinción entre 1-50%; y en 14 (60,86%) casos la tinción era <1%). De los 14 casos con tinción<1%, 11 no presentaban ninguna tinción. En la tabla 1 se muestra el resultado de la tinción inmunohistoquímica anti-PD-L1 en las células neoplásicas.
Este estudio sugiere que en un alto porcentaje de casos las muestras obtenidas por EBUS-TBNA son adecuadas para evaluar la expresión de PD-L1 en células neoplásicas, de la misma forma que son útiles para la determinación de las mutaciones más frecuentes10. El porcentaje de muestras positivas, definido como tinción de más de un 50% de las células neoplásicas, fue de solo del 13% (IC 95%: 0,028-0,336), con una gran mayoría de casos que son negativos para la expresión de PD-L1. Al utilizar 1% como punto de corte de positividad, esta cifra sube al 26% (IC 95%: 0,10-0,48).
Existen escasos estudios que evalúan la expresión de PD-L1 en muestras obtenidas por EBUS-TBNA11-12. Las biopsias de mayor tamaño reportan positividad de PD-L1 de alrededor del 50%, con punto de cohorte >50%7,13. Si bien estas cifras parecen mayores que las observadas en nuestro grupo, esto pudiera ser solo producto del azar debido al número reducido de casos (esto se ve reflejado en el amplio intervalo de confianza). De existir realmente un número más bajo de muestras positivas para PD-L1, en comparación con las reportadas en la literatura, estas pudieran estar relacionadas con diferencias étnicas de nuestra población, así como también diferencias dadas por la técnica, por ejemplo, debido a la heterogeneidad tumoral.
Este es el primer estudio en Sudamérica que evalúa la factibilidad de medición de PD-L1 en muestras de EBUS-TBNA. Lamentablemente tiene las limitaciones del escaso número de pacientes y provenientes todos del mismo centro. Cabe señalar que, si bien es posible medir expresión de PD-L1 en muestras obtenidas por EBUS, desconocemos si la positividad en muestras obtenidas por aguja es representativa de la positividad en el tumor primario y, más importantemente, si son útiles para predecir respuesta a terapia. Estas preguntas deberán ser objeto de futuras investigaciones.