Conocer la etiología del derrame pleural (DP) en pacientes adultos y la rentabilidad de la citología y del cultivo de líquido pleural (LP) en DP malignos e infecciosos, respectivamente.
Pacientes y métodoEstudio retrospectivo de todos los pacientes consecutivos con DP sometidos a una toracocentesis diagnóstica durante los últimos 19 años en un hospital universitario.
ResultadosLas principales causas de DP en los 3.077 pacientes estudiados fueron: cáncer (27%), insuficiencia cardiaca (21%), neumonía (19%), tuberculosis (9%), cirugía abdominal (4%), enfermedades del pericardio (4%) y cirrosis (3%). La tuberculosis fue la etiología más común en pacientes<34 años (52%), mientras que la insuficiencia cardiaca lo fue en octogenarios (45%). Entre los DP malignos, los tumores primarios más comunes fueron el de pulmón (37%) y el de mama (16%). La citología del LP tuvo una rentabilidad global del 59%, pero fue significativamente inferior en mesoteliomas (27%) y carcinomas escamosos de pulmón (25%). En pacientes con DP infecciosos, solo el 30% de los cultivos del LP resultaron positivos, un porcentaje que se duplicó (66%) cuando el líquido era purulento (empiemas). Los estreptococos del grupo viridans representaron el 25,5% del total de aislamientos. El cultivo del LP en medio sólido para Mycobacterium tuberculosis tuvo escasa sensibilidad (18,5%).
ConclusionesLas 3 cuartas partes de los pacientes con un DP en los que se indica la realización de una toracocentesis diagnóstica tienen una neoplasia, insuficiencia cardiaca, neumonía o tuberculosis. La citología y los cultivos del LP son falsamente negativos en un porcentaje significativo de casos.
To investigate the etiology of pleural effusions (PE) in adults and the accuracy of pleural fluid (PF) cytology and cultures in malignant and infectious PE, respectively.
Patients and methodsRetrospective analysis of all consecutive patients with PE undergoing diagnostic thoracentesis during the last 19 years in a university hospital.
ResultsThe leading causes of PE among the 3,077 patients were: cancer (27%), heart failure (21%), pneumonia (19%), tuberculosis (9%), abdominal surgery (4%), pericardial diseases (4%) and cirrhosis (3%). Tuberculosis was the most common etiology in patients <34 years of age (52%), whereas heart failure predominated in octogenarians (45%). The most common primary tumors in malignant PE were lung (37%) and breast (16%). The overall accuracy of PF cytology was 59%, although it was significantly lower in mesotheliomas (27%) and squamous cell lung cancer (25%). In infectious PE, only 30% of cultures yielded positive results, a percentage which increased two-fold (66%) in purulent fluids (empyemas). Viridans streptococci were the most commonly isolated pathogens (25.5%). The sensitivity of solid media cultures of PF for Mycobacterium tuberculosis was low (18.5%).
ConclusionsThree-quarters of patients with PE in whom a diagnostic thoracentesis was indicated had cancer, heart failure, pneumonia or tuberculosis. PF cytology and cultures give false negative results in a significant number of cases.
El derrame pleural (DP) es un problema clínico frecuente entre los pacientes que se atienden en los servicios de medicina interna y neumología1. Sus causas pueden variar según el área geográfica, el ámbito de atención sanitaria, la edad del sujeto o el periodo de tiempo estudiado, entre otros factores. El conocimiento de las principales etiologías del DP (probabilidad preprueba) permite seleccionar e interpretar adecuadamente las diferentes pruebas diagnósticas, siguiendo un modelo bayesiano de razonamiento clínico.
En los últimos 25 años solo se han publicado en nuestro país 3 estudios sobre la etiología del DP, que comprendían 4842, 6423 y 1.0004 pacientes; el último hace más de una década4. El objetivo de la presente investigación es describir las causas de DP y la rentabilidad de algunas pruebas básicas como la citología o el cultivo del líquido pleural (LP) en una serie de más de 3.000 pacientes consecutivos evaluados en un hospital universitario a lo largo de los últimos 19 años.
Pacientes y métodosEn 1994 se creó en nuestro centro una base de datos en la que se han venido introduciendo hasta la actualidad y de forma prospectiva las características demográficas y clínicas de todos los pacientes adultos consecutivos que se han sometido a una toracocentesis diagnóstica, independientemente del servicio médico o quirúrgico de procedencia. La mayor parte de los procedimientos se realizaron en pacientes hospitalizados y muy pocos en sujetos ambulatorios atendidos en las consultas externas. En este estudio analizamos las etiologías del DP en el periodo comprendido entre enero de 1994 y junio de 2013. Se excluyeron de la base de datos 206 pacientes sin un diagnóstico final definitivo o sin los suficientes estudios del LP, imagen y seguimiento clínico para establecer un diagnóstico de presunción o considerar el DP como idiopático. Cada paciente se incluyó en una sola ocasión, si es que se le efectuaron 2 o más toracocentesis por la misma causa del DP. El protocolo de recogida de información fue aprobado por el comité ético local.
Criterios diagnósticosEl diagnóstico de insuficiencia cardiaca se basó en la historia, examen físico, radiografía de tórax, electrocardiograma, ecocardiograma (si estaba disponible) y respuesta al tratamiento diurético.
Se consideró que un paciente tenía un DP maligno definitivo cuando se demostraban células malignas en el estudio citológico del LP o histológico de la biopsia pleural. También se aceptó el diagnóstico de probable malignidad en pacientes con un tumor primario conocido, citología negativa del LP y exclusión de otras causas potenciales del DP.
El diagnóstico de DP tuberculoso se basó en el aislamiento del bacilo tuberculoso en muestras de esputo, LP o biopsia pleural, o en la demostración de granulomas en esta última. El diagnóstico se consideró probable en pacientes con exudados linfocitarios y concentraciones pleurales de adenosina deaminasa>35 U/L, que se resolvieron con tratamiento antituberculoso empírico.
Los DP paraneumónicos fueron todos aquellos asociados con una neumonía, bronquiectasias o absceso pulmonar. Cuando el derrame se solucionó solo con el empleo de antibióticos, se clasificó como DP paraneumónico no complicado. La necesidad de drenar completamente un LP de aspecto no purulento mediante una toracocentesis terapéutica, la inserción de un catéter pleural o cirugía, definió a los DP paraneumónicos complicados. El término empiema hace referencia a la presencia de pus en el espacio pleural y se considera, por definición, un DP complicado, aunque no siempre se debe a una neumonía.
El diagnóstico de embolia pulmonar exigía una prueba de imagen confirmatoria (angio-TC o gammagrafía de ventilación-perfusión) en un contexto clínico adecuado. El hidrotórax hepático se consideró en todo paciente cirrótico sin ninguna enfermedad cardiorrespiratoria, infecciosa o maligna que justificase el DP. Los DP idiopáticos incluyeron aquellos en los que no fue posible determinar la causa del proceso a pesar de una investigación exhaustiva y se resolvieron durante el seguimiento clínico. Para otras enfermedades se aplicaron criterios clínicos ampliamente aceptados. Los DP se clasificaron como exudados o trasudados según los criterios de Light5.
Análisis estadísticoLas variables cuantitativas se expresan como proporciones y las cualitativas como medianas (percentiles 25 y 75%). Se utilizaron las pruebas de la ji al cuadrado y Kruskal-Wallis, con análisis post-hoc de residuales estandarizados o prueba de Mann-Whitney según correspondiese, para comparar variables entre los diferentes grupos etiológicos de DP. La significación estadística se estableció para un valor de p<0,05. Los cálculos se realizaron con el paquete estadístico SPSS versión 18.0 (Chicago, IL, EE. UU.).
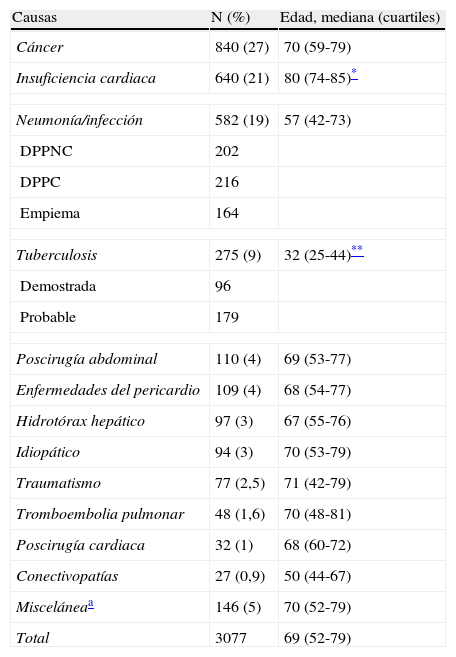
ResultadosCausas de derrame pleuralSe han incluido 3.077 pacientes con DP, con una edad mediana de 69 años (52-79 años), de los que 1.826 (59%) eran varones y 1.251 (41%) mujeres. El 75% de los DP se debieron a alguna de las siguientes 4 causas (tabla 1): cáncer (27%), insuficiencia cardiaca (21%), neumonía (19%) o tuberculosis (9%). Les siguieron en frecuencia los DP poscirugía abdominal (4%), las enfermedades del pericardio (4%) y el hidrotórax hepático (3%). No hubo diferencias en la etiología del DP según el sexo, pero los pacientes con DP tuberculoso tenían una mediana de edad (32 años) significativamente inferior, y aquellos con insuficiencia cardiaca una edad superior (80 años), que el resto de las etiologías. Si consideramos las edades extremas, las causas más comunes de DP en 760 pacientes octogenarios fueron la insuficiencia cardiaca (344; 45%), el cáncer (181; 24%) y la neumonía (86; 11%). Por el contrario, el DP en 293 sujetos <34 años se debió fundamentalmente a tuberculosis (153; 52%) y neumonía (75; 26%).
Etiología del derrame pleural
| Causas | N (%) | Edad, mediana (cuartiles) |
| Cáncer | 840 (27) | 70 (59-79) |
| Insuficiencia cardiaca | 640 (21) | 80 (74-85)* |
| Neumonía/infección | 582 (19) | 57 (42-73) |
| DPPNC | 202 | |
| DPPC | 216 | |
| Empiema | 164 | |
| Tuberculosis | 275 (9) | 32 (25-44)** |
| Demostrada | 96 | |
| Probable | 179 | |
| Poscirugía abdominal | 110 (4) | 69 (53-77) |
| Enfermedades del pericardio | 109 (4) | 68 (54-77) |
| Hidrotórax hepático | 97 (3) | 67 (55-76) |
| Idiopático | 94 (3) | 70 (53-79) |
| Traumatismo | 77 (2,5) | 71 (42-79) |
| Tromboembolia pulmonar | 48 (1,6) | 70 (48-81) |
| Poscirugía cardiaca | 32 (1) | 68 (60-72) |
| Conectivopatías | 27 (0,9) | 50 (44-67) |
| Misceláneaa | 146 (5) | 70 (52-79) |
| Total | 3077 | 69 (52-79) |
DPPC: derrame pleural paraneumónico complicado; DPPNC: derrame pleural paraneumónico no complicado.
A lo largo de los 19 años del estudio, se observó un incremento progresivo de insuficiencias cardiacas (29% de los DP a partir de 2011 vs. 15% antes del 2000) y una reducción en el número de tuberculosis (5% de los DP a partir del 2011 vs. 13% antes del 2000).
Causas de exudados y trasudadosHubo suficientes datos para aplicar los criterios de Light en 2.981 pacientes, de los que 2.316 (78%) tenían exudados y 665 (22%) trasudados. De entre los primeros, 797 (34,4%) eran DP malignos, 542 (23,4%) DP paraneumónicos, 269 (11,6%) DP tuberculosos y 154 (6,6%) insuficiencias cardiacas. Los trasudados se debieron fundamentalmente a insuficiencia cardiaca (485; 73%) y cirrosis hepática (87; 13%).
Cumplían criterios de Light para exudado el 100% de las tuberculosis, derrames postraumáticos, embolias pulmonares y conectivopatías; el 99% de las neumonías; el 98% de los DP malignos; el 97% de los DP poscirugía cardiaca; el 94% de los DP secundarios a enfermedades del pericardio y DP idiopáticos; el 24% de las insuficiencias cardiacas; y el 9% de los hidrotórax hepáticos.
Aspectos radiológicos del derrame pleuralDe 2.767 pacientes en los que pudo evaluarse una proyección radiológica posteroanterior de tórax, 423 (15%) tenían DP masivos que ocupaban 2 tercios o más del hemitórax. De estos últimos, la mayoría correspondían a DP malignos (244; 58%), neumonías (72; 17%), tuberculosis (36; 8,5%) e hidrotórax hepáticos (27; 6,4%). El 32, 14, 14 y 34% de DP producidos por estas etiologías fueron masivos respectivamente.
De entre 2.958 pacientes evaluables, 667 (23%) tenían DP bilaterales en la radiografía de tórax. Las causas más comunes fueron la insuficiencia cardiaca (357; 53,5%), el cáncer (121; 18%) y las enfermedades del pericardio (47; 7%). Si consideramos cada etiología en particular, el 58% de las insuficiencias cardiacas, el 47% de las enfermedades del pericardio y el 41% de las conectivopatías se asociaron con DP bilaterales, mientras que esta característica radiológica solo estuvo presente en el 15% de DP malignos y embolias de pulmón, en el 8% de cirrosis, en el 6% de neumonías y en el 4% de tuberculosis.
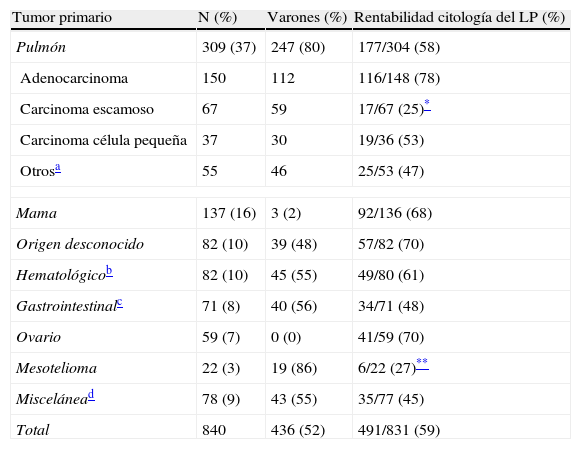
Derrame pleural malignoDe los 840 pacientes con DP maligno, se obtuvo confirmación citohistológica en 538 (64%), mientras que los restantes 302 (36%) se consideraron probablemente malignos según los criterios previamente establecidos. Todos los mesoteliomas se diagnosticaron por criterios histológicos. En aproximadamente la mitad de los pacientes con DP maligno, el tumor primario fue pulmonar (37%) o mamario (16%), como muestra la tabla 2. La prevalencia de tumores primarios de pleura (mesotelioma) fue baja en nuestra área geográfica (3% de todos los DP malignos). Tanto los tumores de pulmón como los mesoteliomas predominaron en varones (80 y 86% de los casos respectivamente). Al menos la mitad de los cánceres de pulmón que metastatizaron a pleura fueron adenocarcinomas.
Causas de derrame pleural maligno y rentabilidad de la citología del líquido pleural
| Tumor primario | N (%) | Varones (%) | Rentabilidad citología del LP (%) |
| Pulmón | 309 (37) | 247 (80) | 177/304 (58) |
| Adenocarcinoma | 150 | 112 | 116/148 (78) |
| Carcinoma escamoso | 67 | 59 | 17/67 (25)* |
| Carcinoma célula pequeña | 37 | 30 | 19/36 (53) |
| Otrosa | 55 | 46 | 25/53 (47) |
| Mama | 137 (16) | 3 (2) | 92/136 (68) |
| Origen desconocido | 82 (10) | 39 (48) | 57/82 (70) |
| Hematológicob | 82 (10) | 45 (55) | 49/80 (61) |
| Gastrointestinalc | 71 (8) | 40 (56) | 34/71 (48) |
| Ovario | 59 (7) | 0 (0) | 41/59 (70) |
| Mesotelioma | 22 (3) | 19 (86) | 6/22 (27)** |
| Miscelánead | 78 (9) | 43 (55) | 35/77 (45) |
| Total | 840 | 436 (52) | 491/831 (59) |
LP: líquido pleural.
Comprende desconocido (34), célula no-pequeña sin concretar estirpe específica (18), indiferenciado (2) y sarcoma (1).
Incluye linfoma no hodgkiniano (61), leucemias (9), síndromes mielodisplásicos (5), mieloma multiple (5) y linfoma Hodgkin (2).
Incluye colon (25), estómago (22), páncreas (15), esófago (5), vía biliar (3) y tumor del estroma gastrointestinal (1).
Globalmente una primera citología del LP fue positiva en 424 (51%) de 831 pacientes con DP maligno. En 214 pacientes con una primera citología pleural negativa se repitió una segunda, que resultó diagnóstica en 55 (26%) casos. Finalmente, en 52 pacientes con 2 citologías negativas, una tercera muestra fue positiva en 12 (23%) casos. En conjunto, teniendo en cuenta todas las citologías realizadas, la rentabilidad de esta prueba para identificar malignidad fue del 59% (491/831). La utilidad del estudio citológico del LP resultó significativamente inferior en mesoteliomas (27%) y carcinomas escamosos de pulmón (25%).
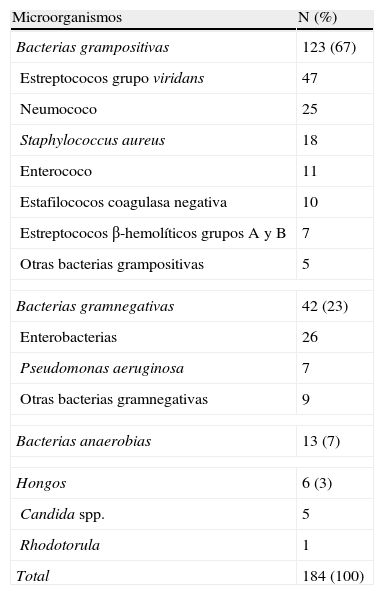
Derrame pleural paraneumónicoEn 562 DP paraneumónicos y empiemas se dispuso de cultivo de LP, que resultó positivo en 108 (66%) de 163 empiemas, en 47 (23%) de 208 DP paraneumónicos complicados y en 14 (7%) de 191 DP paraneumónicos no complicados. El 18% de los empiemas no estaban asociados a neumonías, sino a procesos como perforaciones esofágicas, complicaciones posquirúrgicas o empiemas bacterianos espontáneos del cirrótico.
Se aislaron 184 gérmenes en 169 pacientes (tabla 3); en 156 cultivos creció un único microorganismo, en 11 cultivos crecieron 2, y en 2 cultivos crecieron 3. Los estreptococos del grupo viridans fueron los microorganismos que más se aislaron de forma individual (39, 25%) y en cultivos polimicrobianos (9 de 13 cultivos). El aspecto purulento del LP fue significativamente más frecuente con gérmenes anaerobios (85%), enterococos (82%) y estreptococos viridans (77%) que con el resto de gérmenes aislados (p=0,03).
Aislamientos microbiológicos del líquido pleural
| Microorganismos | N (%) |
| Bacterias grampositivas | 123 (67) |
| Estreptococos grupo viridans | 47 |
| Neumococo | 25 |
| Staphylococcus aureus | 18 |
| Enterococo | 11 |
| Estafilococos coagulasa negativa | 10 |
| Estreptococos β-hemolíticos grupos A y B | 7 |
| Otras bacterias grampositivas | 5 |
| Bacterias gramnegativas | 42 (23) |
| Enterobacterias | 26 |
| Pseudomonas aeruginosa | 7 |
| Otras bacterias gramnegativas | 9 |
| Bacterias anaerobias | 13 (7) |
| Hongos | 6 (3) |
| Candida spp. | 5 |
| Rhodotorula | 1 |
| Total | 184 (100) |
El diagnóstico de tuberculosis pleural fue clínico en el 65% de las ocasiones. Solo creció Mycobacterium tuberculosis en 44 (18,5%) de 237 muestras de LP, utilizando cultivos sólidos (Lowenstein-Jensen). Se realizaron 15 biopsias pleurales en pacientes con cultivo de LP negativo, que demostraron granulomas caseificantes en 13 casos. El 78% (175/225) de los pacientes con tuberculosis pleural tenían una prueba de la tuberculina positiva y un 12,6% (17/135) estaban coinfectados por el virus de la inmunodeficiencia humana.
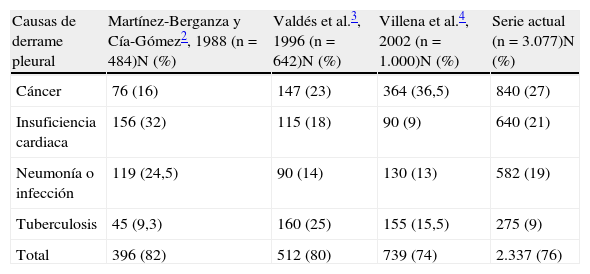
DiscusiónEste estudio pone de manifiesto que las 3 cuartas partes de los DP en los que se realiza una toracocentesis diagnóstica se deben, por orden de frecuencia, a neoplasias, insuficiencia cardiaca, neumonía o tuberculosis. Las series españolas previas (tabla 4) coinciden en este punto2–4, si bien la frecuencia relativa de estas 4 entidades es variable. De este modo, el porcentaje de pacientes con insuficiencia cardiaca es superior en series procedentes de servicios de medicina interna2, por representar esta entidad uno de los grupos relacionados por el diagnóstico más frecuentemente atendidos por los internistas. La tuberculosis pleural predomina en regiones españolas con una mayor prevalencia de la enfermedad como Galicia3, si bien se ha constatado un descenso progresivo en el número de casos durante la última década6; un hecho que también refleja nuestra serie.
Series españolas de derrame pleural en los últimos 25 años
| Causas de derrame pleural | Martínez-Berganza y Cía-Gómez2, 1988 (n=484)N (%) | Valdés et al.3, 1996 (n=642)N (%) | Villena et al.4, 2002 (n=1.000)N (%) | Serie actual (n=3.077)N (%) |
| Cáncer | 76 (16) | 147 (23) | 364 (36,5) | 840 (27) |
| Insuficiencia cardiaca | 156 (32) | 115 (18) | 90 (9) | 640 (21) |
| Neumonía o infección | 119 (24,5) | 90 (14) | 130 (13) | 582 (19) |
| Tuberculosis | 45 (9,3) | 160 (25) | 155 (15,5) | 275 (9) |
| Total | 396 (82) | 512 (80) | 739 (74) | 2.337 (76) |
Las causas de DP en edades extremas de la vida son distintas. Así, mientras que aproximadamente la mitad de los DP en sujetos jóvenes (<34 años) son tuberculosos, en octogenarios son secundarios a insuficiencia cardiaca, una observación ya realizada en el estudio de Villena et al.4. Cabe destacar en nuestro estudio el mayor peso de las pericarditis (4%) y del hidrotórax hepático (3%) como causas de DP, en comparación con series previas3,4, probablemente en relación con que estas últimas reclutaron fundamental o exclusivamente a pacientes ingresados en servicios de neumología.
Tradicionalmente se considera que la distinción entre trasudado y exudado es un primer paso fundamental en la evaluación diagnóstica del DP. Dicha discriminación se establece en la práctica clínica a través de los criterios de Light5. La mayoría de los trasudados corresponden a insuficiencias cardiacas (75-80%)2–4, aunque los derrames cardiacos cumplen criterios de Light para exudado, si bien por un estrecho margen, en alrededor de un 25% de los casos7. En contraposición a la creencia de que las embolias pulmonares pueden producir DP trasudativos, coincidimos con otros autores8 en que siempre cumplen criterios de Light para exudado.
Desde el punto de vista radiológico, el descubrimiento de un DP que opacifique la práctica totalidad del hemitórax o que sea bilateral acota el diagnóstico diferencial. Las neoplasias justifican más de la mitad de los DP masivos9, y las insuficiencias cardiacas más de la mitad de los DP bilaterales. Ocasionalmente, un paciente con DP bilateral tiene causas distintas del derrame en cada hemitórax, una condición que se conoce como síndrome de Contarini10.
En esta y en otras series publicadas2–4,11, el cáncer de pulmón es responsable de una tercera parte o más de los DP malignos. Con alguna excepción4, también hay unanimidad en cifrar en alrededor del 10% los DP malignos con un tumor primario desconocido2,3,11,12. Sin embargo, la frecuencia relativa de mesoteliomas varía según el área geográfica, en relación con el riesgo de exposición al asbesto. De este modo, mientras que en nuestra serie y en otras2,3 los mesoteliomas representaron solo un 3% de todos los DP malignos, otros estudios españoles multiplican por 4 o 5 (13-14,5%) dicho porcentaje4,12. Coincidiendo con lo descrito en la bibliografía médica12,13, en el presente estudio la rentabilidad global de la citología del LP para diagnosticar malignidad fue aproximadamente del 60%. Sin embargo, conviene destacar la baja sensibilidad del estudio citológico en los carcinomas escamosos de pulmón y los mesoteliomas (25 y 27%, respectivamente). El mesotelioma es un ejemplo paradigmático de que la combinación de la experiencia del citólogo (paralela a la prevalencia de la enfermedad) y del empleo de técnicas de inmunocitoquímica puede incrementar extraordinariamente el rendimiento de la citología. Ambos factores se aúnan en el grupo australiano de Segal et al., que recientemente han reportado una sensibilidad de la citología del LP del 73% sobre 517 casos de mesotelioma14. Por último, el rendimiento citológico del LP obtenido en nuestro estudio para tumores hematológicos (61%) contrasta con el descrito por otro grupo español (18%)12, circunstancia que puede justificarse porque en nuestro centro es común solicitar un estudio por citometría de flujo del LP cuando existe la sospecha de linfoma.
Con respecto a la microbiología del LP, la proporción global de pacientes con DP infecciosos en los que el cultivo estándar del LP resultó positivo fue tan solo del 30%, una cifra que aumentó hasta el 66% en el caso de líquidos purulentos (empiemas). Dos estudios amplios han descrito igualmente cultivos positivos en el 56,4 y 58% de 40615 y 43416 empiemas, respectivamente. En nuestra serie, las especies de estreptococo representaron un 43% del total de aislamientos, destacando los estreptococos del grupo viridans (anteriormente grupo milleri), que constituyeron el 25,5% de todos los cultivos positivos, dato coincidente con el de la serie de Maskell et al. (24% de 336 aislamientos en empiemas adquiridos en la comunidad)16. La demostración de bacterias anaerobias depende de unas condiciones adecuadas de recogida, transporte y procesamiento de la muestra, además del tipo de medio de cultivo empleado. Constituyeron el 7% de los gérmenes en nuestra serie, frente al 5,715, 8,517 y 20%16 de otros 3 estudios amplios. Ciertamente, la inoculación de LP en frascos de hemocultivos18 o el empleo de técnicas de amplificación de ácidos nucleicos19 puede incrementar significativamente el número de aislamientos microbiológicos. Con relación a la tuberculosis pleural, solo se consiguió aislar Mycobacterium tuberculosis del LP utilizando medio de Lowenstein-Jensen en el 18,5% de los casos, un cifra que se sitúa entre la horquilla del 720 al 36%21 descrita en la bibliografía. El hecho de que la pleuritis tuberculosa sea una enfermedad paucibacilar explica estos bajos porcentajes que, no obstante, pueden aumentar notablemente con el empleo de medios de cultivo líquidos (63% de sensibilidad en una serie de 382 tuberculosis pleurales)22.
Este estudio tiene algunas limitaciones. Se han incluido solo aquellos pacientes que se sometieron a una toracocentesis diagnóstica. Esto puede conllevar que algunas etiologías de DP se vean poco representadas, como la insuficiencia cardiaca (en muchos pacientes con una sintomatología clínica característica se asume el diagnóstico de derrame cardiaco sin proceder a la aspiración de LP) o la embolia pulmonar (los derrames son generalmente de pequeño tamaño y el paciente suele estar anticoagulado en espera de una prueba de confirmación). Igualmente, la carencia de cirugía cardiaca y torácica en nuestro centro justifica el escaso número de DP relacionados con estas técnicas.
En conclusión, el cáncer, la neumonía y la tuberculosis causan la mayor parte de los exudados pleurales, mientras que la insuficiencia cardiaca es la causa fundamental de trasudados. Las pericarditis y los hidrotórax hepáticos son también etiologías relativamente frecuentes de DP. La tuberculosis pleural predomina en adultos jóvenes y la insuficiencia cardiaca en octogenarios. La rentabilidad de los cultivos bacterianos en derrames infecciosos es baja, excepto si el LP tiene aspecto purulento. Igualmente, los cultivos sólidos para micobacterias identifican muy pocos DP tuberculosos. La citología del LP es un método sencillo para diagnosticar malignidad pero ofrece resultados falsos negativos en al menos el 40% de los casos.
FinanciaciónEste trabajo no ha recibido financiación.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Agradecemos al Biobanco del Institut de Recerca Biomèdica de Lleida, que forma parte de la Xarxa Catalana de Bancs de Tumors y RETIC Biobancos RD09/0076/00059, el procesamiento y conservación de las muestras de líquido pleural.