La enfermedad pulmonar obstructiva crónica (EPOC) es conocida desde hace muchos años, y la preocupación actual se centra en el reciente y continuo incremento de su prevalencia y la alta mortalidad que causa. Es un proceso patológico que se caracteriza por una limitación del flujo respiratorio no completamente reversible; por lo general, es progresiva y se asocia con una respuesta inflamatoria pulmonar anómala a la inhalación de partículas y gases nocivos. Además, el tabaquismo es el factor de riesgo más importante para el desarrollo de la EPOC, por lo que siempre que haya ocasión debe aconsejarse a los fumadores que dejen el hábito. La aparición de la espirometría supuso la posibilidad de objetivar y definir los conceptos funcionales que nos permiten clasificar la enfermedad. Precisamente la idea de valorar la obstrucción al flujo aéreo y relacionar el volumen espiratorio forzado en el primer segundo (FEV1) con la capacidad vital forzada (CVF) introdujo la definición de EPOC.
Obstrucción crónica al flujo aéreo
La presencia de obstrucción al flujo aéreo se define por la disminución del FEV1 en presencia de un cociente FEV1/CVF < 70%. La espirometría es pues necesaria para determinar la presencia de obstrucción al flujo aéreo que, además, debe ser no reversible o sólo parcialmente reversible para establecer el diagnóstico de EPOC. Esto exige la realización de una prueba broncodilatadora para valorar los cambios tras la inhalación de un broncodilatador como salbutamol a dosis de 400 μg.
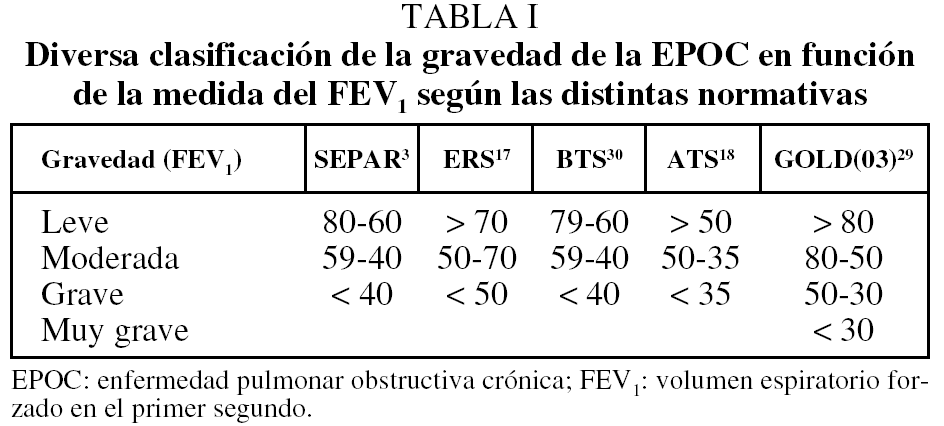
Por esta medida del FEV1 se clasifica el estado de gravedad de la EPOC, que en cualquier caso varía según las diversas cifras establecidas en las guías o normativas utilizadas. En la tabla I se muestran las diferencias en las clasificaciones más frecuentemente reseñadas.
Definición de EPOC
La EPOC se caracteriza por la presencia de obstrucción al flujo aéreo. Esta obstrucción es habitualmente progresiva, no completamente reversible, y no cambia de forma significativa en varios meses. La obstrucción se define por la reducción del FEV1 y el cociente FEV1/CVF; la EPOC precisa para el diagnóstico un FEV1 < 80% del predicho y un cociente FEV1/FVC < 0,7. La obstrucción al flujo aéreo se debe a la suma de las lesiones en el parénquima pulmonar y en la vía respiratoria. La lesión es el resultado de la inflamación crónica establecida, diferente del asma, y se debe fundamentalmente al efecto de la inhalación del humo de tabaco. La obstrucción de la vía respiratoria puede estar presente antes incluso de que el paciente note su presencia con los primeros síntomas. La EPOC produce ciertos síntomas, malestar y un empeoramiento de la calidad de vida, que pueden responder a fármacos u otras terapias que tienen un impacto limitado sobre la obstrucción de la vía respiratoria.
El acrónimo EPOC surge por primera vez en 1965 en el seno de la American Thoracic Society (ATS) y el American College of Chest Phisician1 y se define como una enfermedad de etiología incierta caracterizada por la obstrucción del flujo aéreo que se enlentece en la espiración forzada. Esta definición queda mejor establecida por la ATS como una alteración caracterizada por la disminución de los flujos aéreos espiratorios que no se modifica durante varios meses de observación, producida como consecuencia de las alteraciones estructurales que afectan a las vías respiratorias y al parénquima pulmonar, como la bronquitis crónica, el enfisema y la enfermedad de las pequeñas vías respiratorias2; por tanto, en esta definición se recogen los aspectos morfológicos y funcionales.
La Sociedad Española de Neumología y Cirugía Torácica (SEPAR), en su guía clínica para el diagnóstico y el tratamiento de la EPOC3 define la enfermedad en términos similares, como obstrucción crónica y poco reversible al flujo aéreo; introduce de forma destacada el tabaco como principal agente causal de la enfermedad, y recuerda que su consumo produce cambios inflamatorios pulmonares en todos los fumadores, aunque sólo en una parte de ellos tiene lugar una respuesta anómala que condiciona el desarrollo de alteraciones anatómicas en la vía respiratoria y en el parénquima pulmonar. Esta misma normativa recuerda que la definición de la EPOC y su graduación sobre la base exclusivamente de criterios espirométricos tiene importantes limitaciones, dado que la reducción del flujo aéreo es crónica y poco reversible con el tratamiento. Por este motivo se considera de interés que en la caracterización de la enfermedad también se tomen en consideración las alteraciones del intercambio gaseoso, la percepción de los síntomas, la capacidad de ejercicio y la presencia de alteraciones nutricionales.
Posteriormente, otras definiciones amplían la perspectiva de la enfermedad y añaden otros aspectos distintos del FEV1, que conducen a la idea de que la EPOC no es sólo una enfermedad pulmonar. En este mismo sentido se aventuran otras opciones para explicar la etiología de la enfermedad y plantear posibles bases inmunológicas para su desarrollo4. En esta misma línea se sugiere que el hecho de que la inflamación persista tras el abandono del hábito tabáquico5 puede justificar la presencia de un proceso de autoperpetuación de la enfermedad que impida la resolución de la inflamación. Este tipo de mecanismo se ha relacionado con la patogenia de diversas enfermedades autoinmunitarias6, pero aún se desconoce si puede establecerse en la EPOC. Por tanto, plantear esta opción podría abrir nuevas e insospechadas alternativas terapéuticas en estos pacientes7.
Se complementa la definición de la EPOC con otras características asociadas con la enfermedad, como el número y la gravedad de exacerbaciones, la pérdida de peso y la disfunción muscular. Las modernas técnicas de biología molecular y celular y los avances en las técnicas de imagen permitirán definir con más precisión las diferentes entidades nosológicas incluidas en el término EPOC, que pueden incluso ser tributarias de diversas estrategias terapéuticas8.
Celli et al9 han desarrollado un sistema multidimensional, el BODE index (Body-Mass Index, Airflow Obstruction, Dyspnea, and Exercise Capacity Index), que integra la información sobre distintos aspectos clínicos y funcionales de la EPOC, como el grado de obstrucción, la capacidad de ejercicio, los síntomas y el estado nutricional, con la consideración de que un sistema de este tipo puede graduar mejor la gravedad de la EPOC que con la determinación del FEV1 solamente. En el estudio prospectivo de validación de este índice, la puntuación obtenida con el BODE index se correlacionó con la mortalidad total y de causa respiratoria, y ha mostrado incluso una mayor capacidad predictiva que el FEV1.
¿Hay reversibilidad en la EPOC?
Se considera que la EPOC es una enfermedad obstructiva irreversible y progresiva, y ello se ha ligado durante años al concepto de no tratable o incurable. La misma definición de la enfermedad implica una escasa reversibilidad de la obstrucción al flujo aéreo tras una prueba broncodilatadora. A este respecto, debe considerarse que no siempre la respuesta es tan escasa a la broncodilatación y, en caso de respuesta negativa, los broncodilatadores siguen siendo el tratamiento sintomático primordial. Dado que estos fármacos mejoran claramente la sintomatología de los pacientes, es posible que otro mecanismo diferente de la broncorrelajación, como la reducción en el grado de hiperinsuflación pulmonar, sea el que explique su beneficio10. La administración de anticolinérgicos y agonistas β2 mejora el grado de disnea y la calidad de vida, y reduce el número y la gravedad de las exacerbaciones en los pacientes con EPOC, todo ello sin modificar sustancialmente el FEV111,12. Todo ello confirma que la valoración de la reversibilidad en la EPOC no es igual que en el asma y, por tanto, debe considerarse su resultado de forma diferente. Se ha comunicado13 que al menos un 30% de los pacientes presenta una respuesta broncodilatadora positiva cuando se le realiza una espirometría por primera vez en su vida, y que el 68% de los que tienen una respuesta negativa inicialmente presentará, al menos, una respuesta positiva en espirometrías seriadas realizadas en los meses siguientes.
Algunos factores que influyen en esta variabilidad son la presencia de diversos grados de lesión en el pulmón del paciente con EPOC, incluso la concomitancia, en el tiempo o en diversas zonas pulmonares, de diversos tipos de lesión. Igualmente ocurre con la mejoría clínica observada con frecuencia, sin que se acompañe de cambios en la espirometría forzada. Así, aunque se acepte de forma generalizada que sólo una pequeña proporción de pacientes con EPOC (15-20%) tiene una respuesta positiva al tratamiento broncodilatador, la valoración del efecto terapéutico de los broncodilatadores y corticoides debe realizarse con cautela.
Algunos pacientes refieren una mejoría clínica manifiesta sin una respuesta del FEV1 ≥ 15%, pero sí es posible la mejoría respiratoria relacionada con la de la capacidad vital inspiratoria o en el grado de atrapamiento aéreo. Además, la respuesta broncodilatadora debe valorarse en el momento de mayor eficacia del broncodilatador y en varias pruebas consecutivas, intentando conseguir el máximo efecto del fármaco. Algunos pacientes que no obtienen una respuesta positiva con los betaadrenérgicos de acción rápida, como el salbutamol, pueden responder a los anticolinérgicos de acción corta, como el bromuro de ipratropio.
De igual modo, reviste una cierta relevancia el criterio de broncodilatación usado. La estrategia GOLD14 establece un mínimo de 200 ml o del 12% del valor basal, mientras que en otras normativas se establece un rango del 10-20% en la variación del FEV1 para establecer la positividad de la prueba broncodilatadora. Así, en un trabajo reciente15 sobre los pacientes incluidos en el estudio ISOLDE16, la proporción de los reclasificados por un criterio ERS17 fue del 38% respecto a su reversibilidad establecida previamente por la normativa ATS18.
Como consecuencia de estas limitaciones el análisis de la reversibilidad de la obstrucción bronquial en la EPOC debe realizarse con dosis adecuadas de betaadrenérgicos y de anticolinérgicos, esperando al menos 30 min para conseguir el efecto máximo y medir, además, otros cambios en los volúmenes con maniobras no forzadas, como la capacidad inspiratoria y la capacidad residual funcional; hay que tener siempre en cuenta que la información que aporta una prueba broncodilatadora tiene una limitada relevancia clínica19.
Por tanto, se pueden extraer algunas conclusiones: a) el criterio de reversibilidad de una prueba broncodilatadora no es relevante clínicamente y, en cierto modo, refleja la limitación del FEV1 como parámetro único para establecer la gravedad de la EPOC20; b) la prueba de broncodilatación debe ser repetida en más de una ocasión teniendo en cuenta que una respuesta negativa a un broncodilatador puede ser positiva con otro distinto, y c) el grado de respuesta no se relaciona con el sexo, el grado de atopia, el tabaquismo activo o la toma previa de esteroides inhalados15.
Broncodilatadores en la EPOC
Los broncodilatadores son el principal grupo terapéutico en el tratamiento de la EPOC estable. En pacientes clínicamente estables, el tratamiento regular con broncodilatadores nebulizados no es el más apropiado, a menos que se haya demostrado que su uso sea superior al tratamiento convencional con inhaladores de cartucho presurizado. En los estadios iniciales de la enfermedad se recomienda el uso de anticolinérgicos de acción corta (bromuro de ipratropio) o betaadrenérgicos de acción rápida (salbutamol, terbutalina, fenoterol). Las teofilinas, debido a su estrecho margen de seguridad, sus potenciales efectos secundarios y su menor potencia broncodilatadora, han pasado a ser consideradas fármacos de segunda línea. La elección entre agonistas β2, anticolinérgicos y metilxantinas, o su aplicación combinada, dependerá de la disponibilidad de la medicación y de la respuesta individual de cada paciente desde la perspectiva de la efectividad para aliviar los síntomas y los efectos secundarios.
La misma normativa GOLD14, citada anteriormente, recuerda los siguientes principios básicos para el tratamiento, según la evidencia científica de grado A:
La cesación del tabaco es la medida más coste-efectiva para evitar el desarrollo y la progresión de la enfermedad.
Ningún tratamiento farmacológico disponible hasta la fecha ha demostrado incidir en la progresión de la enfermedad.
Los broncodilatadores son la piedra angular en el tratamiento farmacológico de la EPOC.
Los broncodilatadores de acción prolongada son más efectivos y convenientes en el tratamiento regular de la EPOC estable.
Los corticoides inhalados asociados con los broncodilatadores están indicados en pacientes con FEV1 < 50% y exacerbaciones repetidas.
Además de estas premisas, todas las normativas recomiendan establecer una pauta de tratamiento escalonado en función de los síntomas y la gravedad del proceso. El tratamiento debe completarse con medidas no farmacológicas, como la rehabilitación respiratoria, las medidas generales preventivas, el abordaje de la insuficiencia respiratoria, la aplicación de oxigenoterapia y la valoración quirúrgica (cirugía de reducción de volumen o trasplante pulmonar) cuando sea precisa en las formas más graves y en pacientes seleccionados.
Los broncodilatadores de acción prolongada toman su protagonismo en los estadios moderado o grave de la EPOC, donde se muestran más efectivos y convenientes. Los betaadrenérgicos de acción prolongada (salmeterol y formoterol) se recomiendan en todos los pacientes que requieran tratamiento broncodilatador de forma regular, y esta recomendación se reitera en las últimas normativas. Su uso mejora la tolerancia al ejercicio y la calidad de vida11. Por su parte, los anticolinérgicos de acción prolongada (tiotropio) consiguen una mejoría en la calidad de vida y una reducción del número de exacerbaciones12,21. Los anticolinérgicos son un tratamiento de primera línea en el manejo clínico del paciente con EPOC. En los estudios realizados con tiotropio la respuesta broncodilatadora favorable se confirmó en todas las dosis, aunque con una clara relación dosis-respuesta. Pero lo que realmente avala el tratamiento con este u otros broncodilatadores no es sólo su pico de broncodilatación en una prueba estándar, sino los beneficios funcionales que se obtienen con su uso continuado respecto a la tolerancia al ejercicio y la mejoría de los síntomas. El uso combinado de fármacos con diferente mecanismo de acción y diversa duración de su efecto puede aumentar el grado de broncodilatación con efectos secundarios similares o incluso inferiores. En la tabla II se muestran los resultados de los estudios recientes más significativos, en los que se compara el efecto de los broncodilatadores de acción prolongada frente a placebo en pacientes estables y en períodos largos. Hay más estudios publicados sobre el salmeterol que sobre el formoterol, y últimamente aparecen nuevos trabajos con tiotropio. En su conjunto, valoran la eficacia en relación con la mejoría establecida en el FEV1, el control diario de los síntomas, el uso de medicación de rescate, la disnea, la calidad de vida y las exacerbaciones.
Un reciente estudio22 ha comparado la eficacia de tiotropio a dosis de 18 μg 1 vez al día con salmeterol 50 μg 2 veces al día. Incluye a 1.605 pacientes con un FEV1 ¾ al 65% del valor predicho y con una historia de tabaquismo superior a 10 paquetes/año. Tras cumplir una observación de 6 meses, respecto a las exacerbaciones el resultado mostró que el tiotropio prolongó el tiempo hasta la primera exacerbación frente a placebo y, además, los pacientes tuvieron menos exacerbaciones por año al ser tratados con este anticolinérgico frente a placebo (p < 0,05). Además, tanto los pacientes tratados con tiotropio como con salmeterol tuvieron una menor estancia hospitalaria por exacerbación que los que tomaron placebo, aunque la diferencia no fue estadísticamente significativa. Ambos fármacos mejoraron la disnea frente a placebo. En conclusión, ambos compuestos activos lograron una broncodilatación significativa, y el tiotropio fue superior al salmeterol en cuanto al control de las exacerbaciones, el uso de recursos sanitarios y la calidad de vida.
Asociación de broncodilatadores y corticoides inhalados
Si ambas medicaciones, broncodilatadores y corticoides inhalados, tienen ventajas por separado, ¿puede haber un beneficio adicional si se usan de forma asociada?, ¿pueden conseguir un mayor efecto broncodilatador? Algunos estudios recientes demuestran que la terapia con glucocorticoides inhalados puede beneficiarse de la asociación con betaadrenérgicos de acción prolongada. Así, determinados estudios realizados con budesonida/formoterol han demostrado su eficacia para el tratamiento de la EPOC moderada-grave, ya que reducen las exacerbaciones y procuran mejorías precoces y mantenidas de la función pulmonar y los síntomas, junto con la calidad de vida relacionada con la salud, con un perfil de seguridad similar a placebo23. En otros estudios con esta misma asociación24 la reducción de la puntuación de la disnea fue significativamente mayor en los pacientes tratados con la combinación de fármacos que en los que recibieron sólo budesonida, a la vez que hubo una reducción de las puntuaciones de los síntomas totales, despertares y opresión torácica, y una disminución del uso de fármacos paliativos en relación con los que recibieron sólo formoterol. La asociación de estas dos terapias que pueden ser complementarias en sus efectos25 se demuestra también en otros estudios sobre la asociación salmeterol/fluticasona, que consigue mejorar sustancialmente el flujo respiratorio (FEV1 y flujo espiratorio máximo matutino) y aliviar la disnea, con una mejor puntuación en las pertinentes escalas y un menor uso de medicación de rescate26. En este mismo sentido, un importante estudio27 realizado sobre 1.465 pacientes demuestra que esta misma asociación de fármacos produce un control mejor de los síntomas y de la función pulmonar sin mayor riesgo de efectos secundarios que cuando se usa cualquiera de los fármacos solos. Aunque algunos estudios28 demuestran que es necesario un tratamiento continuado de 3 meses para conseguir una verdadera mejoría de la función pulmonar, se van aportando evidencias de los efectos aditivos de las terapias antiinflamatorias y broncodilatadoras en la EPOC. Estos hallazgos han propiciado que en la revisión de la iniciativa GOLD de 2003 quede su indicación claramente establecida29.
Correspondencia: Dr. J.L. Viejo Bañuelos.
Servicio de Neumología. Hospital General Yagüe.
Avda. del Cid, 96. 09005 Burgos. España.
Correo electrónico: jlviejo@hgy.es