Debido a que la obstrucción al flujo aéreo es la característica esencial de la enfermedad pulmonar obstructiva crónica (EPOC), los broncodilatadores desempeñan un destacado papel en su tratamiento. De hecho, durante años se ha recurrido a fármacos que lograban una respuesta broncodilatadora relativamente rápida, aunque dicho efecto remitía en pocas horas. Todavía hoy disponemos de broncodilatadores de acción corta, tanto en el grupo de los agonistas betaadrenérgicos (salbutamol, terbutalina o fenoterol) como en el de los anticolinérgicos (bromuro de ipratropio). Sin embargo, el desarrollo de broncodilatadores de acción más prolongada ha limitado el empleo de estos medicamentos, y actualmente han quedado más relegados en el arsenal terapéutico.
Recomendaciones y realidad
En los sucesivos consensos para el manejo de la EPOC se ha ido acotando considerablemente el campo de aplicación de los broncodilatadores de acción corta en la enfermedad estable. La normativa SEPAR limitaba su empleo a los pacientes con EPOC leve-moderada poco sintomáticos1. De hecho, se considera más recomendable el empleo de forma pautada de broncodilatadores de acción prolongada, sobre todo cuando predominan los síntomas nocturnos, cuando se quiere reducir el número diario de inhalaciones y siempre que se precise aliviar los síntomas de forma continuada2.
En esta misma línea, el consenso internacional GOLD resulta más categórico y establece que el tratamiento regular con broncodilatadores de acción prolongada es más efectivo y conveniente que con los de acción corta3, y limita el tratamiento con estos últimos a su utilización a demanda en la EPOC de grado I3. No obstante, la reciente recomendación conjunta ATS-ERS matiza muy acertadamente la supuesta primacía de los broncodilatadores de acción prolongada sobre los de acción corta, al establecer que los agonistas betaadrenérgicos de acción prolongada mejoran el estado de salud posiblemente en mayor magnitud que los anticolinérgicos de acción corta, mientras que la mejoría de los síntomas, la necesidad de medicación de rescate y el incremento del tiempo entre las exacerbaciones sólo resulta relevante con respecto al placebo4.
No obstante, las diversas aproximaciones que se han realizado en nuestro medio a la prescripción farmacológica en la EPOC reflejan una situación diferente. Miravitlles et al5 valoraron el manejo de la EPOC por parte de 268 médicos de atención primaria distribuidos en 17 comunidades autónomas de España. Comprobaron que los fármacos más empleados en estos pacientes eran los agonistas betaadrenérgicos de acción corta (65%), seguidos por los corticoides inhalados (47%), las teofilinas (43%) y los agonistas betaadrenérgicos de acción prolongada (41%)5.
Más recientemente, De Miguel et al6 llevaron a cabo un estudio observacional, descriptivo y multicéntrico sobre la prescripción en la EPOC, tanto en atención primaria como en neumología. En su caso, los fármacos más usados fueron el bromuro de ipratropio (77,8%) y los agonistas betaadrenérgicos de acción corta (65,8%), seguidos por los corticoides inhalados (61,0%), los agonistas betaadrenérgicos de acción prolongada (46,4%) y las teofilinas (41,3%). Estos autores comprobaron que la prescripción de agonistas betaadrenérgicos de acción corta era más frecuente en atención primaria y la de anticolinérgicos de acción corta en las consultas de neumología. Por último, estos investigadores hallaron que en atención primaria no había diferencias respecto a la prescripción de agonistas betaadrenérgicos de acción corta entre la EPOC leve-moderada y la grave (el 61,3 frente al 73,8%), mientras que en neumología la utilización de estos fármacos resultaba menos frecuente en la EPOC leve-moderada que en la grave (el 56,8 frente al 68,0%)6.
Ante esta situación resulta evidente que la concordancia entre las recomendaciones y la práctica cotidiana es, cuanto menos, discreta. Para valorar más adecuadamente esta supuesta discrepancia resulta conveniente revisar los datos disponibles sobre la eficacia, la seguridad y el coste de los broncodilatadores de acción corta en la EPOC.
Eficacia en la enfermedad estable
Frente a placebo
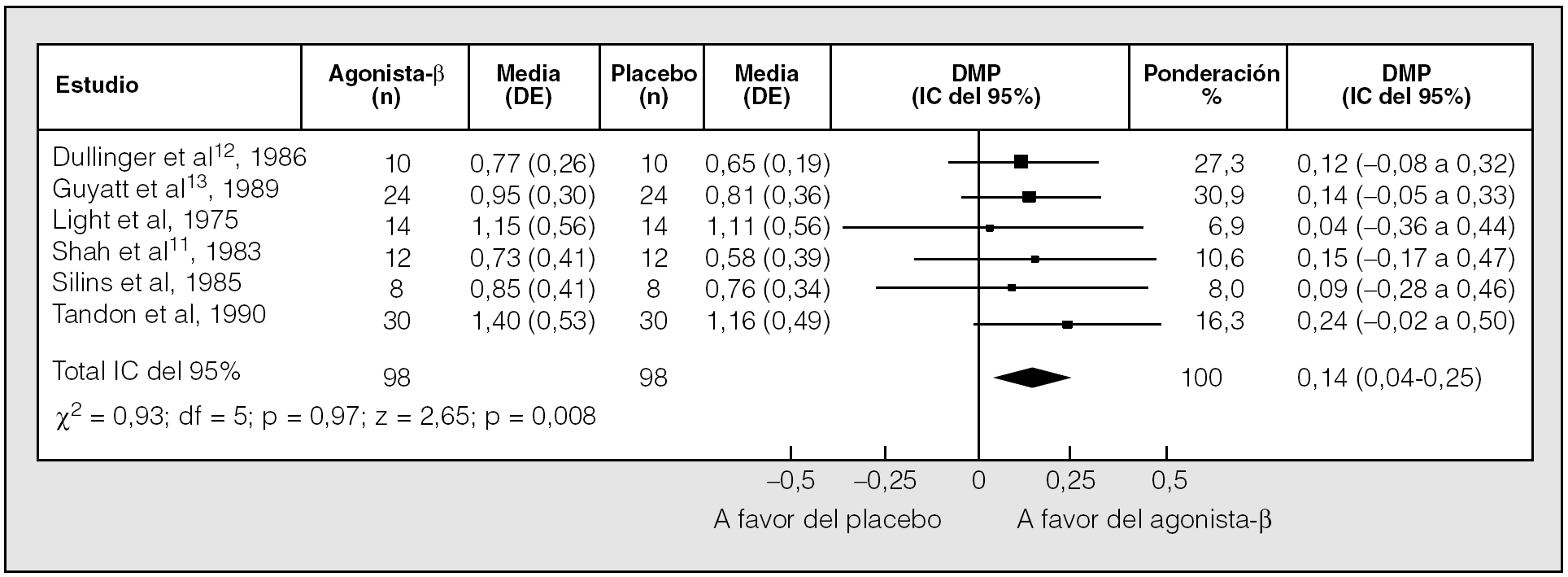
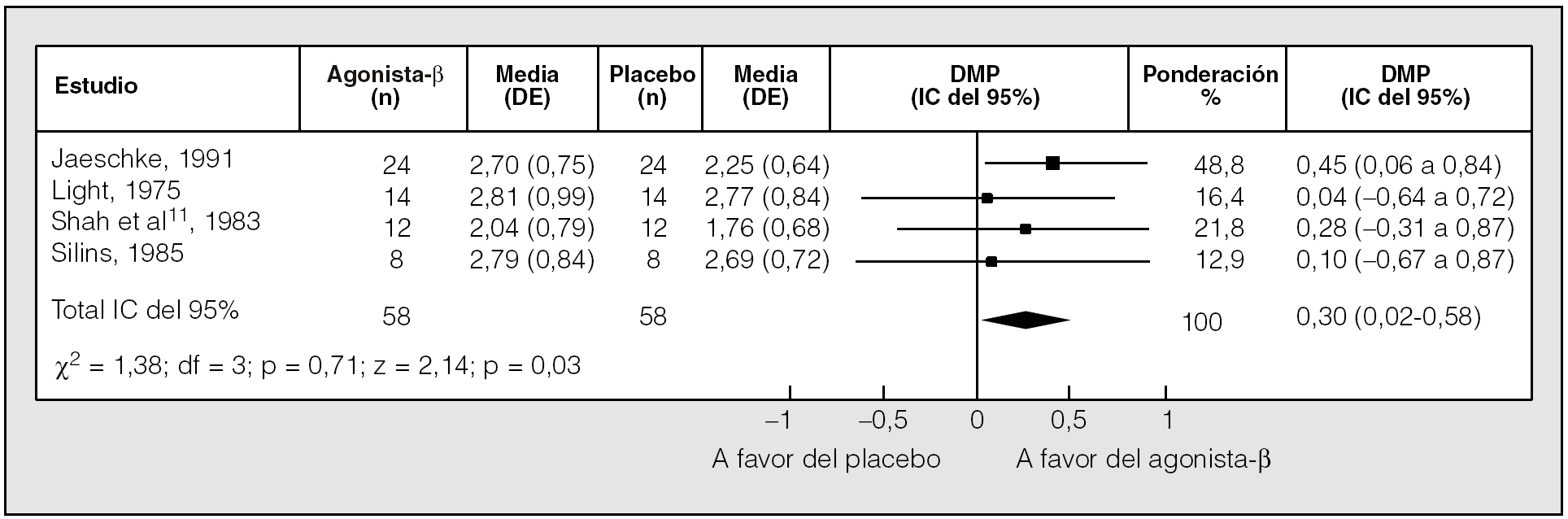
Una reciente revisión sistemática comparó el efecto del tratamiento con agonistas betaadrenérgicos de acción corta inhalados frente a placebo en pacientes con EPOC estable7,8. El análisis final incluyó 13 ensayos clínicos aleatorizados, de al menos 1 semana de duración, con un diseño cruzado todos ellos. Se comprobó que los fármacos inducían un discreto pero significativo incremento del volumen espiratorio forzado en el primer segundo (FEV1) (diferencia de medias ponderada [DMP], 0,14 l; intervalo de confianza [IC] del 95%, 0,04-0,25) (fig. 1) y de la capacidad vital forzada (FVC) (DMP, 0,30 l; IC del 95%, 0,02-0,58) (fig. 2). No se halló ningún efecto del tratamiento sobre la capacidad pulmonar total, la capacidad residual funcional ni el volumen residual, aunque los volúmenes pulmonares estáticos resultaron valorados en pocos estudios8.
Fig. 1. Comparación del efecto de los agonistas betaadrenérgicos de acción corta y un placebo en el volumen espiratorio forzado en el primer segundo (FEV1) posbroncodilatador. DE: desviación estándar; DMP: diferencia media ponderada; IC: intervalo de confianza. (Modificado de Ram y Sestini8.)
Fig. 2. Comparación del efecto de los agonistas betaadrenérgicos de acción corta y un placebo en la capacidad vital forzada posbroncodilatador. DE: desviación estándar; DMP: diferencia media ponderada; IC: intervalo de confianza. (Modificado de Ram y Sestini8.)
También se verificó que, con respecto al placebo, los agonistas betaadrenérgicos de acción corta aumentaban el flujo espiratorio pico (PEF) posbroncodilatador, tanto matutino (DMP, 29,17 l/min; IC del 95%, 0,25-58,09) como vespertino (DMP, 36,75 l/min; IC del 95%, 2,56-70,94)9. Este último hallazgo resulta concordante con otros estudios no incluidos en el metaanálisis. Hansen y May10 documentaron un incremento matutino del PEF de un 11% tras la administración de terbutalina y de un 5% después del placebo. Por la noche, el incremento alcanzado tras la ingesta del fármaco superaba al del placebo (el 8 frente al 3%). Shah et al11 también demostraron, mediante el uso de una prueba de rango verificada, que el PEF medio diario aumentaba 157 y 182 l/min con placebo y salbutamol, respectivamente.
Seis de los estudios incluidos en la revisión sistemática analizaban adecuadamente el efecto del tratamiento sobre la disnea, apreciándose una mejoría significativa en su puntuación media con los broncodilatadores, pese a no identificar diferencias entre las puntuaciones matutina y vespertina.
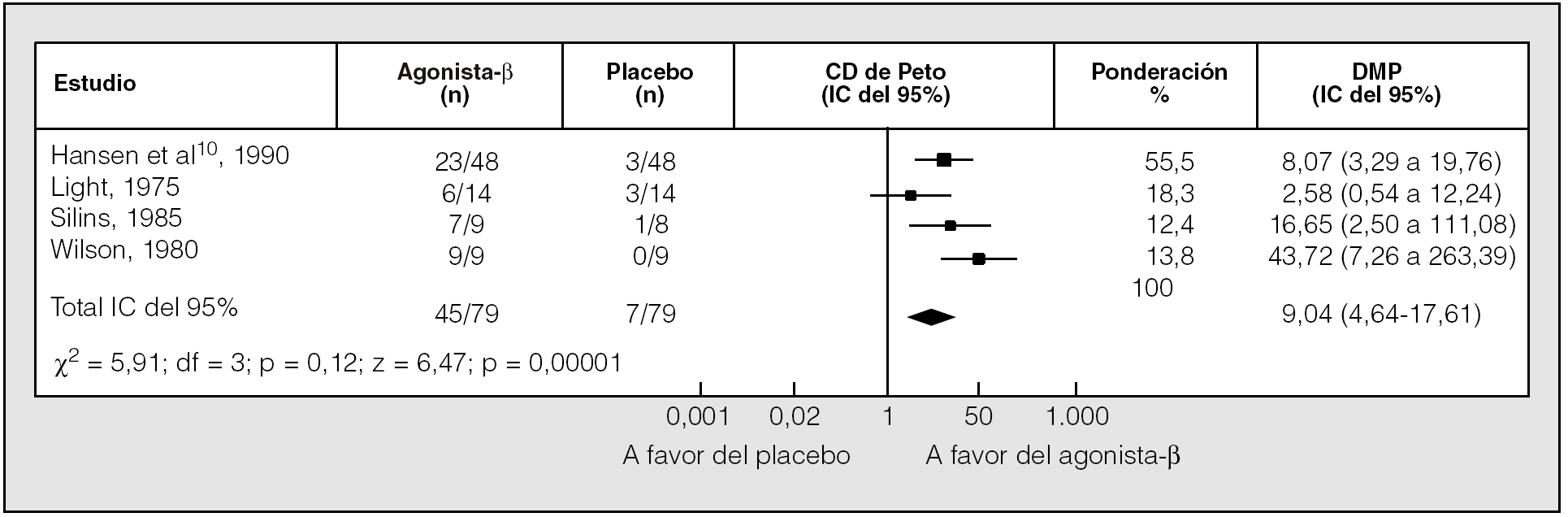
Cinco ensayos informaron sobre el número de pacientes que abandonaron el estudio debido a una exacerbación de la disnea durante el tratamiento con agonistas betaadrenérgicos o placebo (fracaso terapéutico). El número de abandonos con fármacos fue la mitad que con placebo (22 frente a 46 pacientes). El riesgo de fracaso del tratamiento fue significativamente mayor en el grupo de placebo que en el grupo de agonistas betaadrenérgicos de acción corta (riesgo relativo = 0,49; IC del 95%, 0,33-0,73)7,8. Por tanto, los pacientes mostraron una clara preferencia por el tratamiento con los broncodilatadores de acción corta (fig. 3).
Fig. 3. Comparación del efecto de los agonistas betaadrenérgicos de acción corta y un placebo en la preferencia de los pacientes. CD de Peto: coeficiente de disparidad de Peto; IC: intervalo de confianza. (Modificado de Ram y Sestini8.)
En uno de los ensayos clínicos no se detectaron diferencias en el diagrama de coste de oxígeno después del tratamiento con metaproterenol12. Sin embargo, Guyatt et al13 valoraron los cambios en el Chronic Respiratory Disease Questionnaire (CRQ) después de la administración de salbutamol, e indicaron una mejoría significativa en las puntuaciones de disnea y fatiga. La prueba de la caminata de 6 min fue valorada en 4 de los ensayos clínicos seleccionados. En 2 de ellos11,14 se registraron incrementos significativos en la distancia recorrida de 35 y 42 m, mientras que los otros 2 no detectaron modificaciones10,12.
Por último, ninguno de los estudios analizados detectó efectos secundarios graves durante el tratamiento con agonistas betaadrenérgicos inhalados, aunque debe considerarse que los ensayos clínicos analizados no tenían ni el número de pacientes ni la duración en la observación suficientes para excluir con un elevado grado de certeza cualquier posible efecto secundario.
Resulta sorprendente que, a pesar del gran número de pacientes con EPOC tratados actualmente con broncodilatadores betaadrenérgicos, haya tan pocos ensayos clínicos aceptables sobre su eficacia. Además, la mayoría de los estudios disponibles fueron realizados sobre pequeños tamaños muestrales, que raramente alcanzan los 24 sujetos. Por tanto, parece evidente que los agonistas betaadrenérgicos de acción corta han ganado popularidad en el tratamiento de la EPOC estable a partir de los resultados de estudios sobre pacientes agudos y de ensayos clínicos no controlados, así como a partir de la percepción del beneficio por parte de los pacientes.
No obstante, el metaanálisis comentado demuestra un efecto beneficioso y sostenido sobre la función pulmonar y la disnea, pero se carece de resultados a largo plazo, como los relacionados con los ingresos hospitalarios, los efectos secundarios y la supervivencia7,8. A diferencia de la función respiratoria antes del broncodilatador, el incremento del FEV1 posbroncodilatador después del tratamiento activo confirma el efecto broncodilatador del tratamiento con agonistas betaadrenérgicos de acción corta en la EPOC, observado en varios estudios sobre pacientes agudos15,16. Ninguno de los ensayos incluidos fue diseñado para investigar los cambios producidos en la actividad broncodilatadora en el transcurso del tiempo, y estos datos no brindan ninguna evidencia para valorar el desarrollo de la taquifilaxia. La corta duración de los estudios incluidos en la mencionada revisión impidió que pudieran usarse para evaluar cualquier efecto sobre la progresión de la enfermedad con el transcurso del tiempo.
Pese a que para superar las diferentes escalas usadas en los estudios analizados hubo que combinar las puntuaciones de disnea a partir de las medias estandarizadas, la mejoría en la puntuación fue consistente en los diferentes estudios. Por tanto, y aunque la amplitud de la mejoría no puede estimarse exactamente mediante el uso de una puntuación combinada, es probable que este efecto resulte clínicamente relevante. Aunque la disnea en la EPOC tiene un origen multifactorial, una de las causas más importantes es el desarrollo de hiperinsuflación dinámica17,18, que puede revertirse parcialmente con broncodilatadores. Belman et al19 fueron los primeros en demostrar el efecto de los agonistas betaadrenérgicos de acción corta sobre la hiperinsuflación dinámica y su relación con la disnea en la EPOC. Comprobaron que la administración previa de salbutamol reducía los índices de hiperinsuflación dinámica durante el ejercicio, mejoraba el acoplamiento neuroventilatorio (relación entre el impulso inspiratorio desarrollado y la ventilación por minuto alcanzada) y disminuía la disnea.
De forma más específica, en otra revisión sistemática se valora el efecto de los broncodilatadores de acción corta sobre la capacidad de ejercicio en la EPOC20. En ella, se identifican 17 estudios con anticolinérgicos (10 con bromuro de ipratropio, 6 con oxitropio y 1 con atropina), 12 de ellos de dosis única. En 3 estudios con dosis única y en 1 de mantenimiento de dosis se comprobó que el tratamiento farmacológico inducía un incremento significativo de la distancia caminada durante una prueba de marcha. También se apreció una mejoría en la capacidad de ejercicio incremental20. Además, O'Donnell et al21 demostraron un aumento significativo de 2,8 min en el tiempo de endurance, tras nebulizar 500 μg de ipratropio.
El efecto de los agonistas betaadrenérgicos de acción corta sobre la capacidad de ejercicio en la EPOC fue valorado en 14 estudios. En ellos se comprobó que el salbutamol mejoraba significativamente los resultados del ejercicio de carga constante, con independencia de la dosis, el método de administración o la duración del tratamiento. Sin embargo, en 3 estudios no se observó efecto alguno de la terbutalina sobre la capacidad de ejercicio progresivo ni de carga constante20.
Frente a broncodilatadores de acción prolongada
Aunque no tan numerosos, hay algunos estudios en los que se comparó la acción de los broncodilatadores de acción corta con fármacos de acción prolongada (tiotropio, salmeterol o formoterol).
Un ensayo clínico realizado en diversos centros europeos comparó el bromuro de ipratropio con el tiotropio22. Al año de tratamiento, el tiotropio resultó estadísticamente superior al ipratropio para aumentar tanto el FEV1 valle como el pico, logró una mejoría más acusada de la disnea y de la calidad de vida relacionada con la salud, disminuyó en un 20-30% el número anual de exacerbaciones y aumentó el tiempo hasta la primera exacerbación y la siguiente hospitalización22. Sin embargo, la sequedad de boca resultaba ligeramente más frecuente con tiotropio que con bromuro de ipratropio23, aunque este efecto suele ser leve y raramente supone la necesidad de interrumpir el tratamiento. Sin embargo, pese al uso de tiotropio, cuando la disnea resultaba muy intensa, los pacientes necesitaban dosis suplementarias de un broncodilatador de acción corta23.
Además, y aunque el bromuro de ipratropio permite obtener una broncodilatación significativa y aporta otros beneficios tangibles, como la reducción de la disnea, la hiperinsuflación y el número de exacerbaciones, la necesidad de administrarlo cada 6 h puede incidir sobre el cumplimiento terapéutico y atenuar sus beneficios.
También se han establecido comparaciones entre el bromuro de ipratropio y los agonistas betaadrenérgicos de acción corta con los agonistas betaadrenérgicos de acción prolongada. En una revisión sistemática se analizaron 8 ensayos clínicos, 5 paralelos y 3 cruzados, que compararon el salmeterol o el formoterol con el bromuro de ipratropio y un placebo24. No se apreciaron diferencias en la mejoría del FEV1 o de la disnea cuando se comparó el salmeterol con el bromuro de ipratropio. Tampoco se detectaron diferencias en la mejoría del FEV1, la distancia recorrida en la prueba de la caminata de 6 min, la calidad de vida relacionada con la salud, la disnea o el número de exacerbaciones entre el formoterol y el bromuro de ipratropio. Únicamente, se comprobó que el formoterol logró un incremento del PEF superior al bromuro de ipratropio24. Aunque esta revisión concluía que respecto al ipratropio no se demostraba un efecto más beneficioso del formoterol o el salbutamol24, algunos estudios posteriores han alcanzado resultados diferentes.
Dahl et al25 realizaron un ensayo clínico multicéntrico en el que compararon el efecto de salmeterol, bromuro de ipratropio y placebo sobre la función pulmonar en pacientes con EPOC leve-moderada. Comprobaron que, después de 12 semanas de tratamiento, el salmeterol resultaba superior al bromuro de ipratropio para mejorar la función pulmonar y aumentar el tiempo hasta la primera exacerbación. También se ha demostrado que tras 12 semanas de tratamiento se logra un mayor incremento del FEV1 con formoterol que con bromuro de ipratropio26.
Appleton et al27 realizaron una revisión sistemática de los estudios sobre la eficacia de los agonistas betaadrenérgicos de acción prolongada en la EPOC. En los 8 ensayos clínicos seleccionados, 6 de grupos paralelos de 12-16 semanas de duración y 2 cruzados con grupos de 4 semanas de tratamiento, sólo se comparaba el efecto del fármaco en estudio con placebo. Ninguno de estos ensayos permitía establecer comparaciones entre los agonistas betaadrenérgicos de acción corta y prolongada. Por otra parte, y aunque éste es un aspecto muy tangencial a su diseño, en un estudio farmacoepidemiológico del efecto de los corticoides inhalados sobre la morbimortalidad de la EPOC, no se detectaron diferencias respecto a los reingresos o la mortalidad entre los pacientes tratados con agonistas betaadrenérgicos de acción corta y los que recibían agonistas betaadrenérgicos de acción prolongada28.
Por último, y aunque se acepta como principio general que los regímenes de tratamiento más simples pueden mejorar el cumplimiento y los resultados del tratamiento en modalidades a corto y largo plazo, esto no se ha demostrado de forma categórica para los agonistas betaadrenérgicos de acción corta y prolongada en la EPOC.
Tratamiento broncodilatador combinado
Diversos estudios han demostrado que el tratamiento combinado con agonistas betaadrenérgicos de acción corta y bromuro de ipratropio produce un mayor y más sostenido incremento del FEV1 a los 90 días que la monoterapia, sin desarrollar taquifilaxia29-31.
El efecto del tratamiento combinado sobre la tolerancia al ejercicio es más discreto. En 4 estudios, en los que se comparó la asociación de salbutamol y bromuro de ipratropio frente a monoterapia, no se encontraron diferencias significativas32-35. La combinación de un agonista betaadrenérgico de acción corta y bromuro de ipratropio no mostró un efecto superior sobre el consumo de oxígeno pico que cada una de las monoterapias33. La asociación tampoco fue superior a la monoterapia en cuanto a la distancia recorrida durante la prueba de caminar 6 min32.
Uso regular frente a uso a demanda
Sobre este aspecto hay mucha información en cuanto al asma, mientras que es relativamente escasa en la EPOC. Van Schayck et al36 estudiaron a 144 pacientes con un trastorno obstructivo moderado, secundario a asma o bronquitis, tratados durante 2 años con salbutamol o bromuro de ipratropio, en un pauta de uso regular (1.600 μg de salbutamol/día o 160 μg de bromuro de ipratropio/día) o a demanda. A los 2 años de seguimiento, estos autores comprobaron que aunque la calidad de vida relacionada con la salud fue similar en los 2 grupos, el declinar anual del FEV1 resultó menor en los pacientes que utilizaron los broncodilatadores de acción corta a demanda que en quienes los emplearon de forma regular (20 frente a 72 ml/año).
Una aproximación a este problema centrada únicamente en la EPOC fue realizada por Cook et al37, quienes compararon en 53 pacientes con EPOC y una historia de tabaquismo de más de 20 paquetes/año la administración pautada de salbutamol frente a su uso a demanda. En este estudio, todos los pacientes recibieron bromuro de ipratropio (40 μg/6 h), beclometasona (500 μg/12 h) y salbutamol a demanda. Además, fueron aleatorizados a recibir en un diseño cruzado salbutamol de forma regular (200 μg/6 h) o placebo, durante períodos de 3 meses. Se comprobó que durante su administración pautada, los pacientes recibieron casi el doble de dosis de salbutamol que cuando lo utilizaban a demanda, sin que ello originase diferencias en el FEV1, la FVC, la distancia recorrida en la prueba de caminar durante 6 min ni en la calidad de vida relacionada con la salud. Por tanto, la prescripción regular de los agonistas betaadrenérgicos de acción corta en la EPOC supone duplicar la dosis recibida con respecto a su uso a demanda, sin beneficios clínicos ni funcionales.
Eficacia en las exacerbaciones
A diferencia de lo que sucede en la enfermedad estable, las normativas vigentes le otorgan a los broncodilatadores de acción corta un papel primordial en el tratamiento de las agudizaciones1,3. En concreto, la recomendación SEPAR plantea que en el tratamiento ambulante de las exacerbaciones leves es aconsejable el empleo de broncodilatadores de acción rápida a dosis elevadas1. En función del tratamiento habitual del paciente, se sugiere incrementar la dosis de bromuro de ipratropio (hasta 0,12 mg cada 4-6 h) o introducir un agonista betaadrenérgico de acción corta (0,4-0,6 mg de salbutamol o 0,5-1,0 mg de terbutalina, cada 4-6 h), de manera que se consiga un máximo efecto broncodilatador. En caso de que alguno de estos fármacos ya fuese utilizado a dosis elevadas, se recomienda optar por la combinación de ambos, ya que su efecto broncodilatador es aditivo.
Para el tratamiento hospitalario de las exacerbaciones graves es preciso utilizar dosis elevadas de broncodilatador, por lo que se recomienda recurrir a soluciones adecuadas para ser administradas con un nebulizador. De las diferentes opciones posibles, se plantea como primera etapa la combinación de broncodilatadores de acción corta (2,5-10 mg de agonista betaadrenérgico de acción corta y 0,5-1,0 mg de bromuro de ipratropio, cada 4-6 h)1.
La más reciente recomendación internacional de consenso entre la ATS y la ERS continúa manteniendo la indicación de utilizar a demanda agonistas betaadrenérgicos de acción corta o bromuro de ipratropio con cámara espaciadora o nebulizador para las exacerbaciones de grado I y II4. En las de grado III, se aconseja la administración más frecuente de estos mismos fármacos (cada 2-4 h), además de contemplar la posibilidad de añadir agonistas betaadrenérgicos de acción prolongada4.
En una revisión sistemática se comparó el efecto de los anticolinérgicos frente a los agonistas betaadrenérgicos de acción rápida en las exacerbaciones de la EPOC38. El análisis de los 4 ensayos clínicos seleccionados no mostró diferencias en los cambios del FEV1 a corto o largo plazo. Ninguno de los estudios encontró cambios significativos en la PaO2, ya sea a corto o largo plazo, con ipratropio frente a betaadrenérgicos, aunque uno de ellos mostró un aumento de la PaO2 a los 60 min en los pacientes que recibieron bromuro de ipratropio. Las reacciones adversas fueron de similar frecuencia, incluidos la sequedad de boca y el temblor. En definitiva, esta revisión no detectó evidencias de que una modalidad de broncodilatadores de acción corta sea mejor que otra38.
La seguridad y el coste
Los efectos secundarios de los fármacos son valorados de forma deficiente en muchos ensayos clínicos, puesto que plantean sesgos en la indicación del tratamiento o el control de variables importantes, como la gravedad de la enfermedad. Pese a ello, se dispone de numerosa información sobre la seguridad de los broncodilatadores de acción corta en la EPOC.
Corrao et al39 llevaron a cabo un estudio farmacoepidemiológico a partir de los registros del sistema nacional de salud de una región de Italia. A partir de una cohorte de 135.871 sujetos mayores de 40 años, que recibieron entre 1997 y 1999 la prescripción de algún fármaco utilizado en la EPOC, analizaron la mortalidad atribuible a esta enfermedad. Los diferentes análisis epidemiológicos mostraron en todas sus modalidades que los pacientes que consumían más de 0,5 dosis al día de agonistas betaadrenérgicos de acción corta tenían una odds ratio (OR) de muerte por EPOC > 1 (OR ajustada para casos y controles = 1,9; IC del 95%, 1,1-3,3). En definitiva, estos análisis comprobaban que el uso de agonistas betaadrenérgicos de acción corta se asociaba con una mayor mortalidad por EPOC. Sin embargo, este tipo de estudios farmacoepidemiológicos plantean múltiples limitaciones, relacionadas principalmente con el control de la gravedad, la temporalidad del tratamiento o el sesgo del período de supervivencia, que obligan a considerar sus resultados con cautela.
De hecho, en otros estudios se ha demostrado que los agonistas betaadrenérgicos de acción corta resultan tan seguros como los de acción prolongada. Sovani et al40 comprobaron que la cefalea, el temblor, las palpitaciones, las contracciones musculares y la reducción de la concentración sérica de potasio eran los principales efectos secundarios del tratamiento con salbutamol y formoterol. Ambos fármacos presentaban una seguridad y una eficacia similares para su utilización a demanda.
Lemaitre et al41 investigaron si el tratamiento con agonistas betaadrenérgicos de acción corta supone un mayor riesgo de parada cardíaca en los pacientes con EPOC. Estos autores comprobaron que, a diferencia de lo que sucedía en el asma, el uso de estos fármacos en la EPOC no aumenta el riesgo de parada cardíaca. El riesgo de presentar episodios agudos de cardiopatía isquémica fue valorado por Suissa et al42. En un estudio poblacional sobre una muestra de 12.090 pacientes que consumían agonistas betaadrenérgicos de acción corta, la OR ajustada para el desarrollo de un infarto de miocardio fue de 1,12 (IC del 95%, 0,95-1,33). Tampoco se evidenció un riesgo atribuible a los fármacos cuando el análisis se limitó a los pacientes con EPOC y un riesgo cardiovascular previo por hipertensión arterial o diabetes. En definitiva, parece demostrado que el uso de agonistas betaadrenérgicos de acción corta en pacientes con EPOC no aumenta el riesgo de infarto agudo de miocardio42.
Además de su relativa inocuidad, que como mínimo es similar a la de los broncodilatadores de acción prolongada, los broncodilatadores de acción corta resultan mucho más baratos. En un análisis de costes efectuado a partir del estudio IBERPOC, se comprobó que el mayor porcentaje de gasto del tratamiento farmacológico habitual de la EPOC lo generan los corticoides inhalados (26,6%), seguidos por los agonistas betaadrenérgicos de acción prolongada (17,7%). Por el contrario, el coste asociado al uso de bromuro de ipratropio (1,2% del total) fue casi 4 veces inferior al de las teofilinas, 2 veces menor que el de los mucolíticos y casi 22 veces menor que el de los corticoides inhalados. De igual modo, el coste por el uso de agonistas betaadrenérgicos de acción corta inhalados sólo suponía el 2,8% del gasto farmacológico total43.
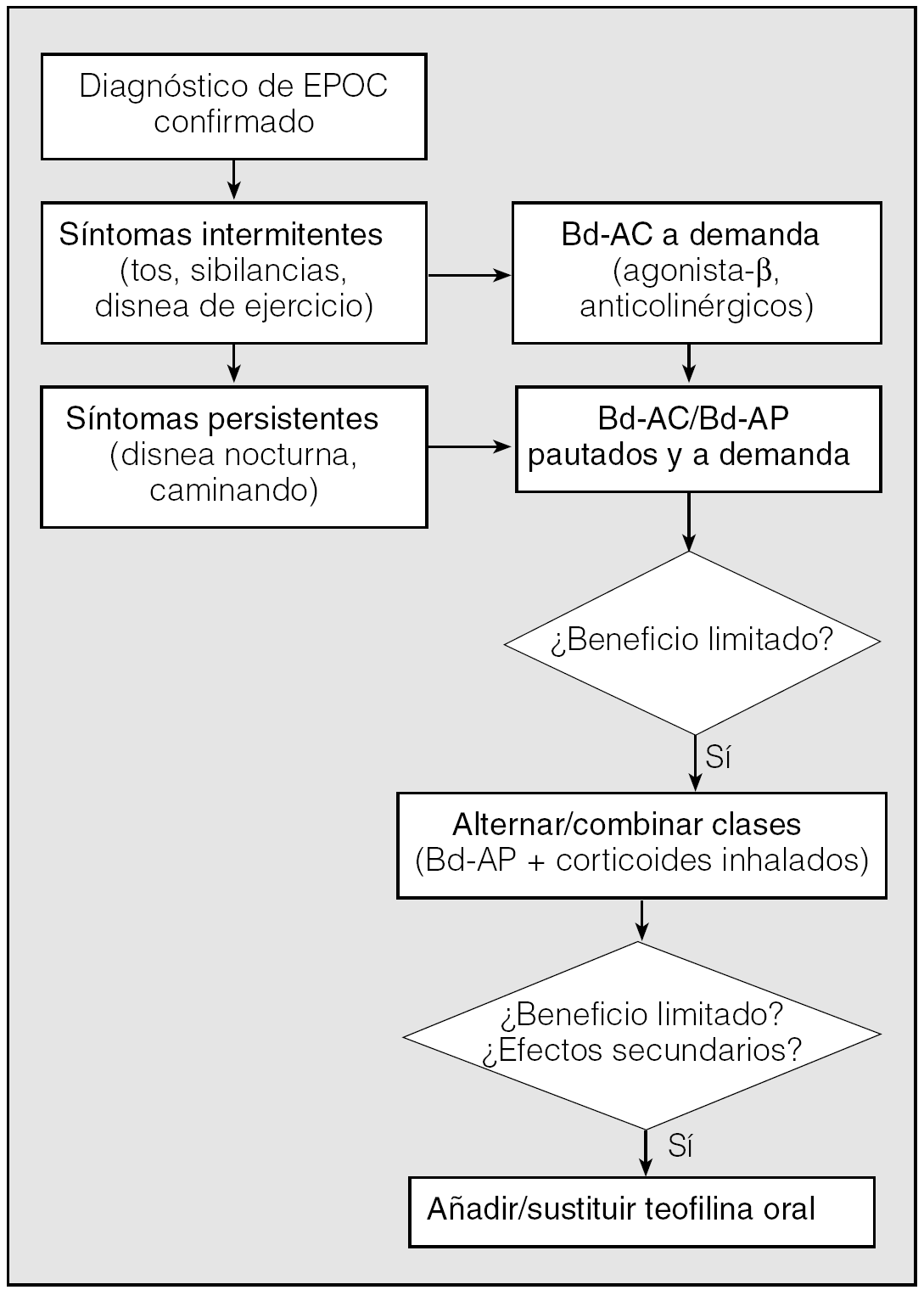
Como conclusión, cabe mencionar que aunque los broncodilatadores de acción prolongada se están imponiendo en el tratamiento de la EPOC, no debe infravalorarse la utilidad de los broncodilatadores de acción corta. Estos fármacos continúan siendo de primera elección en las exacerbaciones y en la EPOC leve (grado I de la clasificación GOLD), mientras que en los otros grados de enfermedad se recomienda su uso a demanda (fig. 4). En cualquier caso, por su eficacia demostrada, seguridad y bajo coste, todavía pueden ser considerados como una alternativa razonable a los broncodilatadores de acción prolongada cuando haya alguna limitación para su uso.
Fig. 4. Algoritmo del tratamiento farmacológico de la EPOC estable propuesto en la recomendación ATS/ERS. Bd-AC: broncodilatadores de acción corta; Bd-AP: broncodilatadores de acción prolongada. (Modificado de Celli et al4.)
Correspondencia: Dr. F. García Río.
Alfredo Marqueríe, 11, izda. 1.º A. 28034 Madrid. España.
Correo electrónico: fgr01m@jazzfree.com