Se trata del caso de un varón de 62 años hipertenso, diabético y dislipémico, exfumador severo y con enolismo crónico en seguimiento por neurología por posible Wernicke-Korsakov. Fue diagnosticado en diciembre del año 2015 de un adenocarcinoma colorrectal de alto grado localmente avanzado, que tras ser intervenido quirúrgicamente (mediante hemicolectomía, apendicectomía, esplenectomía y omentectomía) inició en enero del 2016 quimioterapia adyuvante con esquema FOLFOX, recibiendo 8 ciclos hasta abril del 2016 con enfermedad estable en la tomografía computarizada (TC) de revaluación. Acudió a urgencias 3 semanas después del último ciclo de quimioterapia por disnea, que en la última semana había empeorado progresivamente hasta hacerse de reposo, con tos improductiva y 2 picos vespertinos de fiebre de 38°C, sin mejoría tras 5 días de tratamiento antibiótico ambulatorio. A su llegada, la saturación basal era del 85%. La radiografía de tórax confirmó la existencia de infiltrados compatibles con bronconeumonía bilateral, concordante con los hallazgos clínicos y analíticos: proteína C reactiva (PCR) de 27 (0,1-0,5) y 20.000 leucocitos con desviación izquierda.
Al ser un paciente inmunocomprometido (esplenectomía, quimioterapia, alcoholismo) se decidió iniciar antibioterapia empírica de amplio espectro con meropenem. Las antigenurias fueron negativas y se logró recoger una sola muestra de esputo con cultivo estéril. A los 10 días de tratamiento el paciente permanecía afebril, pero persistía auscultación patológica y disnea de reposo, a pesar de oxigenoterapia. En la radiografía de tórax de control se comprobó la aparición de un nuevo infiltrado neumónico, y dando por hecho que la antibioterapia recibida no había sido eficaz con imposibilidad de obtener nueva muestra de esputo por improductividad de la tos, se realizó una fibrobroncoscopia en la que tampoco se obtuvieron aislamientos microbiológicos en las muestras recogidas. Tras esta última prueba presentó un nuevo pico febril y deterioro aún mayor de la disnea con muy mal estado general, por lo que se realizó una tercera radiografía de tórax que mostraba nuevo empeoramiento con respecto a la previa 24h antes. Se reforzó el tratamiento con vancomicina y cotrimoxazol, con retirada del catéter reservorio por si pudiera suponer un foco infeccioso añadido, y se trasladó finalmente a la UCI por desaturación en torno al 75% a pesar de alto flujo de oxígeno. Los hemocultivos extraídos del catéter y vía periférica fueron ambos negativos, así como el cultivo de la punta de catéter. Se completó estudio de la disnea con un ecocardiograma, también normal. Todas las serologías incluyendo HIV, virus hepatotropos, VEB, CMV, Mycoplasma pneumoniae y Chlamydia pneumoniae, fueron negativas. La PCR para CMV, Ag de influenza A/B y galactomanano también lo fueron. Tampoco se obtuvo ningún resultado positivo en el estudio de autoinmunidad.
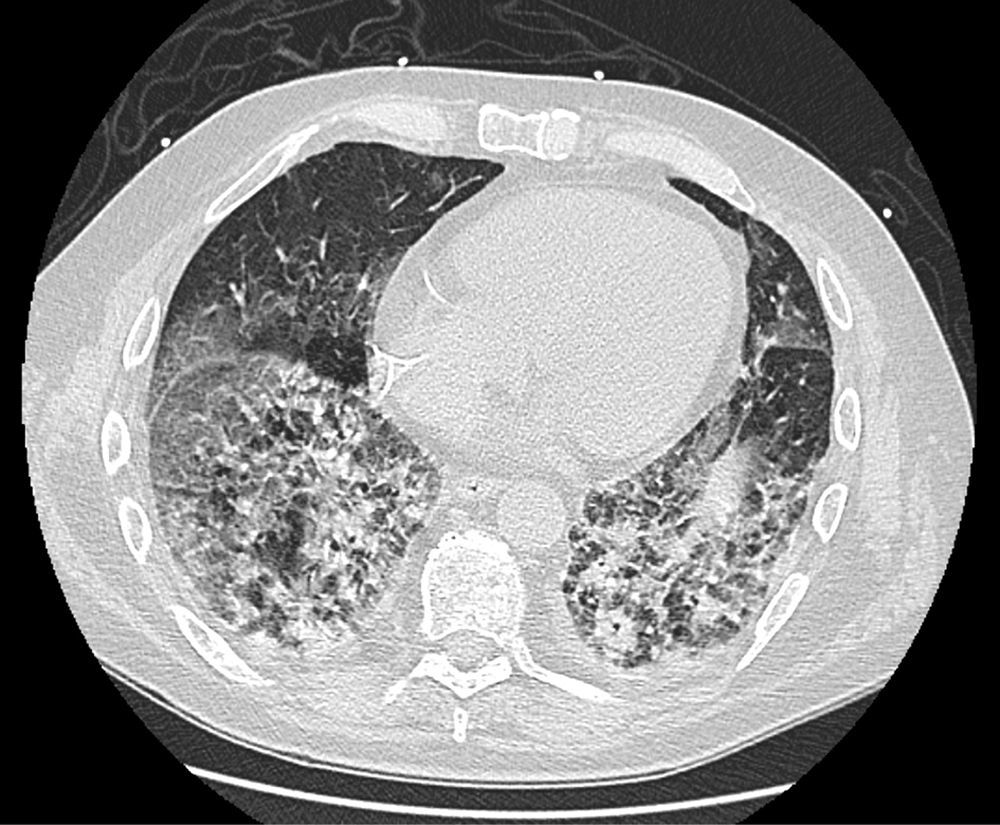
En las analíticas de control se observó un estancamiento del valor de PCR en niveles bajos, pero con leucocitosis llamativa a pesar de que se añadió también medicación antiviral y antifúngica. Por último, una TC de tórax de alta resolución (Fig. 1) mostró hallazgos de distrés respiratorio agudo en fase proliferativa-fibrótica, bronquiectasias y bronquiolectasias por tracción y signos de pérdida de volumen en relación con una fibrosis muy rápida y extensa afectación parenquimatosa con áreas compatibles con neumonitis por fármacos. La refractariedad a los tratamientos recibidos, incluyendo en una fase final corticoterapia a dosis altas, supuso la necesidad de intubación orotraqueal con muy mala evolución, aun así, de su situación respiratoria, que desembocó en el fallecimiento del paciente a las cinco semanas del ingreso.
Señalar que el oxaliplatino se ha convertido en un fármaco habitual en diferentes regímenes de quimioterapia para el cáncer colorrectal, y en concreto la combinación leucovorina-fluorouracilo-oxaliplatino (FOLFOX) ha mostrado clara eficacia en adyuvancia1. Algunos antineoplásicos se han relacionado estrechamente con enfermedad pulmonar como puede ser la bleomicina, con alta tasa de mortalidad (The Drug-Induced Respiratory Disease Website: pneumotox), pero los estudios realizados inicialmente para evaluar la toxicidad del oxaliplatino no demostraron en primera instancia la afectación pulmonar como efecto secundario, solamente un riesgo leve de broncoespasmo por hipersensibilidad. Los principales efectos secundarios son la neuropatía sensorial periférica, la afectación renal, la hematológica y la gastrointestinal2. En la actualidad son varios los casos comunicados en los que se implica el oxaliplatino en el daño pulmonar, pero por estar normalmente en regímenes de combinación resulta muy difícil establecer la contribución individual de cada fármaco. En adyuvancia ya se publicó al menos un caso en 2005 con oxaliplatino en monoterapia, habiendo recibido solamente un ciclo previo de 5FU3, y recientemente se dispone de nuevas publicaciones empleando el esquema FOLFOX4. Según la revisión sistemática realizada en un estudio japonés en 734 pacientes con CCR sometidos a FOLFOX o FOLFIRI, 11 de ellos presentaron enfermedad pulmonar intersticial (1,5 frente al 0,4% descrito por la FDA para complicaciones de este tipo por oxaliplatino)5, siendo la media de aparición a los 20 días del último ciclo, con una media de 10 ciclos de FOLFOX y dosis de oxaliplatino de 85mg/m2.
Esta toxicidad parece ser que es debida a la depleción de glutation (molécula antioxidante), hipótesis que surge como extrapolación de un estudio que evidenciaba el daño hepático por afectación perivascular y endotelial con oxaliplatino6.
La clínica más habitual es tos y disnea, siendo la fiebre infrecuente. Los hallazgos radiológicos suelen ser infiltrados intersticiales y áreas en vidrio deslustrado. Añadir que, a pesar de que se dispone en pocos casos de la histología, los hallazgos más comunes son el daño alveolar difuso y la neumonía organizada7. El tratamiento recomendado consiste en el soporte y la administración de corticoides sistémicos en altas dosis, a pesar de lo cual la mortalidad es elevada8.
Concluimos señalando que no existe una evidencia clara sobre la toxicidad pulmonar inducida por oxaliplatino más allá de los casos comunicados, que apoyan que no solo es una afectación posible, sino que la gravedad de la misma puede llevar a un desenlace fatal como hemos podido comprobar, en lo que influye además un diagnóstico tardío mientras se descartan el resto de opciones hasta llegar al diagnóstico de exclusión. La preexistencia de fibrosis o cualquier otra enfermedad de base predispone a una afectación de mayor gravedad9, razón por la cual su indicación en estos pacientes debería realizarse con mucha cautela, y bajo un seguimiento clínico y de imagen estrecho.