El embolismo gaseoso es una complicación infrecuente pero potencialmente fatal, que se produce como consecuencia del acceso de aire a la vasculatura, ya sea venosa o arterial. Entre sus causas se encuentra la cirugía, los traumatismos, el intervencionismo vascular o el barotrauma1. Presentamos el caso de un varón adulto que fue sometido a una biopsia con aguja gruesa (BAG) transtorácica guiada por tomografía computarizada (TC) de un nódulo pulmonar solitario y que presentó como complicación una embolia gaseosa arterial.
Se trata de un varón de 57 años, fumador activo y bebedor habitual de alcohol, con antecedentes de hepatopatía y carcinoma colorrectal de ciego, que fue tratado con una hemicolectomía derecha ampliada por vía laparoscópica en el año 2013. Cuatro años más tarde se evidenció, en el seguimiento realizado, un nódulo peritoneal sospechoso de corresponder a un implante tumoral. Además se observó un nódulo pulmonar en la língula de 17×24mm de diámetro, con datos de hipermetabolismo en la PET-TC (SUV máximo de 3,4) siendo por tanto sospechoso de malignidad. Por ese motivo, se decidió realizar al paciente una BAG guiada por TC. En el momento de su ingreso, el paciente se encontraba afebril y estable hemodinámicamente, con una saturación de oxígeno basal del 98% y una auscultación cardiopulmonar normal.
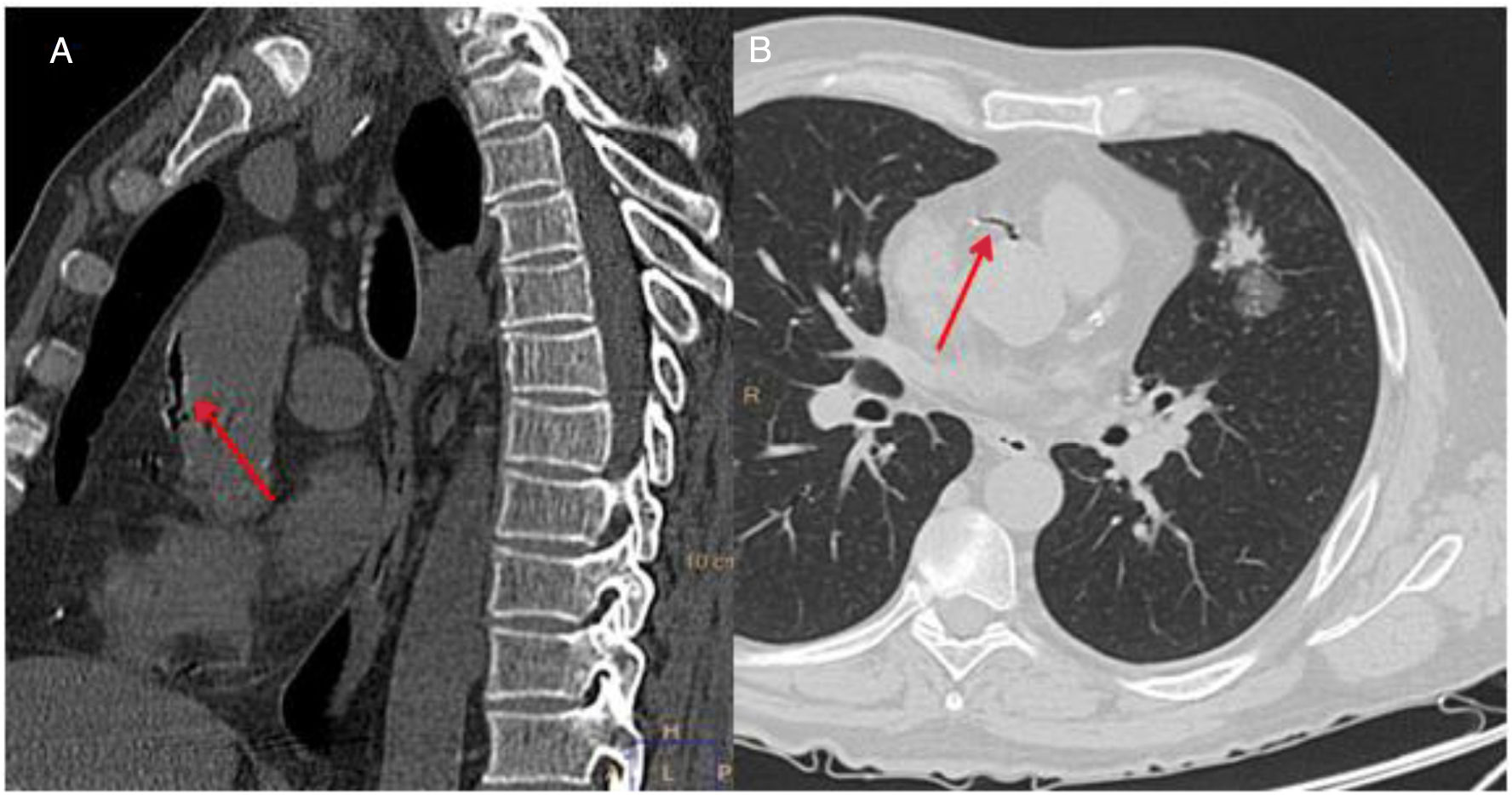
Tras realizar la BAG se efectuó una TC torácica de control. En dicha exploración se observó un pequeño neumotórax izquierdo y una hemorragia local perinodular, visualizándose además, una pequeña cantidad de aire en la aorta torácica ascendente y en la arteria coronaria derecha (fig. 1). A continuación, el paciente sufrió un cuadro brusco de disminución del nivel de conciencia (escala de coma de Glasgow 5/15), con hipotensión arterial (TA 80/40mmHg), bradicardia (FC 35lpm) y marcada desaturación (saturación de oxígeno por pulsioximetría menor al 50%), precisando intubación orotraqueal y conexión a ventilación mecánica. Posteriormente se le realizó un electrocardiograma que mostró alteraciones compatibles con un bloqueo auriculoventricular completo y un síndrome coronario agudo, con elevación del segmento ST en la cara anterior. Ante estos hallazgos, se pautó atropina y una perfusión de noradrenalina, con recuperación posterior de la frecuencia cardiaca y la TA. Ante la posibilidad de que el paciente sufriera además una embolia gaseosa cerebral, dado el cuadro neurológico descrito, se efectuó también una TC craneal, que no mostró alteraciones intracraneales de carácter agudo, siendo el paciente ingresado en la unidad de cuidados intensivos (UCI) para monitorización y seguimiento.
Durante su estancia en la UCI, el paciente permaneció seudoanalgesiado, con perfusión de remifentanilo, sufriendo un cuadro de convulsiones que cedió con midazolam. A nivel hemodinámico, una vez estabilizado, se suspendió la noradrenalina y se comprobó la normalización de los cambios electrocardiográficos descritos, no detectándose tampoco alteraciones en el ecocardiograma transtorácico realizado. Desde un punto de vista respiratorio, la mejoría del paciente fue rápida, lo que permitió su extubación precoz. Posteriormente fue trasladado a la planta de neumología, donde se mantuvo en situación clínica y hemodinámica estable, por lo que se procedió al alta hospitalaria.
El estudio anatomopatológico de la BAG realizada demostró un parénquima pulmonar infiltrado por una proliferación neoplásica de estirpe epitelial y crecimiento glandular, revestida por células columnares seudoestratificadas, que mostraban núcleos agrandados e irregulares, marcadamente pleomorfos, con ocasionales figuras de mitosis. Estos datos orientaban hacia un adenocarcinoma moderadamente diferenciado, siendo el estudio inmunohistoquímico compatible con un origen colorrectal (CK20/ CdX2 positivo, CK7/ TTF-1 negativo).
El embolismo gaseoso arterial es una complicación extremadamente rara, pero fatal, en los procedimientos guiados por imagen para la toma de una biopsia pulmonar. Es consecuencia de la entrada de aire ambiente a las venas pulmonares, circulando desde ahí a la aurícula y al ventrículo izquierdo, y posteriormente a la circulación arterial2. El riesgo de embolia gaseosa arterial se ve incrementado por accesos de tos o por taquipnea. El neumotórax y la hemorragia parenquimatosa pulmonar son las complicaciones más comunes de la BAG. Mucho menos frecuente es el embolismo gaseoso, cuya incidencia oscila entre el 0,02 y el 0,07%3,4.
Los síntomas de la embolia gaseosa varían en función del órgano afecto. El principal es el cerebro y, como consecuencia de ello, el paciente puede presentar alteración del nivel de conciencia o déficit neurológico. Otra manifestación posible es el infarto agudo de miocardio. También puede verse afectada la piel y las arterias retinianas2–6.
El diagnóstico de certeza se obtiene por la demostración de la presencia de aire en el espacio intravascular arterial de los órganos afectos, en aquellos pacientes con factores de riesgo para sufrir un embolismo gaseoso arterial. Cabe destacar que el aire se reabsorbe rápidamente de la circulación, por lo que ocasiones no es posible demostrar su presencia, siendo necesario efectuar un diagnóstico de sospecha ante la aparición de sintomatología sugestiva en un contexto de riesgo adecuado2–6.
Cuando se sospecha o se confirma el diagnóstico de embolismo gaseoso, es importante actuar de forma rápida. Se debe colocar al paciente en decúbito supino o en posición de Trendelenburg7, evitando girarle hacia el lado derecho, así como asegurar su estabilidad respiratoria y hemodinámica con la administración de oxigenoterapia a alto flujo o en cámara hiperbárica, ventilación mecánica, expansores de volumen, fármacos ionotrópicos y soporte vital cardíaco avanzado.
Para minimizar el riesgo, se recomienda la inmovilización del paciente e indicar que durante el procedimiento realice respiraciones superficiales y evite hablar o toser; en ciertas guías se recomienda la realización del procedimiento con un grado de sedación consciente para dicha finalidad, así como una planificación radiológica previa al procedimiento, confirmando la presencia de la aguja en la lesión antes de la toma de la biopsia2.
En cuanto al pronóstico, en diversas series se ha registrado una mortalidad entre el 12 y el 30% según se trate de un embolismo gaseoso venoso o arterial, siendo la gravedad y la mortalidad mayor en este último caso. Hay que tener en cuenta que, aunque el embolismo sistémico puede ser asintomático, tan solo 2ml de aire en la circulación cerebral o 1ml en la circulación venosa pulmonar pueden acarrear consecuencias fatales5.