Introducción
El derrame pleural es un problema clínico frecuente1 que afecta anualmente a más de 3.000 pacientes por cada 1.000.000 de personas y que se debe a un incremento de la producción de líquido, a una disminución de su drenaje o a ambos factores, aunque en la mayor parte de los derrames de tipo exudado la causa subyacente es el aumento de la producción de líquido2. A pesar de la gran importancia de este problema clínico, ninguno de los abordajes terapéuticos actuales, como la pleurectomía o la pleurodesis, parece tener una eficacia suficiente3. La falta de conocimiento sobre los mecanismos básicos que hacen que se acumule líquido en el interior del espacio pleural limita todavía más los intentos de prevención de los derrames pleurales.
El factor de crecimiento endotelial vascular (VEGF), denominado inicialmente factor de permeabilidad vascular, es una proteína homodimérica de 34-42 kD4. Actúa principalmente sobre el endotelio vascular, en el que puede inducir cambios morfológicos, alterar la expresión genética, estimular la proliferación y migración celulares e inhibir la apoptosis5-9. Su capacidad para incrementar la permeabilidad vascular explica el papel tan importante que desempeña en la formación del líquido de derrame pleural. El VEGF también es un factor angiógeno en los tumores10.
El objetivo del nuestro estudio ha sido la determinación de la concentración de VEGF en derrames pleurales de orígenes distintos. Especialmente, se ha intentado determinar si las concentraciones de VEGF son significativamente diferentes en los derrames benignos y malignos.
Pacientes y métodos
Se ha estudiado prospectivamente a 52 pacientes a los que se realizó toracocentesis entre agosto de 2001 y junio de 2002. Para identificar la causa del derrame pleural se utilizaron las definiciones estándar siguientes: a) derrame pleural maligno (n = 20), un derrame con citología positiva para células malignas; b) derrame pleural paraneumónico (n = 10), en pacientes con historia clínica indicativa de infección reciente, sin características de empiema y sin recidiva a las 6 semanas de seguimiento ambulatorio; c) derrame consistente en trasudado (n = 10), secundario a insuficiencia ventricular izquierda o a hipoalbuminemia, con un contenido de proteínas inferior a 3 g/dl y sin una causa identificable, y d) derrame pleural tuberculoso (n = 12), diagnosticado a través de la demostración de la presencia de bacilos ácido-alcohol resistentes, del crecimiento de Mycobacterium tuberculosis en cultivo, de la presencia de lesiones granulomatosas en la biopsia pleural o de cualquier combinación de estos hallazgos.
A todos los pacientes se les efectuaron los estudios citológicos y microbiológicos convencionales en el líquido de derrame pleural. Las muestras del derrame se cultivaron para demostración de la presencia de M. tuberculosis, y también para la determinación de las concentraciones de proteínas, glucosa y lactatodeshidrogenasa (LDH), así como para la detección de la actividad de la adenosindesaminasa. Se obtuvieron aproximadamente 20 ml de derrame pleural que se centrifugaron a 3.000 revoluciones por minuto durante 10 min hasta que se formó un grumo con los elementos celulares; el sobrenadante se almacenó a -70 °C para la determinación subsiguiente de la concentración de VEGF.
La determinación de la concentración de VEGF en los derrames pleurales se realizó mediante una técnica cuantitativa de inmunoabsorción ligada a enzimas en sándwich con un equipo VEGF (Cytelisa Human VEGF, Cytimmune Sciences Inc., Rockville, MD, EE.UU.), siguiendo las recomendaciones del fabricante.
Análisis estadístico
Los resultados se analizaron mediante el programa informático SPSS, versión 10.0 (Chicago, Illinois, EE.UU.). Se utilizó el coeficiente de correlación de Pearson para establecer correlaciones entre las variables. La significación se estableció en p = 0,01. Las diferencias respecto al VEGF entre los 4 grupos se evaluaron mediante el análisis de la variancia de Kruskal-Wallis; en los casos en los que las diferencias mostraron un nivel de significación de p < 0,05 según el test de Kruskal-Wallis, se aplicó posteriormente un test de comparación múltiple.
Resultados
En el estudio participó un total de 52 pacientes (9 mujeres y 43 varones). Entre los 20 pacientes con tumores malignos, 13 presentaban cáncer pulmonar primario (8, adenocarcinoma; 4, carcinoma microcítico, y uno, carcinoma epidermoide) y 7, mesotelioma maligno. En la tabla I se recogen los valores medios ± desviación estándar de la edad, concentraciones de VEGF y parámetros bioquímicos.
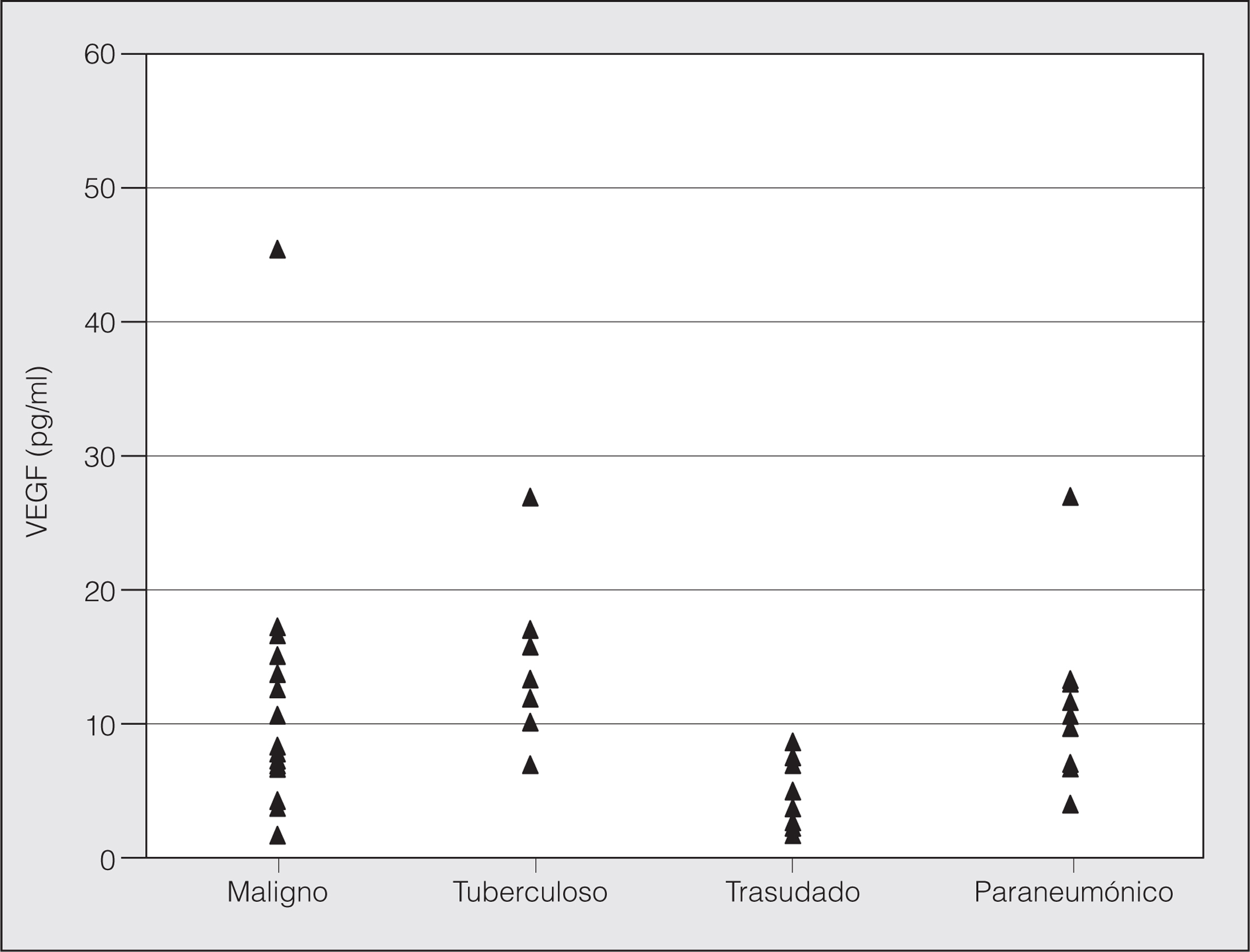
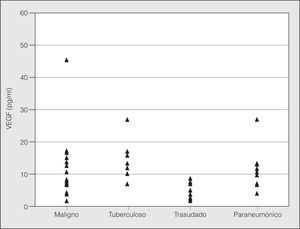
Los pacientes con derrame de tipo trasudado fueron los que mostraron las concentraciones medias de VEGF más bajas, mientras que los que presentaban derrames malignos mostraron las concentraciones de VEGF más elevadas. La concentración mediana de VEGF en los derrames de tipo exudado (10,16 pg/ml) fue significativamente mayor que la concentración mediana en los trasudados (3,82 pg/ml) (p = 0,001). Aunque los derrames pleurales malignos mostraron una tendencia a presentar concentraciones medianas y medias de VEGF mayores que los derrames de origen tuberculoso, las diferencias no fueron estadísticamente significativas. Asimismo, las concentraciones medias de VEGF fueron similares en los derrames malignos y en los de origen paraneumónico. Las concentraciones medias de VEGF en los 4 tipos de derrames se muestran en la figura 1.
Fig. 1. Distribución de las concentraciones de factor de crecimiento endotelial vascular (VEGF) en los 4 grupos de pacientes. No aparece en la gráfica el valor de 190 pg/ml de la concentración de VEGF en el derrame pleural de un paciente del grupo maligno.
Después se efectuó el análisis de los datos correspondientes a todos los pacientes con el objetivo de detectar la existencia de relaciones entre las concentraciones de VEGF en el líquido del derrame pleural como variable dependiente y las concentraciones de VEGF, proteínas totales, albúmina y glucosa también en el derrame pleural. La correlación más intensa fue la existente entre las concentraciones de VEGF y LDH (r = 0,75; p < 0,001).
Entre los pacientes con derrame pleural maligno, las concentraciones de VEGF fueron similares con independencia de la localización del tumor primario o de los subtipos histológicos de cáncer pulmonar.
Discusión
El VEGF, denominado inicialmente factor de permeabilidad vascular, es una proteína homodimérica de 34-42 kD que induce vasodilatación in vivo, en un efecto dependiente de la dosis11. Tiene una potencia 50.000 veces mayor que la de la histamina en lo relativo a la inducción de la permeabilidad vascular8 y también es un mitógeno potente para las células endoteliales macro y microvasculares originadas en arterias, venas y vasos linfáticos12-15. Además, se supone que el VEGF actúa como factor de angiogénesis tumoral. Su mecanismo de acción tiene lugar a través de 3 receptores de la tirosincinasa que se expresan principalmente en las células endoteliales, así como en los tejidos pleurales y en la mayor parte de las células tumorales7. Por tanto, se ha prestado una gran atención a la contribución de este factor a la acumulación del derrame pleural y a la progresión tumoral.
Se ha demostrado que el VEGF está presente en cantidades importantes en los derrames pleurales y peritoneales de diversas etiologías. En modelos experimentales de ascitis maligna se ha observado una correlación directa entre la acumulación de líquido y la producción de VEGF16. También se ha identificado la presencia de VEGF en diversos tumores malignos, entre ellos varios tipos histológicos de cáncer pulmonar17-19. El mecanismo de la acumulación del líquido de derrame pleural en los pacientes con tumores malignos no se ha definido con precisión, pero se considera que el incremento de la permeabilidad capilar en la pleura visceral desempeña una función importante en la formación de los derrames de tipo exudado20. El papel que desempeña el VEGF en la acumulación de líquido de derrame pleural a través del aumento de la permeabilidad vascular también ha sido observado en un modelo animal21.
Los resultados de nuestro estudio demuestran que las concentraciones de VEGF en el líquido de derrame pleural son distintas en función de su etiología. Nuestras observaciones son congruentes con las realizadas previamente en el sentido de que las concentraciones de VEGF son significativamente diferentes en los derrames de tipo trasudado y en los de tipo exudado. Thickett et al4 demostraron que el 90% de los derrames pleurales de tipo exudado muestra concentraciones de VEGF mayores que las que se observan en los derrames de tipo trasudado. La existencia de concentraciones bajas de VEGF en los derrames de tipo trasudado no es sorprendente ya que estos derrames se deben a modificaciones en los gradientes de presión osmótica o hidrostática, mientras que se supone que el VEGF actúa sobre la permeabilidad de las células endoteliales.
Se han publicado 2 estudios en los que se observó que las concentraciones de VEGF en los derrames de origen maligno eran significativamente mayores que las que aparecían en los derrames de origen no maligno; los autores de estos estudios señalaron que esta diferencia podría ser útil para discriminar los derrames malignos y los no malignos22,23. Sin embargo, Cheng et al24 no apreciaron diferencias significativas entre los derrames malignos y paraneumónicos en lo relativo a las concentraciones de VEGF, a pesar de que en su estudio estas concentraciones fueron significativamente mayores en los derrames de origen maligno que en los derrames que presentaron los pacientes que habían sido intervenidos mediante cirugía de revascularización coronaria. Los autores señalaron que era poco probable que las concentraciones de VEGF tuvieran utilidad diagnóstica. En congruencia con sus resultados, en nuestro estudio se ha observado que las concentraciones medias de VEGF fueron mayores en los derrames de origen maligno que en los exudados de otras causas, pero la diferencia no fue estadísticamente significativa. No obstante, consideramos que son necesarios nuevos ensayos clínicos de mayor envergadura y efectuados con controles antes de poder establecer una conclusión definitiva acerca de la utilidad diagnóstica de este parámetro.
Aunque algunos autores han observado que las concentraciones de VEGF en el líquido pleural de los pacientes con cáncer pulmonar son significativamente mayores que las observadas en las pacientes con cáncer de mama y derrame pleural16,24, la explicación de esta diferencia no está clara y hasta el momento no hay pruebas de que las células del carcinoma de mama produzcan cantidades menores de VEGF que las del carcinoma pulmonar. Por el contrario, en nuestro estudio no se han observado diferencias significativas al comparar las concentraciones de VEGF en los derrames pleurales malignos de orígenes diversos. Tampoco ha habido diferencias significativas en las concentraciones pleurales de VEGF respecto a los distintos subtipos histológicos de cáncer pulmonar, en congruencia con lo observado en estudios previos22.
Al correlacionar las concentraciones de VEGF con otros marcadores bioquímicos en el líquido de derrame pleural, la única correlación significativa observada ha sido con la concentración de LDH, tal como ya observaron previamente Cheng et al24. Dado que la LDH es un marcador básico de la inflamación, este hallazgo no es sorprendente.
En conclusión, aunque hay variaciones en las concentraciones de VEGF en los derrames pleurales de distintos orígenes, este marcador sólo permite diferenciar los exudados de los trasudados. Son necesarios nuevos estudios con grupos mayores de pacientes para establecer qué función puede desempeñar la concentración de VEGF en el diagnóstico de los derrames pleurales de orígenes neoplásico, tuberculoso o ambos.