Los estudios de los biomarcadores inflamatorios en suero y en el condensado de aire exhalado (CAE) en la apnea obstructiva del sueño (AOS) han producido resultados contradictorios. El objetivo de este estudio es evaluar los biomarcadores en CAE y en suero en pacientes con AOS en la situación basal y después de la aplicación de presión positiva continua de vías aéreas (CPAP) o de cirugía de las vías aéreas superiores (CVAS).
Pacientes y métodosNueve pacientes con AOS que fueron remitidos para CVAS fueron emparejados según sus características antropométricas y el índice de apnea-hipopnea con 20 pacientes que fueron tratados con CPAP. Se efectuaron determinaciones de pH, nitrito (NO2−), nitrato e interleucina 6 en CAE, y de NO2−, nitrato, leucotrieno B4 e interleucina 6 en suero. Se obtuvieron muestras de CAE y de suero en la situación basal y 3 meses después de la CPAP o la CVAS.
ResultadosEl valor medio del índice de masa corporal de los pacientes fue de 30 (rango 24,9-40) kg/m2. Los niveles de marcadores en CAE en la situación basal estuvieron dentro del rango normal y no presentaron diferencias significativas tras la CPAP o la CVAS. No se observaron cambios significativos en las concentraciones séricas de los biomarcadores evaluados tras la CPAP, pero la concentración sérica de NO2− aumentó significativamente a los 3 meses de la CVAS (p=0,0078).
ConclusiónEn los pacientes con AOS y obesidad leve, los biomarcadores de la inflamación o el estrés oxidativo en el CAE presentaron unos niveles basales normales y se mantuvieron inalterados 3 meses después de la CVAS o la CPAP. La CVAS, aunque no resultó efectiva por lo que respecta a la reducción de la gravedad de la AOS, se asoció a un aumento de los niveles séricos de NO2−.
Studies on inflammation biomarkers in serum and in exhaled breath condensate (EBC) in obstructive sleep apnea (OSA) have shown conflicting results. The objective of this study is to assess EBC and serum biomarkers in OSA patients at baseline and after continuous positive airway pressure (CPAP) or upper airway surgery (UAS).
Patients and methodsNine OSA patients referred for UAS were matched for anthropometric characteristics and apnea-hypopnea index with 20 patients receiving CPAP. pH, nitrite (NO2−), nitrate and interleukin 6 in EBC and NO2−, nitrate, leukotriene B4 and interleukin 6 in serum were determined. EBC and serum samples were collected at baseline and 3 months after CPAP or UAS.
ResultsPatients’ mean body mass index was 30 (range 24.9-40) kg/m2. EBC biomarker levels at baseline were within normal range and did not differ significantly after CPAP or UAS. No significant changes were observed in the serum concentration of the biomarkers determined after CPAP but the serum concentration of NO2− increased significantly at 3 months after UAS (P=.0078).
ConclusionIn mildly obese OSA patients, EBC biomarkers of inflammation or oxidative stress were normal at baseline and remained unchanged 3 months after UAS or CPAP. Although UAS was not effective in terms of reducing OSA severity, it was associated with an increase in serum NO2−.
Hay evidencias crecientes que indican que los procesos inflamatorios, de estrés oxidativo y de disfunción endotelial intervienen en la asociación entre la apnea obstructiva del sueño (AOS) y la morbimortalidad1. El análisis del condensado de aire exhalado (CAE) es un método no invasivo de estudio de los biomarcadores inflamatorios y se ha evaluado principalmente en los pacientes con asma2,3. Algunos estudios han abordado la posible utilidad del CAE en la evaluación de la inflamación y el estrés oxidativo en pacientes con AOS4–10. La justificación del análisis de la inflamación y el estrés oxidativo en el CAE está en que el traumatismo mecánico inducido por los ronquidos y el colapso repetido de las vías aéreas altas induce una inflamación local que puede transmitirse al sistema respiratorio y a la circulación sistémica y, por tanto, puede intervenir en la patogenia y el mantenimiento de la AOS. Los pacientes con AOS grave presentan un aumento de la expresión de citocinas proinflamatorias en los compartimentos mucoso y muscular del tejido de las vías aéreas altas, con un aumento simultáneo del depósito de tejido conjuntivo11. Sin embargo, continúa sin haberse determinado el grado en el que estas anomalías contribuyen a producir una disfunción de las vías aéreas altas en la AOS, así como las alteraciones inflamatorias sistémicas. En estudios previos se ha demostrado un aumento de los niveles de biomarcadores de la inflamación y del estrés oxidativo en suero que disminuyen tras la aplicación de un tratamiento de presión positiva continua de vías aéreas (CPAP), aunque los resultados no son concluyentes12–15.
La CPAP es el tratamiento de elección en los pacientes con AOS de moderada a grave, pero algunas personas rechazan este tratamiento y prefieren la opción quirúrgica para agrandar las vías aéreas altas. Aunque la cirugía de las vías aéreas superiores (CVAS) es un tratamiento controvertido para la AOS, nosotros hemos descrito un aumento de la tasa de supervivencia en los pacientes con AOS grave tratados con CVAS en comparación con los no tratados16, y un estudio ha observado una reducción del factor de necrosis tumoral-alfa (TNF-α) después de la CVAS, lo cual evidencia una posible mejoría de la inflamación sistémica y de las consecuencias cardiovasculares17.
El objetivo del presente estudio fue evaluar los efectos de 2 tratamientos para la AOS mediante la hipótesis de que, en los pacientes con AOS, tanto la CPAP como la CVAS mejoran la inflamación local (pH, interleucina-6 [IL-6], nitrito [NO2−], nitrato [NO3−]), la inflamación sistémica (IL-6, leucotrieno B4 [LTB4]) y la función endotelial (NO2−, NO3−).
Material y métodosPoblación en estudioNueve pacientes con AOS (índice de apnea-hipopnea [IAH]>5/h) seleccionados para la aplicación de CVAS según lo determinado por un otorrinolaringólogo fueron emparejados según edad, sexo, índice de masa corporal (IMC) e IAH con 20 pacientes con AOS remitidos a unidades del sueño a los que se les ofreció un tratamiento con CPAP si el IAH era>5/h. La inclusión de pacientes en el estudio se realizó entre abril de 2008 y abril de 2009.
Los pacientes cumplían los siguientes criterios de inclusión: no fumadores o exfumadores durante más de 3 meses antes del inicio del estudio, que no tomaran ningún tratamiento antiinflamatorio (inhalado, nasal, oral o inyectable) durante las 4 semanas previas, sin ningún trastorno endocrino ni otras causas conocidas de alteración del sueño por enfermedad ni por fármacos u otras intervenciones. Se descartaron otras posibles causas de inflamación de vías aéreas superiores o inferiores (rinitis, asma o enfermedad pulmonar obstructiva crónica) mediante la historia clínica y las pruebas funcionales respiratorias. Se excluyó a los pacientes con enfermedades pulmonares obstructivas (volumen espiratorio forzado en un segundo [FEV1]/capacidad vital forzada [FVC]≤0,7). Se determinó la altura (cm) y el peso (kg), y se calculó el IMC (peso en kilogramos/altura en metros al cuadrado).
Los criterios para el uso de la CVAS fueron un IAH>5 y menos de 40 episodios/h, en pacientes con alteraciones morfológicas de las vías aéreas altas (hipertrofia velopalatina) que rechazaban el tratamiento con CPAP. Los pacientes con un IMC>35kg/m2 o con alteraciones craneofaciales como micrognatia o retrognatia no fueron considerados candidatos a CVAS. La intervención de CVAS utilizada fue una uvulopalatofaringoplastia.
El estudio fue aprobado por el Comité Ético del hospital y se obtuvo el consentimiento informado por escrito de todos los participantes.
Poligrafía respiratoriaSe efectuó un registro de toda una noche del flujo aéreo nasal, la pulsioximetría, el esfuerzo respiratorio, la posición corporal y los ronquidos, utilizando el dispositivo Somnea (Compumedics, Abbotsford, Australia). Las apneas se definieron como una ausencia total de flujo aéreo nasal durante al menos 10s, y las hipopneas, como una disminución clara de la amplitud del flujo aéreo nasal durante al menos 10s seguida de una desaturación del 3%. Se diferenciaron las apneas obstructivas de las centrales mediante los canales de esfuerzo respiratorio (presencia o ausencia de movimiento toracoabdominal). El IAH se obtuvo dividiendo el número total de apneas e hipopneas entre el tiempo total de registro. La AOS se definió como un IAH de al menos 5. Los pacientes con un IAH de entre 5 y 30 se clasificaron como casos de AOS de leve a moderada, y los pacientes con un IAH>30 se consideraron casos de AOS grave.
Ajuste de la presión positiva continua de vías aéreasEn los pacientes del grupo de CPAP se realizó un ajuste de esta con el empleo de un dispositivo de presión automática (AutoSet Spirit™; ResMed, Sydney, Australia). La presión óptima se determinó visualmente a partir del informe de datos impreso18. A continuación, se prescribió a los pacientes la CPAP, que les fue proporcionada sin coste por el Sistema Nacional de Salud de España.
Pruebas de la función pulmonarSe determinó el FEV1, la FVC y el cociente FEV1/FVC con un espirómetro (MasterScreen™ PFT; Jaeger, Höchberg, Alemania).
Muestras de sueroSe obtuvieron muestras de suero mediante la centrifugación de la sangre total. Cada muestra de suero se dividió en partes alícuotas de 500μL. Las muestras alícuotas utilizadas para las determinaciones de la concentración de NO2−, NO3−, LTB4 e IL-6 se almacenaron de inmediato a −70°C, y se analizaron en el plazo de un mes tras la obtención.
Obtención del condensado de respiración exhaladaEl CAE se obtuvo durante la respiración corriente con un condensador comercial (EcoScreen™; Jaeger, Wurzburgo, Alemania), según lo descrito con anterioridad19. El aire exhalado entraba y salía de la cámara a través de válvulas unidireccionales de entrada y salida, con lo que se mantenía la cámara cerrada. Los pacientes realizaban respiraciones de un volumen corriente a través de una boquilla conectada al condensador, llevando una pinza en la nariz. La baja temperatura en el interior de la cámara de condensación durante todo el tiempo de obtención producía un enfriamiento de la muestra. Se obtuvieron muestras de sangre en tubos de muestras que, antes del uso, habían sido desinfectados durante 30min con el empleo de dicloroisocianurato de sodio (Inibsa Lab, Barcelona, España), y lavados durante 24h con agua destilada y 2h con agua ultra pura (Fresenius Kabi, Barcelona, España). Para determinar el patrón de ventilación, se utilizó un espirómetro (EcoVent; Jaeger, Wurzburgo, Alemania) que se conectó al equipamiento en la válvula espiratoria. El espirómetro registró la espiración total, el tiempo de obtención, el volumen corriente, la ventilación-minuto y la frecuencia respiratoria. Se indicó a los pacientes que evitaran el consumo de alimento durante las 2h previas a la obtención de la muestra. Se recogió un volumen fijo de 150L de aire exhalado por paciente. Cada muestra de CAE se dividió en partes alícuotas de 500μL en 2-5 tubos de plástico. Las muestras alícuotas utilizadas para las determinaciones de la concentración de NO2−, NO3− e IL-6 se almacenaron de inmediato a −70°C, y se analizaron en el plazo de un mes tras la obtención. Se utilizó una muestra alícuota para la determinación del pH inmediatamente después de la obtención.
Determinación del pH del condensado de respiración exhaladaEl pH se determinó en una de las muestras alícuotas tras la desaireación del CAE con helio (350mL/min durante 10min), utilizando un pH-metro calibrado (modelo GLP 21; Crison Instruments, S. A., Barcelona, España) con una exactitud de±0,01 pH, y una sonda para volúmenes pequeños (Crison 50 28; Crison Instruments, S. A., Barcelona, España). La sonda se calibró diariamente con tampones patrón de pH 7,02 y 4,0020.
Determinaciones de nitrito y nitratoLas concentraciones de NO2− y NO3− en las muestras de suero y de CAE se determinaron con un análisis colorimétrico basado en la reacción de Griess. Se determinó el total de NO2−/NO3− (NO3− convertido más NO2−) en muestras duplicadas, utilizando el reactivo de Griess (Cayman Chemical Company, Ann Arbor, MI, EE. UU.). Las concentraciones se determinaron a una absorbancia de 540nm con un lector de microplaca. La sensibilidad del análisis fue de 1μM para NO2− y de 2,5μM para NO3−. Se observaron unos coeficientes de variación intraanálisis del 6 y 4%, y unos coeficientes interanálisis del 9 y 5% para NO3− y NO2−, respectivamente. Los autores decidieron determinar los productos terminales del metabolismo de NO en vez de NO exhalado, con objeto de comparar compuestos generados a partir de la misma muestra.
Determinaciones de interleucina 6 y leucotrieno B4La concentración de IL-6 en muestras de suero y CAE se determinó con el empleo de un ensayo inmunoabsorbente ligado a enzimas comercial de alta sensibilidad (Bender MedSystems GmbH, Viena, Austria). La sensibilidad del análisis era de 0,03pg/mL. Los coeficientes de variación intraanálisis e interanálisis fueron del 4,9 y 6,0%, respectivamente.
La concentración de LTB4 en las muestras de suero se determinó con un kit de imnunoanálisis enzimático de LTB4 comercial (Cayman Chemical Company, Ann Arbor, IM, EE. UU.). La sensibilidad del análisis era de 13pg/mL.
ProtocoloEn todos los pacientes se obtuvo una poligrafía respiratoria durante una noche entera, en la situación basal, que se repitió 3 meses después en los pacientes tratados con CVAS. Las muestras de CAE y de sangre se obtuvieron en la situación basal y 3 meses después de la CVAS o después del inicio de la CPAP.
Tamaño muestralAceptando un riesgo alfa de 0,05 y un riesgo beta inferior a 0,2 en una prueba de contraste bilateral, eran necesarios 7 pacientes en cada grupo para detectar una diferencia igual o superior a 0,58 unidades en los valores de pH del CAE. Se asumió una desviación estándar de 0,44, según los resultados presentados por Petrosyan et al.8.
Análisis de los datosEl parámetro de valoración principal del estudio fue la comparación del cambio de los biomarcadores en CAE y en suero con el empleo de CPAP y de CVAS en un seguimiento de 3 meses. Como criterio de valoración secundario analizamos la correlación entre los biomarcadores en CAE y en suero y la gravedad de la AOS, evaluada mediante el IAH. Se utilizó la prueba de Kolmogorov-Smirnov para una muestra para evaluar la normalidad de la distribución de los datos. Las diferencias entre los grupos se analizaron con la prueba de Mann-Whitney, y las diferencias dentro del grupo se analizaron con la prueba de rango con signo de Wilcoxon. Se aplicó la prueba de correlación de rango de Spearman para determinar las correlaciones entre el IAH y los biomarcadores estudiados. A las concentraciones de NO2− y NO3− no detectables se les asignó el valor del límite de detección (1μM y 2,5μM, respectivamente). A las concentraciones de IL-6 o LTB4 no detectables se les asignaron los valores del límite de detección (0,03pg/mL y 13pg/mL, respectivamente). Los datos se expresaron en forma de número absoluto o mediana (rango), según fuera apropiado. Para los análisis estadísticos se utilizó un programa informático (SPSS® versión 17.0 para Windows®; SPSS, Inc., Chicago, IL, EE. UU.).
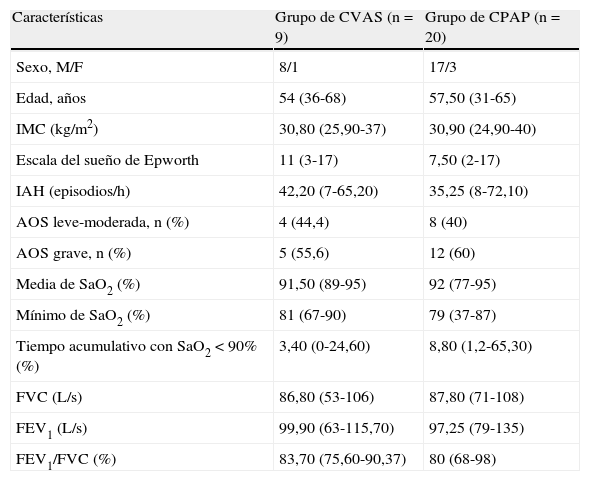
ResultadosLos datos demográficos y las características clínicas de los pacientes estudiados se resumen en la tabla 1. No hubo diferencias significativas en las características antropométricas, los parámetros respiratorios del sueño ni los datos de la función pulmonar entre los pacientes de los grupos de CPAP y CVAS.
Características basales y datos de sueño y función pulmonar de los sujetos estudiados
| Características | Grupo de CVAS (n=9) | Grupo de CPAP (n=20) |
| Sexo, M/F | 8/1 | 17/3 |
| Edad, años | 54 (36-68) | 57,50 (31-65) |
| IMC (kg/m2) | 30,80 (25,90-37) | 30,90 (24,90-40) |
| Escala del sueño de Epworth | 11 (3-17) | 7,50 (2-17) |
| IAH (episodios/h) | 42,20 (7-65,20) | 35,25 (8-72,10) |
| AOS leve-moderada, n (%) | 4 (44,4) | 8 (40) |
| AOS grave, n (%) | 5 (55,6) | 12 (60) |
| Media de SaO2 (%) | 91,50 (89-95) | 92 (77-95) |
| Mínimo de SaO2 (%) | 81 (67-90) | 79 (37-87) |
| Tiempo acumulativo con SaO2<90% (%) | 3,40 (0-24,60) | 8,80 (1,2-65,30) |
| FVC (L/s) | 86,80 (53-106) | 87,80 (71-108) |
| FEV1 (L/s) | 99,90 (63-115,70) | 97,25 (79-135) |
| FEV1/FVC (%) | 83,70 (75,60-90,37) | 80 (68-98) |
CPAP: presión positiva continua de vías aéreas; CVAS: cirugía de las vías aéreas superiores; F: femenino; FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; M: masculino; SaO2: saturación de oxígeno arterial.
Los datos se presentan en forma de n o mediana (rango), salvo que se indique lo contrario.
La poligrafía respiratoria realizada 3 meses después de la CVAS no mostró cambios significativos de los parámetros respiratorios medidos respecto a la situación basal. En los pacientes tratados con CPAP, la mediana (rango) de uso de CPAP fue de 4,9h (0,33-6,7), y la mediana (rango) del valor de CPAP fue de 9cmH2O (7-13).
No hubo una correlación significativa entre la concentración de ninguno de los biomarcadores en CAE o en suero y la gravedad de la AOS.
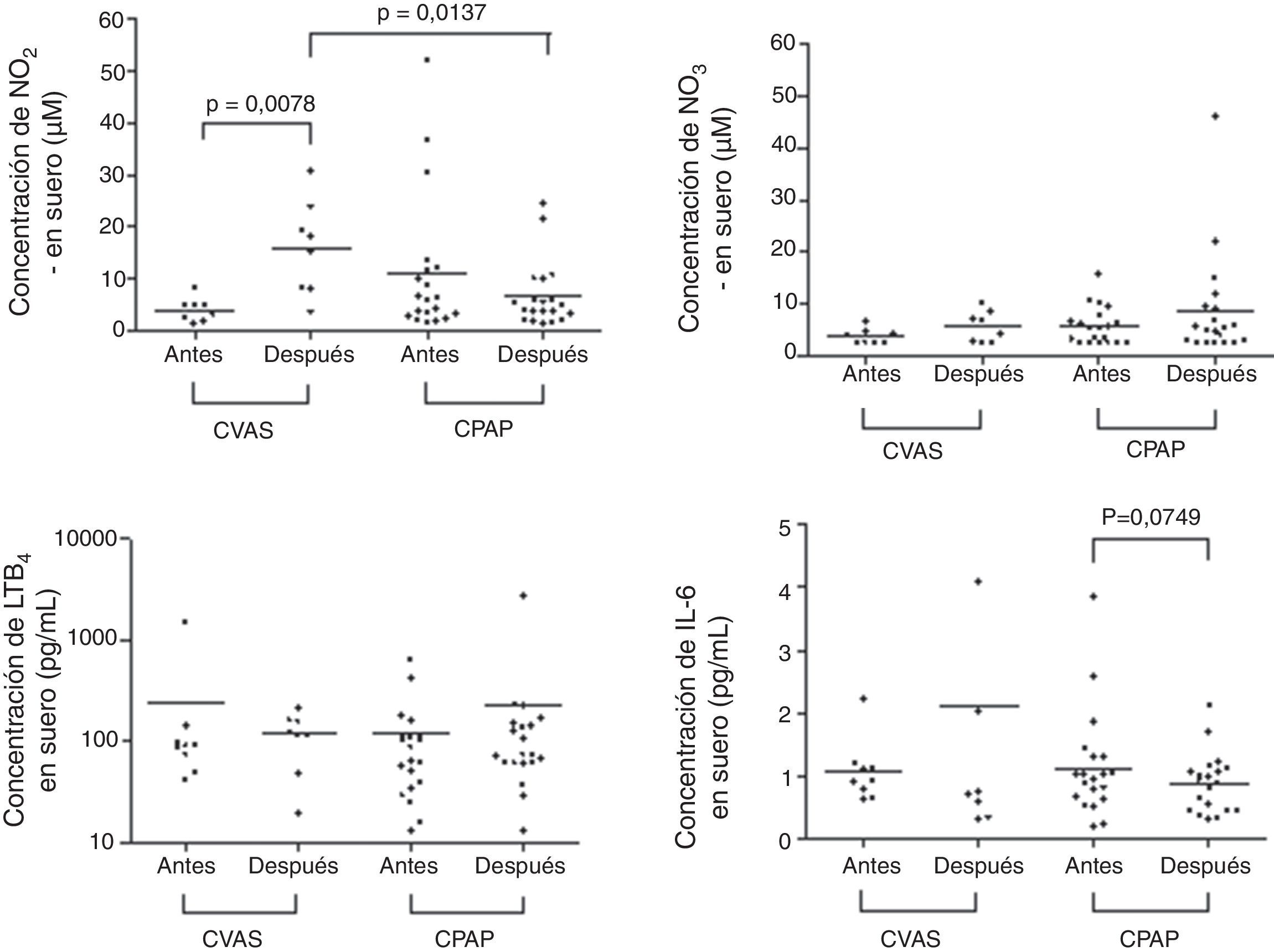
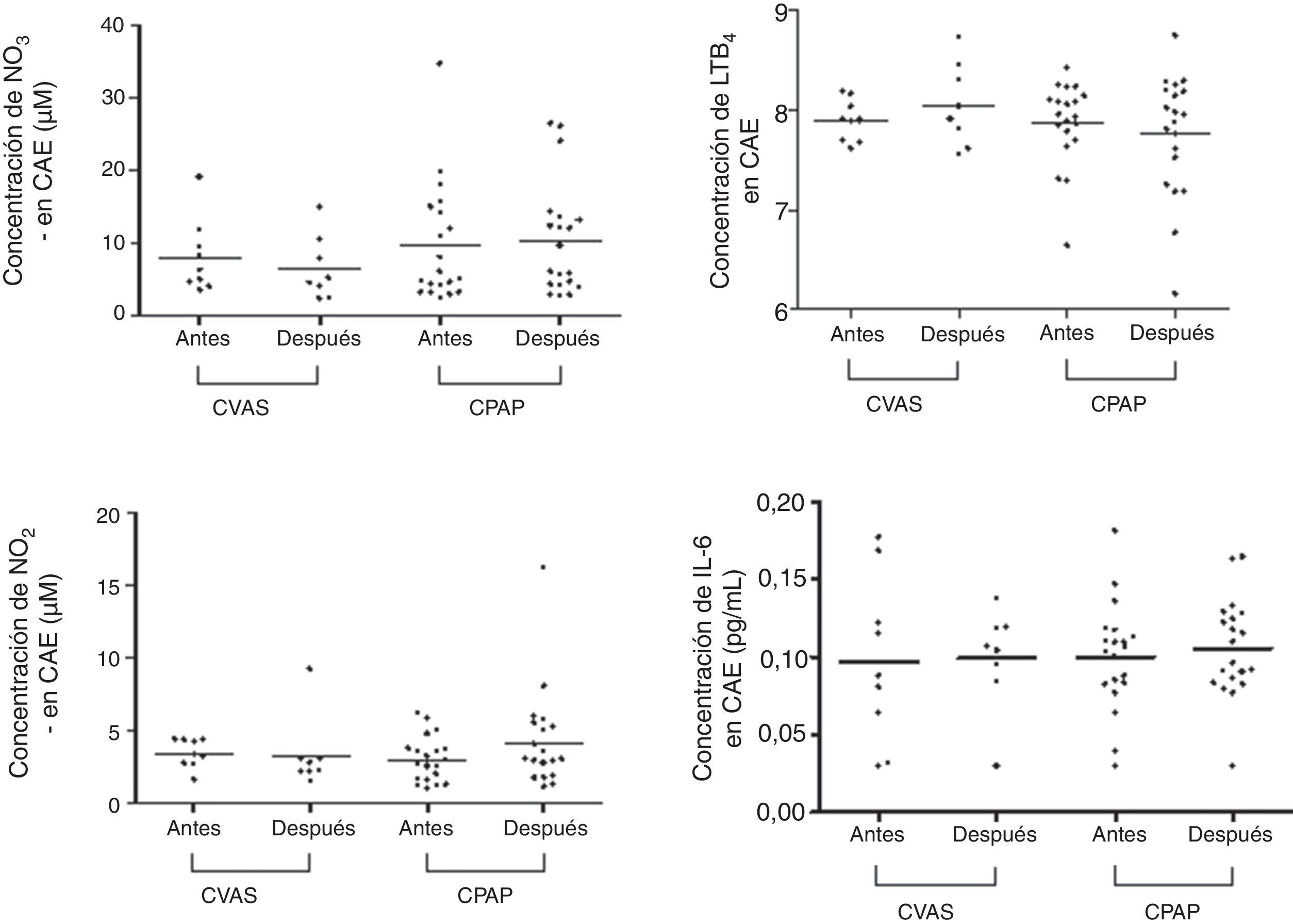
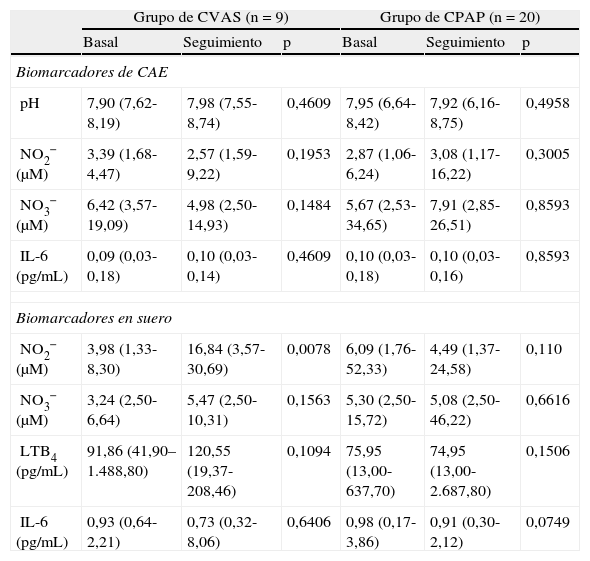
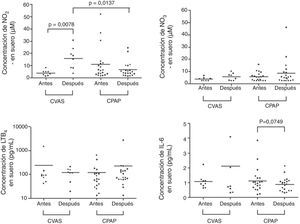
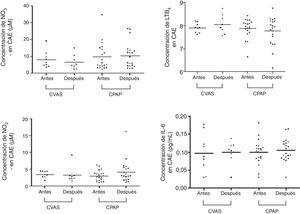
En la tabla 2 y en las figuras 1 y 2 se presentan los datos de concentración de biomarcadores en CAE y en suero en la situación basal y en el seguimiento realizado a los 3 meses. No hubo diferencias significativas entre los valores basales y los del seguimiento a los 3 meses en los niveles de biomarcadores en CAE, ni en los pacientes tratados con CPAP ni en los tratados con CVAS. En las muestras de suero observamos un aumento significativo de la concentración de NO2− en el grupo de CVAS 3 meses después de la cirugía (p=0,0078). Además, la concentración de NO2− en suero fue superior en el grupo de CVAS en comparación con el grupo de CPAP (p=0,0137). Se observó una tendencia a una reducción de las concentraciones de IL-6 en suero después de 3 meses de tratamiento con CPAP (p=0,0749). No observamos ninguna diferencia significativa en otros biomarcadores determinados en suero.
Determinaciones en muestras de condensado de respiración exhalada y de suero
| Grupo de CVAS (n=9) | Grupo de CPAP (n=20) | |||||
| Basal | Seguimiento | p | Basal | Seguimiento | p | |
| Biomarcadores de CAE | ||||||
| pH | 7,90 (7,62-8,19) | 7,98 (7,55-8,74) | 0,4609 | 7,95 (6,64-8,42) | 7,92 (6,16-8,75) | 0,4958 |
| NO2− (μM) | 3,39 (1,68-4,47) | 2,57 (1,59-9,22) | 0,1953 | 2,87 (1,06-6,24) | 3,08 (1,17-16,22) | 0,3005 |
| NO3− (μM) | 6,42 (3,57-19,09) | 4,98 (2,50-14,93) | 0,1484 | 5,67 (2,53-34,65) | 7,91 (2,85-26,51) | 0,8593 |
| IL-6 (pg/mL) | 0,09 (0,03-0,18) | 0,10 (0,03-0,14) | 0,4609 | 0,10 (0,03-0,18) | 0,10 (0,03-0,16) | 0,8593 |
| Biomarcadores en suero | ||||||
| NO2− (μM) | 3,98 (1,33-8,30) | 16,84 (3,57-30,69) | 0,0078 | 6,09 (1,76-52,33) | 4,49 (1,37-24,58) | 0,110 |
| NO3− (μM) | 3,24 (2,50-6,64) | 5,47 (2,50-10,31) | 0,1563 | 5,30 (2,50-15,72) | 5,08 (2,50-46,22) | 0,6616 |
| LTB4 (pg/mL) | 91,86 (41,90–1.488,80) | 120,55 (19,37-208,46) | 0,1094 | 75,95 (13,00-637,70) | 74,95 (13,00-2.687,80) | 0,1506 |
| IL-6 (pg/mL) | 0,93 (0,64-2,21) | 0,73 (0,32-8,06) | 0,6406 | 0,98 (0,17-3,86) | 0,91 (0,30-2,12) | 0,0749 |
CAE: condensado de aire exhalado; CPAP: presión positiva continua de vías aéreas; CVAS: cirugía de las vías aéreas superiores.
Los datos se presentan en forma de mediana (rango), salvo que se indique lo contrario.
En el grupo de CVAS observamos una correlación negativa significativa entre el IMC y la concentración de NO2− en suero en la situación basal (r=−0,814, p=0,014).
DiscusiónEn nuestro estudio se determinó, en pacientes con AOS, la concentración basal y el efecto de la CVAS y la CPAP sobre los biomarcadores inflamatorios (IL-6, NO2−, NO3−) y del estrés oxidativo (pH) en el CAE, así como sobre los biomarcadores de la inflamación y la función endotelial (IL-6, LTB4 y NO2−, NO3−, respectivamente) en el suero. No hubo una correlación significativa entre la concentración de ninguno de los biomarcadores en CAE o en suero y la gravedad de la AOS. A pesar de la ausencia de efecto de la CVAS sobre el IAH o los valores de la saturación de oxígeno, la cirugía se asoció a un aumento de los niveles de NO2− en suero en el seguimiento realizado a los 3 meses. La CPAP no produjo ningún cambio significativo en los parámetros determinados en CAE o en suero a los 3 meses.
Por lo que respecta a los resultados en el CAE, nuestro estudio puso de manifiesto que el pH y las concentraciones de NO3− y NO2− estaban situadas dentro del rango normal para la edad, según lo descrito por nuestro grupo en un estudio previo llevado a cabo en voluntarios sanos21. Este resultado contrasta con los de 3 estudios que han descrito un valor de pH bajo en el CAE en pacientes con AOS7,8,22. En 2 de estos estudios, los pacientes eran de menor edad7,22, mientras que en la totalidad de estos los pacientes eran más obesos y la AOS era más grave. Así pues, el mayor grado de obesidad y de gravedad de la AOS podría explicar la discrepancia respecto a nuestros resultados. La obesidad puede ser un factor de confusión en las determinaciones de los biomarcadores en el CAE: se ha descrito una inflamación de las vías aéreas en los pacientes obesos con o sin AOS en comparación con los individuos de control delgados7, y otro estudio ha mostrado unos niveles superiores de biomarcadores de la inflamación en las vías aéreas en los pacientes con AOS obesos, en comparación con los pacientes con AOS no obesos8.
Diversos estudios han observado unas concentraciones altas de IL-6, un marcador de la inflamación neutrofílica, en el CAE de pacientes con AOS4,5,8,22, pero tan solo un estudio8 ha analizado los niveles de NO2−, NO3− y LTB4 en el CAE de pacientes con AOS; en dicho estudio se observó un aumento de estos niveles, que evidenciaba la presencia de inflamación local. Agustí et al.23 señalaron que el NO en el aire exhalado de los pacientes con AOS (aunque con el empleo de un método diferente) no presentaba diferencias significativas respecto a los individuos sanos.
Nosotros no observamos correlación alguna entre los niveles de biomarcadores en el CAE y la gravedad de la AOS, lo cual no concuerda con la correlación observada entre algunos biomarcadores y los parámetros de polisomnografía por otros autores4,8,9,22. El hecho de que se utilizaran métodos diferentes para el análisis de los biomarcadores, las diferencias en las características antropométricas de los pacientes, la gravedad de la AOS y las comorbilidades podrían explicar los resultados contradictorios obtenidos en los estudios publicados.
No se ha descrito el efecto de la CVAS sobre el CAE. En nuestros pacientes, la cirugía no resultó efectiva por lo que respecta a la reducción del IAH o a la mejora de los valores de SaO2, y no se asoció a ningún cambio en los niveles de biomarcadores en el CAE. La explicación más probable de esta observación es que los valores basales de los biomarcadores (pH, NO2− y NO3−) estuvieran ya dentro de los límites normales, lo cual evidencia un efecto suelo21, y la falta de eficacia de la cirugía.
No pudimos demostrar efecto alguno del tratamiento con CPAP sobre los niveles de biomarcadores en el CAE. De nuevo, los valores basales normales obtenidos en nuestros pacientes dificultan la obtención de un cambio con el tratamiento de CPAP. Tan solo unos pocos estudios han evaluado el efecto del tratamiento con CPAP sobre los niveles de biomarcadores en el CAE. Petrosyan et al.8 observaron un aumento del pH del CAE después de un mes de CPAP, pero no identificaron cambio alguno en los niveles de NO3−, LTB4 o 8-isoprostano. Carpagnano et al.6 describieron una reducción de 8-isoprostano después de 2 noches de tratamiento con CPAP. Karamanli et al.9 observaron que el tratamiento con CPAP reduce los niveles de TNF-α, IL-6, 8-isoprostano y peroxinitrito en el CAE.
Al analizar los efectos producidos por ambos tratamientos en el suero, el único cambio significativo observado 3 meses después de la cirugía fue un aumento de la concentración plasmática de NO2−. Esta nueva e intrigante observación podría considerarse un efecto beneficioso, ya que los niveles de NO2− en el suero reflejan la producción de NO endotelial y, por asociación, una mejora de la función endotelial. Este resultado podría interpretarse como una observación debida al azar, teniendo en cuenta el bajo número de pacientes estudiados, o podría atribuirse a un efecto sistémico beneficioso real de la CVAS, no relacionado con el IAH o la SaO2, puesto que estos 2 parámetros se mantuvieron inalterados en las evaluaciones realizadas en el estudio de control del sueño a los 3 meses. Una explicación hipotética podría ser la mejoría en los ronquidos y, en consecuencia, de los niveles de NO2−, pero esto parece improbable puesto que la CPAP produce también una abolición de los ronquidos y este tratamiento no afectó a los niveles de NO2− en suero. Que nosotros sepamos, el efecto de la CVAS sobre los biomarcadores inflamatorios circulantes en la AOS se ha analizado tan solo en un estudio, en el que se observó una disminución de los niveles plasmáticos de TNF-α, una semana después del tratamiento quirúrgico de las vías aéreas altas en los pacientes con AOS17. El aumento de los niveles de NO2− en suero después de la CVAS no se observó, en cambio, en el CAE. Es probable que el origen de la expresión de citocinas en las vías aéreas altas y en el suero sea diferente. La hipoxia intermitente y la activación simpática inducen la expresión de citocinas y una disfunción endotelial, mientras que en las vías aéreas altas pueden intervenir esos mecanismos y sus consecuencias, así como la inflamación local inducida por los ronquidos y por la oclusión intermitente de las vías. Que nosotros sepamos, tan solo un estudio ha analizado los biomarcadores de la inflamación, el estrés oxidativo y la disfunción endotelial en los mismos pacientes, tanto en CAE como en suero9. En este estudio se observó que el tratamiento con CPAP se asociaba a una disminución de todos los biomarcadores analizados en el CAE, aunque tan solo el 8-isoprostano y la nitrotirosina se redujeron en el suero.
No observamos ningún cambio significativo de los biomarcadores circulantes de la inflamación o la función endotelial a los 3 meses del tratamiento de CPAP, si bien hubo una tendencia no significativa a una reducción de las concentraciones de IL-6 en suero. El efecto de confusión introducido por la obesidad visceral puede explicar los resultados controvertidos obtenidos en los estudios en los que se ha investigado el nivel sérico de IL-6, una citocina producida por el tejido adiposo visceral, en la AOS. En estudios anteriores se ha planteado la existencia de un aumento de los niveles de IL-6 en los pacientes con AOS24. En un estudio no controlado, llevado a cabo en 17 pacientes con AOS moderada-grave, Yokoe et al. describieron una reducción significativa de los niveles de IL-6 y de proteína C reactiva después de 4 semanas de CPAP14, pero este resultado no fue confirmado por Mehra et al.25 ni por el primer ensayo controlado aleatorizado realizado por Kohler et al.26, en el que se observó una ausencia de efecto de 4 semanas de tratamiento con CPAP sobre las citocinas IL-6 y el interferón-gamma en 100 pacientes con AOS moderada-grave. Karamanli et al. mostraron una disminución significativa de los niveles de nitrotirosina y de 8-isoprostano en suero con un tratamiento de CPAP durante 3 meses, pero no hubo cambios en la velocidad de sedimentación, la proteína C reactiva, la IL-6 ni el TNF-α9.
Los niveles séricos de NO se han utilizado como marcador de la función endotelial, puesto que el NO circulante procede directamente del endotelio vascular27. Varios investigadores han descrito una reducción de los niveles circulantes de NO (NO3−, NO2−) en los pacientes con AOS en comparación con los pacientes sin AOS28, y que el tratamiento con CPAP puede elevar la concentración de NO29-31. Nuestros resultados no confirman esas observaciones, y las posibles explicaciones están en las diferencias en cuanto a metodología utilizada para determinar los derivados de NO o en las características de las poblaciones estudiadas.
El LTB4 es un mediador inflamatorio que procede de la vía de la 5-lipoxigenasa del metabolismo del ácido araquidónico y es producido por las células polimorfonucleares. Lefebvre et al.32 observaron que la producción de LTB4 estaba aumentada en los pacientes con AOS no obesos en relación con la desaturación de oxígeno y disminuía de manera significativa después de 3 meses de tratamiento con CPAP, y que los niveles de LTB4 estaban correlacionados con el diámetro de la luz de la carótida. Contrariamente a lo indicado por este resultado, nosotros no pudimos identificar ningún cambio significativo en los niveles de LTB4 en suero en una población con mayor sobrepeso, pero con un periodo de seguimiento similar.
Aparte de estas consideraciones, es probable que el estudio careciera de la potencia estadística suficiente para detectar diferencias en los parámetros séricos. La potencia estadística del estudio en el grupo de CPAP fue del 52% para la IL-6 y de tan solo el 3% para el NO2−. En cambio, la potencia del estudio fue del 96% para la detección de cambios en el NO2− en el grupo de CVAS y esto podría respaldar el aumento significativo del NO2− después de la cirugía.
Los puntos fuertes de nuestro estudio son la selección cuidadosa de los pacientes, el hecho de que el efecto de la CVAS se evaluara mediante poligrafía respiratoria en el seguimiento, y la determinación objetiva de la CPAP. Las limitaciones del estudio fueron las siguientes: la ausencia de todo efecto de la CVAS sobre los parámetros de la AOS, y que el número de pacientes incluidos fue bajo, aun cuando el tamaño muestral era suficiente para detectar una diferencia significativa al menos en los valores de pH del CAE. Sin embargo, el estudio no tuvo la potencia estadística suficiente para detectar cambios significativos en los parámetros séricos. Los resultados podrían haber sido distintos si hubiéramos seleccionado tan solo a pacientes con AOS grave. Sin embargo, la CVAS no es un método de tratamiento frecuente, y en el momento en el que se realizó el estudio la Unidad de Otorrinolaringología remitió tan solo a 9 pacientes con AOS (IAH>5 y<40) que estaban en espera de una CVAS; cada uno de estos pacientes fue emparejado según la gravedad de la SAHS con 2 pacientes estudiados en la Unidad del Sueño a los que se ofreció la CPAP. No utilizamos un diseño de ensayo aleatorizado ya que, como se ha mencionado antes, el número de procedimientos de CVAS de nuestro centro es bajo, y también porque no consideramos ético asignar pacientes a un tratamiento reconocido como la CPAP y otros a un tratamiento controvertido como la CVAS.
Queda por determinar en futuros estudios si un periodo de seguimiento más largo podría demostrar un efecto beneficioso sobre los parámetros del CAE y el suero de ambos tratamientos, puesto que la mayoría de los estudios publicados disponen de evaluaciones a corto plazo. Nosotros planteamos que puesto que la edad, la obesidad y la gravedad de la AOS pueden influir en la inflamación y el estrés oxidativo, los pacientes con una mayor obesidad y/o gravedad de la AOS podrían tener una mayor probabilidad de mostrar una respuesta mensurable al tratamiento en cuanto a los biomarcadores en el CAE o en el suero.
En resumen, hemos observado que en pacientes con AOS y obesidad leve, el tratamiento con CPAP o con CVAS no produjo cambios en los biomarcadores determinados en el CAE a los 3 meses. Aunque la CVAS resultó ineficaz para mejorar los parámetros polisomnográficos, el nivel de NO2− en suero aumentó significativamente a los 3 meses, mientras que la CPAP no produjo ningún cambio mensurable en los biomarcadores séricos. Serán necesarios nuevos estudios para definir la aplicabilidad del CAE en la investigación o en la práctica clínica en pacientes con SAHS.
AutoríaLa Dra. Patrícia Lloberes participó en el diseño del estudio, la obtención e interpretación de los datos, y la redacción del manuscrito.
La Sra. Sara Sánchez-Vidaurre participó en el diseño del estudio, y en la obtención e interpretación de los datos.
El Dr. Alex Ferré participó en el diseño del estudio, y en la obtención e interpretación de los datos.
La Dra. María Jesús Cruz participó en el diseño del estudio, y en la obtención e interpretación de los datos.
El Dr. Juan Lorente participó en el diseño del estudio y en la interpretación de los datos.
El Dr. Gabriel Sampol participó en el diseño del estudio y en la interpretación de los datos.
El Dr. Ferran Morell participó en el diseño del estudio y en la interpretación de los datos.
El Dr. Xavier Muñoz participó en el diseño del estudio y en la interpretación de los datos.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Los autores dan las gracias a María Dolores Untoria por el procesamiento de las muestras de CAE y de sangre, a Rosa Llòria por su ayuda en la redacción del manuscrito, y a Yvette Jusseaume por la traducción al inglés y la corrección.