Los determinantes en fases iniciales de la historia natural de la enfermedad pulmonar obstructiva crónica (EPOC) son poco conocidos. Entenderlos mejor es de capital importancia para poder diseñar intervenciones dirigidas a modificar su pronóstico. Los principales objetivos del estudio son: a) caracterizar a una población de adultos jóvenes con EPOC de forma multidimensional; b) comparar estos pacientes con sujetos fumadores con función pulmonar normal; y c) establecer una cohorte de adultos jóvenes con y sin EPOC, que pueda ser seguida a largo plazo para conocer mejor la historia natural de la enfermedad.
Participantes y métodoEARLY COPD es un estudio multicéntrico de casos y controles que permitirá establecer una cohorte de sujetos para su seguimiento posterior. Se seleccionaron 311 (101 casos y 210 controles) participantes reclutados en una treintena de centros de atención primaria y 12 hospitales de 8 comunidades autónomas españolas. Los participantes eran fumadores o exfumadores (>10 paquetes año) de entre 35-50 años de edad. Los casos presentaban una espirometría obstructiva con un FEV1/FVC<70% y los controles una espirometría normal con un FEV1/FVC≥70%. Las principales variables de estudio que se han determinado son las siguientes: cuestionarios de salud, síntomas, exacerbaciones y actividad física, pruebas de función respiratoria, análisis biológicos de sangre y esputo y TAC de baja radiación. Para el análisis estadístico de los resultados se describirán las características de los pacientes con EPOC y se compararán con los sujetos del grupo control mediante un modelo de regresión logística.
Determinants of chronic obstructive pulmonary disease (COPD) in the early stages of its natural history are not well known. Improving our knowledge of these factors will help to design interventions that can modify prognosis.
Study objectives are: a) to characterize a COPD population of young adults aged 35-50 years from a multidimensional point of view; b) to compare these patients with smokers with normal lung function; and c) to create a cohort of young adults aged 35-50 years (smokers or former smokers), with and without COPD, who will be followed in the future to improve understanding of the natural history of the disease.
Participants and methodThis is a case-control multicenter study aimed at establishing a well-characterized cohort of young adults, smokers or former-smokers, with and without COPD, for subsequent follow-up.
A total of 311 participants (101 cases and 210 controls) were selected from approximately 30 primary care settings and 12 hospitals in 8 Spanish regions. Subjects were smokers or former smokers (>10 pack-years) aged 35-50 years. Diagnosis of COPD was based on a post-bronchodilator result of FEV1/FVC<70%.
The main study variables were: questionnaires on health, symptoms, exacerbations and daily physical activity, lung function tests, blood and sputum samples, and low-dose computed tomography. In the statistical analysis, COPD patient characteristics will be described and compared with control subjects using a logistic regression analysis.
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad respiratoria caracterizada por síntomas persistentes y limitación crónica al flujo aéreo. Está causada principalmente por el tabaco1 y tiene una importante repercusión sobre la calidad de vida de los que la sufren, así como una elevada carga socioeconómica para el sistema sanitario2, lo que hace necesario diseñar estrategias dirigidas a su prevención y tratamiento temprano. Sin embargo, debido a su naturaleza heterogénea3 y a que la enfermedad se diagnostica en fases avanzadas, el conocimiento patobiológico de sus fases iniciales es muy escaso4.
El actual conocimiento de la historia natural de la EPOC está basado en los estudios de Fletcher y Peto de 19775 sobre la evolución de la función pulmonar en trabajadores británicos en diferentes franjas de edad. Estos estudios demostraron una pérdida acelerada de volumen espiratorio forzado el primer segundo (FEV1) en los denominados «fumadores susceptibles». Sin embargo, la naturaleza heterogénea de la EPOC ha llevado a proponer que pueden existir diferentes historias naturales con mecanismos etiopatogénicos diversos dentro de la EPOC6,7. De hecho, los resultados del estudio ECLIPSE han demostrado que la mencionada pérdida acelerada de función pulmonar no está presente en hasta un 60% de los pacientes diagnosticados y tratados de EPOC8. Existen además otros interrogantes sobre la historia natural de la enfermedad no resueltos, como por ejemplo el efecto del desarrollo pulmonar en la infancia y adolescencia, la evolución de la enfermedad en fases iniciales, el papel de la hiperreactividad bronquial y de las infecciones, la influencia de las comorbilidades o la historia natural de la EPOC en la mujer y en los individuos no fumadores.
A pesar de que la EPOC se diagnostica de promedio en la sexta década de la vida, todos los estudios coinciden en que se inicia de forma temprana9, aunque no se diagnostica hasta que los síntomas son percibidos por el enfermo en edades más avanzadas. En este sentido, un estudio reciente ha demostrado que existen diferentes trayectorias para llegar a EPOC, y que una proporción importante de los casos que se detectan en la edad adulta parten de una función pulmonar ya reducida en edades más jóvenes10. Sin embargo, se conoce poco acerca de la EPOC en sus fases iniciales. Los estudios poblacionales como el European Community Respiratory Health Survey11 y el EPISCAN en España12, estiman una prevalencia del 3,6% y 3,8% (4,4% en varones y 3,2% en mujeres) respectivamente, en la franja de edad entre los 40 y 49 años. Sin embargo, los determinantes de la evolución de la EPOC desde sus fases iniciales son desconocidos. Ciertos estudios han observado que el descenso de la función pulmonar es mucho más acelerado en las fases iniciales que en las fases avanzadas de la enfermedad13, principalmente entre los pacientes sintomáticos14. También es de interés la asociación de la EPOC inicial con otras enfermedades, como la depresión15, los problemas cardiovasculares o el incremento de la prevalencia del cáncer de pulmón16,17.
La falta de biomarcadores validados que nos permitan predecir y monitorizar la respuesta al tratamiento de la enfermedad ha sido una de las principales limitaciones para conocer su historia natural. El FEV1, parámetro universalmente aceptado para diagnosticar y estadificar la EPOC se correlaciona pobremente con los síntomas en etapas tempranas de la enfermedad18. También serían necesarios los marcadores de imagen, como la tomografía axial computarizada, para evaluar longitudinalmente los cambios estructurales en la EPOC18. En relación con otros biomarcadores, la proteína secretora 16 de las células club19 o la proteína D del surfactante20 fueron propuestos como marcadores biológicos de la enfermedad21–23. Otros marcadores inflamatorios, como la proteína C reactiva también se han asociado a los efectos sistémicos y al pronóstico de la EPOC24. No obstante, ninguno de ellos ha sido todavía validado como un marcador de progresión en pacientes con fases iniciales de la enfermedad. Otros tipos de marcadores de progresión, como la actividad microbiológica, la exposición ambiental persistente o los factores genéticos no han sido todavía explorados a fondo.
Por todo lo expuesto, es de capital importancia estudiar a los pacientes con EPOC desde las fases tempranas para conocer la historia natural de la enfermedad y poder diseñar intervenciones dirigidas a modificar su pronóstico.
Así pues, los objetivos principales del estudio EARLY COPD son los siguientes:
- 1.
Caracterizar a una población de pacientes jóvenes con EPOC de forma multidimensional.
- 2.
Comparar a estos pacientes con sujetos fumadores con función pulmonar normal.
- 3.
Establecer una cohorte de pacientes jóvenes con EPOC que pueda ser seguida a largo plazo para conocer la historia natural completa de la enfermedad, así como evaluar los parámetros asociados con el desarrollo de la enfermedad durante el seguimiento de la población de riesgo constituida por los controles fumadores para determinar qué variables se asocian con mayor progresión y peor pronóstico.
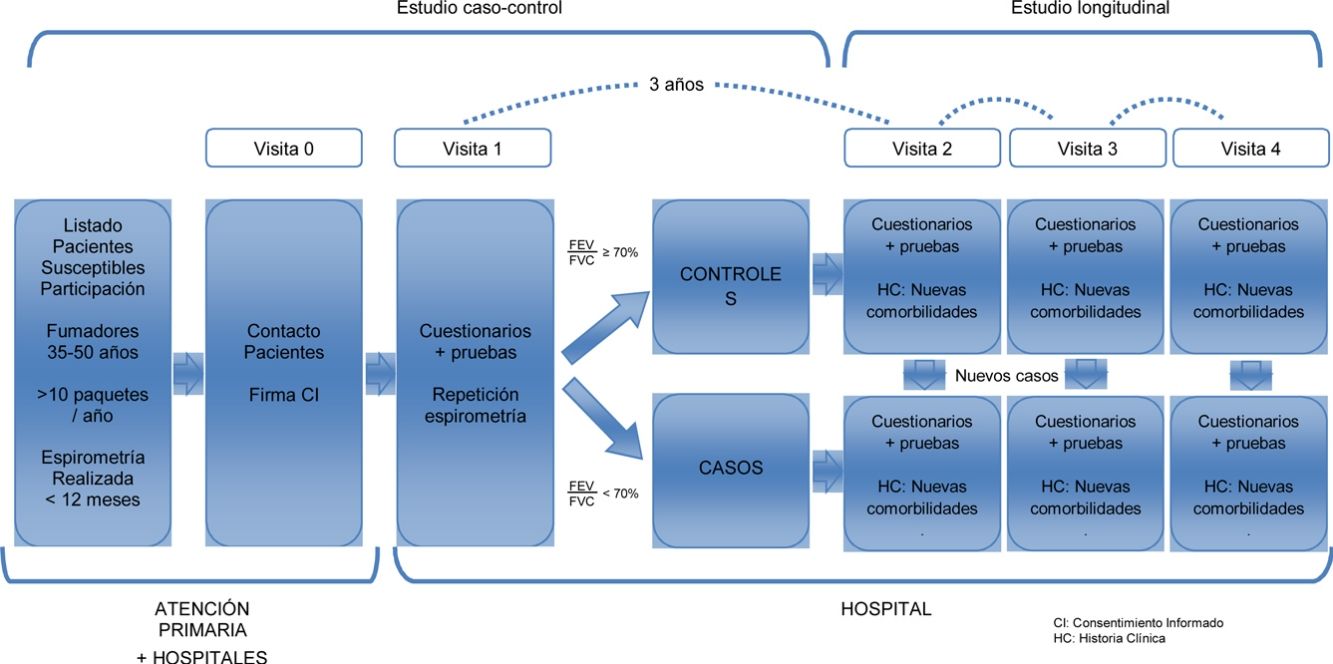
Estudio multicéntrico con 2 fases diferentes. Para caracterizar a una población joven de pacientes con EPOC y comparar a estos pacientes con sujetos fumadores con función pulmonar normal (objetivos 1 y 2) se ha realizado un estudio de casos y controles. En una segunda fase estos mismos sujetos constituyen una cohorte bien caracterizada de sujetos jóvenes, fumadores o exfumadores, con y sin EPOC, para su seguimiento posterior. Esto permitirá estudiar longitudinalmente la evolución de la enfermedad (objetivo 3 [fig. 1]).
Población de estudioLos sujetos fueron seleccionados a partir de los listados de una treintena de centros de atención primaria y 12 hospitales de 8 comunidades autónomas españolas. Las visitas se realizaron en los hospitales. En el anexo 1 se indican los centros e investigadores principales de cada zona.
Selección de participantesEntre marzo de 2015 y marzo de 2017 (24 meses) se reclutó una muestra aleatoria de 311 sujetos (101 casos y 210 controles) a razón de 1:2. Los criterios de inclusión fueron sujetos fumadores o exfumadores (>10 paquetes año), de entre 35-50 años de edad, capaces de realizar una espirometría forzada. Los casos presentaban una alteración ventilatoria obstructiva, con un FEV1/FVC<70%. Los controles presentaban una espirometría normal, con un FEV1/FVC≥70%. Ambos, casos y controles, fueron seleccionados de forma aleatoria de los listados de atención primaria o de consultas externas de los hospitales participantes, por ser individuos jóvenes fumadores. En el caso de no tener una espirometría previa, esta siempre se realizaba en la visita 1, en el hospital, donde se clasificaba al sujeto como caso o control, en función de los resultados de la espirometría.
Los criterios de exclusión para los casos fueron los siguientes: cáncer activo, condiciones que pudieran interferir con un posible futuro seguimiento (cambios frecuentes de residencia, problemas psiquiátricos), enfermedades inflamatorias crónicas o autoinmunes bajo tratamiento, bronquiectasias quísticas o saculares, tuberculosis u otra infección pulmonar activa y enfermedad intersticial pulmonar.
Los criterios de exclusión para los controles fueron los mismos que los casos, y además: diagnóstico previo de asma y/o déficit alfa-1-antitripsina.
En ambos casos los sujetos seleccionados no debían tener síntomas de exacerbación (fiebre, aumento de tos, aumento del volumen de esputo y/o purulencia, rinitis aguda) en las 8 semanas previas a la visita del estudio.
El proyecto fue aprobado por el comité ético de todos los centros participantes. Todos los sujetos recibieron información por escrito sobre los objetivos del estudio y firmaron la hoja de consentimiento informado, con firma independiente para los análisis genéticos y el estudio de seguimiento. Los datos de los participantes fueron anonimizados y tratados de acuerdo a la Ley de protección de datos, según Reglamento (UE) 2016/679 del Parlamento Europeo.
Organización del estudioPara la preparación y asesoramiento del estudio se constituyó un comité científico formado por neumólogos, médicos de atención primaria y epidemiólogos. Además se estableció una alianza estratégica entre el Centro de Investigación Biomédica en Red en Enfermedades Respiratorias (CIBERES), el Centro de Investigación en Epidemiología Ambiental (CREAL, actualmente Instituto de Salud Global de Barcelona [ISGlobal]), el PII de EPOC de SEPAR y el Grupo de Respiratorio de Atención Primaria (GRAP). Se designó un coordinador local responsable en cada hospital de referencia, que estaba en contacto con el responsable local de atención primaria.
SeguimientoLa visita de seguimiento se realizará a los 3 años de la visita basal, a partir de marzo de 2018. En esta visita se repetirán los mismos cuestionarios y pruebas que en la primera, a excepción de la tomografía axial computarizada, y se añadirá la bioimpedancia y un electrocardiograma digitalizado. Se plantea idealmente poder seguir a esta cohorte durante unos 5 o 10 años más.
Variables y procedimientosEn un inicio se recopiló la siguiente información a través de la historia clínica de los sujetos:
- •
Enfermedades crónicas diagnosticadas.
- •
Tratamiento farmacológico actual, confirmado con el sujeto.
- •
Utilización de recursos sanitarios durante el último año: número de ingresos hospitalarios, número de visitas a urgencias y número de consultas médicas ambulatorias.
A continuación, los sujetos eran citados en su hospital de referencia local para completar los siguientes cuestionarios y pruebas (tabla 1):
- •
Cuestionario general, elaborado a partir de diversos cuestionarios validados, previamente utilizados en este tipo de sujetos y entorno, que contenía las siguientes secciones:
- -
Datos sociodemográficos: sexo, lugar y fecha de nacimiento, estado civil y situación laboral.
- -
Early life factors: posibles factores del «inicio de la vida» que se hayan relacionado con el desarrollo de la EPOC en la edad adulta, como infecciones respiratorias graves antes de los 5 años de edad, prematuridad, peso al nacer, hábito tabáquico de la madre durante el embarazo9,25–27.
- -
Enfermedades crónicas diagnosticadas donde se preguntaba a los sujetos por enfermedades o síntomas que pudieran afectar o limitar su práctica de actividad diaria normal.
- -
Tratamiento no farmacológico: utilización de oxigenoterapia, ventilación no invasiva o administración de presión continua en la vía aérea.
- -
Hábito tabáquico: edad de inicio, duración, cantidad y paquetes/año.
- -
Dieta: cuestionario de adherencia a dieta mediterránea, donde una puntuación inferior a 9 indica una baja adherencia a la dieta mediterránea, lo que se ha visto asociado a un mayor riesgo cardiovascular y a un patrón inflamatorio, y que podría estar presente también en pacientes con EPOC28,29.
- -
Cuestionario de actividad física: a partir del cuestionario validado IPAQ (versión corta), que consta de 4 preguntas que se refieren al tiempo que se ha empleado haciendo actividad física en los últimos 7 días30.
- -
Disnea según la escala de disnea modificada del Medical Research Council31,32.
- -
Cuestionario breve COPD-PS validado para el cribado de la EPOC33,34.
- -
Cuestionario CAT (COPD assessment test) para evaluar el estado de salud de los participantes, tanto casos como controles35.
Variables/pruebas a estudio
| Categoría | Variables/pruebas |
|---|---|
| Datos demográficos | Sexo, lugar y fecha de nacimiento |
| Early life factors | Infecciones, prematuridad, peso al nacer, hábito tabáquico de la madre |
| Factores de riesgo | Tabaquismo, adherencia dieta mediterránea, lugar de residencia, exposición laboral |
| Datos clínicos | Síntomas, consumo de recursos sanitarios, comorbilidades, tratamiento farmacológico, CAT, COPD-PS, mMRC, espirometría, pletismografía, DLCO, actividad física, 6MWT |
| Bioquímica | Hemograma (con hemoglobina, hematocrito y fórmula leucocitaria con eosinófilos), fibrinógeno. Bioquímica básica: perfil lipídico, alfa1-antitripsina, PCR |
| Microbiología | Cultivo de esputo |
| Inflamación | interleucina (IL) IL-6, IL-8, TNF-alfa, procalcitonina, amiloide A (SAA), SSD proteína surfactante D (SSD) y proteína inducible por el interferón gamma 10 (IP-10) |
| Genética | Variantes genéticas mediante GWAS |
| Nuevos biomarcadores | Micro-ARN, transcriptómica, proteómica y metabolómica |
| Imagen | TAC de baja radiación |
CAT: COPD Assessment Test; COPD-PS: COPD Population Screening; DLCO: transferencia de monóxido de carbón; mMRC: modified Medical Research Council scale; 6MWT: prueba de la marcha de los 6minutos; PCR: proteína C reactiva.
Además todos los sujetos que participaron en el estudio (casos y controles) realizaron en el hospital las siguientes pruebas:
- •
Exploración física: donde se recogía peso, altura, tensión arterial, frecuencia cardiaca y perímetro de cintura y de cadera.
- •
Prueba de la marcha de 6minutos para medir la capacidad de ejercicio. En todos los centros se siguió estrictamente el mismo protocolo, adaptado de las guías publicadas36.
- •
Pruebas completas de función respiratoria: espirometría forzada y prueba broncodilatadora, pletismografía corporal con volúmenes pulmonares, determinación de la capacidad de transferencia del monóxido de carbono y capacidades inspiratoria y espiratoria.
- •
Todos los procedimientos se estandarizaron de acuerdo con el manual de procedimientos de evaluación de la función pulmonar de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)37,38. Para la prueba broncodilatadora se administraron 400mg de salbutamol empleando aerocámara, de acuerdo con las recomendaciones de GOLD39.
- •
Tomografía computarizada de baja radiación para la evaluación, entre otros, de la presencia de enfisema, bronquiectasias, calcificación coronaria y diámetros vasculares de la arteria pulmonar y aorta.
- •
Cultivo de esputo. Se obtuvo una muestra de esputo espontáneo y la muestra se dividió en 2 partes: una fue inmediatamente congelada a –80°C, para la posterior realización de técnicas microbiológicas y moleculares (incluyendo marcadores de inflamación y remodelado). La otra parte fue procesada con tinción de Murray y cultivo convencional, preferiblemente cuantitativo, de los microorganismos potencialmente patógenos en el laboratorio de microbiología.
- •
Muestra de sangre para determinaciones genéticas y biológicas: en todos los participantes se procedió a la extracción de una muestra sanguínea para una analítica estándar, que se llevó a cabo en cada centro (hemograma, colesterol, triglicéridos, proteínas totales, albúmina, tiempo de protrombina, fibrinógeno, proteína C reactiva, velocidad de eritrosedimentación y valores de alfa-1-antitripsina). También se obtuvieron muestras de suero, plasma y cuerpos formes, que fueron inmediatamente congeladas a –80°C para el análisis de biomarcadores como:
- -
Marcadores de inflamación en sangre: interleucina (IL) IL-6, IL-8, TNF-alfa, procalcitonina, amiloide A, SSD proteína surfactante D y proteína inducible por el interferón gamma 10.
- -
Marcadores genéticos: se realizará un estudio de asociación amplia del genoma (GWAS) para evaluar la presencia de variantes genéticas previamente implicadas en la susceptibilidad a la enfermedad, a la vez que descubrir nuevas asociaciones genéticas con diferentes fenotipos/subtipos de la enfermedad. Se utilizará ADN de células sanguíneas extraídas en el momento de la inclusión.
- -
Nuevos biomarcadores: estudios de micro-ARN, transcriptómica, proteómica y metabolómica.
Se llevó a cabo un control de calidad de la recogida de datos en los diferentes centros participantes, tanto previo al inicio del estudio con el entrenamiento de los responsables de la recogida de datos, antes de cada una de las fases, como mediante la creación de una base de datos en formato online. Esta base de datos incorpora en su diseño la definición de intervalos para cada una de las variables.
Tamaño de la muestraEl cálculo del tamaño muestral se calculó con el programa GRANMO 7.1040 tomando diversas variables como la FEV1 (en porcentaje y en litros), el índice de masa corporal o la distancia recorrida durante la prueba de la marcha como medidas resultado. Los cálculos se basaron en datos descriptivos obtenidos de estudios con pacientes EPOC de la misma área geográfica41. También se tuvieron en cuenta estudios que recogían información sobre la evolución del FEV1 en diversos tipos de pacientes42,43. Así pues, para el seguimiento longitudinal de los participantes, aceptando un riesgo alfa de 0,05, un riesgo beta inferior al 0,10, en un contraste bilateral, y asumiendo una tasa de pérdidas de seguimiento del 15%, se necesitarían un mínimo de 99 sujetos en cada grupo para identificar una diferencia estadísticamente significativa entre casos y controles igual o superior a 300ml en la variable FEV1.
Plan de análisis estadísticoEn un inicio se realizará un estudio descriptivo de todas las variables incluidas. Los resultados de las variables continuas se presentarán como media, desviación estándar y número de casos válidos. Para las variables categóricas se utilizará el recuento de casos por cada categoría y la frecuencia relativa al total de respuestas.
Además, se describirán muy detalladamente las características de los pacientes con EPOC y se compararán con los sujetos del grupo control mediante un análisis bivariante. Por último se realizará un modelo de regresión logística para observar qué variables se encuentran asociadas con el desarrollo de la EPOC en pacientes jóvenes.
En todas las pruebas estadísticas el valor de significación estadística será de 0,05. Los análisis estadísticos serán realizados utilizando Stata (www.stata.com).
DiscusiónEl proyecto EARLY COPD pretende caracterizar a una población de pacientes jóvenes con EPOC de forma multidimensional y compararla con sujetos fumadores con función pulmonar normal. Además, se quiere establecer una cohorte de pacientes jóvenes con EPOC que pueda ser seguida a largo plazo, para ayudar a conocer mejor la historia natural completa de la enfermedad. En la etiopatogenia de la EPOC se interrelacionan elementos tanto genéticos como ambientales. Son varios los mecanismos implicados en el desarrollo de la enfermedad que pueden interactuar en un paciente: el pobre desarrollo pulmonar, la presencia de infecciones en la infancia, la atopia, la respuesta inflamatoria crónica de las vías aéreas, el papel de las infecciones recurrentes durante las agudizaciones, el desequilibrio entre la actividad proteolítica y antiproteolítica, que lleva a la destrucción del tejido, entre otros. El estudio EARLY COPD pretende conocer mejor la importancia relativa de estos diferentes mecanismos patogénicos en el desarrollo de la historia natural de la enfermedad. Asimismo, el hecho de seguir a una población de riesgo (controles fumadores) tiene como objetivo determinar qué variables se asocian con el posterior desarrollo de la EPOC. Por último, se quiere identificar diferentes biomarcadores como potenciales indicadores de la progresión de la enfermedad en su fase temprana, lo que será también de vital importancia para avanzar en el diagnóstico precoz. Los resultados de biomarcadores obtenidos en este estudio se compararán con los obtenidos con similar metodología en el estudio BIOMEPOC, que corresponde a una fase relativamente avanzada de la enfermedad.
Como puntos fuertes cabe destacar que este proyecto es el resultado de una alianza estratégica entre diversos centros expertos en epidemiología y salud respiratoria, uniendo además a profesionales del ámbito hospitalario y de la atención primaria. Es un proyecto en el que participan diversos centros sanitarios de todo el territorio español (con un mismo protocolo estandarizado), lo que permite asumir que sus resultados son bastante representativos del territorio estudiado.
Entre las posibles limitaciones del estudio se halla, en primer lugar, la gran dificultad observada a la hora de reclutar casos que cumplieran con los criterios de inclusión-exclusión. El hecho de necesitar a pacientes jóvenes con EPOC dificultó mucho el reclutamiento debido a la baja prevalencia de la enfermedad estudiada en población joven. Otra posible limitación estaría relacionada con el lugar de reclutamiento de nuestros participantes, ya que en un inicio se planteó el reclutamiento de pacientes con EPOC desde atención primaria (pacientes de entre 35 y 50 años que acuden al centro de salud), pero finalmente, y debido a las dificultades encontradas en atención primaria para la selección, se pasó a reclutar también pacientes en el ámbito hospitalario. Esto también podría haber modificado la tipología de los pacientes estudiados, siendo estos de una mayor gravedad.
En resumen, el estudio EARLY COPD permitirá mejorar el conocimiento de la historia natural de la EPOC y sus determinantes en fases iniciales de la enfermedad, para poder diseñar intervenciones dirigidas a modificar su pronóstico. Además, el objetivo más específico de identificar diferentes biomarcadores como potenciales indicadores de la progresión de la enfermedad en la EPOC temprana será también de gran importancia para ayudar en el diagnóstico y tratamiento precoz de esta enfermedad.
FinanciaciónEstudio financiado en parte con un contrato de colaboración entre Boehringer-Ingelheim y CIBERES. Estudio incluido en el PII de EPOC de SEPAR.
Conflicto de interesesEn los últimos tres años, Alicia Borras Santos ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): Boehringer Ingelheim, Esteve y Novartis. En los últimos tres años, Borja G. Cosío ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline, Menarini, Novartis, Rovi, Teva y Zambón.
Jose Luis López-Campos ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): Almirall, AstraZeneca, Bayer, Boehringer Ingelheim, Cantabria Pharma, Chiesi, Esteve, Faes, Ferrer, Gebro, GlaxoSmithKline, Grifols, Menarini, MSD, Novartis, Pfizer, Rovi, Teva y Takeda. En los últimos tres años, Miguel Román Rodríguez ha recibido honorarios por impartir conferencias, asesoría científica o participación en estudios clínicos para (orden alfabético): AstraZeneca, Bial, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Menarini, Novartis, Rovi y Teva. En los últimos tres años, Sergi Pascual Guárdia ha recibido honorarios por impartir conferencias o participación en estudios clínicos (orden alfabético): Almirall, AstraZeneca, Boehringer Ingelheim, Esteve, Ferrer, GlaxoSmithKline, Menarini, Novartis, Teva. En los últimos tres años, Joaquim Gea ha recibido honorarios por impartir conferencias y asesoría científica de (orden alfabético): AstraZeneca y Boehringer Ingelheim. También ha recibido ayudas no restringidas para investigación o docencia de ALK, Astra-Zeneca, Boehringer Ingelheim, Chiesi, Menarini, Mundipharma y Novartis. En los últimos tres años, Ciro Casanova ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Gebro, GlaxoSmithKline, Menarini, Novartis, Rovi y Teva. JJ Soler-Cataluña declara haber recibido honorarios por impartir conferencias, asesoría científica o participación en estudios clínicos por parte de Air Liquide, AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Ferrer, GSK, Menarini, Mundipharma, Novartis, Rovi, Sandoz, Teva y Zambón. En los últimos tres años, G. Peces-Barba ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline y Menarini. En los últimos tres años, Salud Santos ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Laboratorios Ferrer, GlaxoSmithKline, Gebro Pharma, Menarini, Novartis, Pfizer y Rovi.En los últimos tres años, Pedro J. Marcos ha recibido honorarios por impartir conferencias, asesoría científica o participación en estudios clínicos para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, Gebro, GlaxoSmithKline, Menarini, MSD, Mundipharma,Novartis, Rovi, Roche,Sandoz y Teva. En los últimos tres años, Rosa Faner ha recibido honorarios por impartir conferencias o asesoría científica (orden alfabético): Chiesi, GlaxoSmithKline y MSD. En los últimos tres años, Alvar Agusti ha recibido honorarios por impartir conferencias, asesoría científica o participación en estudios clínicos para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline, Menarini, Novartis, Nuvaira y Teva. El resto de autores declaran no tener conflicto de intereses.
Grupo de trabajo del estudio EARLY COPD:
- -
Hospital Son Espases (Mallorca): Borja Garcia-Cosio Piqueras, Rocío Cordova Diaz, María Magdalena Pan Naranjo, Joan Palmer Sancho y Miguel Román Rodríguez.
- -
Hospital Clínic (Barcelona): Alvar Agustí, Rosa Faner Canet, Joan Albert Barberà, Josep Roca Torrent, Yolanda Torralba Garcia, Jorge Moises Lafuente, Anna Maria Pedro Pijoan, Amparo Hervas Docón, Carmen Herranz y Núria Sanchez Ruano.
- -
Hospital del Mar (Barcelona): Joaquim Gea Guiral, Diego A. Rodríguez Chiaradía, Anna Rodó-Pin, Clara Martín-Ontiyuelo, Mireia Admetlló, Concepción Ballano Castro, Laura Gutiérrez Martín, José Ignacio Aoiz Linares, Sergi Pascual-Guardia y Marta Mourelo Cereijo.
- -
Fundación Jiménez Díaz (Madrid): Germán Peces-Barba Romero, José Fernández Arias, Carolina Gotera Rivera, Manuel Martin Bernal, Guillermo Gallardo Madueño, Andrés Alcázar Peral, Carmelo Palacios Miras, María Teresa Pinedo Moraleda, María Belén Torres Labandeira, Mercedes Colomo Rodríguez, María Concepción Rodríguez Gallego, Carmen Lobon Agundez, Mónica Nácher Conches, María José Mansilla y Rosario Serrano Martín.
- -
Hospital 12 Octubre (Madrid): Carlos J. Álvarez Martínez, Marta Padilla Bernáldez y Jesús Molina París.
- -
Hospital Parc Taulí (Sabadell): Laura Vigil Giménez, Eduard Monsó Molas, Laia Seto Gort, Montserrat Baré Mañas y Anna María Fabra Noguera.
- -
Hospital Virgen del Rocío (Sevilla): José Luis López Campos, Carmen Calero Acuña y Laura Carrasco Hernández.
- -
Hospital Universitario de Bellvitge (Hospitalet de Llobregat, Barcelona): Salud Santos Perez, Montserrat Navarro, Elisabeth Serra, Ferran Ferrer Keysers, Damaris Batallé, M. Dolores Peleato Catalan, Albert Dorca y Javier Burgos, Marina Bosch Ventura y José Carlos Ruibal
- -
Hospital Arnau de Vilanova (Valencia): Juan José Soler-Cataluña, Noelia González García y Lourdes Sánchez Sánchez
- -
Hospital Universitario Central de Asturias (Oviedo): Cristina Martínez González, Amador Prieto Fernández y Susana Martínez González
- -
Hospital Candelaria (Canarias): Ciro Casanova Macario y Delia Mayato
- -
Hospital Universitario de A Coruña: Pedro J. Marcos Rodríguez, Luis Domínguez Juncal, Rosario Timiraos Carrasco y Rosa García Palenzuela.