La oxigenoterapia, como todos los tratamientos que dependen de la tecnología, no para de evolucionar. No hay dudas respecto a su eficacia en el tratamiento de la insuficiencia respiratoria aguda y crónica en diferentes escenarios clínicos. Sin embargo, su dosificación terapéutica no es tan estricta como la de otros tratamientos. El uso de flujos más altos de lo necesario y por periodos demasiado prolongados, derivados de la percepción de «terapia salvavidas con pocos efectos secundarios» por parte del clínico, ha conllevado un uso bastante liberal de este medicamento, pese a la evidencia de que tanto su uso en exceso como su ajuste subóptimo tienen efectos nocivos. La titulación de la oxigenoterapia ha demostrado efectos beneficiosos en los pacientes. Tradicionalmente, se ha realizado de forma manual. Recientemente, se han desarrollado nuevos dispositivos para ajustar automáticamente las tasas de flujo de oxígeno a las necesidades de cada paciente, con el objetivo de mantener las saturaciones de oxígeno estables. Estos sistemas de suministro de oxígeno de circuito cerrado tienen el potencial de reducir el error médico, mejorar la morbimortalidad y reducir los costes del cuidado. Dar a conocer estos nuevos avances tecnológicos ayudará a concienciar a la comunidad médica de los riesgos del uso inadecuado del tratamiento con oxígeno. Este trabajo pretende ser una puesta al día de las recientes novedades en relación con la titulación de la oxigenoterapia.
Oxygen therapy, like all technology-based treatments, is continuously evolving. There are no doubts as to its effectiveness in the treatment of acute and respiratory failure in different clinical scenarios. However, the dosing guidelines for oxygen therapy are not as strict as for other treatments. The use of higher than necessary flows over excessively long periods, derived from the clinician's perception of it as a ‘life-saving treatment with few side effects’, has led to a rather liberal use of this intervention, despite evidence that overuse and suboptimal adjustment can be harmful. The titration of oxygen therapy, which is traditionally performed manually, has been shown to be beneficial. Recently, new devices have been developed that automatically adjust oxygen flow rates to the needs of each patient, in order to maintain stable oxygen saturation levels. These closed-loop oxygen supply systems can potentially reduce medical error, improve morbidity and mortality, and reduce care costs. Familiarizing the medical community with these technological advances will improve awareness of the risks of the inappropriate use of oxygen therapy. The aim of this paper is to provide an update of recent developments in oxygen therapy titration.
La oxigenoterapia, como todos los tratamientos que dependen de la tecnología, no para de evolucionar. Se define como el uso terapéutico del oxígeno (O2) administrado a concentraciones mayores de las del aire ambiente para tratar o prevenir los efectos de la hipoxemia1-3. Su administración persigue mantener una oxigenación estable fuera del rango de la insuficiencia respiratoria (presión arterial de O2 [PaO2]>60mmHg, saturación arterial de oxígeno medida por pulsioximetría [SpO2]>90%). Es utilizada ampliamente en diferentes ámbitos de cuidados para pacientes con problemas respiratorios agudos y crónicos, en domicilio y en el hospital4. Aunque el O2 es considerado un medicamento por las autoridades sanitarias, su uso generalizado y la consideración de que es un tratamiento benigno y sin complicaciones han condicionado que nunca se haya prestado demasiada importancia a su dosificación y efectos secundarios, a pesar de la evidencia científica disponible5,6. Como medicamento, el O2 debería ser utilizado con el mismo rigor que cualquier otro fármaco, siendo necesario establecer de forma fundada sus indicaciones y posología. Solo así alcanzaríamos los objetivos principales de esta terapia: mejorar la supervivencia, corregir la hipoxemia de forma adecuada y evitar los riesgos de una oxigenación excesiva. Abordaremos en la presente revisión por qué es necesaria la titulación de la oxigenoterapia, ventajas de realizar la titulación de forma automática o manual, qué características debe tener un dispositivo de titulación automática, de cuáles disponemos en el mercado y qué evidencia los soportan, finalizando con las limitaciones y carencias de los equipos actuales.
Por qué es necesaria la titulación de la oxigenoterapiaTanto la hipoxemia como la hiperoxia resultante de la exposición a flujos de O2 más altos de lo necesario pueden tener consecuencias graves para los pacientes7,8. Disponemos de datos que avalan estas afirmaciones en niños y en adultos, en situaciones de insuficiencia respiratoria aguda y crónica.
En la población neonatal, la evidencia clínica de los efectos indeseables de la oxigenoterapia es amplia. Un aporte de O2 insuficiente tiene efectos deletéreos en el desarrollo neurológico y en la circulación pulmonar9-15, y un aporte excesivo se relaciona con un daño oxidativo sistémico en diferentes órganos16-19. Por ello, mantener una correcta oxigenación es imprescindible. Tradicionalmente la titulación del tratamiento se ha realizado manualmente, ajustando los flujos de O2 para mantener la SpO2 en el rango deseado. Sin embargo, se ha comprobado en el ámbito de la pediatría que este método mantiene a los pacientes más de la mitad del tiempo con SpO2 por debajo del rango y al menos un tercio del tiempo por encima. Esto podría relacionarse tanto con la capacidad de respuesta del personal sanitario a las fluctuaciones de SpO2 como con la excesiva tolerancia de los niños a altos niveles de SpO220-22.
En adultos, el objetivo de la oxigenoterapia es también evitar las consecuencias de la hipoxemia, pero se olvidan con más frecuencia, si cabe, los efectos dañinos de la hiperoxia, a pesar de ser bien conocidos23.
En pacientes con insuficiencia respiratoria aguda, la hipoxemia se ha asociado con un aumento de la mortalidad tras un infarto de miocardio y en pacientes con traumatismos craneoencefálicos graves24-26. También conlleva un incremento de la mortalidad en pacientes ingresados en unidades de críticos (UCI) y un mayor número de complicaciones en el periodo postoperatorio27,28. En pacientes con exacerbación de enfermedad pulmonar obstructiva crónica (EPOC), en quienes los efectos de la hipoxemia son particularmente importantes y ampliamente conocidos, también se ha comprobado que la prescripción de la oxigenoterapia es subóptima29,30, manteniendo los pacientes una oxigenación baja amplios periodos de tiempo31.
La hiperoxia supone igualmente un riesgo mayor para los pacientes con insuficiencia respiratoria aguda; no por ser desconocido, sino por ser minimizado por los profesionales sanitarios6,7. Su presencia se asocia, independientemente de la hipoxemia, a un aumento del riesgo de muerte tras una parada cardiorrespiratoria y a una mayor mortalidad en pacientes con traumatismos craneoencefálicos graves25,32,33. Casi el 25% de los pacientes con exacerbación de EPOC están expuestos a periodos importantes de hiperoxia, lo que se relaciona con una mayor mortalidad y peores resultados clínicos, evitables si ajustamos con precisión los flujos de O2 administrados34-36. A pesar de toda esta evidencia, la realidad clínica es que la gran mayoría de los pacientes reciben O2 a flujos elevados durante las exacerbaciones de su EPOC, con el mayor riesgo de inducción de acidosis respiratoria que ello conlleva37.
Los pacientes con insuficiencia respiratoria crónica en situación estable es frecuente que presenten hipoxemia durante periodos prolongados de tiempo, siendo esta la principal responsable de una reducción de la tolerancia al ejercicio y causando múltiples y conocidas complicaciones (hipertensión pulmonar, insuficiencia cardíaca derecha, policitemia o aumento de la mortalidad)38,39. El uso de oxigenoterapia continua domiciliaria (OCD) ha demostrado en pacientes con EPOC efectos beneficiosos en supervivencia, calidad de vida y tolerancia al ejercicio2,40-42. Y por analogía, su indicación se ha trasladado a otras enfermedades pulmonares crónicas43-47. El ajuste de la OCD suele realizarse con flujos fijos, lo que no siempre es óptimo48, ya que las necesidades de los pacientes varían a lo largo del día. Más de la mitad presentan desaturación de O2 durante sus actividades habituales49,50.
A la vista de estos datos, adaptar la oxigenoterapia a los requerimientos de los pacientes es una necesidad. La evidencia disponible nos indica que un uso apropiado de la oxigenoterapia es un factor importante que influye en los resultados clínicos51 y que una prescripción basada en la monitorización continua puede aumentar significativamente el porcentaje de tiempo con una SpO2 adecuada, disminuyendo también la cantidad de O2 prescrita52. Objetivos imprescindibles en el ajuste de la oxigenoterapia deberían ser:
- •
Optimizar la terapia y la seguridad, minimizando al máximo el número de episodios de hipoxemia e hiperoxia. La prescripción debería establecerse con el objetivo de alcanzar un rango de saturación, en lugar de establecer flujos de O2 altos independientemente de los niveles de O2 arterial35.
- •
Personalizar el flujo de O2 a las necesidades reales de los pacientes en sus actividades diarias. Normalmente el flujo de O2 se selecciona de forma que no siempre cubre las necesidades del paciente, pudiendo ser insuficiente cuando la demanda aumenta53.
- •
Optimizar el consumo de O2 para aumentar el tiempo de uso de los dispositivos portátiles, cuyas limitaciones tecnológicas precisan de medidas para adecuar la terapia a la vida real.
- •
Mejorar los resultados en morbimortalidad.
- •
Reducir los costes excesivos por un uso inadecuado.
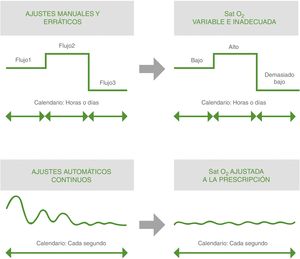
La realidad muestra que estos objetivos son difíciles de lograr en la práctica clínica54. Como ya se ha mencionado, el método tradicional de titulación manual tiene importantes limitaciones. Se necesita personal entrenado tanto en el hospital como en el domicilio. Al personal sanitario le consume un tiempo especialmente relevante en unidades de críticos, y al paciente puede suponerle un aumento de las cargas, con el consiguiente deterioro de la adherencia. Además, solo consigue un ajuste subóptimo con frecuentes episodios de infra- y sobredosificación, lo que disminuye su eficiencia y pone en riesgo la seguridad de los pacientes.
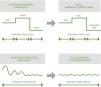
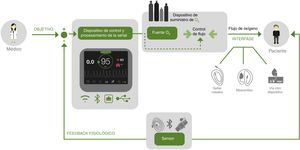
Titulación automática de oxígenoTodos estos hallazgos, inquietudes y limitaciones han facilitado que, en los últimos años, se desarrollen dispositivos médicos, fisiológicos, controlados, de circuito cerrado, para titular automáticamente el flujo de O2. En general, se definen como dispositivos que utilizan uno o más sensores para cambiar una variable fisiológica de forma automática (el flujo de O2) y mantener así el nivel de oxigenación determinado para cada paciente55 (fig. 1). Un equipo de titulación automática de O2 consta de 3 partes: un sistema de monitorización de la oxigenación, un algoritmo que determina los ajustes del flujo de O2 para alcanzar el nivel adecuado de dicha oxigenación y una fuente de suministro de O253.
- 1)
Monitorización del grado de oxigenación. Se pueden utilizar diferentes sistemas de monitorización dependiendo de la variable elegida. Los electrodos de PaO2 permanentes y los de presión de O2 transcutáneos (PtcO2) tienen un uso limitado por la necesidad de un catéter invasivo en los primeros y por necesitar frecuentes calibraciones los segundos. Es por ello que la SpO2 se ha convertido en el sistema de monitorización preferido al ser un método no invasivo que no requiere calibración.
- 2)
Algoritmos. Los algoritmos que determinan el ajuste del flujo de O2 para mantener las cifras de SpO2 establecidas comparan de forma continua o intermitente la SpO2 medida con el objetivo establecido y ajustan el flujo de O2 en función de los datos obtenidos. Un reto importante es determinar cuándo la hipoxemia es un evento real y cuándo se debe a artefactos de movimiento o a una señal deficiente del pulsioxímetro, para evitar sobredosificación de O2 e hiperoxia. Además, la respuesta a la hipoxemia debe ser adecuada para corregirla, pero sin producir hiperoxia de rebote. Los algoritmos son específicos de cada dispositivo y difícilmente comparables, por lo que es necesario validar todos ellos clínicamente antes de su uso.
- 3)
Fuente de O2. El O2 administrado puede provenir de una toma de pared o botella de O2 comprimido, en general, de cualquier fuente cuyo flujo pueda ser controlado por un automatismo externo. El gas enriquecido de O2 puede llegar finalmente al paciente a través de ventiladores mecánicos, dispositivos de presión positiva continua en la vía aérea (CPAP), equipos de alto flujo o dispositivos de oxigenoterapia como las gafas nasales. Las mascarillas Venturi no son válidas para la autotitulación de O2, al depender la fracción de O2 inspirada (FiO2) de la mayor o menor regulación de la abertura de la mascarilla y no del flujo suministrado. Los ventiladores y equipos de alto flujo deben tener mezcladores precisos y resistentes que soporten los cambios de flujo de O2 requeridos.
El modo de funcionamiento es fácil e intuitivo. La señal de pulsioximetría es analizada de forma continua por la unidad central, que aumentará o reducirá el flujo de O2 según convenga para mantener el nivel de SpO2 prefijado.
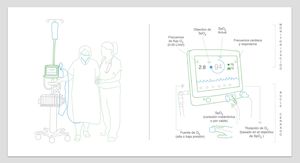
Estos dispositivos tienen el potencial de optimizar la oxigenoterapia, reduciendo el riesgo de infra- y sobredosificación y la sobrecarga asistencial, mejorando los resultados clínicos de los pacientes. Frente al ajuste errático logrado con la titulación manual, estos consiguen cifras de oxigenación adecuadas y sostenidas en el tiempo mediante ajustes continuos y automatizados del flujo de O253 (fig. 2). Los resultados de un reciente metaanálisis, en el que se muestra cómo estos dispositivos aumentan el tiempo en que la SpO2 se mantiene en el rango predefinido por el clínico en comparación con la titulación manual56, abren nuevas posibilidades en el mundo de la titulación de la oxigenoterapia: la titulación automática o autotitulación.
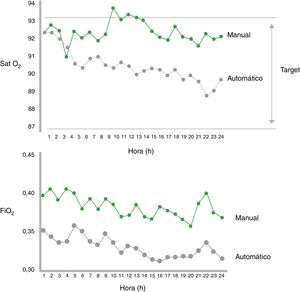
Evidencias clínicas en autotitulación de la oxigenoterapiaEstudios en neonatosLos primeros estudios sobre titulación automática tuvieron lugar en neonatos que recibían ventilación mecánica o CPAP en un entorno de cuidados críticos. Dichos estudios evaluaron la eficacia de los sistemas de titulación automática frente a la titulación manual (estándar o con personal dedicado), analizando el mantenimiento de la oxigenación en el rango de SpO2 prefijado57-63. Los sistemas de titulación automática fueron más efectivos que la titulación manual en el control de la SpO2 y con tiempos de hiperoxia menores62,63 (fig. 3). Además, objetivaron una notable disminución de las cargas de trabajo del personal. En la tabla 1 se muestran las características de los principales estudios en neonatos.
Características de los principales estudios en neonatos
| Estudios en neonatos | % tiempo dentro del rango | % tiempo por encima del rango | % tiempo por debajo del rango | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Primer autor | Año | Soporte | Monitor | Objetivo | Modo manual | Titulación automática | Titulación manual | Titulación automática | Titulación manual | Titulación automática | Titulación manual |
| Morozoff57 | 1992 | VM | SpO2 | 92% | Rutinario | Disminución en DS de 6/8 | ND | 23 | 39 | 27 | 32 |
| Sun58 | 1997 | VM | SpO2 | Set±3% | Rutinario | 72 | 58 | ND | ND | ND | ND |
| Claure60 | 2001 | VM | SpO2 | 88-96% | Con dedicación | 75 | 66 | 10 | 15 | 17 | 19 |
| Urschitz61 | 2004 | CPAP | SpO2 | 87-96% | Rutinario | 91 | 82 | ∼1,3a | ∼4,9a | ∼3,2a | ∼6,7a |
| Con dedicación | 91 | ∼1,8a | ∼3,9a | ||||||||
| Morozoff59 | 2009 | VM | SpO2 | 90-96% | Rutinario | 73 | 57 | ||||
| Claure62 | 2009 | VM | SpO2 | 88-95% | Rutinario | 58 | 42 | 9,3 | 31 | 33 | 27 |
| Con dedicación | ND | 16 | 4,6 | 6,6 | |||||||
| Claure63 | 2011 | VM | SpO2 | 87-93% | Rutinario | 40 | 32 | 21 | 37 | 32 | 23 |
| 75-98% | ND | ND | 0,7 | 5,6 | 4,7 | 5,4 | |||||
Modo manual rutinario: control de la FiO2 según cuidados estándar.
Modo manual con dedicación: personal de enfermería dedicado a tiempo completo al control de la FiO2.
CPAP: presión positiva continua en la vía aérea; DS: desviación estándar; ND: no disponible; SpO2: saturación arterial de oxígeno por pulsioximetría; VM: ventilación mecánica.
En adultos, los primeros estudios se desarrollaron también en unidades de cuidados críticos, primer ámbito de aplicación de esta tecnología, generalmente en el contexto de pacientes ventilados64. Posteriormente, en los últimos 10 años la investigación se ha orientado al desarrollo de dispositivos autónomos, que permitieran su uso en pacientes menos graves en otras áreas del hospital, como las plantas de hospitalización y los servicios de urgencias, e incluso fuera del ámbito hospitalario. Se han comparado sistemas de titulación automática con modos convencionales de administración de O2 en pacientes EPOC con OCD durante sus actividades habituales65 y durante el ejercicio66, y en voluntarios sanos a quienes se les indujo hipoxemia48. Los dispositivos de titulación automática obtuvieron mejores resultados que la titulación manual convencional o la suplementación de O2 a flujo fijo continuo, en tiempo en rango de SpO2 y tiempo de hipoxemia o hiperoxia, con un importante ahorro de O2. Un resumen de los estudios más importantes en adultos se muestra en la tabla 2.
Características de los principales estudios en adultos
| Estudios en adultos | % tiempo dentro del rango | % tiempo por debajo del rango | % tiempo por encima del rango | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Primer autor | Año | Soporte | Aplicación | Rango | Titulación automática | Titulación manual | Titulación automática | Titulación manual | Titulación automática | Titulación manual |
| Johannigman64 | 2009 | VM | Cuidados intensivos | SpO2 92-96% | 83 | 33 | 1,0 | 1,9 | 16,6 | 60,1 |
| Rice65 | 2011 | Cánula oxígeno con sistema de ahorro | Domicilio | SpO2≥90% | 71 | 41 | 22 | 23,5 | 7 | 35 |
| Cánula oxígeno flujo constante | 50 | 22 | 28 | |||||||
| Cirio66 | 2011 | Cánula oxígeno | Ejercicio | SpO2 94% | ND | ND | 19 | 38 | 19 | 38 |
| Lellouche48 | 2012 | Cánula oxígeno flujo constante | Hipoxia inducida | SpO2 92-96% | 66,5 | 36,8 | 17 | 27,3 | 14,5 | 39 |
| Cánula con aire | 26 | 67 | 4,1 | |||||||
| Lellouche71 | 2016 | Cánula oxígeno | Hospital | Predefinida por el clínico para cada paciente (∼90%) | 81,2 | 51,3 | 0,2 | 2,3 | 1,5 | 10,4 |
| Lellouche68 | 2016 | Cánula oxígeno | Ejercicio | SpO2 92-96% | 62,3 | 42,9 | 21,4 | 30,4 | 14,4 | 26,7 |
| Cánula con aire | 41,6 | 51,4 | 6,9 | |||||||
| L’Her73 | 2017 | Cánula oxígeno | Urgencias | SpO2 92-96% | 81,3 | 51,8 | 3,2 | 5,1 | 4,2 | 21,6 |
| Huynh74 | 2017 | Cánula oxígeno | Hospital | SpO2 90-92% | ND | ND | 0,4 | 4 | 22 | 57 |
| SpO2 90-97% | ND | 1,2 | 30 | |||||||
ND: no disponible; SpO2: saturación arterial de oxígeno por pulsioximetría; VM: ventilación mecánica.
Actualmente solo hay 3 dispositivos autónomos comercializados y validados en adultos: AccuO2® (Optisat Medical, Minneapolis, EE.UU.) (fig. 4); el O2 Flow Regulator® (Dima Italia Srl, Bolonia, Italia (fig. 5); y el FreeO2® (Oxynov, Québec, Canadá) (fig. 6).
- a)
O2 Flow Regulator®. Este dispositivo fue validado por Cirio y Nava66 en pacientes con EPOC que recibían oxigenoterapia a largo plazo, ajustando el O2 durante el ejercicio para mantener una SpO2 del 94%. Los pacientes realizaron de forma aleatoria 2 ejercicios en bicicleta durante 15min con carga constante. Los autores demostraron que con el sistema de titulación automática los pacientes mostraron una mejor oxigenación, reduciéndose la carga de trabajo de los terapeutas respiratorios. Hay dos modelos en el mercado, que pueden regular un flujo máximo de 10l/min (modelo 106A) y 20l/min (modelo 106A Plus) respectivamente.
- b)
AccuO2®. Este dispositivo fue validado por Rice et al.65 también en pacientes con EPOC. Los autores asignaron aleatoriamente a 28 pacientes EPOC con OCD a utilizar 3 sistemas de administración de O2 (flujo continuo, dispositivo de ahorro de O2 CR50® y AccuO2®) durante 8h al día, 2 días consecutivos en su domicilio. Veintidós pacientes completaron los 3 brazos del estudio. Comparado con el O2 a flujo continuo o el CR50®, el AccuO2® mantuvo valores de SpO2 más cerca del objetivo. Las variaciones de SpO2 también fueron menores con el AccuO2® y la reducción en el consumo de O2 fue incluso mayor que con el CR50®.
- c)
FreeO2®. Este dispositivo es el que goza de mayor evidencia científica y es distribuido en España por Linde Médica. El modelo disponible en el mercado toma el O2 directamente de pared y puede alcanzar flujos de 20l/min. Pronto aparecerá un nuevo modelo con capacidad de alcanzar flujos de 50l/min. Tiene 3 modos operativos: neonatos (máximo 5l/min), niños (máximo 10l/min) y adultos (máximo 20l/min). El clínico selecciona en la pantalla de tratamiento qué SpO2 quiere mantener y, si desea, puede limitar un flujo máximo. El equipo irá regulando el flujo aumentándolo o reduciéndolo, para mantener la SpO2 prefijada. En caso de pérdida de señal, el equipo mantiene el flujo que liberaba previamente a la pérdida, como mecanismo de seguridad. Puede funcionar también a flujo continuo o simplemente ser usado como un pulsioxímetro. Dispone de alarmas de SpO2, flujo y frecuencia cardíaca. Presenta los datos en la pantalla en tiempo real y en tendencias de hasta 72h.
El FreeO2® fue originalmente validado por Lellouche y L’Her48 en un estudio piloto realizado en 10 voluntarios sanos a quienes se les inducía hipoxemia experimental moderada. Los sujetos fueron aleatorizados a recibir aire con flujo continuo a 1,5l/min, O2 con flujo continuo a 1,5l/min o titulación automática con FreeO2®. El sistema FreeO2® fue más eficiente para mantener el objetivo de SpO2 y aseguró una disminución significativa en las tasas de hipoxemia grave e hiperoxia, con menor consumo de O2 que en el brazo de flujo continuo.
Estos autores han continuado validando posteriormente este dispositivo en diferentes situaciones clínicas67. En una evaluación del efecto del dispositivo FreeO2® en pacientes con EPOC moderada sin criterios de OCD que desaturaban al ejercicio (endurance shuttel test), este consiguió una mejor oxigenación (rango prefijado SpO2 del 92-96%) con un menor número de episodios de desaturación (SpO2<88%) en comparación con el flujo de O2 constante a 2l/min y el aire comprimido68. La mejoría de la tolerancia al ejercicio se obtuvo tanto con la titulación automática como con el O2 a flujo constante, y aunque la distancia recorrida mejoró un 17% con FreeO2®, la diferencia no fue estadísticamente significativa. Además, para conseguir estos resultados con FreeO2® fueron necesarios flujos de O2 más altos que los utilizados habitualmente (>5l/min en la mayoría de pacientes y hasta 10l/min en uno de ellos). Esto genera dudas en cuanto a su aplicabilidad clínica, tanto por el riesgo de hipercapnia asociado —no objetivado en el estudio por la exposición limitada a la hiperoxia— como por la ausencia de dispositivos que suministren estos flujos en los dispositivos ambulatorios actuales.
Vivodtzev et al.69, en un estudio realizado en pacientes EPOC hipercápnicos con OCD, demostraron que la titulación automática con FreeO2® durante un test de marcha se asociaba a una mejora significativa en la SpO2 sin hipercapnia asociada, pero no con un aumento significativo de los metros caminados. Estos resultados, sumados a los del estudio LTOT70, en los que los autores concluyen que el uso de O2 suplementario no proporciona ningún beneficio clínicamente significativo en pacientes con desaturación moderada en reposo o al ejercicio, nos hacen ver que quedan demasiados interrogantes en el campo de la oxigenoterapia portátil que esperamos puedan ser resueltos en un futuro próximo con nuevas investigaciones.
En pacientes con exacerbación de EPOC, el grupo canadiense ha validado el dispositivo FreeO2® en dos situaciones: en pacientes ingresados en una planta de hospitalización70 y a su llegada al servicio de urgencias71. En el primer escenario aleatorizaron 50 pacientes a titulación manual frente a FreeO2® y concluyeron que el FreeO2® mantenía la SpO2 en el nivel programado mejor que la titulación manual, reduciendo también los periodos de desaturación e hiperoxia. Fue, además, considerado un sistema apropiado por enfermeras y médicos. No encontraron, sin embargo, diferencias significativas en la estancia media, las admisiones a UCI o la tasa de readmisiones71. Afirmaron también que esta tecnología podría mejorar significativamente la eficiencia del sistema de salud al reducir los costos en un 20,7% por paciente, calculado a 180 días72. En el segundo escenario aleatorizaron 187 pacientes con agudización de EPOC y necesidades de O2≥3l/min, a FreeO2® o a titulación manual, a su llegada al servicio de urgencias. Los autores concluyeron que los pacientes con FreeO2® presentaban un mejor control de la SpO2, con tiempos de hipoxemia e hiperoxia menores; un menor tiempo de uso del O2 durante la estancia hospitalaria y un porcentaje mayor de destete del O2, lo que reducía el tiempo de oxigenación y mejoraba la seguridad del procedimiento. El dispositivo fue bien aceptado por los médicos, sin diferencias en términos de interrupción prematura del tratamiento73. Estos autores mantienen otras líneas de investigación novedosas con este dispositivo en pacientes con síndrome coronario agudo y en el manejo de las apneas centrales, aunque aún sin resultados conocidos74,75.
Limitaciones de la titulación automáticaA pesar de los numerosos estudios de titulación automática, aún quedan múltiples interrogantes. ¿Funcionan los dispositivos de autotitulación con cualquier interface? ¿Son los sensores de oximetría lo suficientemente sensibles y fiables? ¿El hardware puede tener episodios de mal funcionamiento por defectos en su desarrollo o problemas eléctricos? ¿Cuál es su lugar en el mundo de la oxigenoterapia?, ¿el paciente agudo?, ¿el domicilio?, ¿el esfuerzo?
En la mayoría de los estudios, la variable utilizada como retroalimentación del circuito fue la SpO2, debiendo estar conectado el paciente continuamente a un pulsioxímetro. Es la única fuente de información que alimenta el algoritmo para determinar el ajuste de la terapia. En el cuidado manual, sin embargo, el médico dispone de varias fuentes (monitores, respuesta del paciente,…), lo que aumenta su seguridad. A este respecto es importante la inestabilidad del sensor con los movimientos o el retraso fisiológico en las mediciones, por lo que el avance de la pulsioximetría supondrá un hecho clave en el desarrollo de controladores clínicamente efectivos.
Por otro lado, el valor de la oximetría para evaluar la hiperoxia es muy limitado, al igual que lo es su capacidad para detectar precozmente la depresión respiratoria, incluso cuando se asocia con retención considerable de CO2. Nuevas líneas de investigación, como el índice de reserva de oxígeno (ORI), son muy interesantes para mejorar la fiabilidad de la medida76. El ORI es una variable continua no invasiva proporcionada por una generación de oxímetros que utilizan cooximetría de pulso de longitud de onda múltiple. Reflejan la oxigenación en el rango hiperóxico moderado, lo que proporciona una alarma temprana cuando la oxigenación se deteriora, antes incluso de que haya cambios en la SpO2. Es, por tanto, un buen complemento a la oximetría en el manejo de pacientes con oxigenoterapia76.
Otro problema de la titulación automática es que el aumento del flujo de O2 puede no ser una respuesta adecuada cuando la hipoxemia se debe a hipoventilación. Y para minimizar el riesgo de enmascarar el deterioro continuo de la función respiratoria por el aumento automático del flujo de O2, los dispositivos de titulación automática deberían advertir sobre aumentos persistentes del flujo de O2, incluso si la SpO2 está en rango.
Reflexión finalPodemos concluir que los sistemas de titulación automática mejoran la dosificación de la oxigenoterapia evitando las consecuencias deletéreas de la hipoxemia e hiperoxia en la insuficiencia respiratoria aguda y crónica, pero sin sustituir al control clínico, sobre todo por sus limitaciones cuando la causa de la hipoxemia es la hipoventilación. A pesar de sus limitaciones su potencial clínico es amplio, pudiendo ayudar a los médicos a prescribir la oxigenoterapia de forma personalizada a las diferentes situaciones de los pacientes. Y no debemos olvidar que, aunque la oxigenoterapia salva vidas, si la utilizamos de forma inadecuada puede causar daños importantes. El desarrollo tecnológico en este campo va a permitir disponer, sin duda, de equipos más fiables, con sensores más sensibles y con una capacidad de respuesta más ágil, pero será necesario seguir abriendo vías de investigación en esta área de conocimiento. En el momento actual, la autotitulación de la oxigenoterapia debe situarse en el escenario de la investigación.
Conflicto de interesesSagrario Mayoralas Alises trabaja como directora médico en Oximesa Grupo Praxair, empresa proveedora de terapias respiratorias a domicilio. Oximesa no comercializa ninguno de los dispositivos descritos en el manuscrito. El resto de autores declaran no tener conflictos de intereses respecto del contenido del manuscrito.