El riesgo de enfermar de tuberculosis ha aumentado en los pacientes con enfermedades inflamatorias crónicas que reciben tratamiento inmunosupresor, en particular en aquellos tratados con terapia anti-TNF (del inglés tumor necrosis factor). En estos pacientes es obligatoria la detección de la infección tuberculosa latente y el tratamiento de dicha infección, dirigido a reducir el riesgo de progresión a enfermedad tuberculosa
Este documento de consenso resume la opinión de expertos y los conocimientos actuales sobre tratamientos biológicos, incluidos los bloqueantes del TNF. Se establecen recomendaciones para la utilización de las técnicas de liberación de interferón-gamma (IGRA) y la prueba de la tuberculina (PT) para el diagnóstico y el tratamiento de la infección tuberculosa latente.
Tuberculosis risk is increased in patients with chronic inflammatory diseases receiving any immunosuppressive treatment, notably tumor necrosis factor (TNF) antagonists therapy. Screening for the presence of latent infection with Mycobacterium tuberculosis and targeted preventive treatment to reduce the risk of progression to TB is mandatory in these patients.
This Consensus Document summarizes the current knowledge and expert opinion of biologic therapies including TNF-blocking treatments. It provides recommendations for the use of interferon-gamma release assays (IGRA) and tuberculin skin test (TST) for the diagnosis of latent tuberculosis infection in these patients, and for the type and duration of preventive therapy.
El desarrollo de las terapias biológicas en esta última década ha supuesto un cambio definitivo en el tratamiento de las enfermedades inflamatorias crónicas, que comprenden la artritis reumatoide (AR), la espondilitis anquilosante (EA), la artritis idiopática juvenil (AIJ), la enfermedad de Crohn (EC), la colitis ulcerosa (CU), la psoriasis y la artritis psoriásica, entre otras. En 1998, la Administración de Medicamentos y Alimentos estadounidense (Food and Drug Administration [FDA])1 autorizó el uso del infliximab en los pacientes resistentes al tratamiento inmunomodulador convencional. Desde entonces se han comercializado más de 20 nuevos fármacos para el tratamiento de enfermedades inflamatorias mediadas inmunológicamente (EIMI) en las que el factor de necrosis tumoral (tumor necrosis factor [TNF]) y los receptores del TNF juegan un papel clave en la respuesta inmunitaria durante los procesos de inflamación aguda y crónica2.
La farmacovigilancia de los primeros agentes biológicos autorizados (infliximab y etanercept) puso rápidamente en relieve la aparición de casos de tuberculosis (TB) asociada3-5.
Varios estudios han demostrado que el diagnóstico de infección tuberculosa latente (ITL) en los pacientes y su tratamiento preventivo con isoniazida (INH) durante 9meses reduce la probabilidad de progresión a tuberculosis activa6,7. Sin embargo, dado que se siguen observando casos incluso después del tratamiento preventivo con INH, resulta necesario revisar los protocolos y buscar mejoras en la sensibilidad y especificidad de las pruebas de diagnóstico para mejorar el abordaje terapéutico en la población con EIMI8.
Justificación y objetivos del documentoExiste abundante y reciente información sobre las nuevas terapias biológicas en pacientes con EIMI, a lo que se suma la falta de unas guías consensuadas entre las diferentes sociedades científicas de nuestro país. Esta situación justifica la necesidad de un documento de consenso basado en la evidencia científica disponible y en el consenso de un grupo de expertos con el fin de actualizar la información existente y las recomendaciones anteriores. Uno de sus principales objetivos es facilitar el diagnóstico, tratamiento y seguimiento de los pacientes con ITL candidatos a terapias biológicas.
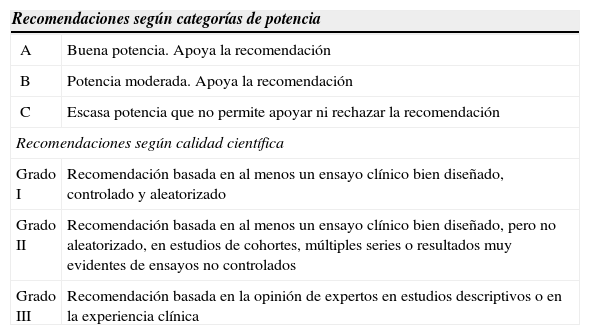
MetodologíaEn la redacción del documento han participado expertos designados por las diferentes sociedades científicas, los cuales se dedican particularmente y tienen experiencia en el estudio y control de pacientes candidatos a terapias biológicas. A partir de la información obtenida se han establecido recomendaciones basadas en la clasificación de la Sociedad Americana de Enfermedades Infecciosas9 según la tabla 1.
Recomendaciones según las categorías de potencia y calidad científica9
| Recomendaciones según categorías de potencia | |
|---|---|
| A | Buena potencia. Apoya la recomendación |
| B | Potencia moderada. Apoya la recomendación |
| C | Escasa potencia que no permite apoyar ni rechazar la recomendación |
| Recomendaciones según calidad científica | |
| Grado I | Recomendación basada en al menos un ensayo clínico bien diseñado, controlado y aleatorizado |
| Grado II | Recomendación basada en al menos un ensayo clínico bien diseñado, pero no aleatorizado, en estudios de cohortes, múltiples series o resultados muy evidentes de ensayos no controlados |
| Grado III | Recomendación basada en la opinión de expertos en estudios descriptivos o en la experiencia clínica |
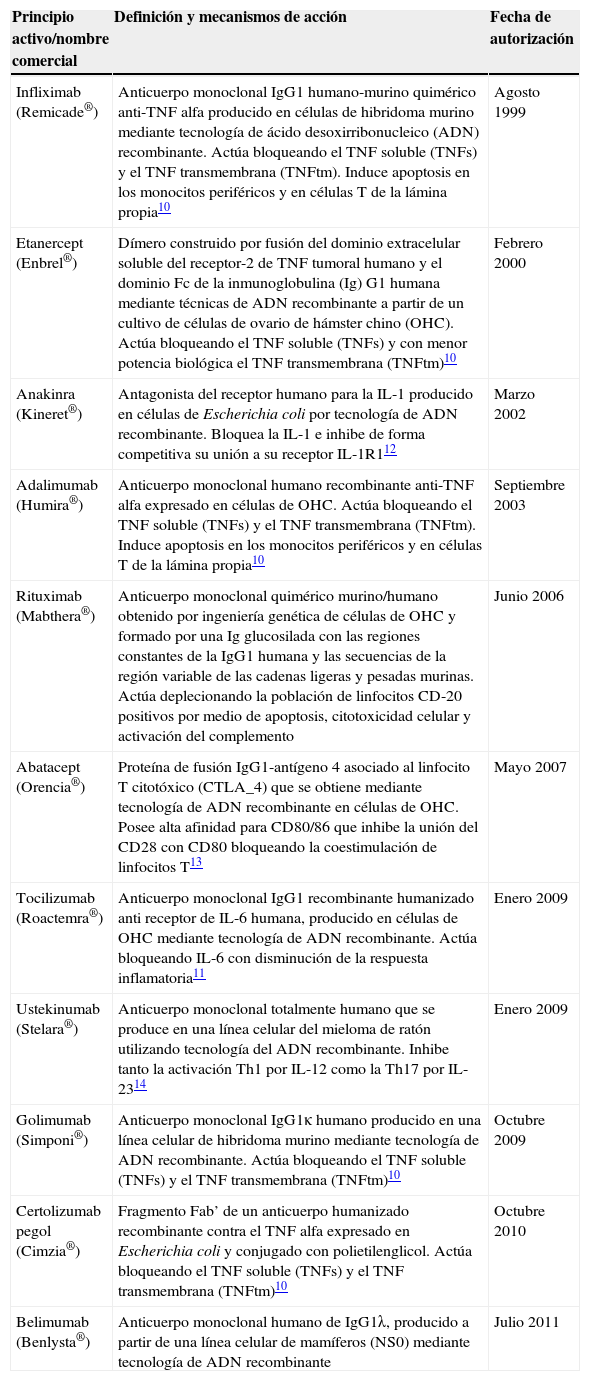
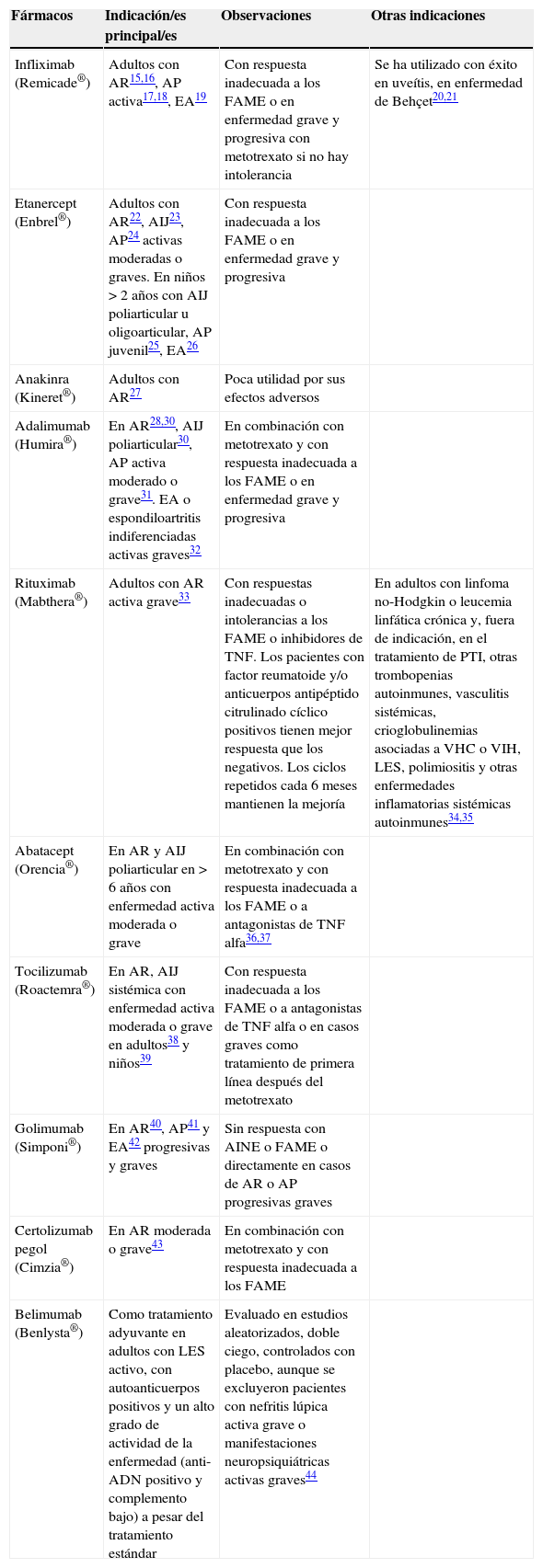
Los tratamientos biológicos han supuesto una revolución en el tratamiento de las enfermedades inflamatorias sistémicas autoinmunes y en las espondiloartritis. Antes de su aparición, se disponía de antiinflamatorios no esteroideos (AINE), glucocorticoides y los denominados fármacos modificadores de enfermedad (FAME) que, en general, modificaban poco la evolución natural de la AR. Hoy en día se puede detener la progresión de la enfermedad y alcanzar la remisión completa en la mayoría de los pacientes. En las tablas 2 y 3 se resumen los principales fármacos utilizados en el tratamiento de las enfermedades reumatológicas y sus indicaciones actuales10-44.
Resumen de las principales terapias biológicas comercializadas
| Principio activo/nombre comercial | Definición y mecanismos de acción | Fecha de autorización |
|---|---|---|
| Infliximab (Remicade®) | Anticuerpo monoclonal IgG1 humano-murino quimérico anti-TNF alfa producido en células de hibridoma murino mediante tecnología de ácido desoxirribonucleico (ADN) recombinante. Actúa bloqueando el TNF soluble (TNFs) y el TNF transmembrana (TNFtm). Induce apoptosis en los monocitos periféricos y en células T de la lámina propia10 | Agosto 1999 |
| Etanercept (Enbrel®) | Dímero construido por fusión del dominio extracelular soluble del receptor-2 de TNF tumoral humano y el dominio Fc de la inmunoglobulina (Ig) G1 humana mediante técnicas de ADN recombinante a partir de un cultivo de células de ovario de hámster chino (OHC). Actúa bloqueando el TNF soluble (TNFs) y con menor potencia biológica el TNF transmembrana (TNFtm)10 | Febrero 2000 |
| Anakinra (Kineret®) | Antagonista del receptor humano para la IL-1 producido en células de Escherichia coli por tecnología de ADN recombinante. Bloquea la IL-1 e inhibe de forma competitiva su unión a su receptor IL-1R112 | Marzo 2002 |
| Adalimumab (Humira®) | Anticuerpo monoclonal humano recombinante anti-TNF alfa expresado en células de OHC. Actúa bloqueando el TNF soluble (TNFs) y el TNF transmembrana (TNFtm). Induce apoptosis en los monocitos periféricos y en células T de la lámina propia10 | Septiembre 2003 |
| Rituximab (Mabthera®) | Anticuerpo monoclonal quimérico murino/humano obtenido por ingeniería genética de células de OHC y formado por una Ig glucosilada con las regiones constantes de la IgG1 humana y las secuencias de la región variable de las cadenas ligeras y pesadas murinas. Actúa deplecionando la población de linfocitos CD-20 positivos por medio de apoptosis, citotoxicidad celular y activación del complemento | Junio 2006 |
| Abatacept (Orencia®) | Proteína de fusión IgG1-antígeno 4 asociado al linfocito T citotóxico (CTLA_4) que se obtiene mediante tecnología de ADN recombinante en células de OHC. Posee alta afinidad para CD80/86 que inhibe la unión del CD28 con CD80 bloqueando la coestimulación de linfocitos T13 | Mayo 2007 |
| Tocilizumab (Roactemra®) | Anticuerpo monoclonal IgG1 recombinante humanizado anti receptor de IL-6 humana, producido en células de OHC mediante tecnología de ADN recombinante. Actúa bloqueando IL-6 con disminución de la respuesta inflamatoria11 | Enero 2009 |
| Ustekinumab (Stelara®) | Anticuerpo monoclonal totalmente humano que se produce en una línea celular del mieloma de ratón utilizando tecnología del ADN recombinante. Inhibe tanto la activación Th1 por IL-12 como la Th17 por IL-2314 | Enero 2009 |
| Golimumab (Simponi®) | Anticuerpo monoclonal IgG1κ humano producido en una línea celular de hibridoma murino mediante tecnología de ADN recombinante. Actúa bloqueando el TNF soluble (TNFs) y el TNF transmembrana (TNFtm)10 | Octubre 2009 |
| Certolizumab pegol (Cimzia®) | Fragmento Fab’ de un anticuerpo humanizado recombinante contra el TNF alfa expresado en Escherichia coli y conjugado con polietilenglicol. Actúa bloqueando el TNF soluble (TNFs) y el TNF transmembrana (TNFtm)10 | Octubre 2010 |
| Belimumab (Benlysta®) | Anticuerpo monoclonal humano de IgG1λ, producido a partir de una línea celular de mamíferos (NS0) mediante tecnología de ADN recombinante | Julio 2011 |
Resumen de las terapias biológicas en las enfermedades reumáticas
| Fármacos | Indicación/es principal/es | Observaciones | Otras indicaciones |
|---|---|---|---|
| Infliximab (Remicade®) | Adultos con AR15,16, AP activa17,18, EA19 | Con respuesta inadecuada a los FAME o en enfermedad grave y progresiva con metotrexato si no hay intolerancia | Se ha utilizado con éxito en uveítis, en enfermedad de Behçet20,21 |
| Etanercept (Enbrel®) | Adultos con AR22, AIJ23, AP24 activas moderadas o graves. En niños >2años con AIJ poliarticular u oligoarticular, AP juvenil25, EA26 | Con respuesta inadecuada a los FAME o en enfermedad grave y progresiva | |
| Anakinra (Kineret®) | Adultos con AR27 | Poca utilidad por sus efectos adversos | |
| Adalimumab (Humira®) | En AR28,30, AIJ poliarticular30, AP activa moderado o grave31. EA o espondiloartritis indiferenciadas activas graves32 | En combinación con metotrexato y con respuesta inadecuada a los FAME o en enfermedad grave y progresiva | |
| Rituximab (Mabthera®) | Adultos con AR activa grave33 | Con respuestas inadecuadas o intolerancias a los FAME o inhibidores de TNF. Los pacientes con factor reumatoide y/o anticuerpos antipéptido citrulinado cíclico positivos tienen mejor respuesta que los negativos. Los ciclos repetidos cada 6 meses mantienen la mejoría | En adultos con linfoma no-Hodgkin o leucemia linfática crónica y, fuera de indicación, en el tratamiento de PTI, otras trombopenias autoinmunes, vasculitis sistémicas, crioglobulinemias asociadas a VHC o VIH, LES, polimiositis y otras enfermedades inflamatorias sistémicas autoinmunes34,35 |
| Abatacept (Orencia®) | En AR y AIJ poliarticular en >6años con enfermedad activa moderada o grave | En combinación con metotrexato y con respuesta inadecuada a los FAME o a antagonistas de TNF alfa36,37 | |
| Tocilizumab (Roactemra®) | En AR, AIJ sistémica con enfermedad activa moderada o grave en adultos38 y niños39 | Con respuesta inadecuada a los FAME o a antagonistas de TNF alfa o en casos graves como tratamiento de primera línea después del metotrexato | |
| Golimumab (Simponi®) | En AR40, AP41 y EA42 progresivas y graves | Sin respuesta con AINE o FAME o directamente en casos de AR o AP progresivas graves | |
| Certolizumab pegol (Cimzia®) | En AR moderada o grave43 | En combinación con metotrexato y con respuesta inadecuada a los FAME | |
| Belimumab (Benlysta®) | Como tratamiento adyuvante en adultos con LES activo, con autoanticuerpos positivos y un alto grado de actividad de la enfermedad (anti-ADN positivo y complemento bajo) a pesar del tratamiento estándar | Evaluado en estudios aleatorizados, doble ciego, controlados con placebo, aunque se excluyeron pacientes con nefritis lúpica activa grave o manifestaciones neuropsiquiátricas activas graves44 |
AIJ: artritis idiopática juvenil; AP: artritis psoriásica; AR: artritis reumatoide; EA: espondilitis anquilosante; FAME: fármacos modificadores de la enfermedad; LES: lupus eritematoso sistémico.
La enfermedad inflamatoria intestinal (EII) incluye 2 enfermedades, la CU y la EC, que se caracterizan por su carácter crónico y la alternancia de brotes entre periodos de remisión de duración variable.
El objetivo terapéutico incluye el control rápido de la actividad inflamatoria durante los brotes, con el fin de mejorar los síntomas y evitar complicaciones que condicionan daños estructurales en el aparato digestivo, con consecuencias incapacitantes permanentes. Una vez conseguida la remisión, el objetivo del tratamiento de mantenimiento es que la enfermedad permanezca inactiva y evitar la aparición de nuevos brotes.
Los principales tratamientos biológicos de la EII y sus indicaciones se resumen en la tabla 445-69.
Resumen de las terapias biológicas en las enfermedades intestinales
| Fármacos biológicos | Indicaciones y observaciones | ||
|---|---|---|---|
| Infliximab (Remicade®) | EC activa de moderada a grave45 | El beneficio se traduce en un ahorro de consumo de corticoides45,46, en la disminución en la tasa de hospitalizaciones y cirugía47,48 y en una mejor calidad de vida percibida por los pacientes47,49. En el tratamiento sistemático ha demostrado su capacidad para inducir la curación de la mucosa en la EC52 | En adultos que no han respondido a pesar de un curso de terapia completo y adecuado con un costicosteroide y/o inmunomoduladores; o que sean intolerantes o presenten contraindicaciones médicas a dichas terapias |
| EC activa fistulizante46 | |||
| CU activa, de moderada a grave51 | Demuestra su efectividad y mejora la calidad de vida a corto y largo plazo en los pacientes con CU52 | ||
| EC o CU activa en edad pediátrica53 | Infliximab se ha demostrado efectivo e induce una mejoría en la calidad de vida y estatura de los niños, así como una reducción significativa del uso de corticosteroides | ||
| Infliximab ha sido efectivo en situaciones no recogidas en ficha técnica como son la prevención de la recurrencia poscirugía de la EC tras la resección de ileon54, la resevoritis en pacientes con CU y colectomía55 y el pioderma gangrenoso asociado a la EII56 | |||
| Adalimumab (Humira®) | EC activa de moderada a grave57,58 | Adalimumab ha demostrado su eficacia y seguridad en la inducción de la remisión y en el mantenimiento de esta en la EC y su beneficio se traduce en la disminución en la tasa de hospitalizaciones y cirugía59. Su uso ha demostrado su capacidad para inducir la curación de la mucosa en la EC60 | En pacientes adultos que han presentado una respuesta inadecuada a la terapia convencional, incluidos corticosteroides y 6-mercaptopurina o azatioprina, o que presentan intolerancia o contraindicaciones a dichas terapias |
| CU activa, de moderada a grave61,62 | En estos enfermos reduce la necesidad de ingreso hospitalario a 52 semanas, tanto para las hospitalizaciones ocasionadas por la totalidad de causas como para las relacionadas solo con la CU63 | ||
| EC activa grave en pacientes pediátricos (>6años) | En los que presentan una respuesta insuficiente a la terapia convencional incluyendo tratamiento nutricional primario, un corticosteroide y un inmunomodulador, o que son intolerantes o tiene contraindicadas estas terapias64 | ||
| Adalimumab se ha mostrado útil en situaciones no contempladas en la ficha técnica como son la prevención de la recurrencia poscirugía de la EC tras resección de íleon65 | |||
| Golimumab (Simponi®) | CU activa de moderada a grave | En pacientes adultos que han presentado una respuesta inadecuada a la terapia convencional, incluidos corticosteroides y 6-mercaptopurina o azatioprina, o que presentan intolerancia o contraindicaciones a dichas terapias | |
| Golimumab favorece la curación mucosa y mejora la calidad de vida frente a placebo66 y mantiene una respuesta clínica sostenida hasta la semana 5267. Los datos de seguridad de ambos estudios son similares a los de otros anti-TNF o a los de golimumab para otras indicaciones | |||
| Certolizumab pegol (Cimzia®) | EC de moderada a grave | Para la inducción de la respuesta y el mantenimiento de esta en pacientes con respuesta inadecuada a la medicación convencional | El fármaco está aprobado para este uso en EE.UU. y Suiza pero no en otros países europeos. Aceptado por la FDA pero no por la EMA |
| La eficacia de certolizumab pegol se evaluó en 2 ensayos clínicos aleatorizados, doble ciego, controlados con placebo68,69. Uno de los motivos para la denegación de autorización por EMA se basa en la escasa duración de los estudios de mantenimiento | |||
CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; EMA: Agencia Europea del Medicamento.
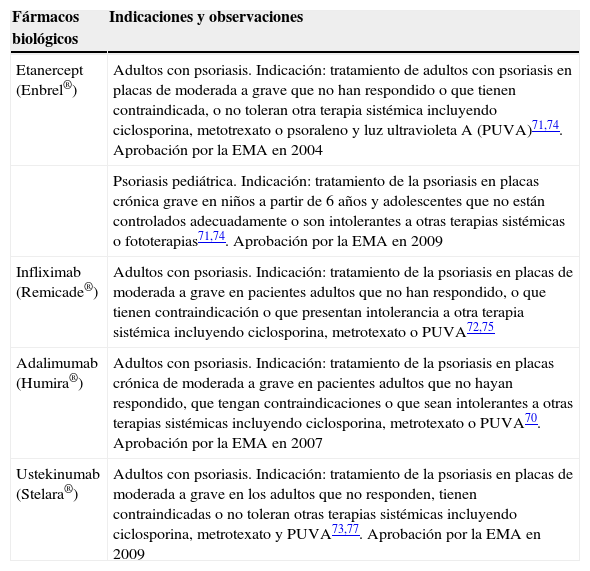
Hoy en día, los fármacos biológicos empleados en el tratamiento de la psoriasis, la única indicación dermatológica autorizada, son los siguientes: etanercept, infliximab, adalimumab y ustekinumab. Las fichas técnicas de estos 4 fármacos establecen que han sido autorizados para «el tratamiento de la psoriasis en placas moderada a grave en pacientes adultos que no han respondido o con contraindicación o intolerancia a otro tratamiento sistémico, tales como ciclosporina, metotrexato o PUVA»70–73. En la tabla 5 se resumen las indicaciones de cada fármaco biológico en la psoriasis70-77.
Resumen de las terapias biológicas en enfermedades dermatológicas
| Fármacos biológicos | Indicaciones y observaciones |
|---|---|
| Etanercept (Enbrel®) | Adultos con psoriasis. Indicación: tratamiento de adultos con psoriasis en placas de moderada a grave que no han respondido o que tienen contraindicada, o no toleran otra terapia sistémica incluyendo ciclosporina, metotrexato o psoraleno y luz ultravioletaA (PUVA)71,74. Aprobación por la EMA en 2004 |
| Psoriasis pediátrica. Indicación: tratamiento de la psoriasis en placas crónica grave en niños a partir de 6años y adolescentes que no están controlados adecuadamente o son intolerantes a otras terapias sistémicas o fototerapias71,74. Aprobación por la EMA en 2009 | |
| Infliximab (Remicade®) | Adultos con psoriasis. Indicación: tratamiento de la psoriasis en placas de moderada a grave en pacientes adultos que no han respondido, o que tienen contraindicación o que presentan intolerancia a otra terapia sistémica incluyendo ciclosporina, metrotexato o PUVA72,75 |
| Adalimumab (Humira®) | Adultos con psoriasis. Indicación: tratamiento de la psoriasis en placas crónica de moderada a grave en pacientes adultos que no hayan respondido, que tengan contraindicaciones o que sean intolerantes a otras terapias sistémicas incluyendo ciclosporina, metrotexato o PUVA70. Aprobación por la EMA en 2007 |
| Ustekinumab (Stelara®) | Adultos con psoriasis. Indicación: tratamiento de la psoriasis en placas de moderada a grave en los adultos que no responden, tienen contraindicadas o no toleran otras terapias sistémicas incluyendo ciclosporina, metrotexato y PUVA73,77. Aprobación por la EMA en 2009 |
EMA: Agencia Europea del Medicamento.
La infección tuberculosa está causada por la inhalación de bacilos viables que, por lo general, persisten en un estado inactivo conocido como ITL. Sin embargo, estos pueden progresar rápidamente en algunas ocasiones y originar enfermedad tuberculosa activa. Las personas con ITL permanecen asintomáticas y no son contagiosas. En la mayoría de los individuos, la infección inicial por M.tuberculosis queda contenida por las defensas del huésped y permanece latente. Sin embargo, esta situación de latencia puede convertirse en enfermedad activa en cualquier momento.
El riesgo de reactivación tuberculosa con la utilización de anti-TNF depende de 2 variables: el efecto inmunomodulador del tratamiento y la prevalencia de infección tuberculosa subyacente en una determinada población.
El hecho de haber realizado un tratamiento previo de la infección latente no otorga una protección total78, y no se ha determinado la existencia de un período estándar para la reactivación, ya que este varía según el fármaco empleado79. El registro británico (BSRBR) detectó una incidencia de TB de 39 casos por 100.000 pacientes/año con etanercept, de 103 casos por 100.000 con infliximab y de 171 casos por 100.000 con adalimumab.
Técnicas de diagnóstico de la infección tuberculosa latente: utilidad en enfermos inmunodeprimidosLa investigación de una posible infección tuberculosa entre las personas candidatas a tratamientos biológicos debería comenzar con la evaluación del riesgo potencial de exposición al M.tuberculosis. Los grupos de mayor riesgo son los constituidos por:
- a.
Personas que han tenido contacto reciente con pacientes con enfermedad tuberculosa.
- b.
Personas nacidas o que residen en países con elevada prevalencia de TB, o bien que viajan con frecuencia a estas áreas por motivos comerciales, familiares o humanitarios.
- c.
Residentes y trabajadores de instituciones cerradas, tales como prisiones, albergues para personas sin recursos económicos o centros sociosanitarios de todo tipo.
- d.
Personas con reacción a la prueba de la tuberculina (PT) que no han recibido tratamiento específico.
- e.
Personas que abusan del alcohol u otros tóxicos, sin olvidar también que el desarrollo de la TB es más frecuente en personas fumadoras que en no fumadoras.
- f.
Trabajadores sanitarios, en particular los que atienden pacientes con TB activa.
- g.
Personas con lesiones radiológicas sugestivas de TB antigua, especialmente si nunca han recibido tratamiento, como es el caso de las personas con prueba de la tuberculina positiva.
- h.
Clásicamente, también los individuos en las edades extremas de la vida, aquellos con enfermedades inmunosupresoras y otras comorbilidades que se han relacionado con un mayor riesgo de TB. Entre estas patologías cabe destacar la infección por el VIH, las enfermedades autoinmunes y la situación postrasplante, pero también las neumopatías (silicosis), la insuficiencia renal crónica, la gastrectomía, la diabetes y algunos tumores, como los de cabeza y cuello.
En ausencia de una prueba de referencia para el diagnóstico de la infección tuberculosa, el manejo actual de los pacientes con enfermedades autoinmunes candidatos a tratamiento con fármacos anti-TNF incluye la realización de una anamnesis dirigida a dilucidar los antecedentes de TB o infección latente, tratada o no con anterioridad, buscar evidencias de TB previa en la radiografía de tórax y realizar una PT.
La PT consiste en medir la respuesta de hipersensibilidad retardada que se produce en la piel tras la inoculación intradérmica del derivado proteico purificado (PPD), una mezcla de más de 200 proteínas de M.tuberculosis. Dado que los antígenos contenidos en el PPD se encuentran también en otras micobacterias, la vacunación con BCG puede ser causa de falsos positivos en la PT. Además, la sensibilidad de la PT se ve afectada en los pacientes que reciben tratamiento inmunodepresor, en los cuales se observa un porcentaje elevado de falsos negativos80,81. En este sentido, algunos estudios en pacientes con AR han demostrado que la tasa de falsos negativos de PT puede llegar hasta el 40%82. En ocasiones se aconseja repetir la PT para aumentar su sensibilidad debido al «efecto booster» (efecto empuje) sobre los falsos negativos, pero ello también disminuye su especificidad, al aumentar el número de falsos positivos debido a la vacunación con BCG y a la exposición a micobacterias no tuberculosas83.
Técnicas diagnósticas basadas en la liberación de interferón gammaLa secuenciación del genoma del M.tuberculosis permitió identificar mejor los genes involucrados en su patogenia y conocer la presencia de regiones de diferencia genética. En la región conocida como RD1 se codifican proteínas propias de M.tuberculosis (ESAT-6 y CFP-10) que se comportan como antígenos específicos. En las personas infectadas por M.tuberculosis, estas inducen una respuesta inmunitaria de tipo Th-1 con producción de interferón gamma (IFN-γ). Esta región, ausente en todas las cepas de M.bovis-BCG y en casi todas las micobacterias no tuberculosas, a excepción del M.kansasii, M.marinum y M.szulgai, está presente en todas las cepas de M.tuberculosis virulentas conocidas.
Las técnicas de IGRA se fundamentan en la detección, en la sangre periférica de individuos infectados, del IFN-γ liberado por células T sensibilizadas en respuesta a la estimulación in vitro con antígenos específicos del M.tuberculosis.
Existen dos técnicas comercializadas:
QuantiFERON®-TB-Gold (Cellestis Ltd. Carnegie, Australia)84, que determina la producción total de IFN-γ en individuos infectados por M.tuberculosis por medio de una técnica ELISA. Un valor igual o superior a 0,35UI/ml se considera positivo.
T-SPOT.TB® (Oxford Immunotec Ltd., Reino Unido), desarrollada por A. Lalvani a finales de los años noventa85. Se trata de un procedimiento más laborioso que requiere la separación previa de los monocitos antes de incubarlos con los antígenos ESAT-6 y CFP-10. Su lectura se hace por medio de la técnica del Elispot, en la cual cada punto visible (o spot) representa una célulaT secretora de IFN-γ. El resultado se considera positivo a partir de 6spots.
Ambas técnicas incorporan controles positivos y negativos capaces de detectar falsos resultados debidos a anergia o a problemas inmunológicos (informados como resultados indeterminados)86. La mayoría de las guías, ante el hallazgo de un resultado indeterminado (más frecuente en EIMI) aconsejan repetir la técnica, lo que en muchos casos confirma la negatividad87,88.
La utilización de técnicas de IGRA presenta diversas ventajas respecto a la PT:
- a.
Evita la subjetividad en la interpretación de los resultados.
- b.
Se puede repetir la determinación si es necesario.
- c.
No es necesaria una visita de lectura a las 48-72h para obtener los resultados.
- d.
Son de fácil estandarización y aplicación en el laboratorio.
- e.
Permite la detección de pacientes anérgicos.
- f.
Respeta la privacidad del paciente.
Entre los inconvenientes está el coste económico, que es superior al de la PT.
Interpretación de los resultados en pacientes candidatos a tratamientos biológicosLas técnicas de IGRA se utilizan como pruebas rutinarias para el diagnóstico de la ITL en Estados Unidos, Canadá, Australia, Japón y en algunos países de Europa occidental (Reino Unido, Italia, Alemania, Suiza). Algunos países las utilizan en lugar de la PT, y otros la combinan con esta. En España se recomienda complementar la PT con una técnica de IGRA en personas candidatas a recibir tratamiento si han estado vacunados con BCG (para descartar un falso positivo de la tuberculina) y en aquellas con prueba cutánea negativa y sospecha de inmunosupresión (para descartar un falso negativo a la tuberculina)89,90.
A pesar de los numerosos estudios publicados en los últimos años, los datos sobre el rendimiento de estas pruebas en pacientes con EIMI son limitados y controvertidos80,89,91-94. Los datos procedentes de estos estudios concluyen que: a)la concordancia entre la PT y las pruebas de IGRA es más débil en pacientes con enfermedades inflamatorias sistémicas que en sujetos sanos, debido a la menor prevalencia de positivos a la tuberculina entre los primeros82,95-100; b)la magnitud de la respuesta tuberculínica es significativamente menor entre los pacientes con EIMI que entre los controles sanos82; c)en personas vacunadas se observa discordancia entre una PT positiva y un resultado negativo en una prueba de IGRA, y d)en pacientes que reciben tratamiento con corticoides con frecuencia se observa discordancia entre una PT negativa y una prueba de IGRA positiva96.
Debido a la vulnerabilidad de estos pacientes frente a la TB cuando se hallan en tratamiento anti-TNF, parece prudente realizar las 2 pruebas en paralelo (IGRA y PT) para maximizar la sensibilidad diagnóstica del cribado, al menos hasta que se haya consolidado la evidencia de la utilidad de las técnicas de IGRA en esta población88. Es importante mencionar que cuando se realizan las 2 pruebas de manera secuencial, se deben realizar las pruebas de IGRA en primer lugar, en prevención al «efecto booster» causado por la PT101,102. Se desconoce cuánto tiempo persiste el efecto y si depende de la cantidad de PPD administrado o de sus características.
Los resultados de las pruebas de IGRA en pacientes en tratamiento con anti-TNF siguen siendo difíciles de interpretar. Los datos de estudios recientes103-105 muestran conversiones y reversiones en ambas pruebas, las cuales estarían relacionadas con problemas de reproducibilidad y cambios en el estado inmunológico de los pacientes. Dicha variabilidad supone que no es aconsejable repetir las pruebas para el seguimiento de los pacientes durante el tratamiento.
Tratamiento de la infección tuberculosa latente: pautas de tratamientoLa identificación y tratamiento de la ITL reduce la probabilidad de reactivación en estos pacientes, protegiendo así su salud y la de otras personas del entorno al reducir el número de posibles fuentes de infección106,107. El tratamiento de la infección latente solo se iniciará una vez que la TB activa se haya excluido.
Los regímenes para el tratamiento de la ITL comprenden el uso de INH durante 9meses, rifampicina sola (RIF) durante 4meses, o INH con RIF durante 3meses108.
Isoniazida. La dosis habitual es de 5mg/kg/día con un máximo de 300mg al día en adultos. En el único estudio que compara la eficacia de diferentes duraciones del tratamiento con INH demostró una eficacia del 65% en la pauta de 6meses, mientras que en la pauta de 12meses fue del 75% (sin llegar a ser significativamente diferente de la primera)109. Por extrapolación de los datos de los ensayos aleatorios, la duración óptima del tratamiento con INH para la ITL es de 9meses109,110. El efecto secundario más importante de la INH es la hepatitis, con una incidencia de un caso por cada 1.000 personas111.
Rifampicina. La dosis habitual es de 10mg/kg/día, con un máximo de 600mg al día. Se estima que la eficacia de la RIF para reducir la incidencia de TB activa es similar a la de INH112,113. Aunque hay pocos datos, la RIF parece ser bien tolerada, con una baja tasa de hepatotoxicidad112.
Isoniazida y rifampicina. Existen pocos datos sobre el uso de la combinación de INH y RIF en pacientes VIH negativos, pero algunos estudios han mostrado que es una pauta efectiva, con buena adherencia y bien tolerada114. Un metaanálisis de estudios pequeños realizados en población no VIH concluyó que es igualmente eficaz y no más tóxica115.
Tratamiento de la infección tuberculosa latente en pacientes candidatos a terapias biológicasEl Center for Disease Control and Prevention (CDC) estadounidense recomienda el tratamiento de la ITL en los pacientes a los que se vaya a iniciar tratamiento con un inhibidor de TNF que presenten una PT positiva (≥5mm de induración) o una prueba de IGRA positiva, independiente de si han sido vacunados con BCG (ya que su efecto sobre la PT se atenúa mucho con el paso del tiempo)116-118. También se recomienda en el caso de pacientes con PT o IGRA negativa pero en los que hay evidencia de enfermedad tuberculosa no tratada en la radiografía de tórax, o bien constancia epidemiológica de exposición previa a la TB (por ejemplo, después de haber estado en contacto estrecho con una persona infectada de TB o haber residido en un país con una alta incidencia de TB).
En general, los pacientes candidatos a recibir anti-TNF que tengan indicación de tratamiento de la ITL deben recibir el tratamiento estándar, es decir, INH durante 9meses. La duración recomendada del tratamiento de la ITL antes de comenzar terapia con un inhibidor del TNF no está bien establecida, pero la mayoría de autores proponen que, siempre que sea posible, los pacientes reciban al menos un mes de tratamiento para la infección latente de TB antes de iniciar el anti-TNF8,119.
El tratamiento de la infección latente con INH no protegerá al sujeto frente a la reactivación de la infección por cepas resistentes a la INH120. La RIF está indicada en el caso de los pacientes que sean intolerantes a la INH o cuyos casos índices presenten cepas resistentes a la INH pero sensibles a la RIF.
Recomendaciones del documento de consensoLas recomendaciones que se resumen aquí se basan en la evidencia publicada hasta 2013, en las diferentes guías nacionales y en las opiniones de expertos que trabajan en las especialidades que tratan a los pacientes con EIMI que pueden ser candidatos a recibir un tratamiento biológico.Estas recomendaciones se concretan del modo siguiente:
1. Todos los pacientes candidatos a tratamiento biológico deben ser estudiados para detectar una posible ITL, dado que constituyen uno de los grupos de mayor riesgo para desarrollar enfermedad tuberculosa (AII).
2. El riesgo de estos pacientes de desarrollar la enfermedad está relacionado con el fármaco anti-TNF utilizado, siendo el infliximab y el adalimumab los fármacos con los que se ha detectado mayor riesgo (AIII).
3. Los métodos diagnósticos de la ITL se basan en:
- -
La búsqueda activa de antecedentes de TB en la historia clínica del paciente y de haber tenido contacto con pacientes con TB activa.
- -
La evidencia de posibles lesiones tuberculosas antiguas en la radiología de tórax. En caso de duda, se aconseja completar el estudio con una TAC torácica, dado que tiene mejores prestaciones que la radiología convencional para detectar signos radiológicos precoces de TB activa o de lesiones antiguas.
- -
La realización simultánea de pruebas de IGRA y de una PT. La positividad en cualquiera de estas pruebas se considera indicativa de ITL (AIII).
4. Los resultados negativos falsos en la PT y las pruebas de IGRA son más frecuentes en pacientes con diagnóstico de EIMI (AIII).
5. No se ha demostrado que la repetición de la PT («efecto booster») mejore la sensibilidad de la prueba en las EIMI y sí que reduce su especificidad, por lo que no se recomienda su realización en la actualidad, al disponer de técnicas de IGRA (CIII).
6. La extracción de sangre para la realización de las pruebas de IGRA debe hacerse antes de la PT, debido al efecto «booster» detectado sobre las pruebas de IGRA (AIII).
7. La especificidad y sensibilidad de ambas técnicas de IGRA para el diagnóstico de la ITL es similar en los pacientes con EIMI, siendo la sensibilidad del T-SPOT.TB algo mayor en pacientes tratados con corticoides. Por lo tanto, se debe valorar su utilización en dichos pacientes (BIII).
8. Los resultados indeterminados en las pruebas de IGRA siempre deberán confirmarse con una segunda determinación, que suele ser negativa en la mayoría de los casos (AIII).
9. La negatividad en la PT y las pruebas de IGRA no descarta la presencia de una ITL (AIII).
10. Se aconseja realizar un tratamiento preventivo en todos los pacientes candidatos a terapias biológicas que presenten resultados positivos en alguna prueba diagnóstica de ITL una vez se haya excluido la tuberculosis activa (AII).
11. La pauta de tratamiento aconsejada es INH durante 9meses. Solo en casos excepcionales puede estar indicado el tratamiento con INH+RIF durante 3meses (AIII).
12. La monitorización del tratamiento será mensual. En caso de hepatotoxicidad debida a la INH, se recomienda una pauta alternativa con RIF durante 4meses (AIII).
13. El tratamiento de la ITL durante 4semanas se considera seguro (por la mayoría de los expertos) para iniciar el tratamiento anti-TNF (AIII).
14. De acuerdo a los datos actuales, no están indicados como estrategia de diagnóstico de falsos negativos iniciales el estudio y el cribado de la ITL tras del inicio y durante el tratamiento anti-TNF. Solo se aconseja repetir estudio de cribado si se producen cambios en la sintomatología clínica o tras una posible exposición a M.tuberculosis en viajes a zonas de alta endemia (AIII).
15. Si al paciente se le diagnostica enfermedad tuberculosa activa, debe suspenderse el tratamiento anti-TNF; se aconseja no reiniciarlo hasta que se haya completado todo el ciclo de tratamiento antituberculoso. No hay evidencia de que la duración del tratamiento de la enfermedad por TB deba modificarse en este contexto (AIII).
16. El riesgo de recaída de los pacientes que han completado de forma correcta el tratamiento de la enfermedad tuberculosa no parece ser mayor tras el inicio del tratamiento anti-TNF (AIII).
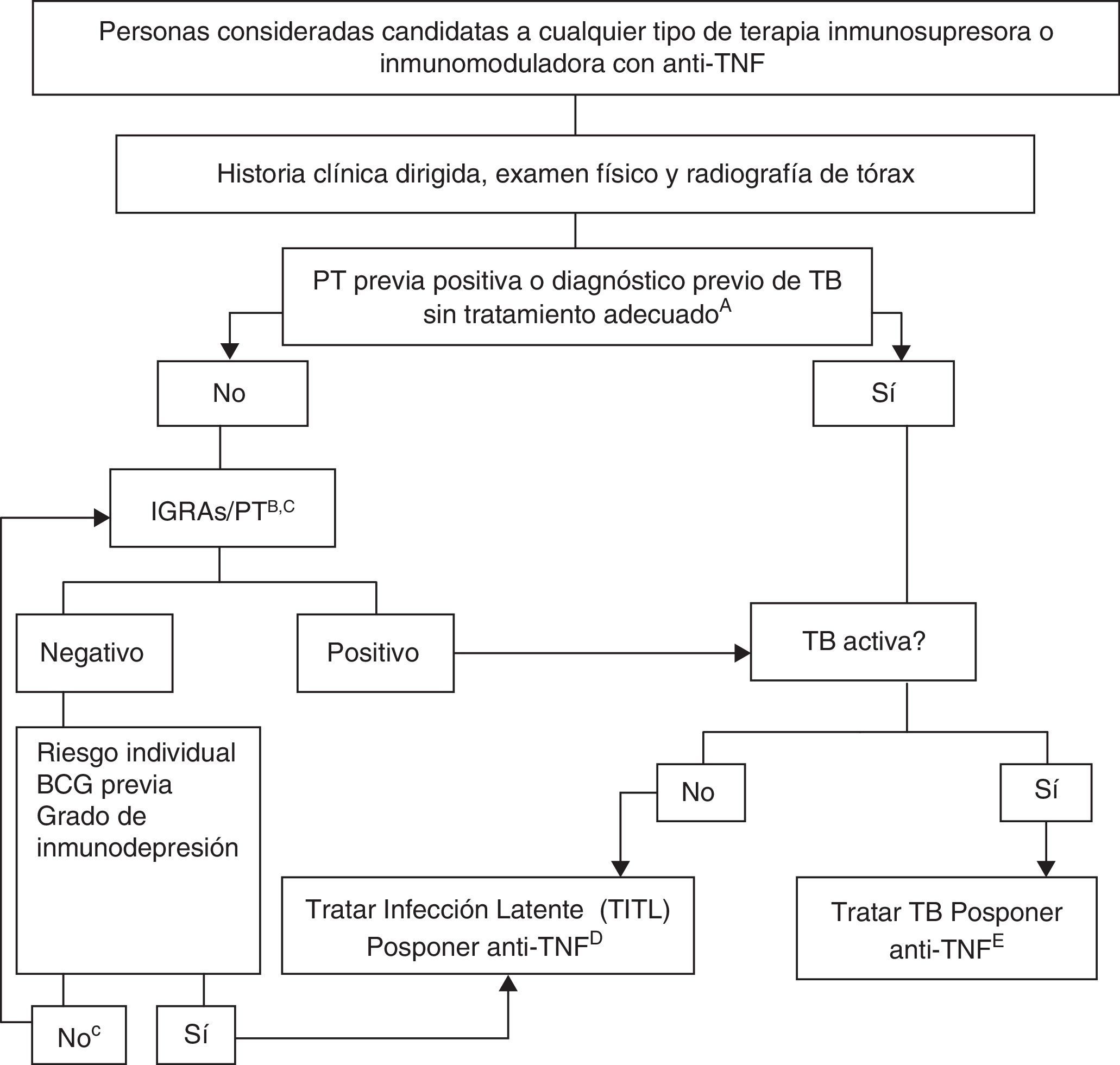
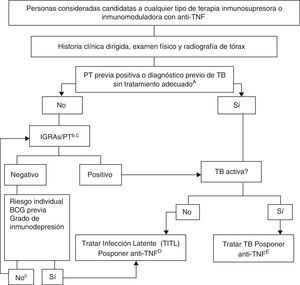
En la figura 1 se muestra el algoritmo propuesto para evaluar la infección tuberculosa en pacientes candidatos a tratamientos biológicos121, en el que se han utilizado los siguientes condicionantes:
A. El tratamiento adecuado de la TB se define como ≥6meses de terapia con fármacos de primera línea, e incluye ≥2meses con la asociación RIF+INH+pirazinamida+etambutol. El tratamiento adecuado de la infección latente se puede realizar con 9meses de INH, 3meses de INH+RIF o 4meses de RIF sola.
B. El riesgo de infección latente se deduce de ponderar factores como la exposición conocida a un caso contagioso, la edad, el país de origen y la historia laboral y social, incluidos los viajes a países endémicos y la exposición reiterada a colectivos de riesgo (instituciones cerradas, personas sin techo, usuarios de drogas).
C. En personas portadoras de ITL desde muchos años antes, la PT puede ser negativa y positivizarse en una segunda PT (fenómeno booster). Con la disponibilidad de las técnicas de IGRA no se aconseja realizar una segunda prueba. Solo se aconseja repetir el estudio según la recomendación n.° 14.
D. No se dispone de datos concluyentes que permitan establecer un período seguro entre el inicio del tratamiento de la infección latente y el del tratamiento anti-TNF. La mayoría de los expertos consideran que un retraso de 4semanas es una práctica habitual y segura.
E. Antes de iniciar el tratamiento biológico es necesario completar el tratamiento de la TB activa.
Conflictos de interesesEsteban Daudén Tello declara ser miembro de un consejo asesor, consultor, haber recibido becas y ayudas a la investigación, haber participado en ensayos clínicos o haber recibido honorarios como ponente de las siguientes compañías farmacéuticas: Abbvie (Abbott), Amgen, Janssen-Cilag, Leo Pharma, MSD, Pfizer, Novartis, Celgene y Lilly.
Carlos Taxonara Samso declara haber sido consultor y conferenciante para MSD y AbbVie.
Francisco Javier López Longo declara contratos puntuales como ponente con Abbvie, Actelion, Bristol-Myers-Squibb, GSK, MSD, Pfizer, Roche Farma y UCB, y haber recibido financiación para investigación de Abbvie y GSK.
El resto de autores declaran no tener ningún conflicto de intereses.
Documento de Consenso de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), Academia Española de Dermatología y Venereología (AEDV), Sociedad Española de Patología Digestiva (SEPD), Sociedad Española de Reumatología (SER) y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC).