A pesar de que es conocido que la presencia crónica de microorganismos en las vías aéreas de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) en fase de estabilidad conlleva una evolución desfavorable, ninguna guía de manejo de la enfermedad establece pautas sobre cómo diagnosticar y tratar este tipo de casos.
Con la intención de orientar a los profesionales, desde la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) se ha elaborado un documento que pretende aportar respuestas clínicas sobre el manejo de pacientes con EPOC en los que se aíslan microorganismos de forma puntual o persistente. Dado que la heterogeneidad de las evidencias científicas disponibles no permite crear una Guía de Práctica Clínica, se ha elaborado un documento basado en la literatura científica existente y/o en la propia experiencia clínica que aborda tanto la definición de las diferentes situaciones clínicas como su diagnóstico y manejo. El texto ha sido consensuado entre un amplio número de neumólogos con gran experiencia clínica y científica en este ámbito. Este documento cuenta con el aval del Comité Científico de SEPAR.
Although the chronic presence of microorganisms in the airways of patients with stable chronic obstructive pulmonary disease (COPD) confers a poor outcome, no recommendations have been established in disease management guidelines on how to diagnose and treat these cases.
In order to guide professionals, the Spanish Society of Pulmonology and Thoracic Surgery (SEPAR) has prepared a document which aims to answer questions on the clinical management of COPD patients in whom microorganisms are occasionally or habitually isolated. Since the available scientific evidence is too heterogeneous to use in the creation of a clinical practice guideline, we have drawn up a document based on existing scientific literature and clinical experience, addressing the definition of different clinical situations and their diagnosis and management. The text was drawn up by consensus and approved by a large group of respiratory medicine experts with extensive clinical and scientific experience in the field, and has been endorsed by the SEPAR Scientific Committee.
La enfermedad pulmonar obstructiva crónica (EPOC) cursa con una inflamación bronquial crónica que altera los mecanismos de defensa locales, lo que favorece el aislamiento de microorganismos potencialmente patógenos (MPP) en los cultivos de muestras respiratorias del 8-43% de pacientes en fase de estabilidad clínica1,2. Estos aislamientos son más frecuentes en pacientes más graves, exacerbadores o bronquíticos crónicos, con bronquiectasias o con bajo número de eosinófilos periféricos3-6. En la tabla 1 se detallan los MPP más frecuentes.
Listado de los microorganismos aislados con mayor frecuencia en pacientes con EPOC128-131
| MPP | M-no-PP |
|---|---|
| Haemophilus influenzaeStreptococcus pneumoniaeMoraxella catarrhalisPseudomonas aeruginosaOtros bacilos gramnegativos no fermentadores (Achromobacter xylosoxidans, Acinetobacter baumannii, Alcaligenes faecalis, Stenotrophomonas maltophilia, Pseudomonas spp., …)Klebsiella pneumoniaeOtros Enterobacterales (Escherichia coli, Klebsiella aerogenes, Enterobacter cloacae, Serratia marcescens, Proteus spp., Povidencia spp., Citrobacter spp.. …)S. aureus, incluyendo SARMPasteurella multocida | Streptococcus del grupo viridansGemella morbillorumNeisseria comensalesStaphylococcus epidermidis y otros SCNMicrococcus spp.Enterococcus spp. |
MPP: microorganismos potencialmente patógenos; M-no-PP: microorganismos no potencialmente patógenos o flora habitual; SARM: Staphylococcus aureus resistente a meticilina; SCN: estafilococo coagulasa negatiiva.
La presencia de MPP en pacientes en fase de estabilidad clínica presenta diversas consecuencias, como una mayor inflamación neutrofílica bronquial3,7-11, mayor purulencia del esputo10,12, pérdida progresiva del FEV18,13-15, peor calidad de vida16,17, exacerbaciones más frecuentes y más graves11,18,19 y mayor mortalidad20,21. Probablemente se trata de una infección de bajo grado que puede contribuir a la progresión de la EPOC22.
Las evidencias científicas a este respecto presentan gran variabilidad metodológica, lo que genera controversia sobre las definiciones, el diagnóstico y el manejo de estos pacientes. Por ello, las guías de tratamiento de la EPOC establecen escasas recomendaciones al respecto23,24. Sin embargo, la presencia de MPP podría tener implicaciones terapéuticas, pudiendo condicionar el uso de ciertos tratamientos como los corticosteroides inhalados (CI) o la antibioterapia. Con la intención de orientar a los clínicos, desde la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) se planteó elaborar un documento de consenso basado en la escasa literatura científica existente y en la propia experiencia de los expertos. Este documento se refiere únicamente al diagnóstico y manejo de pacientes con EPOC y el aislamiento de MPP en muestras respiratorias.
La metodología de elaboración del presente documento se detalla en el Suplemento online 1.
Módulo 1. DefinicionesDada la escasa sensibilidad del esputo y la escasa monitorización microbiológica que habitualmente se lleva a cabo, es difícil asegurar la situación microbiológica del paciente con EPOC. No existen definiciones validadas para referirnos a la presencia de MPP en la vía aérea en estos pacientes, por lo que se han consensuado las siguientes definiciones:
- •
Primoinfección: el primer aislamiento de un determinado MPP en un cultivo de muestra respiratoria en fase estable de la enfermedad.
- •
Infección bronquial crónica (IBC): el crecimiento de un mismo MPP en al menos 3cultivos en un año, separados al menos 1mes.
- •
Erradicación: cuando no se aísla el MPP responsable de la IBC en al menos 3cultivos consecutivos durante un año, separados al menos 1mes.
- •
Si tras la erradicación se vuelve a aislar un MPP, se considerará nuevamente como una primoinfección, siempre que el paciente no estuviera recibiendo antibioterapia crónica.
- •
En el caso de pacientes que no se ajusten exactamente a estas definiciones, se deberá clasificar el caso en aquella que clínicamente más se le asemeje.
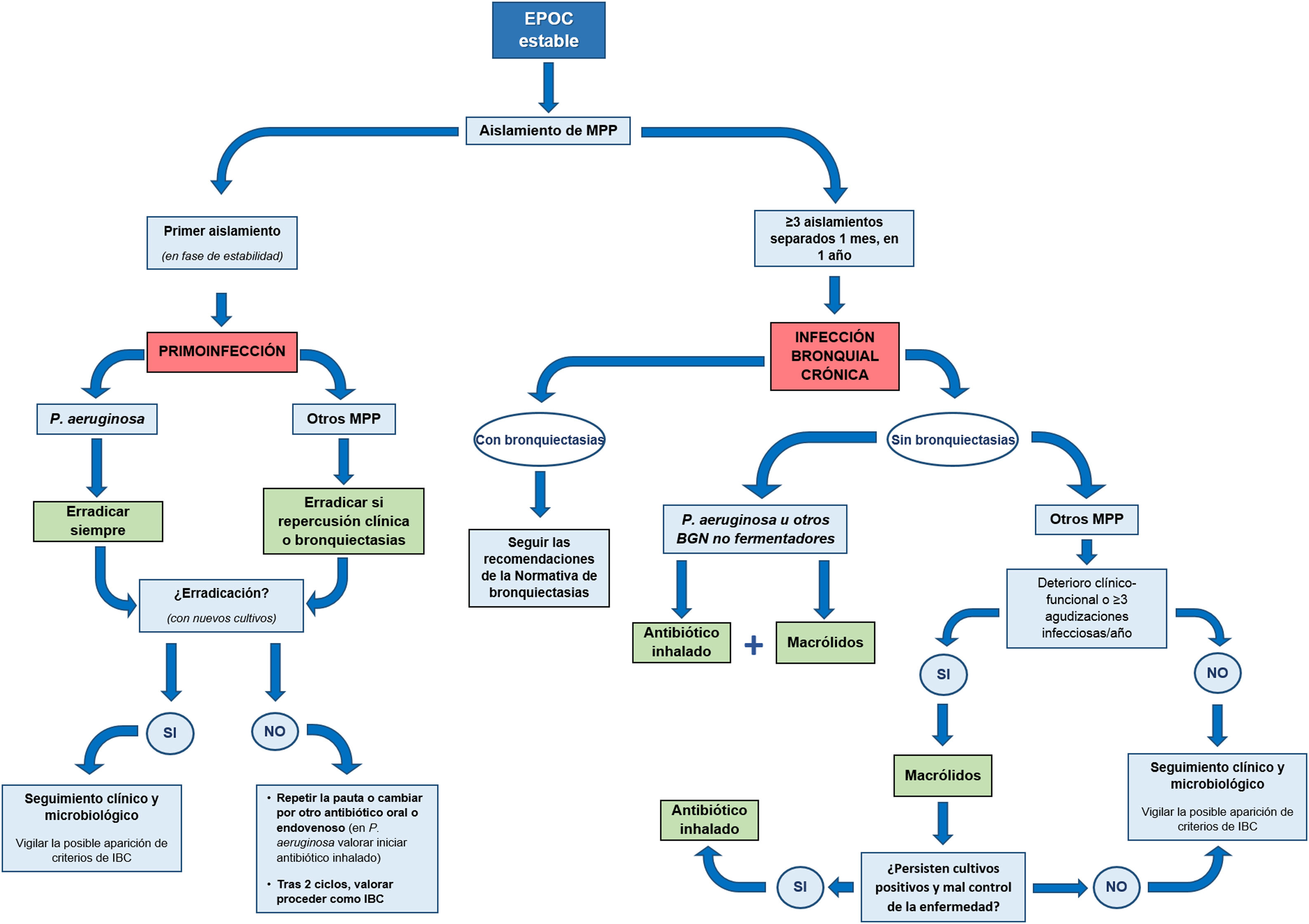
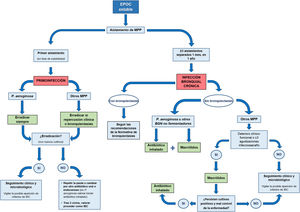
La figura 1 muestra un resumen del manejo de los pacientes con EPOC y aislamientos puntuales o persistentes de MPP.
Módulo 2. Aspectos microbiológicosEn la actualidad, para el aislamiento de MPP en muestras respiratorias se utilizan técnicas de cultivo convencionales a pesar de sus limitaciones25, ya que las técnicas moleculares, aunque muestran y permiten el estudio de la microbiota pulmonar26,27, presentan un elevado coste28,29.
Un caso especial es el de Pseudomonas aeruginosa, presente en el 3 al 20% de los pacientes estables con determinados factores de riesgo: FEV1<50%, más de 3exacerbaciones en el último año, uso crónico de corticoides orales, bronquiectasias, ingreso en cuidados intensivos y un índice BODE elevado5,30-33. Confiere un fenotipo más grave de EPOC que otros MPP, con más inflamación34, exacerbaciones y mortalidad19,35-37.
En lo que respecta a otros microorganismos, es frecuente el aislamiento de Aspergillus en pacientes con determinados factores de riesgo, y se asocia a más síntomas38,39. Por otro lado, en la última década han aumentado las tasas de detección de micobacterias no tuberculosas40, que se relacionan con exacerbaciones de EPOC más frecuentes y una pérdida funcional acelerada41.
Se han consensuado las siguientes pautas sobre el diagnóstico y seguimiento microbiológico de los pacientes con EPOC:
- •
Realizar un cultivo de esputo como parte del estudio inicial en EPOC de alto riesgo23 y/o con expectoración mucopurulenta habitual.
- •
Serán válidas las muestras con >25 leucocitos y <25 células epiteliales por campo (grados 4-5 de Murray-Washington)42. En caso de muestras no válidas, se debería repetir la toma de muestras (sobre todo si hay elevada sospecha de IBC o si se ha aislado P.aeruginosa).
- •
Llevar a cabo un seguimiento microbiológico a todos los pacientes con aislamientos previos de MPP en fase de estabilidad clínica o con alguno de los criterios de la tabla 218,43-45.
Tabla 2.Criterios clínicos para decidir el tratamiento de la primoinfección por MPP distintos de P. aeruginosa, en pacientes con EPOC en fase de estabilidad clínica (se debe cumplir al menos uno de ellos)a
Expectoración mucopurulenta/purulenta (3-8 de la escala de Murray) o hemoptoica habitual Mal control de la enfermedad132,133: aumento de la disnea, aumento de la necesidad de medicación de rescate, reducción de la actividad física, aumento de la purulencia del esputo, deterioro de la puntuación del CAT Empeoramiento progresivo de la función pulmonar Exacerbaciones infecciosas frecuentes (≥2 exacerbaciones que hayan requerido tratamiento antibiótico oral o ≥1 que haya requerido hospitalización o tratamiento antibiótico intravenoso) EPOC: enfermedad pulmonar obstructiva crónica; IBC: infección bronquial crónica; MPP: microorganismos potencialmente patógenos.
- •
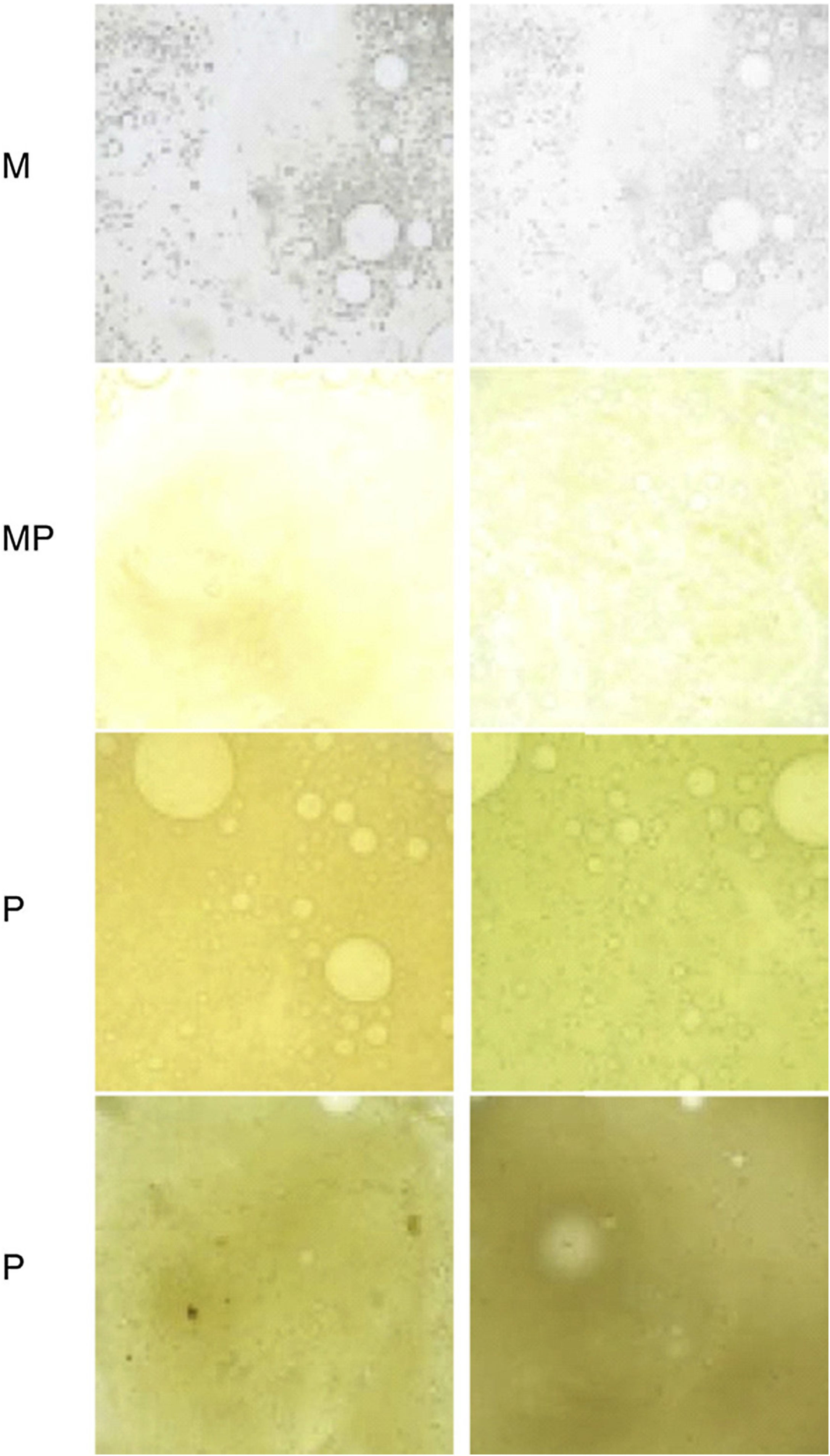
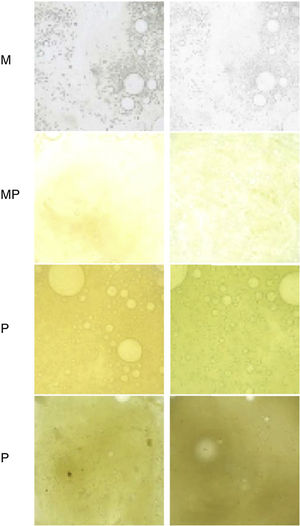
Monitorización del color del esputo, ya que se asocia con la presencia de MPP en EPOC estable46,47 (fig. 2).
Figura 2.Escala de Murray para valorar la coloración del esputo de menor a mayor purulencia.
M: mucoso; MP: mucopurulento; P: purulento.
Fuente: reproducido con permiso de Murray et al.47.
(0.37MB). - •
Se debería realizar cultivo de hongos y/o micobacterias no tuberculosas al menos una vez al año, aunque el paciente esté estable. Llevarlo a cabo asimismo en pacientes con: ≥2 exacerbaciones que hayan requerido esteroides sistémicos y/o antibióticos en el último año; tratamiento con CI a dosis altas; con bronquiectasias; si hay imágenes radiológicas compatibles con infección por micobacterias; antes y durante el tratamiento crónico con macrólidos (micobacterias); y si no hay mejoría clínica a pesar de tratar correctamente los MPP aislados38-41,48-50.
- •
En los casos en los que se aísle un microorganismo considerado potencialmente no patógeno («flora mixta orofaríngea» o «flora normal») no es necesaria ninguna actuación adicional, salvo que exista una elevada sospecha de IBC.
- •
Desde su recogida, el trasporte y el procesamiento de las muestras deben ser inferiores a 6h. En cualquier caso, evitar mantenerlas más de 24h a temperatura ambiente. Es preferible su almacenamiento a 4°C que a −20°C51.
La IBC puede contribuir a la aparición y/o progresión de bronquiectasias en pacientes con EPOC52. Estas se asocian con formas más graves y sintomáticas de EPOC: mayor producción y purulencia de esputo, más comorbilidades, mayor disnea, mayor obstrucción bronquial, exacerbaciones más frecuentes y graves, mayor carga bacteriana, mayor riesgo de IBC (particularmente por P.aeruginosa) y mayor riesgo de mortalidad44,45,53-59. Por tanto, la detección de bronquiectasias es importante, dado que puede beneficiarse de terapias específicas60. En estos pacientes el tratamiento antibiótico es clave, ya que, aunque la erradicación es prácticamente imposible, reduce los recuentos bacterianos, disminuye las exacerbaciones y mejora la función pulmonar61. No hay evidencia de que la presencia de bronquiectasias aumente la probabilidad de aislamientos resistentes a antibióticos convencionales62.
Se han consensuado las siguientes aseveraciones sobre la relación entre EPOC, IBC y bronquiectasias:
- •
Se debe llevar a cabo una tomografía computarizada de alta resolución de tórax para valorar la presencia de bronquiectasias en pacientes con determinadas características clínicas (tabla 3)51.
Tabla 3.Criterios clínicos que hacen recomendable llevar a cabo una tomografía computarizada de alta resolución de tórax en pacientes con EPOC, para valorar la presencia de bronquiectasias
EPOC de alto riesgo23 Exacerbaciones infecciosas frecuentes (≥2 exacerbaciones que hayan requerido tratamiento antibiótico oral o ≥1 que haya requerido hospitalización o tratamiento antibiótico intravenoso) Expectoración mucopurulenta o purulenta habitual Expectoración hemoptoica Alteraciones radiológicas sugestivas de bronquiectasias Aislamientos repetidos de MPP (o un único aislamiento de P.aeruginosa) Pérdida funcional progresiva Presencia de comorbilidades asociadas al desarrollo de bronquiectasias51 MPP: microorganismos potencialmente patógenos.
- •
Si en el paciente coexisten EPOC y bronquiectasias, se tendrán en cuenta las definiciones y pautas terapéuticas propuestas por las normativas de bronquiectasias en lo que respecta al aislamiento de MPP en cultivos de muestras respiratorias51.
- •
En el abordaje terapéutico de estos pacientes se deben seguir tanto las guías de tratamiento de la EPOC23,24 como las de bronquiectasias63-65.
En los pacientes con EPOC sin bronquiectasias no existen evidencias que indiquen si hay que tratar la primoinfección, ni cuál es la mejor estrategia erradicadora. Sin embargo, P.aeruginosa tiene tendencia a persistir, sobre todo sus cepas mucoides66, y al igual que Haemophilus influenzae, tiene tendencia a formar biopelículas, lo que dificulta la acción de los antimicrobianos y favorece la persistencia del microorganismo67-70.
Se han consensuado las siguientes pautas sobre el tratamiento de la primoinfección (fig. 1):
- •
En la primoinfección por P.aeruginosa se aconseja indicar siempre tratamiento erradicador.
- •
En el resto de MPP, considerar realizar tratamiento erradicador en pacientes estables con bronquiectasias o al menos uno de los criterios de la tabla 2.
- •
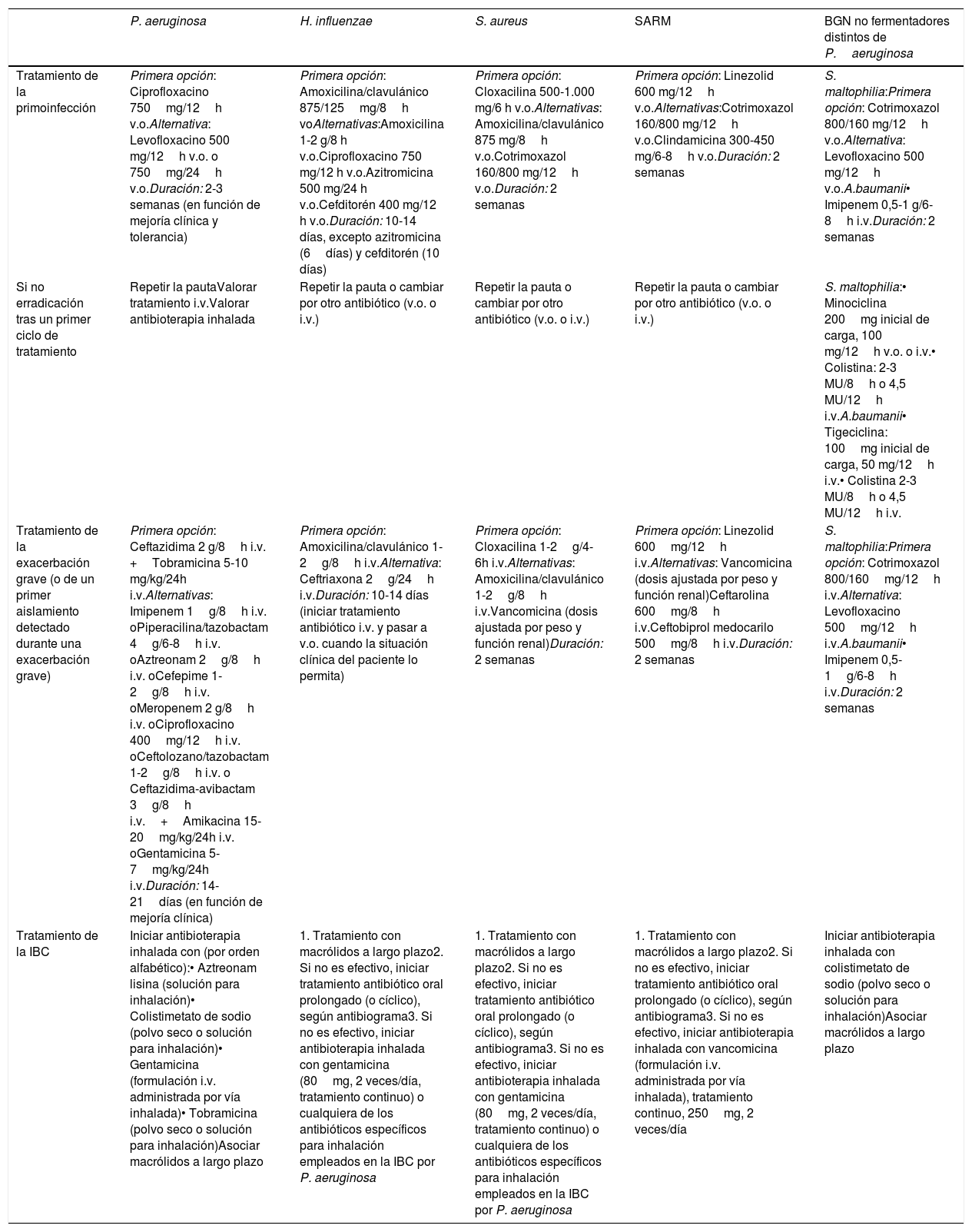
La tabla 4 muestra las pautas de tratamiento erradicador de los MPP más frecuentes.
Tabla 4.Recomendaciones de tratamiento antibiótico en pacientes con EPOC sin bronquiectasias, con aislamientos de MPP en muestras respiratorias
P. aeruginosa H. influenzae S. aureus SARM BGN no fermentadores distintos de P.aeruginosa Tratamiento de la primoinfección Primera opción: Ciprofloxacino 750mg/12h v.o.Alternativa: Levofloxacino 500 mg/12h v.o. o 750mg/24h v.o.Duración: 2-3 semanas (en función de mejoría clínica y tolerancia) Primera opción: Amoxicilina/clavulánico 875/125mg/8h voAlternativas:Amoxicilina 1-2 g/8 h v.o.Ciprofloxacino 750 mg/12 h v.o.Azitromicina 500 mg/24 h v.o.Cefditorén 400 mg/12 h v.o.Duración: 10-14 días, excepto azitromicina (6días) y cefditorén (10 días) Primera opción: Cloxacilina 500-1.000 mg/6 h v.o.Alternativas: Amoxicilina/clavulánico 875 mg/8h v.o.Cotrimoxazol 160/800 mg/12h v.o.Duración: 2 semanas Primera opción: Linezolid 600 mg/12h v.o.Alternativas:Cotrimoxazol 160/800 mg/12h v.o.Clindamicina 300-450 mg/6-8h v.o.Duración: 2 semanas S. maltophilia:Primera opción: Cotrimoxazol 800/160 mg/12h v.o.Alternativa: Levofloxacino 500 mg/12h v.o.A.baumanii• Imipenem 0,5-1 g/6-8h i.v.Duración: 2 semanas Si no erradicación tras un primer ciclo de tratamiento Repetir la pautaValorar tratamiento i.v.Valorar antibioterapia inhalada Repetir la pauta o cambiar por otro antibiótico (v.o. o i.v.) Repetir la pauta o cambiar por otro antibiótico (v.o. o i.v.) Repetir la pauta o cambiar por otro antibiótico (v.o. o i.v.) S. maltophilia:• Minociclina 200mg inicial de carga, 100 mg/12h v.o. o i.v.• Colistina: 2-3 MU/8h o 4,5 MU/12h i.v.A.baumanii• Tigeciclina: 100mg inicial de carga, 50 mg/12h i.v.• Colistina 2-3 MU/8h o 4,5 MU/12h i.v. Tratamiento de la exacerbación grave (o de un primer aislamiento detectado durante una exacerbación grave) Primera opción: Ceftazidima 2 g/8h i.v. +Tobramicina 5-10 mg/kg/24h i.v.Alternativas: Imipenem 1g/8h i.v. oPiperacilina/tazobactam 4g/6-8h i.v. oAztreonam 2g/8h i.v. oCefepime 1-2g/8h i.v. oMeropenem 2 g/8h i.v. oCiprofloxacino 400mg/12h i.v. oCeftolozano/tazobactam 1-2g/8h i.v. o Ceftazidima-avibactam 3g/8h i.v.+Amikacina 15-20mg/kg/24h i.v. oGentamicina 5-7mg/kg/24h i.v.Duración: 14-21días (en función de mejoría clínica) Primera opción: Amoxicilina/clavulánico 1-2g/8h i.v.Alternativa: Ceftriaxona 2g/24h i.v.Duración: 10-14 días (iniciar tratamiento antibiótico i.v. y pasar a v.o. cuando la situación clínica del paciente lo permita) Primera opción: Cloxacilina 1-2g/4-6h i.v.Alternativas: Amoxicilina/clavulánico 1-2g/8h i.v.Vancomicina (dosis ajustada por peso y función renal)Duración: 2 semanas Primera opción: Linezolid 600mg/12h i.v.Alternativas: Vancomicina (dosis ajustada por peso y función renal)Ceftarolina 600mg/8h i.v.Ceftobiprol medocarilo 500mg/8h i.v.Duración: 2 semanas S. maltophilia:Primera opción: Cotrimoxazol 800/160mg/12h i.v.Alternativa: Levofloxacino 500mg/12h i.v.A.baumanii• Imipenem 0,5-1g/6-8h i.v.Duración: 2 semanas Tratamiento de la IBC Iniciar antibioterapia inhalada con (por orden alfabético):• Aztreonam lisina (solución para inhalación)• Colistimetato de sodio (polvo seco o solución para inhalación)• Gentamicina (formulación i.v. administrada por vía inhalada)• Tobramicina (polvo seco o solución para inhalación)Asociar macrólidos a largo plazo 1. Tratamiento con macrólidos a largo plazo2. Si no es efectivo, iniciar tratamiento antibiótico oral prolongado (o cíclico), según antibiograma3. Si no es efectivo, iniciar antibioterapia inhalada con gentamicina (80mg, 2 veces/día, tratamiento continuo) o cualquiera de los antibióticos específicos para inhalación empleados en la IBC por P. aeruginosa 1. Tratamiento con macrólidos a largo plazo2. Si no es efectivo, iniciar tratamiento antibiótico oral prolongado (o cíclico), según antibiograma3. Si no es efectivo, iniciar antibioterapia inhalada con gentamicina (80mg, 2 veces/día, tratamiento continuo) o cualquiera de los antibióticos específicos para inhalación empleados en la IBC por P. aeruginosa 1. Tratamiento con macrólidos a largo plazo2. Si no es efectivo, iniciar tratamiento antibiótico oral prolongado (o cíclico), según antibiograma3. Si no es efectivo, iniciar antibioterapia inhalada con vancomicina (formulación i.v. administrada por vía inhalada), tratamiento continuo, 250mg, 2 veces/día Iniciar antibioterapia inhalada con colistimetato de sodio (polvo seco o solución para inhalación)Asociar macrólidos a largo plazo IBC: infección bronquial crónica; i.v.: intravenoso; v.o.: vía oral; SARM: S. aureus resistente a la meticilina.
- •
Se aconseja constatar la erradicación con cultivos de esputo al menos 15días tras finalizar el tratamiento. Si no se consigue la erradicación tras dos ciclos, valorar proceder como IBC (tabla 4).
La terapia con antibióticos inhalados (AI) ha experimentado un incremento notable debido a sus buenos resultados en el tratamiento de la IBC en fibrosis quística71 y en bronquiectasias72. Alcanzan elevada concentración en el árbol bronquial y producen escasos efectos adversos sistémicos73,74. No hay ensayos clínicos publicados en EPOC, pero sí algunos pequeños estudios con colistina, tobramicina y amoxicilina-ácido clavulánico, con buenos resultados y escasos efectos adversos75-79.
Se han consensuado las siguientes pautas sobre el tratamiento con AI en pacientes con EPOC e IBC (fig. 1 y tabla 4). En todos los casos se debe asegurar que el paciente está recibiendo un tratamiento correcto de la EPOC (incluyendo una correcta prescripción, técnica inhalatoria y adherencia).
- •
Si coexisten EPOC y bronquiectasias se seguirán las normativas de bronquiectasias en cuanto al tratamiento de la IBC con AI63.
- •
Pautar AI en pacientes con IBC por P.aeruginosa u otros bacilos gramnegativos no fermentadores de especial virulencia (tabla 1).
- •
En pacientes con IBC por otros MPP, con deterioro clínico-funcional o frecuentes exacerbaciones infecciosas, tratar con macrólidos a largo plazo23,80. Si a pesar de ello persisten cultivos positivos y un mal control de la enfermedad, iniciar AI.
- •
La decisión de dar un AI u otro no depende del antibiograma, sino del MPP, ya que el AI alcanza en la mucosa bronquial concentraciones muy superiores a la CMI. Hay que elegir un AI al que se conoce que es sensible la familia del MPP.
- •
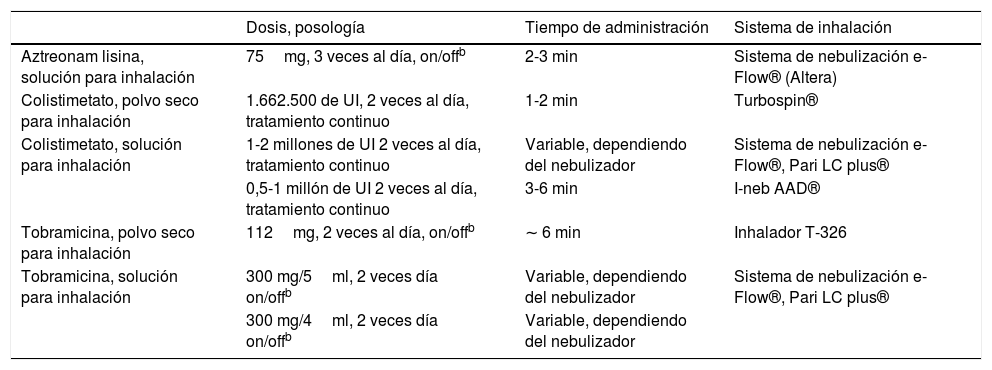
La posología a seguir es la misma a la utilizada en bronquiectasias (tabla 5).
Tabla 5.Antibióticos específicamente diseñados para ser inhalados disponibles en el mercadoa
Dosis, posología Tiempo de administración Sistema de inhalación Aztreonam lisina, solución para inhalación 75mg, 3 veces al día, on/offb 2-3 min Sistema de nebulización e-Flow® (Altera) Colistimetato, polvo seco para inhalación 1.662.500 de UI, 2 veces al día, tratamiento continuo 1-2 min Turbospin® Colistimetato, solución para inhalación 1-2 millones de UI 2 veces al día, tratamiento continuo Variable, dependiendo del nebulizador Sistema de nebulización e-Flow®, Pari LC plus® 0,5-1 millón de UI 2 veces al día, tratamiento continuo 3-6 min I-neb AAD® Tobramicina, polvo seco para inhalación 112mg, 2 veces al día, on/offb ∼ 6 min Inhalador T-326 Tobramicina, solución para inhalación 300 mg/5ml, 2 veces día on/offb Variable, dependiendo del nebulizador Sistema de nebulización e-Flow®, Pari LC plus® 300 mg/4ml, 2 veces día on/offb Variable, dependiendo del nebulizador aEn casos excepcionales, según el tipo de microorganismo potencialmente patógeno o de su sensibilidad a antibióticos, pueden administrarse por vía nebulizada las formulaciones parenterales de algunos antibióticos: gentamicina (80mg/12h de forma continua), vancomicina (250mg/12h de forma continua) o ceftazidima (1g/12h de forma continua).
- •
Mantener el tratamiento con AI mientras que se aprecie un beneficio clínico: esputo lo menos purulento posible según la escala de colores de esputo de la figura 2 y reducción de las exacerbaciones. Valorar retirar a partir de los 6meses en caso de estabilidad clínica y con cultivos negativos. En ese caso, realizar seguimiento microbiológico estricto, y en caso de reaparecer la IBC, tratar a largo plazo.
- •
Dado el posible riesgo de que condicionen alergia, broncoespasmo, disnea, tos o hemoptisis81-83, considerar una serie de precauciones al tratar con AI, sobre todo en pacientes con EPOC más grave:
- -
Educación sobre el uso y el mantenimiento de los dispositivos.
- -
Inhalación previa de broncodilatadores de acción rápida.
- -
Administrar la primera dosis en el medio hospitalario, ya sea en hospital de día (observación en las 2-3h posteriores) o en una hospitalización corta (en los pacientes más graves).
- -
En EPOC grave considerar el riesgo de broncoconstricción inducida por el AI. Valorar la posibilidad de realizar espirometría antes y después de la primera dosis (caída del FEV1 ≥15%)84. Si se constata broncoconstricción, valorar cambiar el tipo de AI, el diluyente o el volumen de nebulización.
- •
Valorar el riesgo de nefrotoxicidad y ototoxicidad por aminoglucósidos: evitar su uso en insuficiencia renal crónica grave, analítica semestral durante el primer año (posteriormente, anual), evaluar pérdida auditiva durante el tratamiento85.
- •
En el caso de que el paciente lleve a cabo técnicas de drenaje bronquial o tratamiento con suero salino hipertónico nebulizado, estos deben preceder a los AI.
Los macrólidos (el más estudiado es la azitromicina) modulan la inflamación bronquial neutrofílica, interfieren en la formación de biopelículas, reducen la carga bacteriana y reducen el número de exacerbaciones86-89. Aunque la aparición de resistencias es un posible riesgo a largo plazo90,91, actualmente se considera que los beneficios del este tratamiento superan a los riesgos23,24,90,92.
Se han consensuado las siguientes pautas sobre el tratamiento con macrólidos en pacientes con EPOC e IBC (fig. 1):
- •
Iniciar tratamiento con macrólidos en pacientes estables con 3 o más exacerbaciones/año (moderadas o graves, que hayan requerido tratamiento antibiótico), a pesar del tratamiento de base correcto.
- •
En el caso de IBC por P.aeruginosa se aconseja no pautarlos en monoterapia, sino asociados a AI.
- •
Las dos pautas con mayor evidencia son: azitromicina 500mg/día, tres días/semana o azitromicina 250mg/día, cada día, durante un año. Posteriormente individualizar en función de respuesta clínica (reducción de las exacerbaciones y de la expectoración) y de la aparición de efectos secundarios.
- •
Debido a la distribución estacional de las exacerbaciones93, se puede plantear descansar durante los meses cálidos, si hay un periodo largo de estabilidad sin exacerbaciones y escasa secreción mucosa, valorando reiniciar en otoño (o antes, si reaparecen exacerbaciones).
- •
Antes del inicio del tratamiento se deben llevar a cabo: electrocardiograma, análisis de función hepática, cultivo de micobacterias y valoración auditiva. Valorar repetirlos, al menos anualmente, en tratamientos prolongados. En el Suplemento online 2 se detallan los requisitos y precauciones a tener en cuenta al iniciar un tratamiento a largo plazo con macrólidos.
Los CI reducen las exacerbaciones y mejoran los síntomas y la calidad de vida de los pacientes con EPOC avanzada94. Su uso en pacientes con EPOC, exacerbaciones bacterianas frecuentes, IBC y/o cifras bajas de eosinófilos sanguíneos se asocia a efectos adversos: alteran la respuesta inmunitaria antiviral95, modifican la composición del microbioma96, aumentan la carga bacteriana97, el riesgo de infecciones de vías altas, de neumonía98-100 y de micobacterias no tuberculosas101,102.
Se han consensuado las siguientes aseveraciones sobre el tratamiento con CI en pacientes con EPOC e IBC:
- •
Se debe tener especial precaución con el uso de CI en pacientes con IBC63.
- •
En caso de pautarlos, valorar hacerlo a la dosis más baja posible.
- •
Reevaluar la relación riesgo/beneficio de su uso en pacientes que no presenten: eosinofilia (<100 eosinófilos/mm3 de forma habitual) o rasgos consistentes con asma concomitante23.
A pesar de su infrautilización, los programas de rehabilitación y fisioterapia respiratoria mejoran diversos resultados de salud, como síntomas bronquiales, función respiratoria, calidad de vida y riesgo de reingreso hospitalario103,104. Los programas de actividad física deben ser una parte integral y complementaria de la rehabilitación respiratoria, ya que mejoran el estado físico y promueven un estilo de vida más saludable en pacientes con EPOC105.
El uso prolongado de mucolíticos en EPOC podría tener beneficios clínicos en pacientes exacerbadores, sobre todo la N-acetil cisteína y la carbocisteína93,106-109.
Dado el mayor riesgo de desnutrición y mayor requerimiento energético de los pacientes con EPOC, la valoración nutricional, una dieta y una nutrición adecuadas son fundamentales110-112.
El uso de probióticos parece reducir la tasa de infecciones del tracto respiratorio superior113, y su potencial efecto también parece prometedor para infecciones pulmonares114. También pueden ayudar a evitar la diarrea y la disbiosis inducida por los antibióticos115-117.
Se han consensuado las siguientes afirmaciones sobre otros tratamientos en pacientes con EPOC e IBC:
- •
Se debe prescribir un programa de rehabilitación respiratoria (que incluya educación sanitaria, fisioterapia respiratoria, entrenamiento muscular y programas de actividad física) a pacientes con expectoración habitual, grado de disnea ≥2 o escasa actividad física.
- •
El tratamiento prolongado con N-acetil cisteína o carbocisteína podrá considerarse en pacientes con EPOC con exacerbaciones frecuentes23,24.
- •
Debe hacerse una valoración nutricional en los pacientes con EPOC e IBC que incluya al menos: evaluación del índice de masa corporal, valoración de la ingesta y evaluación longitudinal de la pérdida ponderal progresiva.
- •
Valorar, a criterio del médico, el posible beneficio del uso de probióticos en pacientes que precisen varios ciclos de antibióticos al año, coincidiendo con cada ciclo, para evitar las diarreas y la disbiosis intestinal.
Las exacerbaciones de la EPOC presentan una etiología muy variada. La etiología bacteriana suele estar mediada por un aumento de la carga bacteriana bronquial118, la adquisición de nuevas cepas de una determinada bacteria119,120 o cambios en el microbioma bronquial121. No obstante, la evidencia sugiere que el MPP que coloniza la vía aérea inferior durante la fase estable se relacionará con el MPP aislado durante la exacerbación122.
Se han consensuado las siguientes pautas sobre el manejo de las exacerbaciones en pacientes con EPOC e IBC:
- •
Se debería recoger siempre una muestra de esputo para cultivo al inicio de la exacerbación, antes de iniciar el tratamiento antibiótico.
- •
La presencia de una IBC previa debería orientar al clínico a elegir el antibiótico de acuerdo con los resultados del último antibiograma (tratamiento anticipado) y los datos de sensibilidad antibiótica del centro (tabla 4).
- •
Ajustar el tratamiento si el resultado del nuevo cultivo es diferente al previo o si la evolución clínica de la exacerbación es desfavorable.
- •
Si en una exacerbación se aísla un MPP diferente del que produce la IBC, se administrará un tratamiento antibiótico que cubra ambos MPP (tabla 4)9,15,121-128.
- •
En general, en toda exacerbación de EPOC se deberían valorar los factores de riesgo de que P.aeruginosa esté implicada en la misma.
- •
Tras una exacerbación con aislamiento de un MPP, siempre que sea posible debería llevarse a cabo un cultivo de control al menos 15días tras finalizar el tratamiento antibiótico.
Se han consensuado las siguientes pautas de seguimiento de los pacientes con EPOC e IBC (tabla 6):
- •
El seguimiento inicial tras la primoinfección está marcado por la necesidad de monitorización microbiológica (valorar erradicación, reducción de carga bacteriana o de nuevos MPP) y clínica (reducción de síntomas y exacerbaciones).
- •
El cronograma de visitas de control dependerá de la gravedad de la EPOC, de la frecuencia de exacerbaciones y de la evolución funcional. En pacientes graves (Gold D, FEV1<50% y/o insuficiencia respiratoria crónica) pueden ser necesarios controles al menos cada 3meses, que pueden espaciarse en pacientes más leves o estables a cada 4-6meses.
- •
Durante los primeros 2años tras la primoinfección se debería valorar monitorizar la situación microbiológica del paciente en cada visita; las visitas se irán espaciando si el paciente continúa estable.
- •
Deberían obtenerse al menos 3esputos/año y siempre que haya una exacerbación con aumento de la cantidad o purulencia del esputo, antes de iniciar el tratamiento antibiótico.
- •
Llevar a cabo al menos una espirometría al año para detectar los declinadores rápidos24. En pacientes que inician AI, hacer una espirometría cada 3-6meses durante el primer año. También tras una exacerbación grave o tras un cambio en el tratamiento de mantenimiento.
Información a registrar durante las visitas de seguimiento en pacientes con EPOC e infección bronquial crónica. Exploraciones complementarias recomendadas
| En cada visita | Anual | En exacerbaciones | Otras periodicidades | |
|---|---|---|---|---|
| Datos clínicos | ||||
| Síntomas y signos en fase de estabilidad:Disnea (escala mMRC)Criterios clínicos de bronquitis crónicaVolumen (semicuantitativo marcado en un recipiente graduado); color (escala de Murray47)Clínica sugestiva de asma/hiperreactividad bronquialExpectoración hemoptoicaSíntomas sistémicos (fiebre, pérdida de peso, etc.)SatO2 | ||||
| Exacerbaciones:Número de exacerbaciones con antibióticos y/o corticoidesNúmero de ingresos por exacerbación o tratamientos antibióticos intravenosos domiciliarios | ||||
| Impacto de la enfermedad:Calidad de vida: cuestionario CAT134Gravedad: puntuación índice BODEx135 | ||||
| Tratamientos | ||||
| Tratamiento no farmacológicoSituación del tabaquismoEjercicio y actividad físicaFisioterapiaVacunación antigripal y antineumocócica | Vacunación antigripal estacionalVacunación antineumocócica (preferentemente conjugada 13-valente) una vez en la vida | |||
| Tratamiento farmacológicoCumplimentaciónEfectos adversosTécnica inhalatoriaSatisfacción con los dispositivos de inhalación | ||||
| Laboratorio / microbiología | ||||
| Cultivo de esputo | Solicitar también cultivo de hongos y/o micobacterias una vez al año, o si sospecha clínico/radiológica, así como antes/durante el tratamiento con macrólidos a largo plazo (ver módulo 2) | |||
| Analíticaa | Al diagnóstico de la IBCAl inicio de tratamiento crónico con macrólidos o antibióticos inhalados; en el caso de los aminoglucósidos inhalados, hacer cada 6 meses | |||
| Pruebas de función respiratoria | ||||
| Espirometría forzada | ||||
| Prueba de la marcha de 6 min | En caso de deterioro clínico, funcional y/o de la SatO2 | |||
| Pletismografía/difusión | Según clínica y disponibilidad | |||
| Pruebas de imagen | ||||
| Radiografía de tórax | ||||
| Tomografía computarizada de alta resolución | Al diagnóstico de la IBC (para valorar posibles bronquiectasias asociadas)Cada 2 años en caso de deterioro clínico-funcional rápido, hemoptisis frecuente o factores de riesgo para una mala progresiónPara el resto de los pacientes cada 4-5 años63 | |||
| Otras exploraciones complementarias | ||||
| Electrocardiograma | Al diagnóstico de IBC; antes de iniciar tratamiento con azitromicina a largo plazo | |||
| Evaluar audición±audiometría | Antes de iniciar y durante el tratamiento con azitromicina a largo plazoHacer audiometría en caso de pérdida de audición durante el mismo |
CAT: COPD assessment test; IBC: infección bronquial crónica; mMRC: modified Medical Research Council.
Valoración de marcadores de inflamación (proteína C reactiva), alfa1-antitripsina136, eosinofilia, parámetros nutricionales (albúmina) o efectos adversos del tratamiento (función renal, hepática, etc.).
El presente documento ha sido elaborado con el objetivo de aportar a los clínicos pautas sobre cómo detectar, definir y tratar a los pacientes con EPOC en los que se aíslan MPP con mayor o menor frecuencia. Dada la escasez de publicaciones sobre el tema, se optó por llevar a cabo un texto con propuestas clínicas consensuadas entre un amplio grupo de expertos, basadas en la escasa literatura existente y en la abundante experiencia de los mismos. La tabla 7 resume todas las aseveraciones de los 10 módulos, y todas han alcanzado un amplio grado de consenso. Por todo ello, este conjunto de recomendaciones estará sujeto a una continua revisión para modificar su contenido conforme vayan apareciendo nuevas evidencias científicas.
Resumen de las recomendaciones clínicas para el manejo de los pacientes con EPOC y aislamientos de microorganismos potencialmente patógenos. Se especifica el grado de consenso alcanzado por parte del comité científico para cada una de ellas (% de revisores que han marcado cada una de las puntuaciones del 1 al 5 de la escala Likert)
| En desacuerdo(puntuación 1 o 2) | Indiferente(puntuación 3) | En acuerdo(puntuación 4 o 5) | |
|---|---|---|---|
| Módulo 1. Definiciones | |||
| Primoinfección: el primer aislamiento de un determinado MPP en un cultivo de muestra respiratoria en fase estable de la enfermedad | 2,9 | 2,9 | 94,2 |
| Infección bronquial crónica (IBC): el crecimiento de un mismo MPP en al menos 3cultivos en un año, separados al menos 1mes | − | 2,9 | 97,1 |
| Erradicación: cuando no se aísla el MPP responsable de la IBC en al menos 3cultivos consecutivos durante un año, separados al menos 1mes | 2,9 | − | 97,1 |
| Si tras la erradicación se vuelve a aislar un MPP, se considerará nuevamente como una primoinfección, siempre que el paciente no estuviera recibiendo antibioterapia crónica | − | 2,9 | 97,1 |
| En el caso de pacientes que no se ajusten exactamente a estas definiciones, se deberá clasificar el caso en aquella que clínicamente más se le asemeje | − | 8,6 | 91,4 |
| Módulo 2. Aspectos microbiológicos | |||
| Realizar cultivo de esputo como parte del estudio inicial en EPOC de alto riesgo y/o con expectoración mucopurulenta habitual | − | − | 100 |
| Serán válidas las muestras con >25 leucocitos y <25 células epiteliales por campo (grados 4-5 de Murray-Washington). En caso de muestras no válidas, se debería repetir la toma de muestras (sobre todo si hay elevada sospecha de IBC o si se ha aislado P.aeruginosa) | − | 5,8 | 94,2 |
| Llevar a cabo un seguimiento microbiológico a todos los pacientes con aislamientos previos de MPP en fase de estabilidad clínica o con alguno de los criterios de la tabla 2 | − | − | 100 |
| Monitorización del color del esputo, ya que se asocia con la presencia de MPP en EPOC estable (fig. 2) | − | 2,9 | 97,1 |
| Se debería realizar cultivo de hongos y/o micobacterias no tuberculosas al menos una vez al año, aunque el paciente esté estable. Llevarlo a cabo asimismo en pacientes con: ≥2 exacerbaciones que hayan requerido esteroides sistémicos y/o antibióticos en el último año; tratamiento con CI a dosis altas; con bronquiectasias; si hay imágenes radiológicas compatibles con infección por micobacterias; antes y durante el tratamiento crónico con macrólidos (micobacterias); y si no hay mejoría clínica a pesar de tratar correctamente los MPP aislados | − | 2,9 | 97,1 |
| En los casos en los que se aísle un microorganismo considerado potencialmente no patógeno («flora mixta orofaríngea» o «flora normal») no es necesaria ninguna actuación adicional, salvo que exista una elevada sospecha de IBC | − | 2,9 | 97,1 |
| Desde su recogida, el trasporte y procesamiento de las muestras debe ser inferior a 6h. En cualquier caso, evitar mantenerlas más de 24h a temperatura ambiente. Es preferible su almacenamiento a 4°C que a −20°C | − | 2,9 | 97,1 |
| Módulo 3. Relación entre EPOC, infección bronquial crónica y presencia de bronquiectasias | |||
| Se debe llevar a cabo una tomografía computarizada de alta resolución de tórax para valorar la presencia de bronquiectasias en pacientes con determinadas características clínicas (tabla 3) | − | − | 100 |
| Si en el paciente coexisten EPOC y bronquiectasias, se tendrán en cuenta las definiciones y pautas terapéuticas propuestas por las normativas de bronquiectasias, en lo que respecta al aislamiento de MPP en cultivos de muestras respiratorias | − | 5,8 | 94,2 |
| En el abordaje terapéutico de estos pacientes se deben seguir tanto las guías de tratamiento de la EPOC como las de bronquiectasias | − | 2,9 | 97,1 |
| Módulo 4. Tratamiento de la primoinfección | |||
| En la primoinfección por P.aeruginosa se aconseja indicar siempre tratamiento erradicador | − | 2,9 | 97,1 |
| En el resto de MPP, considerar realizar tratamiento erradicador en pacientes estables con bronquiectasias o al menos uno de los criterios de la tabla 2 | − | 2,9 | 97,1 |
| La tabla 4 muestra las pautas de tratamiento erradicador de los MPP más frecuentes | − | − | 100 |
| Se aconseja constatar la erradicación con cultivos de esputo al menos 15días tras finalizar el tratamiento. Si no se consigue la erradicación tras dos ciclos, valorar proceder como IBC (tabla 4) | − | − | 100 |
| Módulo 5. Tratamiento antibiótico inhalado | |||
| Si coexisten EPOC y bronquiectasias se seguirán las normativas de bronquiectasias en cuanto al tratamiento de la IBC con AI | 2,9 | − | 97,1 |
| Pautar AI en pacientes con IBC por P.aeruginosa u otros bacilos gramnegativos no fermentadores (tabla 1), dada su especial virulencia | 2,9 | − | 97,1 |
| En pacientes con IBC por otros MPP, con deterioro clínico-funcional o frecuentes exacerbaciones infecciosas, tratar con macrólidos a largo plazo. Si a pesar de ello persisten cultivos positivos y un mal control de la enfermedad, iniciar AI | 2,9 | 2,9 | 94,2 |
| La decisión de dar un AI u otro no depende del antibiograma, sino del MPP. Hay que elegir un AI al que se conoce que es sensible la familia del MPP | 2,9 | − | 97,1 |
| La posología a seguir es la misma a la utilizada en bronquiectasias (tabla 5) | − | − | 100 |
| Mantener el tratamiento mientras que se aprecie un beneficio clínico: esputo lo menos purulento posible según la escala de colores de esputo de la figura 2 y reducción de las exacerbaciones. Valorar retirar a partir de los 6meses si el paciente está clínicamente estable y con cultivos negativos. En ese caso, realizar seguimiento microbiológico estricto, y en caso de reaparecer la IBC, tratar a largo plazo | − | 2,9 | 97,1 |
| Dado el posible riesgo de que condicionen alergia, broncoespasmo, disnea, tos o hemoptisis, tener una serie de precauciones al tratar con AI: educación sobre el uso y mantenimiento de los dispositivos; inhalación previa de broncodilatadores de acción rápida; administrar la primera dosis en el medio hospitalario; en EPOC grave (FEV1<50%), considerar el riesgo de broncoconstricción inducida por el AI, valorando la posibilidad de realizar espirometría antes y después de la primera dosis (caída del FEV1≥15%) | − | 5,8 | 94,2 |
| Valorar el riesgo de nefrotoxicidad y ototoxicidad por aminoglucósidos: evitar su uso en pacientes con insuficiencia renal crónica grave, llevar a cabo analítica semestral durante el primer año (posteriormente, anual), valoración de pérdida auditiva durante el tratamiento | − | − | 100 |
| En el caso de que el paciente lleve a cabo técnicas de drenaje bronquial o tratamiento con suero salino hipertónico nebulizado, estos tratamientos deben preceder a los AI | − | − | 100 |
| Módulo 6. Tratamiento con macrólidos a largo plazo | |||
| Iniciar tratamiento con macrólidos en pacientes estables con 3 o más exacerbaciones/año (moderadas o graves, que hayan requerido tratamiento antibiótico), a pesar del tratamiento de base correcto | 2,9 | 5,8 | 91,3 |
| En el caso de IBC por P.aeruginosa se aconseja no pautarlos en monoterapia, sino asociados a AI | 5,8 | 8,5 | 85,7 |
| Las dos pautas con mayor evidencia son: azitromicina 500mg/día, tres días/semana, o azitromicina 250mg/día, cada día, durante un año. Posteriormente individualizar en función de respuesta clínica (reducción de exacerbaciones y de la expectoración) y de la aparición de efectos secundarios | − | − | 100 |
| Debido a la distribución estacional de las exacerbaciones, se puede plantear descansar durante los meses cálidos, si hay un periodo largo de estabilidad sin exacerbaciones y escasa secreción mucosa, valorando reiniciar en otoño (o antes, si reaparecen exacerbaciones) | 2,9 | 11,4 | 85,7 |
| Antes del inicio del tratamiento se deben llevar a cabo: electrocardiograma, análisis de función hepática, cultivo de micobacterias y valoración auditiva. Valorar repetirlos, al menos anualmente, en tratamientos prolongados | − | − | 100 |
| Módulo 7. Tratamiento con corticosteroides inhalados | |||
| Se debe tener especial precaución con el uso de CI en pacientes con IBC | − | 5,8 | 94,2 |
| En caso de pautarlos, valorar hacerlo a la dosis más baja posible | 2,9 | − | 97,1 |
| Reevaluar la relación riesgo/beneficio de su uso en pacientes que no presenten: eosinofilia (<100 eosinófilos/mm3 de forma habitual) o rasgos consistentes con asma concomitante | 5,8 | 2,9 | 91,3 |
| Módulo 8. Otros tratamientos de mantenimiento | |||
| Se debe prescribir un programa de rehabilitación respiratoria (que incluya educación sanitaria, fisioterapia respiratoria, entrenamiento muscular y programas de actividad física) a pacientes con expectoración habitual, grado de disnea ≥2 o escasa actividad física | − | 2,9 | 97,1 |
| El tratamiento prolongado con N-acetil cisteína o carbocisteína podrá considerarse en pacientes con EPOC con exacerbaciones frecuentes | − | 11,4 | 88,6 |
| Debe hacerse una valoración nutricional en los pacientes con EPOC e IBC que incluya al menos: evaluación del índice de masa corporal, valoración de la ingesta y evaluación longitudinal de la pérdida ponderal progresiva | − | − | 100 |
| Valorar, a criterio del médico, el posible beneficio del uso de probióticos en pacientes que precisen varios ciclos de antibióticos al año, coincidiendo con cada ciclo, para evitar las diarreas y la disbiosis intestinal | − | 25,7 | 74,3 |
| Módulo 9. Manejo de las exacerbaciones de pacientes con EPOC e infección bronquial crónica | |||
| Se debería recoger siempre una muestra de esputo para cultivo al inicio de la exacerbación, antes de iniciar el tratamiento antibiótico | − | 2,9 | 97,1 |
| La presencia de una IBC previa debería orientar al clínico a elegir el antibiótico de acuerdo con los resultados del último antibiograma (tratamiento anticipado) y los datos de sensibilidad antibiótica del centro (tabla 4) | − | − | 100 |
| Ajustar el tratamiento si el resultado del nuevo cultivo es diferente al previo o si la evolución clínica de la exacerbación es desfavorable | − | − | 100 |
| Si en una exacerbación se aísla un MPP diferente del que produce la IBC, se administrará un tratamiento antibiótico que cubra ambos MPP (tabla 4) | 2,9 | − | 97,1 |
| En general, en toda exacerbación de EPOC se deberían valorar factores de riesgo de que P.aeruginosa esté implicada en la misma | − | − | 100 |
| Tras una exacerbación con aislamiento de un MPP, siempre que sea posible, debería llevarse a cabo un cultivo de control al menos 15días tras finalizar el tratamiento antibiótico | 2,9 | 8,5 | 88,6 |
| Módulo 10. Seguimiento de los pacientes con EPOC e infección bronquial crónica | |||
| El seguimiento inicial tras la primoinfección está marcado por la necesidad de monitorización microbiológica (valorar erradicación, reducción de carga bacteriana, o de nuevos MPP) y clínico (reducción de síntomas y exacerbaciones) | − | − | 100 |
| El cronograma de visitas de control dependerá de la gravedad de la EPOC, de la frecuencia de exacerbaciones y de la evolución funcional. En pacientes graves (Gold D, FEV1<50% y/o insuficiencia respiratoria crónica) pueden ser necesarios controles al menos cada 3meses, que pueden espaciarse en pacientes más leves o estables a cada 4-6meses | − | − | 100 |
| Durante los primeros 2años tras la primoinfección se debería valorar monitorizar la situación microbiológica del paciente en cada vista, que se irán espaciando si el paciente continúa estable | 5,8 | 11,4 | 82,8 |
| Deberían obtenerse al menos 3 esputos/año y siempre que haya una exacerbación con aumento de la cantidad o purulencia del esputo, antes de iniciar el tratamiento antibiótico | 5,8 | 14,2 | 80 |
| Llevar a cabo al menos una espirometría al año para detectar los declinadores rápidos. En pacientes que inician AI, hacer una espirometría cada 3-6meses durante el primer año. También tras una exacerbación grave o tras un cambio en el tratamiento de mantenimiento | 5,8 | 8,5 | 85,7 |
AI: antibiótico inhalado; CI: corticosteroides inhalados; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; IBC: infección bronquial crónica; MPP: microorganismos potencialmente patógenos.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de los autores al estudioConcepción y diseño: DDRC, JLLC, MAMG.
Adquisición de datos: todos los autores.
Borrador del manuscrito y revisión crítica del contenido intelectual: todos los autores.
Aprobación definitiva de la versión que se presenta: todos los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directa o indirectamente con los contenidos del manuscrito.
Francisco Javier Callejas (Hospital Universitario de Albacete); Ángela Cervera Juan (Hospital General de Valencia); Marta Palop Cervera (Hospital de Sagunto); Antonia Fuster Gomila (Hospital Son Llàtzer); Alicia Marín Tapia (Hospital Germans Trias i Pujol); Xavier Pomares Amigo (Hospital Parc Taulí); Mirian Torres González (Hospital San Pedro de Alcántara); Jacinto Hernández Borge (Hospital de Badajoz); Gerardo Pérez Chica (Hospital Ciudad de Jaén); Rocío Jimeno Galván (Hospital Punta de Europa); Rafael Golpe Gómez (Hospital Lucus Augusti); Pedro J. Marcos Rodríguez (Hospital A Coruña); Pilar Cebollero Rivas (Complejo Hospitalario de Navarra); Eva Tabernero Huguet (Hospital de Cruces); Carlos Álvarez Martínez (Hospital 12 de Octubre); Concha Prados Sánchez (Hospital La Paz); José Javier Martínez Garcerán (Hospital Santa Lucía); Carlos Peñalver Mellado (Hospital Virgen de la Arrixaca); Marta García Clemente (Hospital Central de Asturias); Juan Rodríguez López (Hospital del Oriente de Asturias Francisco Grande Covián); Juan Marco Figueira Gonçalves (Hospital Nuestra Señora de la Candelaria); Guillermo José Pérez Mendoza (Hospital Dr. Negrín); Jesús Hernández Hernández (Hospital Nuestra Señora de Sonsoles); Carlos Amado Diago (Hospital Marqués de Valdecilla); Laura Pérez Giménez (Hospital Royo Vilanova); Virginia Moya Álvarez (Hospital Clínico Lozano Blesa); Alexandre Palou Rotger (Hospital Son Espases); Rosa Girón Moreno (Hospital La Princesa); Marina Blanco Aparicio (Hospital A Coruña); Annie Navarro Rolón (Hospital Mútua de Terrassa); Oriol Sibila (Hospital Clínic de Barcelona); Marc Miravitlles Fernández (Hospital Vall d’Hebron); Juan José Soler Cataluña (Hospital Arnau de Vilanova); José Alberto Fernández Villar (Hospital Alvaro Cunqueiro); Germán Peces-Barba Romero (Hospital Fundación Jiménez Díaz).