La aplicación de dispositivos de presión espiratoria positiva (PEP) durante el ejercicio se había propuesto con el objetivo de contrarrestar la hiperinflación pulmonar, reducir la disnea y mejorar así la tolerancia al ejercicio de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) grave. En este ensayo controlado, aleatorizado y cruzado se investigó el efecto de dos niveles de PEP (1cm de H2O y 10cm de H2O) sobre la distancia recorrida por pacientes con EPOC grave durante la prueba de marcha de 6 min (PM6M). Los criterios de valoración secundarios fueron los efectos de la PEP sobre variables fisiológicas y de la función pulmonar.
MétodosSe reclutaron setenta y dos pacientes con EPOC grave, hospitalizados o ambulatorios, derivados a nuestros hospitales. El primer día de este estudio aleatorizado y cruzado se efectuó la PM6M sin ningún dispositivo, y posteriormente se repitió con una PEP de 1cm de H2O (PEP1) y de 10cm de H2O (PEP10). Antes y después de cada PM6M se practicaron espirometrías lentas y forzadas, que incluyeron la medición de la capacidad inspiratoria.
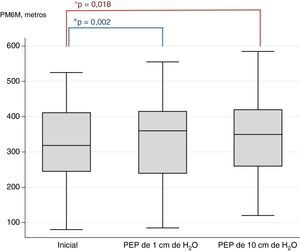
ResultadosCincuenta pacientes (edad media 69,92 años, FEV1 medio 41,42% del previsto) finalizaron el ensayo. La PM6M mejoró significativamente con los dos niveles de PEP, en comparación con la situación inicial (323,8m al inicio vs. 337,8 con la PEP1 y 341,8 con la PEP10; p<0,002 y p<0,018, respectivamente). La diferencia entre la PEP10 y la PEP1 no fue significativa. No se observaron mejorías en la función pulmonar, los síntomas ni las variables fisiológicas posteriores a la prueba PM6M.
ConclusionesEn pacientes con EPOC grave, la aplicación de una PEP de 1cm de H2O parece mejorar la tolerancia al ejercicio, al igual que lo hace la aplicación de 10cm H2O y con un grado similar de disnea. Deben realizarse otros estudios para investigar los efectos de los niveles bajos de PEP en los programas de entrenamiento aeróbico.
The application of positive expiratory pressure (PEP) devices during exercise had been proposed in order to counteract the pulmonary hyperinflation, reduce the dyspnea and thus increase the exercise tolerance in patients with severe chronic obstructive pulmonary disease (COPD). This randomized controlled crossover trial investigated the effect of two different levels of PEP (1 cmH2O and 10 cmH2O) on distance covered at 6minute walk test (6MWT) in patients with severe COPD. Secondary outcomes were the evaluation of PEP effects on physiological and pulmonary function variables.
MethodsSeventy-two severe COPD patients, referred to our hospitals as in and out patients, were recruited. A basal 6MWT without devices was performed on the first day, and then repeated with PEP 1 cmH2O (PEP1) and 10 cmH2O (PEP10), with a randomized crossover design. Slow and forced spirometries, including the inspiratory capacity measure, were repeated before and after each 6MWT.
Results50 patients (average age 69,92 year, mean FEV1 41,42% of predicted) concluded the trial. The 6MWT improved significantly among both PEP levels and baseline (323,8 mt at baseline vs. 337,8 PEP1 and 341,8 PEP10; p<.002 and p<.018, respectively). The difference between PEP10 and PEP1 did not reach the significance. No improvements were found in pulmonary function, symptoms and physiological variables after the 6MWT.
ConclusionsIn patients with severe COPD, the application of 1 cmH2O of PEP seems to improve the exercise tolerance as 10 cmH2O, with similar dyspnea. Further studies should investigate the effects of low levels of PEP on aerobic training programs.
Existen pruebas sólidas que respaldan la importancia del ejercicio como componente fundamental de la rehabilitación pulmonar de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC)1. Como procedimiento normalizado para evaluar la capacidad de ejercicio de los pacientes con enfermedades pulmonares, se adoptó la prueba de marcha de seis min (PM6M)2. Se trata de una prueba simple, de uso generalizado y fiable, que permite evaluar el estado funcional y el pronóstico de pacientes con una gran variedad de enfermedades, e investigar los efectos de distintas intervenciones, tales como la rehabilitación, el tratamiento farmacológico o la suplementación de oxígeno3–5.
El abandono de la práctica de ejercicio físico de los pacientes con EPOC está más relacionado con la disnea que con la fatiga de las piernas5,6. Estos pacientes pueden mostrar reducción de su rendimiento físico por una significativa limitación ventilatoria durante el ejercicio, en particular si no presentan deterioro de la potencia muscular periférica7–9. Así, para mejorar la tolerancia al ejercicio, se han propuesto estrategias complementarias, como por ejemplo la ventilación no invasiva10 o la aplicación de presión espiratoria positiva (PEP)11.
La PEP se aplica en la boca con el fin de contrarrestar la compresión dinámica de las vías aéreas que causa la hiperinflación pulmonar inducida por el ejercicio. En algunos pacientes con EPOC, la disminución del retroceso elástico y la limitación del flujo espiratorio conducen a la hiperinflación pulmonar. Los pacientes pueden mostrar un incremento del volumen residual en reposo (hiperinflación estática) y/o desarrollar hiperinflación por sobrecarga (hiperinflación dinámica) debido a que, al aumentar la frecuencia respiratoria, se acorta el tiempo de espiración12. Asimismo, durante la espiración puede haber compresión dinámica de las vías aéreas, especialmente si el flujo es elevado. El punto de equipresión (PE) se desplaza hacia la periferia, lo que resulta en el cierre precoz de las vías aéreas periféricas y el consecuente atrapamiento aéreo. Este fenómeno produce el cambio gradual del volumen corriente (Vt) a niveles más elevados de capacidad residual funcional (FRC) y la disminución progresiva de la capacidad inspiratoria (IC). La hiperinflación pulmonar dinámica se puede cuantificar determinando esta disminución de la IC13.
La aplicación de PEP aumenta la presión en las vías aéreas intraluminales y desplaza el punto de equipresión hacia las vías aéreas superiores, reduciendo la compresión dinámica y limitando en consecuencia la hiperinflación pulmonar11,14. Con la respiración con los labios fruncidos (RLF), que puede considerarse una PEP espontánea, se consigue un efecto similar15.
Algunos estudios han investigado los efectos de la aplicación de PEP sobre la fuerza, la resistencia, los volúmenes pulmonares o los ejercicios de deambulación de pacientes con EPOC. Padkao et al.14 demostraron que el uso de una PEP cónica dependiente del flujo permite realizar un ejercicio isotónico de fuerza del cuádriceps durante más tiempo, aumenta la capacidad vital lenta (SVC) y la IC (+ 200ml, p=0,05), y reduce la hiperinflación pulmonar. Monteiro et al.16 aplicaron PEP mediante una máscara oronasal a pacientes con EPOC de moderada a grave que habían realizado un ejercicio submáximo en una cinta continua, y observaron un incremento de la IC después del ejercicio. Asimismo, Martin y Davenport17 demostraron que una PEP extrínseca de 10cm de H2O reducía la disnea postejercicio en pacientes con EPOC. Más recientemente, Nicolini et al.11 observaron que en pacientes con EPOC grave, la aplicación de una PEP adyuvante de 5cm de H2O administrada a través de una pieza bucal durante la ejecución de la PM6M, mejoraba significativamente la distancia recorrida, la saturación de oxígeno y la frecuencia cardíaca.
Sin embargo, Wibmer et al.18 obtuvieron resultados opuestos con la aplicación de una PEP dependiente del flujo de 10 a 20cm de H2O a pacientes con EPOC estable de leve a grave durante la PM6M. Demostraron que la PEP reducía la FRC y el volumen residual (RV) después del ejercicio, pero el grupo de pacientes a los que se aplicó la PEP recorrió 30 metros menos que el grupo de control. A pesar de que se dispone de algunos datos, ningún estudio ha descrito cuál es el nivel óptimo de PEP capaz de mejorar la tolerancia al ejercicio.
En este contexto, la finalidad principal de nuestro estudio fue investigar el efecto de dos niveles diferentes de PEP (1cm de H2O vs. 10cm de H2O) sobre la distancia recorrida por pacientes con EPOC grave (FEV1<50%) durante la PM6M (PM6M-D), en comparación con la PM6M inicial efectuada sin PEP. Los criterios de valoración secundarios fueron los efectos de la PEP sobre la función pulmonar, los síntomas y los parámetros vitales inmediatamente después de la PM6M.
MétodosEste estudio prospectivo, aleatorizado, cruzado y simple ciego se llevó a cabo en la Unidad de Rehabilitación Respiratoria del Hospital Sestri Levante, Italia y la Unidad de Rehabilitación Pulmonar de la Fondazione S. Maugeri IRCCS, Lumezzane (Brescia, Italia), desde enero hasta octubre de 2013.
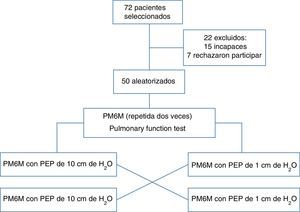
PacientesReclutamos 72 pacientes con EPOC grave (FEV1<50%) remitidos consecutivamente a nuestros hospitales como pacientes hospitalizados o ambulatorios. Los criterios de inclusión comprendieron: más de 18 años de edad, estabilidad clínica son cambios en la medicación en las dos semanas anteriores a la prueba, sin exacerbaciones durante al menos tres semanas. Los criterios de exclusión comprendieron: antecedentes de asma bronquial, enfisema bulloso grave con antecedentes de neumotórax espontáneo, ausencia de consentimiento escrito y enfermedades ortopédicas y neurológicas limitantes de la capacidad para realizar la PM6M. Se incluyeron cincuenta pacientes y veintidós fueron excluidos (quince por ser incapaces de realizar la PM6M y siete por no otorgar el consentimiento informado escrito). El Comité Ético de ASL 4 Chiavarese, Italia aprobó el protocolo, que se llevó a cabo en cumplimiento de la Declaración de Helsinki. El estudio se registró con el código ChiCTR-TTRCC-12002761 www.chi.ctr.org.
Protocolo de estudioAl inicio del estudio, el primer día de su ingreso en el servicio de rehabilitación, todos los pacientes se sometieron a dos PM6M, una espirometría y una pletismografía de cuerpo entero. El segundo día se inició el protocolo y los pacientes fueron aleatorizados en dos grupos: un grupo realizó la PM6M con una PEP adyuvante de 10cm de H2O (PEP10) y el otro lo realizó con una PEP adyuvante de 1cm de H2O (PEP1). Al tratarse de un estudio con diseño cruzado, se intercambió la secuencia de las pruebas de los grupos.
InstrumentosDurante el desarrollo de la PM6M se administró PEP mediante una válvula de PEP (válvula PEEP, Ambu, Dinamarca), que consiste en una válvula de presión espiratoria con un umbral de presión ajustable entre 0 y 20cm de H2O, que se coloca en la vía espiratoria de un circuito bidireccional. En la vía inspiratoria hay una válvula que se abre durante la inspiración, y el circuito bidireccional está conectado a una máscara oronasal a través de un tubo de 20mm de diámetro interno y 100mm de longitud. Debido a que el tubo de 100mm añade una cierta resistencia a la exhalación del paciente, calculamos la PEP total aplicada en la boca con un manómetro manual colocado en serie en el circuito. Se estableció que la resistencia espiratoria en reposo era de 10cm de H2O en el grupo PEP10 y de 1cm de H2O en el grupo PEP1.
DeterminacionesTodas las PM6M se efectuaron en un pasillo interior, recto y plano (30m marcados mediante una cinta de color para indicar los puntos de giro) y de acuerdo con las orientaciones de la Sociedad Torácica Americana19,20. La saturación de oxígeno y la frecuencia cardíaca se registraron de manera continuada mediante un oxímetro inalámbrico bluetooth ligero (Avant 9600, Nonin Medical Inc., EE. UU.). Al inicio y al final de cada prueba se registraron la frecuencia respiratoria, la disnea (evaluada con la escala de Borg) y la distancia recorrida (en metros). Entre prueba y prueba, los pacientes descansaron durante al menos una hora.
Al inicio, se practicó una espirometría y una pletismografía de cuerpo entero (VMax 20 PFT Sensor Medics Yorba Linda, CA, EE. UU.) a todos los pacientes, de acuerdo con las orientaciones americanas y europeas (ATS/ERS)21.
Para las pruebas funcionales respiratorias (espirometrías lentas y forzadas) se empleó un espirómetro portátil (Spirolab III, Medical International Research, Italia). Las mediciones se realizaron justo al inicio y en el minuto posterior a la finalización de cada PM6M con PEP1 y con PEP10.
Análisis estadísticoLos datos se analizaron mediante un programa informático de estadística (Stata Statistical Software: Release 12. StataCorp LP. College Station, TX, EE. UU.).
El criterio de valoración principal fue la PM6M-D con los diferentes niveles de PEP (PEP1, PEP10). Los criterios de valoración secundarios incluyeron los cambios en las medidas funcionales respiratorias (disnea evaluada mediante la escala de Borg, frecuencia respiratoria [FR], pulsioximetría) y medidas espirométricas (capacidad vital lenta [SVC], capacidad inspiratoria [IC], capacidad vital forzada [FVC], volumen de reserva espiratorio [ERV]). Un estadístico no involucrado en el estudio diseñó el plan de aleatorización, utilizando una tabla de aleatorización generada por un programa informático. Los médicos reclutadores recibieron las asignaciones de la aleatorización en sobres sellados.
En los análisis descriptivos se muestran los valores medios±desviación estándar. Para las comparaciones de los parámetros espirométricos obtenidos en las pruebas con PEP1 y PEP10 se utilizó la prueba de la t pareada. Las diferencias entre las tres situaciones (inicial, PEP1 y PEP10) se analizaron con ANOVA para medidas repetidas (prueba de Fisher). En los casos en los que se observaron diferencias significativas se realizó un análisis retrospectivo mediante la prueba de la t pareada y con corrección de Bonferroni.
Los investigadores que analizaron los datos del estudio desconocían las asignaciones de tratamiento de los pacientes.
ResultadosInicialmente se reclutaron 72 pacientes. El perfil del ensayo se describe en la figura 1.
Se excluyeron quince pacientes por no poder realizar la PM6M y otros 7 rechazaron participar. Así, nuestra muestra estuvo compuesta por 50 participantes. En la tabla 1 se describen las características clínicas y antropométricas de los pacientes incluidos. En general, eran varones, relativamente ancianos y con EPOC grave. Una cuarta parte recibían oxigenoterapia crónica por presentar insuficiencia respiratoria asociada y todos presentaban hiperinflación pulmonar estática grave. Los cincuenta pacientes completaron el estudio.
Características antropométricas y basales de los pacientes estudiados
| Variable | Pacientes (n=50) | |
|---|---|---|
| Media | DE | |
| Sexo (varón), % | 69,9 | 7,3 |
| Nivel GOLD, % | ||
| III | 73,5 | |
| IV | 24,5 | |
| Oxigenoterapia crónica, % | 24,5 | |
| Edad, años | 69,9 | 7,3 |
| IMC | 26,7 | 6,3 |
| FVC, % predicho | 69,56 | 15,83 |
| FVC, L | 2,13 | 0,73 |
| SVC, L | 2,21 | 0,76 |
| FEV1, % predicho | 41,43 | 12,54 |
| FEV1, L | 1,03 | 0,56 |
| FEV1/FVC | 49,43 | 14,63 |
| TLC, % predicho | 114,71 | 27,27 |
| IC, L | 1,59 | 0,54 |
| ERV, L | 0,78 | 0,49 |
| RV, % predicho | 181,67 | 58,10 |
| SpO2% | 94,14 | 2,33 |
| DLCO, % predicho | 63,64 | 12,83 |
| Disnea inicial, puntuación de Borg | 1,65 | 1,93 |
DLCO:capacidad de difusión del pulmón del monóxido de carbono; ERV:volumen de reserva espiratorio; FEV1:volumen espiratorio forzado en el primer segundo; FVC:capacidad vital forzada; IC:capacidad inspiratoria; IMC:índice de masa corporal; RV:volumen residual; SpO2:saturación de oxígeno periférica; TLC:capacidad pulmonar total.
La prueba de la F del criterio de valoración principal (PM6M-D) muestra una diferencia significativa en los resultados obtenidos con los diferentes niveles de PEP y la situación inicial (prueba de la F: 0,02). El análisis retrospectivo muestra que el uso de PEP1 y PEP10 aumentó la distancia recorrida (PEP1: p<0,002; PEP10: p<0,018), en comparación con la situación inicial. No se observaron diferencias significativas entre PEP1 y PEP10. En la figura 2 se presentan los diagramas de cajas de la PM6M-D.
Todos los cambios (final – inicio de la PM6M) en los criterios de valoración secundarios se presentan en la tabla 2. Observamos una tendencia hacia una disminución de la FC y un aumento de la FR, tanto con PEP1 como con PEP10 en comparación con la situación inicial, que no alcanzaron la significación estadística. En cuanto a los cambios en la función pulmonar, los síntomas y las variables fisiológicas, no observamos diferencias significativas entre PEP1 y PEP10.
Cambios en los criterios de valoración secundarios entre las diferentes condiciones de PEP, media (DE)
| Sin PEP | PEP1 | PEP10 | Valor de p | |
|---|---|---|---|---|
| Disnea final, escala de BORG | 5,37 (2,32) | 5,18 (2,29) | 5,65 (2,43) | 0,61 |
| Δ Disnea, escala de BORG | 3,91 (2,22) | 3,86 (2) | 3,47 (2,04) | 0,52 |
| Δ Disnea, % | 176 (172) | 244 (228) | 161 (157) | 0,23 |
| Fatiga de las piernas final, escala de BORG | 5,43 (1,36) | 4,90 (1,56) | 5,62 (1,22) | 0,17 |
| Δ Fatiga de las piernas, escala de BORG | 3,05 (1,16) | 2,79 (0,82) | 2,95 (0,86) | 0,67 |
| Δ Fatiga de las piernas, % | 172 (145) | 188 (163) | 205 (95) | 0,75 |
| FR final, resp./minuto | 25,75 (4,44) | 25,53 (5,53) | 25,88 (7,74) | 0,94 |
| Δ FR, resp./minuto | 5,46 (3,87) | 4,37 (3,47) | 3,86 (3,66) | 0,06 |
| FR, % de cambio | 28,7 (19,9) | 23,5 (22,7) | 19,3 (18,8) | 0,10 |
| FC final, latidos/minuto | 93,53 (13,77) | 97,10 (16,77) | 97,06 (16,53) | 0,44 |
| Δ FC, latidos/minuto | 18,61 (12,42) | 13,76 (9,67) | 16,30 (12,58) | 0,07 |
| FC, % de cambio | 25,4 (18,9) | 18,6 (15,5) | 21,2 (16,8) | 0,15 |
| SpO2 final, % | 90,55 (5,66) | 91,82 (4,10) | 90,78 (6,81) | 0,50 |
| Δ SpO2, % | −3,33 (6,25) | −3,45 (4,96) | −2,49 (3,89) | 0,60 |
| SpO2, % de cambio | −3,53 (6,68) | −3,67 (5,41) | −2,62 (4,15) | 0,60 |
| Δ IC, L | 0,03 (0,21) | 0,04 (0,27) | 0,90 | |
| IC, % de cambio | 1,27 (15,72) | 3,42 (19,37) | 0,56 | |
| Δ SVC, L | 0,08 (0,23) | 0,10 (0,51) | 0,82 | |
| SVC, % de cambio | 2,87 (12,56) | 8,08 (37,11) | 0,39 | |
| Δ ERV, L | −0,02 (0,28) | −0,06 (0,28) | 0,50 | |
| ERV, % de cambio | −15,91 (85,33) | −30,04 (159,64) | 0,60 | |
| Δ FVC, L | 0,08 (0,19) | 0,15 (0,52) | 0,40 | |
| FVC, % de cambio | 4,47 (10,15) | 11,02 (44,94) | 0,34 |
El porcentaje de cambio se ha calculado como Δ*100/valor inicial (en reposo antes de iniciar la prueba PM6M).
ERV:volumen residual espiratorio; FC:frecuencia cardíaca; FR:frecuencia respiratoria; FVC:capacidad vital forzada; IC:capacidad inspiratoria; SVC:capacidad vital lenta.
Se consideró que los pacientes presentaban hiperinflación dinámica si la reducción de la IC era de un 10% y/o > 150ml respecto al valor inicial22,23. Del total de pacientes incluidos, 10 mostraron hiperinflación dinámica y 40 no. En los 40 pacientes que no presentaban hiperinflación dinámica observamos un cambio significativo en la distancia recorrida (Δ metros) al aplicar la PEP de 1cm de H2O, pero no observamos cambios significativos al aplicar la PEP de 10cm de H2O. Estos resultados se muestran en la tabla 3.
Resultados de distancia recorrida (PM6M-D) de pacientes con o sin hiperinflación dinámica
| PEP1 | PEP10 | |||||
|---|---|---|---|---|---|---|
| Pacientes | Metros | Δ metros | Pacientes | Metros | Δ metros | |
| Pacientes con hiperinflación dinámica | 10 (20%) | 290 (95) | −3,22 (21,98) | 8 (16,0%) | 304 (132) | 14,42 (31,08) |
| Pacientes sin hiperinflación dinámica | 40 (80%) | 342 (124) | 20,83 (26,71) | 42 (84,0%) | 345 (110) | 24,39 (31,91) |
| Valor de p | 0,24 | 0,001 | 0,38 | 0,45 | ||
PEP:presión espiratoria positiva; PM6M-D:distancia recorrida en 6 min.
En este ensayo aleatorizado y cruzado en pacientes con EPOC grave, observamos que la aplicación de una PEP de 1cm de H2O durante la ejecución de la prueba PM6M puede mejorar la distancia recorrida, al igual que la aplicación de una PEP de 10cm de H2O, sin que la respuesta cardiovascular al ejercicio resulte afectada. No observamos efectos de la PEP sobre el grado de disnea ni los volúmenes dinámicos pulmonares después del ejercicio, en particular las IC, SVC, FVC y el ERV. También observamos que al aplicar la PEP, la mejoría en la prueba PM6M-D es mayor en los pacientes que no presentan o presentan poca hiperinflación dinámica.
Hasta la fecha, solamente otros dos ensayos aleatorizados cruzados han investigado, al igual que hicimos nosotros, los efectos de los dispositivos de PEP sobre la prueba PM6M-D, con resultados contradictorios.
En 2013, Nicolini et al.11 demostraron que la aplicación de un umbral de PEP de 5cm H2O a pacientes con EPOC de moderada a grave mejoraba la distancia andada durante la prueba PM6M. También demostraron que la PEP mejoraba significativamente la saturación de oxígeno postejercicio y disminuía la frecuencia cardíaca máxima durante la prueba PM6M, en comparación con los pacientes de control que no usaron ningún dispositivo. Sin embargo, en el mismo año, Wibmer et al.18 estudiaron a pacientes similares y observaron que aquellos con una PEP dependiente del flujo de 10 a 20cm de H2O recorrían 30,8 metros menos que los sujetos de control que no usaron ningún dispositivo (352±92 metros sin PEP, 321±93 metros con PEP, p=0,001). En este estudio, demostraron la eficacia de la PEP dependiente del flujo sobre los volúmenes dinámicos pulmonares, tales como la capacidad pulmonar total, la FRC y el volumen residual, que se redujeron de forma significativa tras la prueba PM6M efectuada con PEP, en comparación con el grupo control.
Aunque los tres estudios utilizaron diferentes tipos de PEP, los resultados en términos de distancia recorrida durante la PM6M parecen ser mejores con la aplicación de bajas presiones. Pese a ello, todavía se desconoce y es necesario investigar cuál es el nivel «correcto» de PEP durante el ejercicio.
En este contexto, Martin et al.17 aplicaron dos umbrales de PEP (13,8 y 2cm de H2O) y demostraron que el nivel más alto de PEP disminuía significativamente la disnea después de una prueba en una cinta continua con una carga constante. No obstante, estos resultados no pueden compararse con los nuestros, puesto que Martin et al. solo aplicaron la PEP tras finalizar la prueba de ejercicio, en lugar de hacerlo durante la sobrecarga.
Bhatt et al.15 han comunicado recientemente los buenos resultados que obtuvieron en relación con la mejoría de la tolerancia al ejercicio de pacientes con EPOC grave. Estos autores realizaron un ensayo cruzado en el que investigaron los efectos de la RLF sobre la prueba PM6M-D y observaron que los pacientes andaban 34,9 metros más si respiraban con los labios fruncidos que si respiraban normalmente (p=0,002), y observaron también una reducción concomitante de la FR después de la prueba. Además, estudiaron el movimiento del diafragma mediante ecografía y observaron que existía una correlación entre la mejoría en la prueba PM6M-D y el mayor movimiento del diafragma con la RLF. Los autores explican sus hallazgos y sugieren que la RLF controla y reduce la FR, rompiendo el círculo vicioso de atrapamiento de aire e hiperinflación pulmonar dinámica. Esto se podría traducir en una menor disociación neuroventilatoria y una menor percepción de la disnea. Nosotros suponemos que la PEP a baja presión podría tener un efecto similar.
En relación a la función pulmonar, el uso de la PEP de bajo nivel también se ha propuesto en el campo de la limpieza de las vías aéreas de los pacientes con EPOC e hipersecreción. Venturelli et al.24 estudiaron un dispositivo mecánico que aplica una PEP de 1cm de H2O en la boca y comunicaron una mejoría significativa de la IC en reposo cuando los pacientes respiran a través del dispositivo de PEP, en comparación con los pacientes de control (+19,5% y+2,2%, p=0,044). Sin embargo, no se dispone de datos obtenidos durante el ejercicio.
En cuanto a la mejoría en los volúmenes pulmonares dinámicos y estáticos, observados por Monteiro16 y Padkao14 en los estudios citados previamente, no pudimos confirmar el efecto de los dispositivos de PEP sobre los volúmenes pulmonares postejercicio. Al no haber realizado la espirometría inmediatamente después de la primera PM6M, no tenemos datos relativos al comportamiento de la IC y otros volúmenes pulmonares durante la PM6M sin PEP, por lo que en la actualidad desconocemos si el uso de PEP produce alguna mejoría en los volúmenes pulmonares, en comparación con la ausencia de PEP. No observamos diferencias significativas entre la PEP1 y la PEP10 respecto al comportamiento de la IC, SVC, ERV o la FVC. La aplicación de una PEP de nivel bajo o alto durante la prueba PM6M demostró producir un efecto similar sobre los volúmenes pulmonares.
Sin embargo, en el análisis retrospectivo, observamos que la mejoría en la distancia recorrida con la aplicación de una PEP de bajo nivel fue mayor en el grupo de pacientes que no presentaban hiperinflación dinámica, en comparación con el grupo que presentaba hiperinflación dinámica. Este hallazgo concuerda con lo que ya habían sugerido Callens et al., que observaron que el cambio en la IC después de andar no se correlacionaba con la PM6M-D25.
Para concluir, comparar los efectos de la PEP sobre la tolerancia al ejercicio en pacientes con EPOC es difícil, puesto que los estudios realizados son demasiado heterogéneos, con una gran variedad de protocolos de ejercicio, tipos y niveles de PEP y variables de resultados. Con el fin de aclarar cuáles son los efectos de la PEP sobre la mecánica pulmonar, sería útil evaluar su efecto durante una prueba de ejercicio estandarizada, como la prueba de ejercicio cardiopulmonar. Wibmer et al.18 ya habían puntualizado que la evaluación de los volúmenes pulmonares dinámicos también se debería estandarizar, incluyendo algunas mediciones de la IC durante el ejercicio físico.
Los estudios futuros deberían conducirnos a una utilización más práctica de los dispositivos de PEP. Recomendamos investigar los efectos de los niveles bajos de PEP durante los protocolos de ejercicio aeróbico y de fuerza, tanto a medio como a largo plazo.
Limitaciones del estudioEn nuestro estudio hemos detectado algunas limitaciones. En primer lugar, la función pulmonar no se evaluó directamente durante la prueba, sino que en promedio hubo un retraso de un minuto entre la finalización de la PM6M y la ejecución de la espirometría. Esto podría haber causado una infraestimación de los efectos de la PEP sobre la función pulmonar.
Además, se han propuesto dos tipos de dispositivo de PEP: los dependientes del flujo y aquellos con umbral de presión.26 Utilizamos una válvula de PEP con umbral de presión, aunque todavía no se han publicado los estudios que han comparado los dos tipos de dispositivo.
En un ensayo controlado y no aleatorizado publicado en 2012,16 Monteiro et al. demostraron que, en pacientes con EPOC grave, respirar a través de una máscara con una PEP de 10cm de H2O durante una prueba en cinta continua de 20 min de duración produce menos hiperinflación pulmonar dinámica, en comparación con la respiración sin PEP. Estos autores observaron un aumento significativo de la IC y un menor descenso de la IC tras el ejercicio en los pacientes del grupo con PEP, en comparación con el grupo control. En este estudio, el paciente iniciaba el ejercicio con una PEP de 10cm de H2O y, si no lo toleraba, la PEP se reducía gradualmente hasta tan solo 5cm de H2O. Observaron que el promedio de PEP tolerada era de 8±1,5cm de H2O. Nosotros no establecimos cuál era el valor más alto de PEP tolerado por los pacientes. Una PEP mayor a la tolerada podría limitar la capacidad de exhalar y empeorar la hiperinflación pulmonar dinámica, causando disnea y conduciendo a unos malos resultados.
Otra limitación podría estar relacionada con el tipo de prueba empleado. Durante la PM6M se permite que los pacientes reduzcan el ritmo o se paren si lo necesitan, por ejemplo en caso de presentar disnea intensa. Además, los propios pacientes eligen la velocidad de deambulación. Por estas razones, es posible que la hiperinflación dinámica no haya destacado durante la PM6M.
Uno de los criterios de inclusión fue la presencia de una EPOC grave. Es posible que incluyendo pacientes que solamente presentan disminución de la IC durante el ejercicio se hubiera obtenido una mayor significación.
Finalmente, la diferencia mínima clínicamente importante en la PM6M-D es de 25 metros27,28, y nuestro estudio no alcanzamos este umbral. Creemos que esto podría ser debido a la amplia variabilidad existente en la distancia recorrida por los pacientes. Queremos destacar que incluso una pequeña mejoría al respirar a través de un dispositivo simple, aunque carezca de relevancia clínica, puede ser indicativa de que la estrategia es correcta y merece ser analizada en mayor profundidad en estudios futuros.
Asimismo, no efectuamos un análisis del tamaño de la muestra y es posible que el número de pacientes haya sido demasiado pequeño como para obtener unos resultados más significativos.
ConclusionesEn pacientes con EPOC grave, la aplicación de una PEP de 1cm de H2O parece mejorar la tolerancia al ejercicio como lo hace una PEP de 10cm de H2O, con similar grado de disnea. No se observaron efectos sobre los volúmenes pulmonares postejercicio. Puesto que hemos observado que existe una gran heterogeneidad en los protocolos y los niveles y tipos de PEP aplicados, recomendamos realizar otros estudios para confirmar nuestros resultados y aclarar el mecanismo que actúa sobre la mecánica pulmonar. Estos estudios futuros también deberían investigar los efectos de los niveles bajos de PEP sobre los programas de ejercicio aeróbico y de fuerza.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
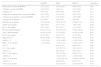
| Wibmer et al15 | 2013 | Factibilidad de la aplicación de una PEP nasal durante el ejercicio, efectos sobre la hiperinflación dinámica | Aleatorizado, cruzado | 20 EPOC leve moderada (FEV1> 50%) | Prueba PM6M repetida dos veces (2-24 h de descanso), con y sin PEP nasal (diseño cruzado), con posterior espirometría y evaluación de la disnea en la escala de Borg | PM6M-D, espirometría | Mascarilla nasal con casco, PEP dependiente del flujo de 10-20 de cmH2O | La PEP disminuye la TLC, FRC y RV (p < 0,05), pero también produce una reducción significativa en la PM6M-D (−30,8m, p=0,001) |
| Martin et al8 | 2011 | ¿Reduce la utilización de PEP la disnea postejercicio? | Doble ciego, cruzado | 8 pacientes ambulatorios (4 controles) con EPOC (FEV1< 50%) y uso habitual de respiración con los labios fruncidos | Prueba en cinta continua con dos repeticiones (diseño cruzado). Al final de la prueba, el grupo de la intervención realizaba 6 respiraciones con la PEP umbral y el grupo de control con una falsa PEP | Escala de disnea de Borg | PEP umbral de 10 cm de H2O (13,8 cm de H2O si se mide en la boca) vs. PEP falsa de 2 cm de H2O | La PEP reduce la disnea 10 min después del ejercicio (Escala de disnea de Borg después del ejercicio: 2,6 y 1,8 puntos en los grupos de control y de la intervención, respectivamente, p < 0,0001) |
| Padkao et al14 | 2010 | La PEP cónica, ¿reduce la hiperinflación e incrementa la duración del ejercicio? | Aleatorizado, cruzado | 13 EPOC de moderada a grave (FEV1 61%) | Extensión de las piernas del 30% 1RM pesas en los tobillos, 15 repeticiones por min y pierna, con y sin PEP (diseño cruzado) | Espirometría (TLC, IC, VC lenta) disnea, esfuerzo de las piernas, duración del ejercicio | PEP cónica dependiente del flujo de 4-20 cm de H2O vs. respiración normal | La PEP produce un aumento de la IC y la VC lenta (+ 200mml, p=0,05), de la duración del ejercicio (+107 segundos, p=0,05), y una reducción de la FR durante el ejercicio (−6,1 respiraciones/min, p=0,05), sin ningún efecto adverso |
| Monteiro et al16 | 2012 | Efecto de la PEP sobre la capacidad inspiratoria | Controlado, no aleatorizado | 17 EPOC (FEV1 38%) con hiperinflación dinámica, definida como una disminución de al menos un 15% en la IC tras un ejercicio en cinta continua | Prueba en cinta continua de 20 min, con medición posterior de la IC. Si la disminución era de al menos un 15%, la prueba se repetía con administración de una PEP (cronología no especificada) | IC | Mascarilla nasal con casco y válvula unidirecciónal, PEP con resorte de 5-10 cm de H2O | La PEP produce un aumento de la IC (1,45 l y 1,13 l con y sin PEP, respectivamente, p=0,02) y un menor descenso de la IC después del ejercicio (−0,18 l y −0,57 l con y sin PEP, respectivamente, p=0,02) |
| Bhatt et al19 | 2014 | Efecto de la respiración con los labios fruncidos sobre la capacidad de practicar ejercicio | Aleatorizado, cruzado | 14 EPOC (FEV1 38,4%) | PM6M en la evaluación, repetición con RLF | PM6M, espirometría, MIP, MEP, movimiento diafragmático mediante ECO | Respiración con los labios fruncidos voluntaria | La PLB incrementa la PM6M-D (+3 4,9mm, p=0,002), reduce la FR después de la prueba PM6M (−4,4 lpm, p=0,003). Correlación entre la mejoría en la PM6M-D y el incremento en el movimiento diafragmático con la RLF. La mejoría fue mayor en los pacientes con peor PM6M-D al inicio |
ECO:ecografía; FEV1:volumen espiratorio forzado en el primer segundo; FRC:capacidad funcional residual; IC:capacidad inspiratoria; MEP:presión espiratoria máxima; MIP:presión inspiratoria máxima; PLB:respiración con los labios fruncidos; PM6M-D:distancia recorrida en el PM6M; 1RM:1 repetición cómo máximo; RV:volumen residual; TLC:capacidad pulmonar total; VC:capacidad vital.