El origen de la inflamación sistémica en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) es poco conocido, y una de las hipótesis más aceptadas es el paso de la inflamación del pulmón a la sangre (spill-over).
ObjetivoEvaluar la relación entre la inflamación pulmonar y sistémica en la EPOC mediante la cuantificación de diversos marcadores inflamatorios en esputo y suero obtenidos en el mismo individuo de forma simultánea.
MetodologíaDe 133 pacientes de la cohorte PAC-EPOC se evaluaron las relaciones entre diferentes variables inflamatorias (TNFα, IL-6, IL-8) en suero y esputo. Como objetivo secundario se evaluaron las relaciones de las variables inflamatorias de suero con la función pulmonar.
ResultadosLos valores de los marcadores inflamatorios fueron claramente superiores en esputo que en suero. No se hallaron correlaciones relevantes (en valor absoluto, r=0,03-0,24) entre los marcadores inflamatorios en sangre y en esputo. Tampoco se identificaron asociaciones significativas entre dichos marcadores, con variables de función pulmonar como el FEV1, DLCO y la PaO2.
ConclusionesEn pacientes con EPOC estable no existe correlación entre la inflamación pulmonar y sistémica, lo que sugiere mecanismos patogénicos diferentes.
The origin of systemic inflammation in chronic obstructive pulmonary disease (COPD) patients remains to be defined, but one of the most widely accepted hypothesis is the ‘spill over’ of inflammatory mediators from the lung to the circulation.
ObjectiveTo evaluate the relationship between pulmonary and systemic inflammation in COPD quantifying several inflammatory markers in sputum and serum determined simultaneously.
MethodologyCorrelations between various inflammatory variables (TNF-α, IL6, IL8) in sputum and serum were evaluated in 133 patients from the PAC-COPD cohort study. A secondary objective was the evaluation of relationships between inflammatory variables and lung function.
ResultsInflammatory markers were clearly higher in sputum than in serum. No significant correlation was found (absolute value, r=0.03-0.24) between inflammatory markers in blood and in sputum. There were no significant associations identified between those markers and lung function variables, such as FEV1, DLCO and PaO2 neither.
ConclusionsWe found no correlation between pulmonary and systemic inflammation in patients with stable COPD, suggesting different pathogenic mechanisms.
La enfermedad pulmonar obstructiva crónica (EPOC) se asocia a inflamación pulmonar y sistémica1-3. La primera parece aumentar en pacientes con mayor limitación al flujo aéreo, aunque cabe señalar que la evidencia actualmente disponible se basa en análisis transversales4, por lo que no puede establecerse una relación causa-efecto. La segunda no está presente en todos los pacientes con EPOC, pero en aquellos en los que persiste en el tiempo, se asocia a mayor mortalidad y frecuencia de exacerbaciones1.
El origen de la inflamación sistémica en la EPOC es poco conocido, y una de las hipótesis principales es el traspaso de inflamación del pulmón a la sangre (spill-over), por lo que de ser así deberían estar relacionadas. Sin embargo, la relación entre inflamación pulmonar y sistémica en la EPOC es objeto de debate5-7. Los estudios publicados hasta la fecha tienen diversas limitaciones, como su relativo pequeño tamaño muestral6,8,9 o la falta de cuantificación simultánea (en el mismo paciente) de los mismos marcadores inflamatorios en el compartimento pulmonar y sistémico10.
Este estudio tiene por objeto superar estas limitaciones y evaluar las posibles relaciones entre la inflamación pulmonar y sistémica en la EPOC mediante la cuantificación de diversos marcadores inflamatorios en esputo y suero obtenidos en el mismo individuo de forma simultánea, en un número importante de pacientes con EPOC (n=133) reclutados en la cohorte PAC-EPOC11,12. Como objetivos secundarios se evaluaron las potenciales asociaciones de la inflamación sistémica con variables de función pulmonar que pueden estar potencialmente relacionadas con la inflamación pulmonar como volumen espiratorio forzado durante el primer segundo (FEV1), capacidad de difusión del monóxido de carbono (DLCO) y presión parcial de oxígeno en sangre arterial (PaO2).
MétodoPoblación y aspectos éticosEl estudio PAC-EPOC reclutó 342 pacientes hospitalizados por primera agudización de EPOC en 9 hospitales españoles desde enero de 2004 hasta marzo de 200611,12. Los pacientes incluidos se estudiaron 3meses después del alta hospitalaria (más una semana de desviación como máximo) en fase de estabilidad clínica (8semanas sin nuevas agudizaciones ni cambios en la medicación) y se siguieron ambulatoriamente durante 3años12. El diagnóstico de EPOC se estableció en estabilidad clínica de acuerdo con las recomendaciones ATS/ERS13. Se excluyeron del estudio pacientes menores de 45años, con cáncer, secuelas postuberculosas, neumonectomía y/o neumoconiosis. En el presente estudio participaron los 133 pacientes (39% del total) que disponían de muestras válidas y simultáneas de inflamación pulmonar y sistémica. El estudio fue aprobado por el Comité de Ética de todos los hospitales participantes, y todos los pacientes firmaron el consentimiento informado.
Caracterización clínica y funcionalComo se ha descrito previamente11,12, los datos clínicos y de historia tabáquica se obtuvieron a partir de cuestionarios validados. El índice de masa corporal (IMC) se calculó como la relación entre el peso y el cuadrado de la altura en metros11,12. La espirometría forzada con prueba broncodilatadora, volúmenes pulmonares, DLCO y gasometría arterial se cuantificaron siguiendo metodología estándar14-16. Los valores de referencia de la espirometría, volúmenes pulmonares y DLCO corresponden a una población mediterránea17,18.
Inflamación pulmonarSiempre que fue posible, se obtuvo y se procesó una muestra de esputo espontáneo al menos 60min después de las pruebas funcionales respiratorias (225pacientes). En el caso de que el paciente fuese incapaz de expectorar espontáneamente, la muestra de esputo se obtuvo tras inducción con suero salino según metodología estándar19. De los pacientes que se obtuvo una muestra de esputo (n=225), 133 mostraron <20% de células escamosas y fueron utilizados para el análisis20.
En el sobrenadante del esputo se cuantificó la concentración de interleucina 6 (IL-6), IL-8 y factor de necrosis tumoral alfa (TNFα) (Cytokine bead array system, BD Biosciences San Diego CA, EE.UU.). El límite inferior de detección (LID) de IL-6, IL-8 y TNFα fue de 2,5, de 3,6 y de 3,7pg/ml, respectivamente. Siguiendo recomendaciones previas, para evitar el sesgo debido a los pacientes que presentaban valores inferiores al LID, en estos pacientes se asignó un valor nominal de la mitad del LID1. Todas las determinaciones se realizaron por duplicado en el laboratorio central del Hospital Universitari Son Espases (Palma de Mallorca). Dado que el coeficiente de variación fue <10% en todos los casos, para el análisis se utilizó el valor medio de las 2 determinaciones.
Las muestras de esputo también fueron cultivadas siguiendo la metodología habitual21. La carga bacteriana se cuantificó mediante unidades formadoras de colonias (ufc) por mililitro. Los cultivos se consideraron positivos para colonización si hubo un crecimiento mínimo de 100ufc/ml de Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis, Pseudomonas aeruginosa, enterobacterias y/o Staphylococcus aureus22. En pacientes con cultivos polimicrobianos se consideró para el análisis el microorganismo potencialmente patogénico (MPP) con mayor carga bacteriana.
Inflamación sistémicaEl mismo día de la obtención del esputo se obtuvo una muestra de sangre venosa (20ml) con EDTA por venopunción periférica entre las 08.00 y las 09.00 horas de la mañana, tras ayuno de al menos 6h; a los fumadores activos también se les solicitó que se abstuvieran de fumar durante las 6h previas a la obtención de muestras biológicas. La muestra de sangre así obtenida fue inmediatamente centrifugada durante 10min a 2.000rpm, y el suero resultante se almacenó a −80°C hasta su análisis posterior.
Los niveles de proteína C reactiva (PCR) se determinaron por duplicado mediante nefelometría de alta sensibilidad, con un LID de 0,175mg/l (Siemens Healthcare Diagnostics Products GMBH, Marburg, Alemania). Los niveles séricos de IL-6, IL-8 y TNFα se determinaron (por duplicado) por ELISA de alta sensibilidad (Biosource, Camarillo, CA, EE.UU.), con un LID de 0,03, de 0,10 y de 0,13pg/ml, respectivamente. Como se ha comentado anteriormente para las determinaciones de esputo, para evitar un sesgo a la baja, en aquellos pacientes con valores inferiores al LID se asignó un valor nominal de la mitad del LID1. Todos los análisis se realizaron de forma centralizada en el Hospital Universitari Son Espases (Palma Mallorca). Dado que el coeficiente de variabilidad fue <10% en todos los casos, para el análisis de datos se utilizó el valor medio de las 2 determinaciones.
Análisis estadísticoEl tamaño muestral del estudio PAC-EPOC (n=342) venía determinado por sus objetivos principales12 y el número de pacientes con datos disponibles para el presente estudio era de 133. Antes de realizar ningún análisis, calculamos el tamaño muestral necesario para identificar como estadísticamente significativas una correlación de 0,35 entre marcadores inflamatorios en suero y vía aérea6 y una correlación de 0,29 entre marcadores inflamatorios y FEV18, usando el programa GRANMO7.1223. Aceptando un riesgo alfa de 0,05 y un riesgo beta de 0,2 en un contraste bilateral, el número de pacientes requerido es de 62 y 92, respectivamente, y en ambos objetivos es superado por el número de pacientes disponible. La normalidad de la distribución de las variables se calculó con el test de Kolgomorov-Smirnov. Los resultados se muestran como media (desviación estándar) en las variables que siguen distribución normal o mediana [percentil 25-75] en caso contrario. Las variables cualitativas se muestran como porcentaje. Para la comparación de los valores de 2 grupos se utilizó el test de t de Student para variables de distribución normal y el de Mann-Whitney o Wilcoxon en caso de variables de distribución no normal. La valoración de las diferencias entre variables cualitativas se realizó mediante el test de Chi-cuadrado. La relación entre las variables de inflamación pulmonar y sistémica se estimó mediante coeficientes de correlación de Spearman. Se consideró una correlación muy baja, baja, moderada o alta si el coeficiente de correlación era en valor absoluto <0,25, 0,25-0,50, 0,51-0,75 o >0,75, respectivamente24. Se consideró significativo un valor de p<0,05, excepto en el caso de comparaciones/correlaciones múltiples, en el que el citado valor de p se modificó de acuerdo a Bonferroni. El análisis estadístico se realizó con el programa SPSS (SPSS Inc, Chicago, IL, EE.UU.).
ResultadosCaracterísticas clínicas y funcionales de los pacientesDe la cohorte inicial (342 pacientes), el esputo no se pudo recoger en un tercio de los pacientes porque fueron incapaces de expectorar, por lo que de entrada se evaluaron 225 pacientes con esputo. Estos pacientes eran (p<0,05) más jóvenes (66 vs. 69años), tenían menor exposición tabáquica (58 vs. 69 paquetes-año), mayor limitación al flujo aéreo (FEV1 49 vs. 54% ref.) y menor valor de DLCO (60 vs. 67% ref.). De estos 225 pacientes, solo 133 tenían esputo representativo. Sus características clínicas eran similares a los que no tenían un esputo válido, excepto que su FEV1 era inferior (52 vs. 57%, p<0,05). De los 133 pacientes con esputo válido, en 76 se obtuvo el esputo espontáneamente y en 57 fue inducido sin haber diferencias clínicas ni biológicas entre ambas poblaciones (datos no mostrados).
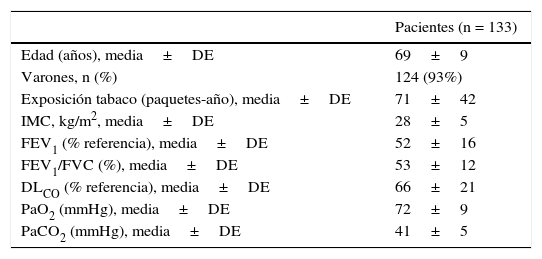
La tabla 1 muestra los principales datos antropométricos, clínicos y funcionales de los pacientes incluidos en el estudio.
Datos clínicos y funcionales de los pacientes incluidos en el análisis
| Pacientes (n = 133) | |
|---|---|
| Edad (años), media±DE | 69±9 |
| Varones, n (%) | 124 (93%) |
| Exposición tabaco (paquetes-año), media±DE | 71±42 |
| IMC, kg/m2, media±DE | 28±5 |
| FEV1 (% referencia), media±DE | 52±16 |
| FEV1/FVC (%), media±DE | 53±12 |
| DLCO (% referencia), media±DE | 66±21 |
| PaO2 (mmHg), media±DE | 72±9 |
| PaCO2 (mmHg), media±DE | 41±5 |
DLCO: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado durante el primer segundo; FEV1/FVC (%): cociente entre el volumen espiratorio forzado durante el primer segundo y la capacidad vital forzada; IMC: índice de masa corporal; PaO2: presión parcial de oxígeno en sangre arterial; PaCO2: presión parcial de dióxido de carbono en sangre arterial.
Treinta y nueve (29%) de los 133 pacientes en los que se obtuvo una muestra válida de esputo estaban colonizados por MPP. El MPP más frecuentemente aislado fue Haemophilus influenzae (n=22, 19%).
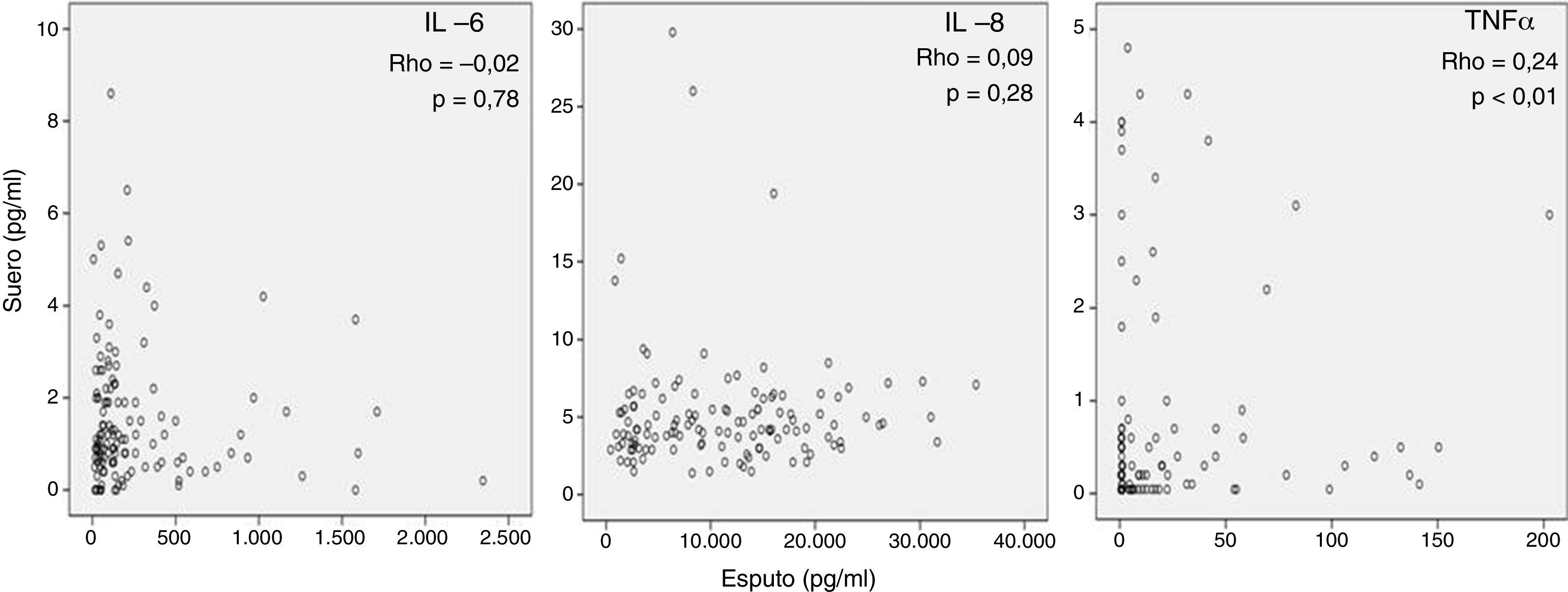
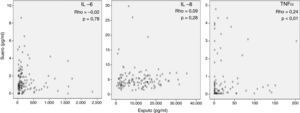
Marcadores inflamatoriosLa tabla 2 muestra los niveles de biomarcadores inflamatorios en esputo y en sangre (siempre superiores en esputo). La mediana de PCR fue de 4,1 [1,9-7] mg/l. La figura 1 muestra la práctica ausencia de relación entre los valores de IL-6, IL-8 y TNFα medidos simultáneamente en el mismo paciente en suero y esputo. Se observa una correlación aislada, baja, con outliers y gran dispersión, entre el TNFα en esputo y en sangre (r=0,24, p<0,01).
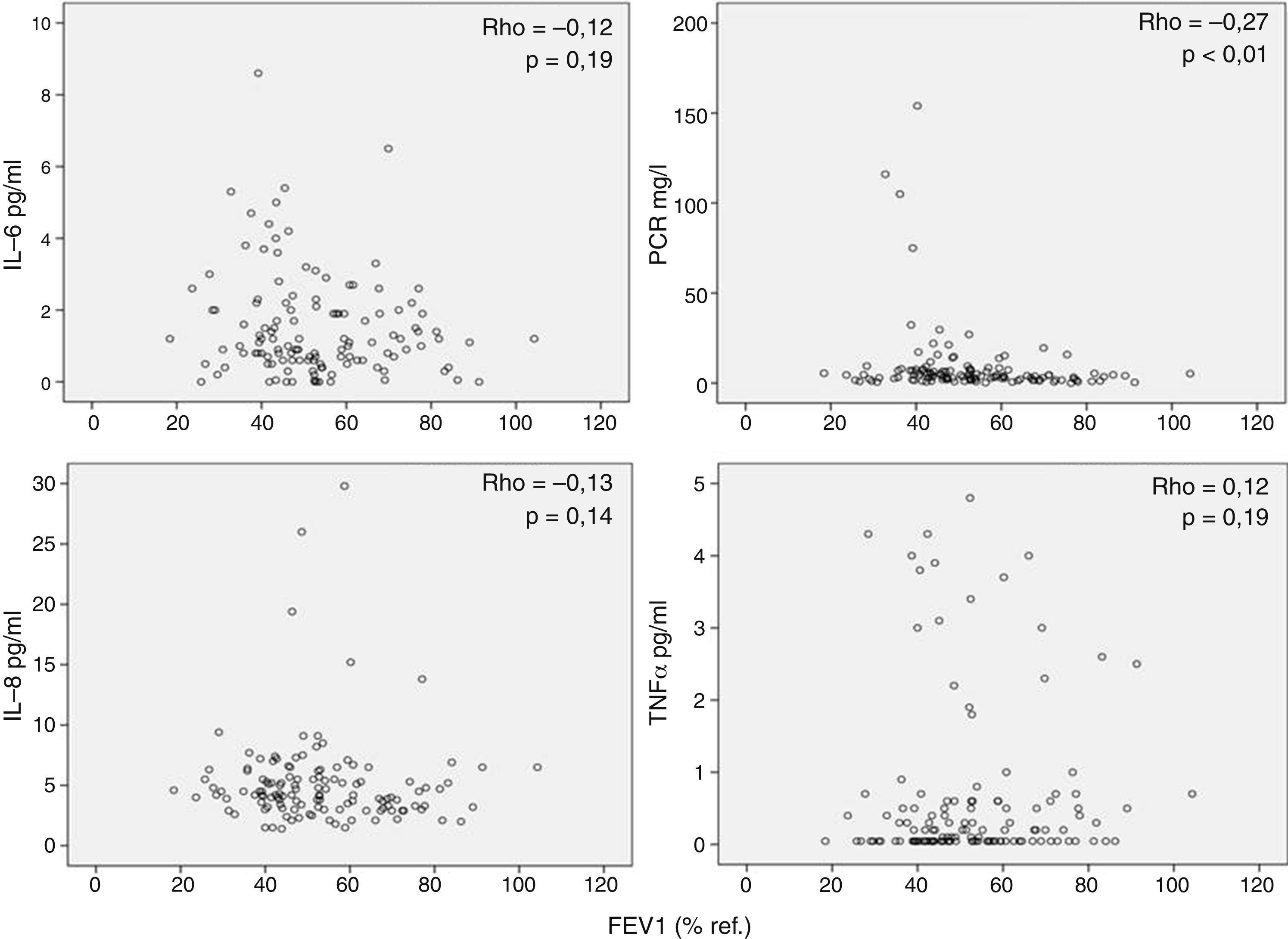
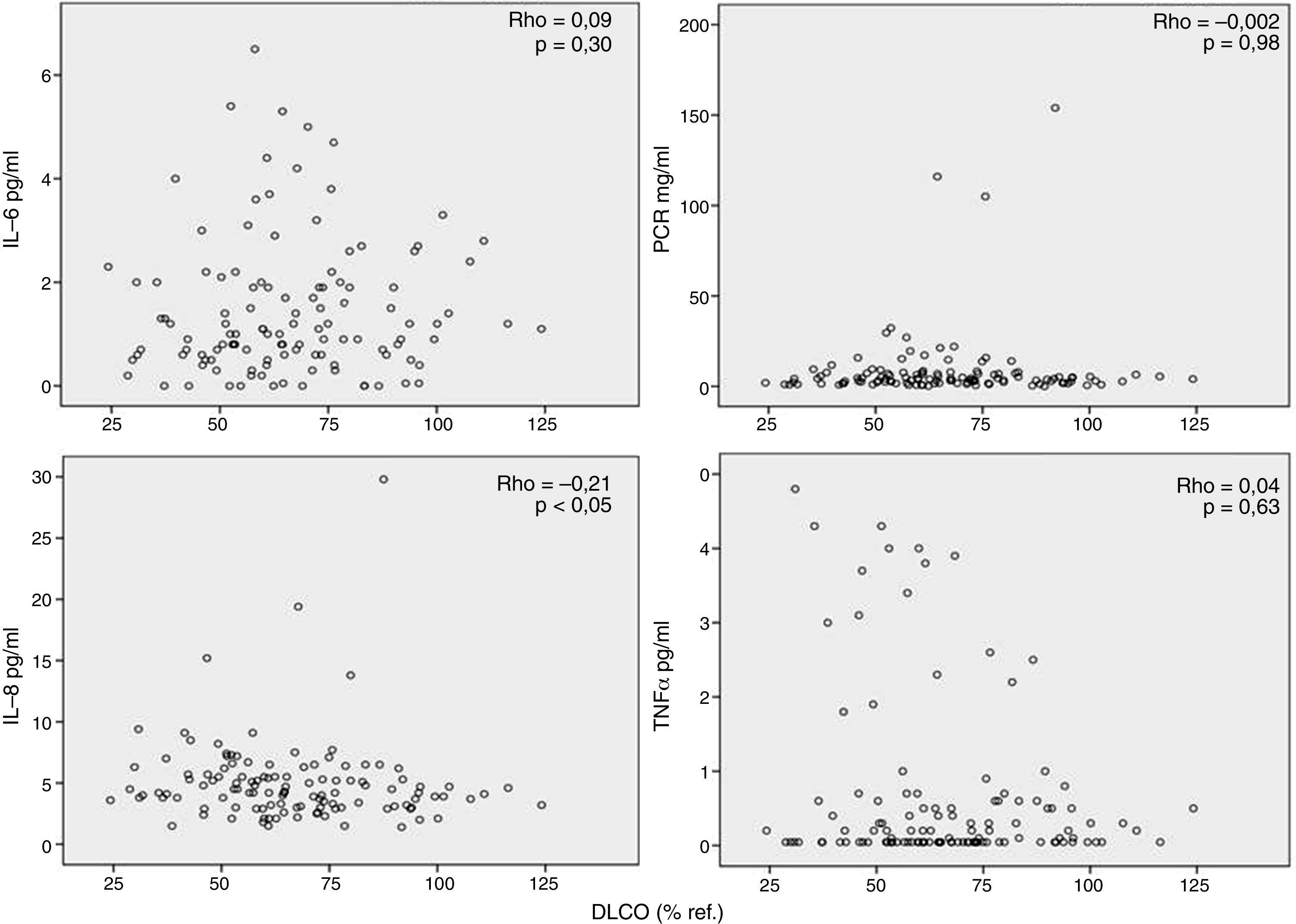
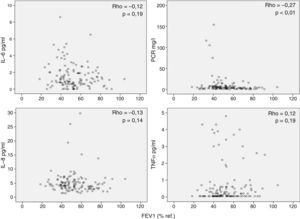
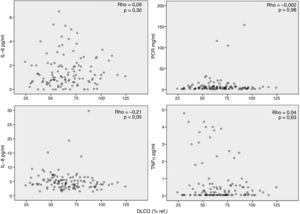
Por otra parte, observamos que los marcadores inflamatorios determinados en suero no tenían relación (aunque alguna aislada, pero al igual que en el caso anterior, con poca relevancia estadística) con los valores de FEV1 (fig. 2), DLCO (fig. 3), PaO2 o edad (datos no mostrados). Los resultados de las asociaciones entre la inflamación sistémica y la colonización bronquial se publicaron previamente y solo se observó una asociación aislada entre PCR y colonización bronquial20.
La principal observación de este estudio es la ausencia de correlación entre diversos marcadores inflamatorios determinados simultáneamente en el mismo paciente con EPOC estable en sangre y en esputo. Tampoco se identificaron asociaciones significativas entre dichos marcadores con variables de función pulmonar, como el FEV1, la DLCO y la PaO2, o con la edad.
Estudios previosDiversos estudios previos han evaluado las relaciones entre inflamación pulmonar y sistémica en pacientes con EPOC. Sin embargo, presentan algunas limitaciones metodológicas, como la correlación entre marcadores diferentes en los compartimentos pulmonar y sistémico10, o que evalúan las relaciones entre inflamación sistémica y variables de función pulmonar, asumiendo que estas son reflejo de la inflamación pulmonar25,26. Por otra parte, los estudios que comparan los mismos marcadores en sangre y pulmón tienen un tamaño muestral pequeño (<30pacientes)6,8,9. Nuestro estudio compara los mismos marcadores en suero y esputo en una muestra muy superior (133 pacientes) a la de estos estudios previos, y además, a diferencia de estos, nuestros pacientes estaban mejor caracterizados11,12.
Interpretación de los resultadosSe ha sugerido que la inflamación sistémica en pacientes con EPOC se debe al paso de células y/o proteínas inflamatorias desde el pulmón a la sangre (spill-over)7. Esta hipótesis se basaba en observaciones previas en animales de experimentación27 y en humanos28 que demostraban que el paso de proteínas pulmonares a la circulación sistémica era posible. Nuestros resultados no apoyan la teoría del spill-over porque no observamos ninguna relación relevante entre marcadores de inflamación pulmonar y sistémica determinados en el mismo paciente de forma simultánea (fig. 1). Por el contrario, nuestras observaciones sugieren que la respuesta inflamatoria en estos 2 compartimentos biológicos en pacientes con EPOC estable tiene mecanismos de regulación diferentes. La ausencia de correlaciones relevantes entre inflamación sistémica y variables de función pulmonar (figs. 2 y 3) apoya esta interpretación y está en concordancia con diversos estudios previos2,29-31. En la misma línea, la colonización bronquial, que se asocia a una marcada respuesta inflamatoria local20, no asociaría un incremento paralelo de estos mismos marcadores a nivel sistémico en nuestros pacientes, aunque asociándose de forma aislada a niveles más elevados de PCR en sangre en los pacientes colonizados20 pero de menor magnitud que los observados durante las agudizaciones de la enfermedad6. En conjunto, todas estas observaciones indican que la presencia de inflamación sistémica es una característica fenotípica independiente en la EPOC cuyo origen y consecuencias tendrán que ser definidos en futuros estudios.
Finalmente, cabe comentar que la relación entre marcadores inflamatorios sistémicos y edad es controvertida29; en nuestro caso no objetivamos ninguna correlación.
Implicaciones clínicas potencialesSi, como sugieren nuestros resultados, la inflamación sistémica es una característica fenotípica independiente en la EPOC, y su presencia se asocia a una mayor frecuencia de agudizaciones y superior mortalidad1, se precisan ensayos clínicos aleatorizados que evalúen diversas alternativas terapéuticas en pacientes con EPOC con estas características. En este sentido es de interés señalar el estudio piloto de McDonald et al.32, en el que se utiliza el valor de PCR para indicar tratamiento con estatinas; los pacientes tratados mostraron una reducción significativa de la PCR.
Fortalezas y limitacionesEl tamaño muestral de nuestro estudio (n=133), muy superior al de estudios previos8,9, la completa caracterización clínica de los pacientes estudiados (función pulmonar, estado nutricional, microbiología, comorbilidades, etc.), y especialmente el hecho de que los diferentes marcadores inflamatorios analizados hayan sido determinados simultáneamente en suero y esputo son claras fortalezas del mismo. Como cualquier estudio, sin embargo, el nuestro también tiene limitaciones, entre las que cabe destacar: 1)La inflamación determinada en esputo podría no ser idéntica a la existente en tejido pulmonar. 2)No se obtuvo esputo en 117 pacientes de la cohorte inicial de 342 pacientes (34%); estos pacientes eran más jóvenes (66 versus 69años), más fumadores (58 versus 69paq-a) y con peor función pulmonar (49% versus 54%). Ello podría explicarse por la mayor historia de tabaquismo que podría favorecer la expectoración33 o que de per se podría constituir otro fenotipo. Por lo que se refiere a la edad, a pesar de que las diferencias fueron estadísticamente significativas, en valor absoluto fueron clínicamente irrelevantes (3años). 3)Solo se obtuvo esputo válido en 133 pacientes del total 225 con esputo. Los pacientes con esputo válido del resto de pacientes que consiguieron expectorar se diferenciaron solo en el FEV1 (52 versus 57%, p<0,05). Este fenómeno ya se ha descrito en otros estudios, que han observado una correlación directa entre el esputo válido y el grado de obstrucción al flujo aéreo34. Por lo que respecta al porcentaje de esputos válidos respecto al total de la cohorte (133/342; 39%), es similar a otras series35,36. 4)Los datos microbiológicos se publicaron en otro artículo20, pero los objetivos del presente estudio son diferentes y la gran mayoría de resultados también. Para complementar mejor las relaciones entre la inflamación pulmonar se han añadido estos datos de microbiología. 5)La mayoría de los pacientes eran hombres, por lo que nuestros resultados no se pueden extrapolar directamente a mujeres, ya que la enfermedad se manifiesta de forma diferente37.
ConclusionesEn pacientes con EPOC estable no existe correlación entre la inflamación pulmonar y sistémica, lo que sugiere que la hipótesis del spill-over es poco probable y los mecanismos patogénicos responsables de la inflamación en ambos compartimentos son independientes.
FinanciaciónFinanciado en parte por: Fondo de Investigación Sanitaria (PI020541, PI052082, PI052486, 11/02029, 14/00713), Ministerio de Salud, España; Agència d’Avaluació de Tecnologia i Recerca Mèdiques (AATRM 035/20/02), Govern de Catalunya; Sociedad Española de Neumología y Cirugía Torácica (SEPAR 2002/137, SEPAR 2013); Fundació Catalana de Pneumologia (FUCAP 2003 Beca Marià Ravà); Red RESPIRA (RTIC C03/11); Red RCESP (RTIC C03/09); Fundació La Marató de TV3 (núm. 041110); DURSI (2005SGR00392), y una beca educativa de Novartis Farmacéutica. CIBERESP y CIBERES están fundadas por el Instituto de Salud CarlosIII, Ministerio de Salud, España. Direcció General d’Investigació i Desenvolupament Tecnològic de la Conselleria d’Innovació, Interior i Justícia de la Comunitat Autònoma de les Illes Balears y Fondos FEDER (Grupos competitivos) (PRE-R-22528-2011).
AutoríaBelén Núñez: reclutamiento pacientes, recolección de muestras, análisis inflamación sangre y esputo, base de datos, análisis estadístico, discusión resultados, redacción manuscrito.
Jaume Sauleda: redacción del proyecto FIS (PI052082), reclutamiento, análisis estadístico, discusión resultados, redacción manuscrito.
Judith García-Aymerich: redacción del proyecto de la cohorte, análisis estadístico, discusión, redacción manuscrito.
Aina Noguera: análisis inflamación sangre y esputo, discusión, redacción manuscrito.
Eduard Monsó: recolección y procesado de los esputos, discusión, redacción manuscritos.
Federico Gómez: reclutamiento, recolección y procesado de los esputos, discusión, redacción manuscritos.
Esther Barreiro: reclutamiento, recolección de muestras, discusión, redacción manuscritos.
Alicia Marín: reclutamiento, recolección y procesado de los esputos, discusión, redacción manuscritos.
Josep Maria Antó: redacción del proyecto de la cohorte, discusión, redacción manuscrito.
Alvar Agustí: redacción del proyecto FIS (PI052082), análisis estadístico, discusión resultados, redacción manuscrito análisis estadístico, discusión, redacción manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los participantes en el estudio por su voluntad de contribuir a la investigación biomédica, así como a Meritxell López (E.I.), Angel Ríos (E.I.), Josep Lluis Valera (E.I.), Sara Barea (E.I.) y a la Dra. Cristina Villena por su ayuda técnica durante el estudio.
Centro de Investigación en Epidemiología Ambiental (CREAL), Institut Municipal d’Investigació Mèdica (IMIM), Barcelona: Josep M. Antó (investigador principal), Judith Garcia-Aymerich (coordinadora de proyecto), Marta Benet, Jordi de Batlle.
Hospital del Mar-IMIM, Barcelona: Joaquim Gea (coordinador del centro), Eva Balcells, Àngel Gayete, Mauricio Orozco-Levi.
Hospital Clínic-Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Barcelona: Joan Albert Barberà (coordinador del centro), Federico P. Gómez, Carles Paré, Josep Roca, Robert Rodríguez-Roisin.
Hospital General Universitari Vall d’Hebron, Barcelona: Jaume Ferrer (coordinador del centro), Esther Pallissa, Esther Rodríguez.
Hospital de la Santa Creu i Sant Pau, Barcelona: Pere Casan (coordinador del centro), Rosa Güell, Ana Giménez.
Hospital Universitari Germans Trias i Pujol, Badalona: Eduard Monsó (coordinador del centro), Alicia Marín, Josep Morera.
Hospital Universitario de Bellvitge, l’Hospitalet de Llobregat: Eva Farrero (coordinador del centro), Joan Escarrabill.
Hospital de Sabadell, Corporació Parc Taulí, Institut Universitari Parc Taulí (Universitat Autònoma de Barcelona), Sabadell: Antoni Ferrer (coordinador del centro)
Hospital Universitari Son Dureta, Palma de Mallorca: Jaume Sauleda (coordinador del centro), Àlvar G.N. Agustí, Bernat Togores.
Hospital de Cruces, Barakaldo: Juan Bautista Gáldiz (coordinador del centro), Lorena López.
Hospital General Universitari, Valencia: José Belda.