La tromboembolia pulmonar (TEP) es un problema de salud pública de primer orden. Aunque menos frecuente que otras enfermedades vasculares, como el infarto de miocardio o la enfermedad cerebrovascular, la TEP es tan grave como las anteriores. Las sociedades médicas españolas involucradas en la atención a estos pacientes han elaborado un documento de consenso que intenta actualizar con la mejor evidencia disponible las recomendaciones de diagnóstico, pronóstico y tratamiento de esta enfermedad. Este documento de consenso realiza recomendaciones o sugerencias en función de la interpretación de la evidencia disponible y de su calidad, del balance entre el riesgo y el beneficio de las intervenciones, y del coste. Para ello se partió de 2 documentos: terapia antitrombótica y prevención de trombosis, 9.a ed: guías de práctica clínica basadas en evidencia del American College of Chest Physicians1 y la guía clínica sobre tratamiento de la enfermedad tromboembólica venosa (ETEV) del National Institute for Health and Clinical Excellence2. Ambos documentos utilizan el sistema GRADE3 para establecer recomendaciones. Adicionalmente, se realizó una revisión sistemática de la bibliografía publicada entre enero de 2012 y marzo de 2013. A partir de estos documentos y de la revisión sistemática de la literatura, 2 autores (F.U. y D.J.) elaboraron un manuscrito que sirvió de base para la discusión final (en una reunión presencial) por un panel constituido por los coordinadores de cada una de las sociedades científicas participantes. En esa reunión, todas las recomendaciones o sugerencias fueron consensuadas entre los asistentes. El consenso se alcanzó mediante discusión entre los miembros del panel, considerando los beneficios y riesgos potenciales de las intervenciones, la práctica clínica habitual, las recomendaciones de otras normativas, la preferencia de los pacientes y los criterios de equidad. Los autores del documento también tuvieron en cuenta aquellas situaciones clínicas en las que la falta de evidencia justifica la espera hasta disponer de resultados de investigación en el futuro.
Concepto, patogenia, factores de riesgo y epidemiologíaLa TEP consiste en el enclavamiento en las arterias pulmonares de un trombo desprendido (émbolo) desde alguna parte del territorio venoso. Aunque el origen del émbolo puede ser una trombosis venosa de localización diversa (extremidades superiores, venas prostáticas, uterinas, renales y cavidades derechas), en la mayoría de los casos (90-95%) se trata de una trombosis venosa profunda (TVP) de extremidades inferiores (EEII), a menudo asintomática.
Los factores de riesgo (tabla 1) para desarrollar TEP están relacionados con uno o varios de los mecanismos etiopatogénicos de la enfermedad: estasis, lesión endotelial e hipercoagulabilidad. Esta normativa los clasifica como mayores o menores, en función de que su riesgo protrombótico sea alto o moderado-bajo, respectivamente. Cuando la ETEV se asocia a factores de riesgo desencadenantes se califica como provocada o secundaria. Cuando no concurren factores desencadenantes se denomina no provocada, espontánea o idiopática.
Factores de riesgo para la enfermedad tromboembólica venosa
| Riesgo alto |
| Prótesis o fractura de cadera o rodilla |
| Cirugía mayor |
| Politraumatismo |
| Daño espinal |
| Riesgo moderado |
| Inmovilización con férula de escayola de EEII |
| Ictus con parálisis de EEII |
| Puerperio |
| TEP o TVP previa |
| Fármacos o dispositivos hormonales estrogénicos |
| Trombofilia |
| Cáncer |
| Quimioterapia |
| Fármacos antipsicóticos |
| Enfermedad inflamatoria intestinal |
| Artroscopia de rodilla |
| Catéteres o dispositivos venosos centrales |
| Riesgo bajo |
| Edad avanzada |
| Cirugía laparoscópica |
| Reposo cama>3 días |
| Viajes prolongados de>6-8h |
| Obesidad mórbida |
| Varices |
| Embarazo |
EEII: extremidades inferiores; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
Se estima una incidencia aproximada de TEP de un caso por cada 1.000 habitantes al año, aunque es probable que la incidencia real sea mayor. Según datos del Ministerio de Sanidad, en España durante el año 2010 se diagnosticaron 22.250 casos de TEP, con una mortalidad durante el ingreso del 8,9%.
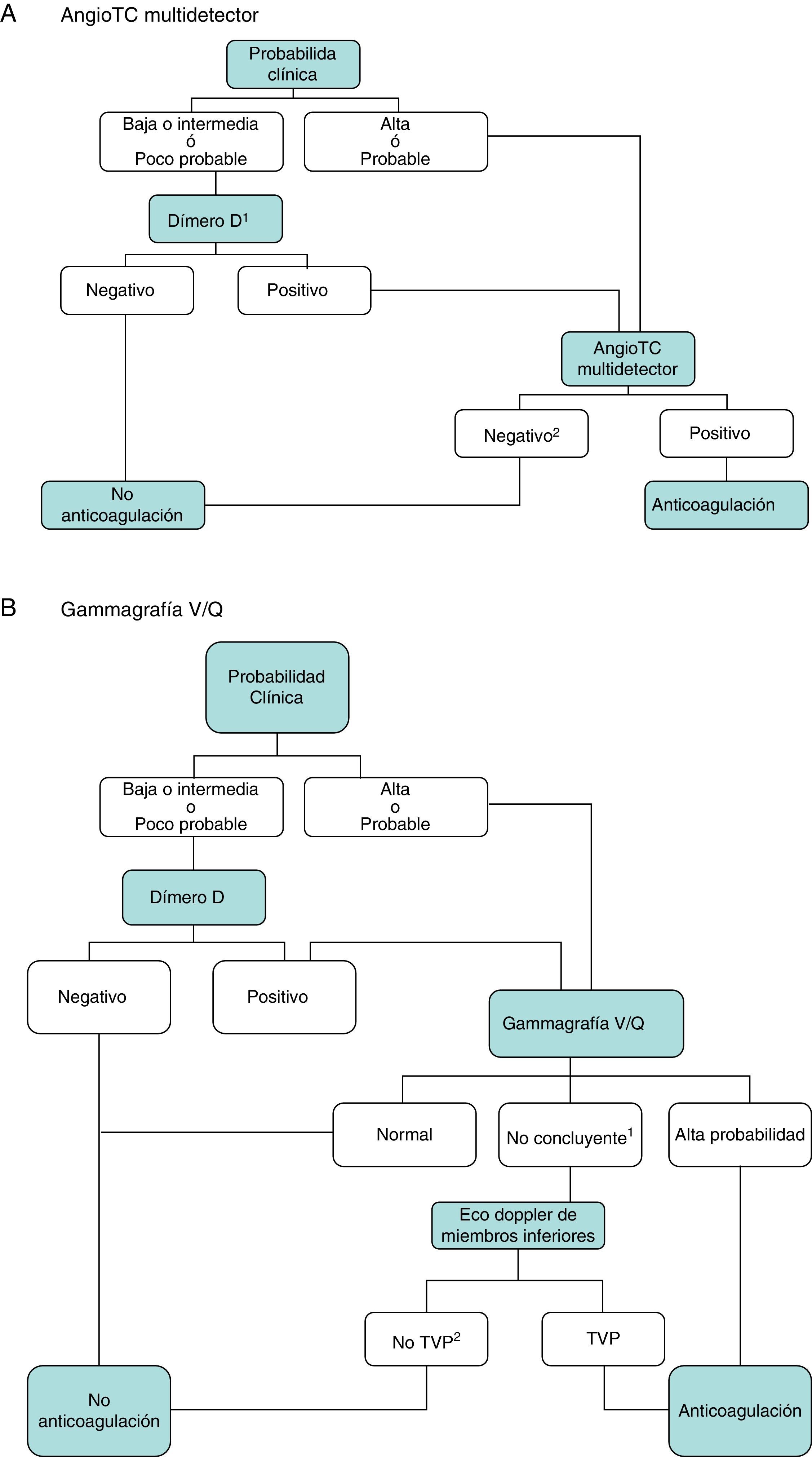
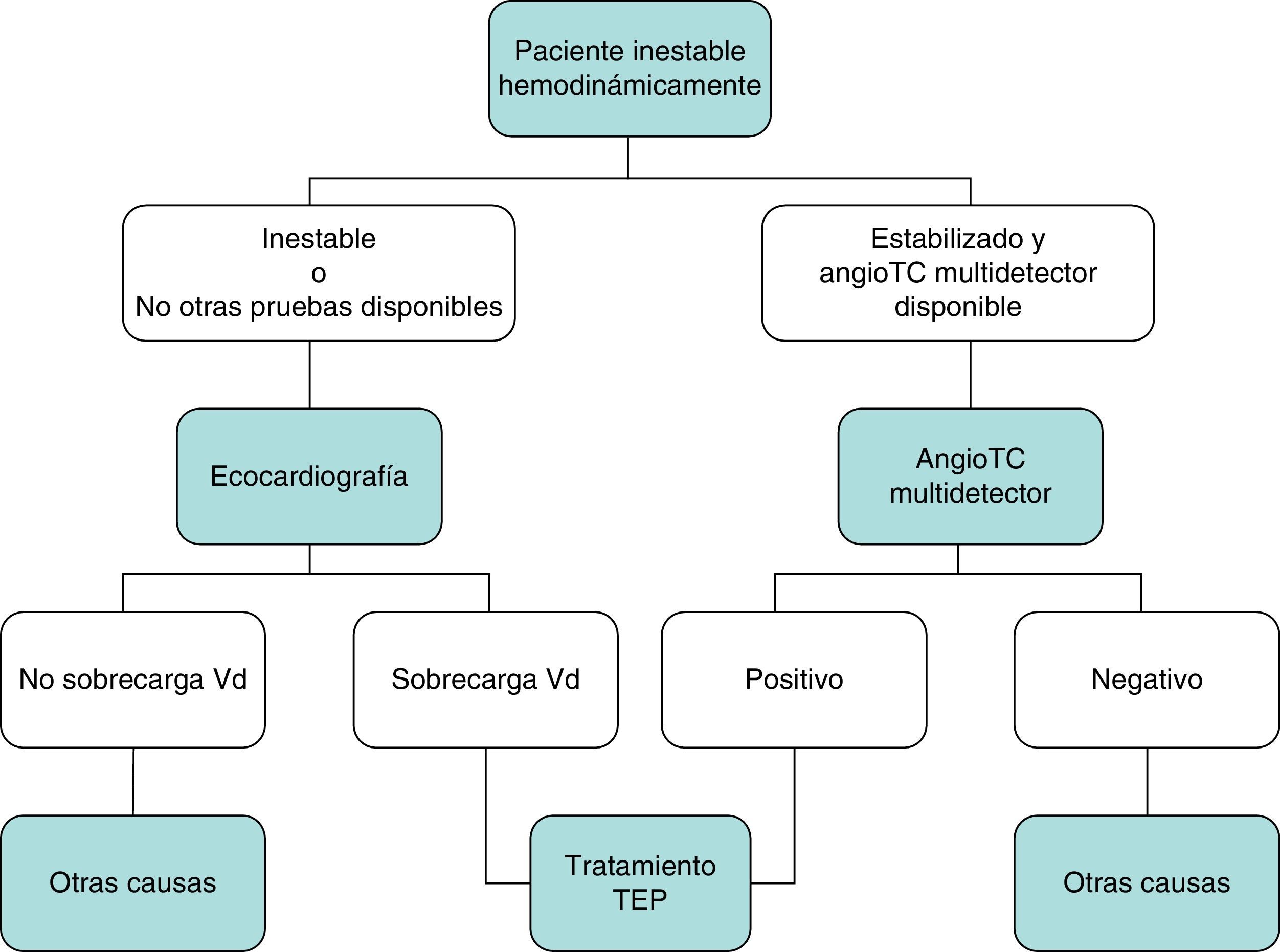
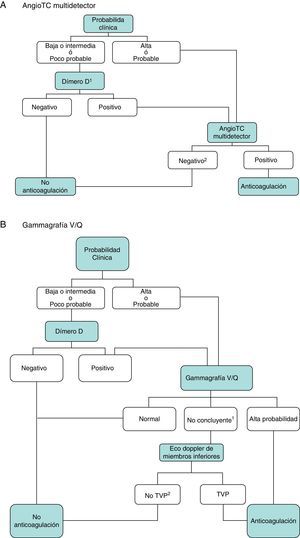
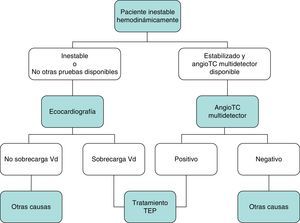
DiagnósticoNinguna prueba aislada es lo suficientemente sensible y específica como para confirmar o descartar la presencia de TEP aguda sintomática. Por este motivo, el diagnóstico de la enfermedad debe combinar la sospecha clínica, los resultados del dímero D y las pruebas de imagen. El seguimiento de los algoritmos diagnósticos comúnmente aceptados mejora el pronóstico de los pacientes evaluados por sospecha de TEP4. Se propone un algoritmo diagnóstico para pacientes estables hemodinámicamente con sospecha de TEP (fig. 1 A y B), y otro para pacientes inestables (fig. 2).
Algoritmo diagnóstico para el paciente ambulatorio estable hemodinámicamente.
A) AngioTC: angiografía por tomografía computarizada. 1Se refiere a un dímero D de alta sensibilidad. En caso de dímero D menos sensible, solo descarta la TEP en pacientes con probabilidad clínica baja o TEP poco probable. 2En caso de probabilidad clínica alta y angioTC multidetector negativa, se sugieren pruebas diagnósticas adicionales (gammagrafía V/Q y/o eco doppler de extremidades inferiores).
B) TVP: trombosis venosa profunda. 1Se refiere a gammagrafías V/Q de baja o intermedia probabilidad. 2En caso de alta probabilidad clínica, gammagrafía de perfusión no concluyente, y eco de miembros inferiores negativa, se debe valorar la necesidad de angioTC multidetector, de acuerdo con el especialista correspondiente.
El proceso diagnóstico no justifica demoras en el inicio del tratamiento anticoagulante, que debe ser precoz en los pacientes con sospecha clínica intermedia o alta.
- •
Se recomienda iniciar precozmente (antes de los resultados de las pruebas diagnósticas) el tratamiento anticoagulante en pacientes con probabilidad clínica intermedia o alta de TEP.
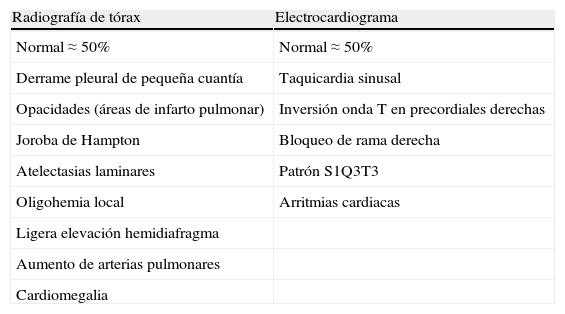
Se debe considerar el diagnóstico de TEP aguda sintomática en todo paciente que refiera disnea de nueva aparición, empeoramiento de su disnea habitual, dolor torácico, síncope o hipotensión sin una explicación alternativa, particularmente cuando las pruebas complementarias básicas (radiografía de tórax, electrocardiograma y gasometría arterial) descartan otros diagnósticos diferenciales. La tabla 2 recoge algunos de los hallazgos radiológicos y electrocardiográficos habituales en la TEP. La evaluación estandarizada, mediante reglas de predicción de la probabilidad clínica, clasifica a los pacientes en categorías con prevalencia de TEP distinta (aproximadamente el 10% para probabilidad baja, el 25% para probabilidad intermedia y >60% para probabilidad alta) y facilita la interpretación de las demás pruebas diagnósticas. La escala de Wells y la escala de Ginebra (tabla 3) han sido las más ampliamente validadas.
- •
Se recomienda utilizar escalas clínicas suficientemente validadas (Wells o Ginebra) como primer escalón en la aproximación diagnóstica al paciente estable hemodinámicamente con sospecha de TEP.
Radiografía de tórax y electrocardiograma en la tromboembolia pulmonar aguda sintomática
| Radiografía de tórax | Electrocardiograma |
| Normal≈50% | Normal≈50% |
| Derrame pleural de pequeña cuantía | Taquicardia sinusal |
| Opacidades (áreas de infarto pulmonar) | Inversión onda T en precordiales derechas |
| Joroba de Hampton | Bloqueo de rama derecha |
| Atelectasias laminares | Patrón S1Q3T3 |
| Oligohemia local | Arritmias cardiacas |
| Ligera elevación hemidiafragma | |
| Aumento de arterias pulmonares | |
| Cardiomegalia |
Escalas de puntuación para la graduación de la probabilidad clínica en la tromboembolia pulmonar aguda sintomática
| Puntuación | |
| Escala de Wells | |
| Diagnóstico alternativo menos probable que la TEP | 3,0 |
| Síntomas o signos de TVP | 3,0 |
| Antecedentes de TEP o TVP | 1,5 |
| Inmovilización de al menos 3 días o cirugía en el último mes | 1,5 |
| Frecuencia cardiaca>100/min | 1,5 |
| Hemoptisis | 1,0 |
| Cáncer en tratamiento activo o paliativo en los últimos 6 meses | 1,0 |
| Para dímero D muy sensibleBaja probabilidad: <2 puntosIntermedia probabilidad: 2-6 puntosAlta probabilidad: ≥6 puntosPara dímero D menos sensibleTEP poco probable:≤4 puntosTEP probable: >4 puntos | |
| Escala de Ginebra | |
| Edad>65 años | 1,0 |
| Antecedente de TVP o TEP | 3,0 |
| Cirugía con anestesia general o fractura≤unmes | 2,0 |
| Cáncer activo sólido o hematológico o curado≤unaño | 2,0 |
| Dolor unilateral en EEII | 3,0 |
| Hemoptisis | 2,0 |
| Frecuencia cardiaca 75-94/min | 3,0 |
| Frecuencia cardiaca ≥ 95/min | 5,0 |
| Dolor a la palpación en EEII y edema unilateral | 4,0 |
| Baja probabilidad: 0-3 puntosIntermedia probabilidad: 4-10 puntosAlta probabilidad: ≥11 puntos | |
EEII; extremidades inferiores; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
El dímero D es un producto de degradación de la fibrina presente en el trombo, que se genera cuando esta es proteolizada por la plasmina. Es una prueba de alta sensibilidad, pero de baja especificidad, porque su elevación también se asocia a otras situaciones clínicas como edad avanzada, infección, cáncer, embarazo o ingreso hospitalario.
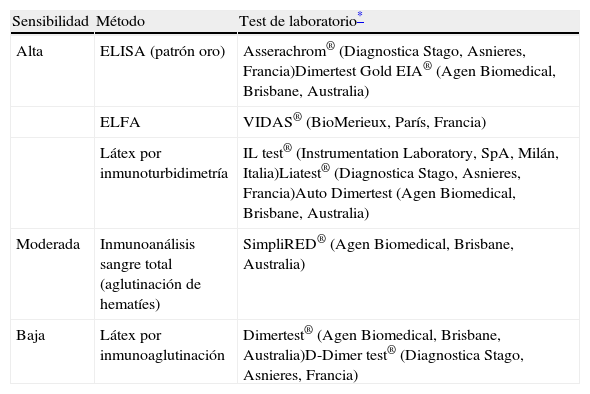
En pacientes normotensos con probabilidad de TEP baja o intermedia, un dímero D de alta sensibilidad (≥95%) negativo (<500ng/mL) excluye el diagnóstico de TEP. En estos pacientes que no son anticoagulados, la incidencia de ETEV en los 3 meses posteriores es del 0,14% (intervalo de confianza de 95% [IC 95%]: 0,05-0,41)5. Los métodos de determinación de dímero D (tabla 4) de sensibilidad moderada o baja (<95%) solo excluyen la enfermedad en el grupo de pacientes con probabilidad clínica baja (o con TEP improbable según la escala de Wells dicotómica).
- •
Se recomienda conocer la sensibilidad del método de determinación de dímero D usado en cada medio.
- •
Un dímero D de alta sensibilidad negativo excluye la TEP en pacientes con probabilidad clínica baja o intermedia.
- •
Un dímero D de sensibilidad moderada o baja negativo excluye la TEP en pacientes con probabilidad clínica baja (o TEP improbable).
- •
Se recomienda no realizar una determinación de dímero D en pacientes con probabilidad clínica alta para TEP.
Técnicas de determinación de dímero D para la tromboembolia pulmonar aguda sintomática
| Sensibilidad | Método | Test de laboratorio* |
| Alta | ELISA (patrón oro) | Asserachrom® (Diagnostica Stago, Asnieres, Francia)Dimertest Gold EIA® (Agen Biomedical, Brisbane, Australia) |
| ELFA | VIDAS® (BioMerieux, París, Francia) | |
| Látex por inmunoturbidimetría | IL test® (Instrumentation Laboratory, SpA, Milán, Italia)Liatest® (Diagnostica Stago, Asnieres, Francia)Auto Dimertest (Agen Biomedical, Brisbane, Australia) | |
| Moderada | Inmunoanálisis sangre total (aglutinación de hematíes) | SimpliRED® (Agen Biomedical, Brisbane, Australia) |
| Baja | Látex por inmunoaglutinación | Dimertest® (Agen Biomedical, Brisbane, Australia)D-Dimer test® (Diagnostica Stago, Asnieres, Francia) |
ELFA: Enzyme-Linked Fluorescence Assay; ELISA: Enzime-Linked InmunoSorbent Assay.
Las pruebas de imagen más utilizadas son la angiografía torácica por tomografía computarizada (angioTC) multidetector, la gammagrafía pulmonar de ventilación-perfusión (V/Q) y la ecografía venosa de EEII con o sin doppler (ED).
Angiografía torácica por tomografía computarizada multidetectorEn el momento actual la angioTC multidetector es la prueba de imagen de elección para el diagnóstico de la TEP. En una revisión sistemática y metaanálisis6 que incluyó a 2.020 pacientes procedentes de 3 estudios, el riesgo tromboembólico de los pacientes que no fueron anticoagulados en base a una angioTC negativa fue del 1,2% (IC 95%: 0,8-1,8), con un riesgo de TEP fatal del 0,6%.
PIOPED II7 fue un estudio multicéntrico que evaluó la utilidad diagnóstica de la angioTC de 4, 8 o 16 detectores en pacientes con sospecha de TEP. La sensibilidad global fue del 83% (IC 95%: 76-92%) y la especificidad del 96% (IC 95%: 93-97%). En este estudio, el valor predictivo negativo (VPN) de la angioTC multidetector aumentó marginalmente al añadir la flebografía en la misma exploración. Hay que destacar que el VPN de la angioTC multidetector fue solo del 60% en pacientes con probabilidad clínica alta de TEP.
Una angioTC multidetector proporciona una dosis efectiva de radiación de 7 miliSievert, equivalente a 2 años de radiación natural de fondo, lo que supone un riesgo adicional de por vida de cáncer fatal bajo8. Los equipos actuales permiten realizar la prueba reduciendo la dosis de radiación. No obstante, la indicación en mujeres fértiles debe estar justificada en función del balance riesgo-beneficio. En mujeres embarazadas se aconseja realizar una gammagrafía de perfusión antes que una angioTC multidetector por la menor radiación, siempre que la radiografía de tórax sea normal9. Si se realiza angioTC multidetector se recomienda protección mamaria. En el periodo de lactancia se desconoce si pudiera haber algún efecto sobre la leche materna. En pacientes con insuficiencia renal se puede realizar ella angioTC siguiendo los protocolos locales de prevención de la nefropatía inducida por el contraste.
- •
Una angioTC multidetector (técnicamente adecuada) negativa descarta la TEP, excepto en los pacientes con probabilidad clínica alta para la enfermedad.
- •
Se recomienda la realización de pruebas diagnósticas adicionales en pacientes con sospecha de TEP y angioTC multidetector no concluyente.
- •
Se sugiere la realización de pruebas diagnósticas adicionales en pacientes con sospecha alta de TEP y una angioTC multidetector negativa.
- •
Se recomienda no realizar de forma rutinaria flebografía por TC para incrementar el rendimiento diagnóstico de la angioTC multidetector.
La gammagrafía V/Q ha sido reemplazada por la angioTC multidetector como prueba diagnóstica de elección. En el momento actual se suele reservar para pacientes con alergia a contrastes yodados, para algunos casos con insuficiencia renal o para mujeres embarazadas con sospecha de TEP en las que la ED de EEII ha sido negativa, y siempre que la radiografía de tórax sea normal.
En el estudio PIOPED I10 el VPN de una gammagrafía normal fue del 97% y el valor predictivo positivo de una gammagrafía de alta probabilidad del 85-90%. Sin embargo, la gammagrafía fue diagnóstica (normal o de alta probabilidad) en tan solo el 30-50% de los pacientes. En el resto de los pacientes, la gammagrafía V/Q fue no concluyente (baja, intermedia o indeterminada probabilidad).
- •
Una gammagrafía V/Q normal descarta la TEP clínicamente significativa.
- •
Una gammagrafía V/Q de alta probabilidad confirma la TEP en pacientes con probabilidad clínica intermedia o alta de la enfermedad.
- •
Se recomienda la realización de pruebas diagnósticas adicionales en pacientes con sospecha de TEP y gammagrafía V/Q no concluyente.
La ED es el método de elección para la detección de TVP concomitante en pacientes con TEP. El criterio diagnóstico principal es la falta de compresibilidad de la luz venosa. Es especialmente sensible y específica en pacientes con síntomas de TVP y en el territorio femoropoplíteo, pero su rendimiento disminuye cuando la TVP es asintomática o se localiza en el territorio sural. Aproximadamente el 50% de los pacientes con TEP aguda sintomática presentan TVP concomitante en el momento del diagnóstico, de las cuales solo la mitad son sintomáticas. Actualmente su uso se reserva para pacientes con discordancia entre la probabilidad clínica y el resultado de las pruebas de imagen torácicas, para pacientes con pruebas torácicas no concluyentes y para pacientes embarazadas como primera exploración en el algoritmo diagnóstico.
- •
Se recomienda la realización de una ED como primera exploración en pacientes embarazadas con sospecha de TEP.
A priori esta prueba no se diferencia de la angioTC multidetector en la obtención de imágenes del árbol arterial pulmonar. Tiene la ventaja de utilizar como contraste el gadolinio, que no contiene yodo, y de no radiar a los pacientes. En el estudio PIOPED III su sensibilidad fue del 78% y su especificidad del 99%11. Al ampliar el estudio con fleborresonancia la sensibilidad aumentó al 92% con una especificidad del 96%. La exploración fue técnicamente inadecuada en el 25% de los pacientes, lo que constituye su mayor limitación. Podría reservarse para pacientes con alergia al contraste yodado. En caso de insuficiencia renal grave (aclaramiento de creatinina<30mL/min) está contraindicada por la toxicidad del gadolinio. Se debe evitar en el embarazo y en la lactancia, aunque no hay evidencias claras de efectos teratogénicos.
- •
Se recomienda no realizar de forma rutinaria una angiorresonancia pulmonar para el diagnóstico de los pacientes con sospecha de TEP.
En general, la ecocardiografía transtorácica carece de utilidad en el algoritmo diagnóstico de los pacientes con sospecha de TEP. Aunque la angioTC multidetector también es la prueba diagnóstica de elección en los pacientes inestables hemodinámicamente con sospecha de TEP, la ecocardiografía realizada a pie de cama puede aportar información diagnóstica muy valiosa en los centros en los que la angioTC multidetector no esté disponible, o en aquellos casos en los que la inestabilidad del paciente impida su traslado a la sala de radiología. En pacientes críticos, la ausencia de signos ecocardiográficos de disfunción o sobrecarga de cavidades derechas descarta la TEP como causa de compromiso hemodinámico.
- •
Se recomienda no realizar de forma rutinaria una ecocardiografía transtorácica para el diagnóstico de los pacientes estables con sospecha de TEP.
La TEP constituye una enfermedad con un espectro amplio de manifestaciones clínicas, con diferente pronóstico y tratamiento. El factor pronóstico más importante es la situación hemodinámica en el momento del diagnóstico de la enfermedad12. La TEP de alto riesgo (antiguamente denominada TEP masiva), que se caracteriza por la presencia de hipotensión arterial o shock, supone aproximadamente el 5% de los casos y se asocia a una mortalidad precoz de al menos el 15%. En general se recomienda tratamiento trombolítico para estos pacientes.
Sin embargo, la mayoría de los pacientes con TEP se presentan con pocos síntomas. La mortalidad precoz de los pacientes estables hemodinámicamente con diagnóstico de TEP oscila entre un 2 y un 10%. La estratificación de riesgo de los pacientes normotensos con TEP debería usarse para identificar a un subgrupo de pacientes de bajo riesgo de mortalidad por todas las causas, que se podrían beneficiar de alta precoz o incluso de tratamiento ambulatorio de su enfermedad; y a un subgrupo de pacientes de mayor riesgo de complicaciones asociadas a la propia TEP (TEP de riesgo intermedio; antigua TEP submasiva), que se podrían beneficiar de tratamientos agresivos para su enfermedad (monitorización intensiva, fibrinólisis)13.
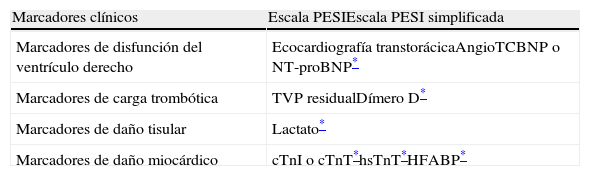
Factores pronósticosLos factores pronósticos más habitualmente usados en los pacientes normotensos con TEP se resumen en la tabla 5. De manera general, estas herramientas evalúan la situación clínica y el estado de salud general del paciente, la disfunción del ventrículo derecho, la carga trombótica y el daño miocárdico.
Herramientas pronósticas para pacientes estables hemodinámicamente con tromboembolia pulmonar aguda sintomática
| Marcadores clínicos | Escala PESIEscala PESI simplificada |
| Marcadores de disfunción del ventrículo derecho | Ecocardiografía transtorácicaAngioTCBNP o NT-proBNP* |
| Marcadores de carga trombótica | TVP residualDímero D* |
| Marcadores de daño tisular | Lactato* |
| Marcadores de daño miocárdico | cTnI o cTnT*hsTnT*HFABP* |
AngioTC: angiografía por tomografía computarizada; BNP: péptido natriurético cerebral; cTnI: troponina cardiaca I; cTnT: troponina cardiaca T; HFABP: proteína ligadora de ácidos grasos cardiacos; hsTnT: troponina T de alta sensibilidad; PESI: Pulmonary Embolism Severity Index; TVP, trombosis venosa profunda.
Las herramientas más útiles para seleccionar a pacientes de bajo riesgo con TEP aguda sintomática son las escalas clínicas pronósticas. La combinación de un conjunto de variables que tiene en cuenta la edad, la comorbilidad y la repercusión cardiovascular de la TEP identifica de manera fiable a un subgrupo de pacientes (aproximadamente un 30%) con un riesgo de mortalidad precoz inferior al 2%. Las escalas clínicas Pulmonary Embolism Severity Index (PESI) y PESI simplificada (PESIs) (tabla 6) han sido validadas extensamente como herramientas excelentes para la identificación de estos pacientes de bajo riesgo14,15. La escala PESIs es más sencilla de usar que la original, y conserva su capacidad pronóstica.
Escalas pronósticas en pacientes con tromboembolia pulmonar aguda sintomática
| Variable | Puntos |
| Escala PESI | |
| Edad | 1/año |
| Sexo varón | 10 |
| Cáncer | 30 |
| Insuficiencia cardiaca | 10 |
| Enfermedad pulmonar crónica | 10 |
| Frecuencia cardiaca ≥110/min | 20 |
| Tensión arterial sistólica<100mm Hg | 30 |
| Frecuencia respiratoria ≥30/min | 20 |
| Temperatura<36°C | 20 |
| Estado mental alterado | 60 |
| Saturación O2<90% | 20 |
| Estratificación de riesgoClase I (riesgo muy bajo): <65 puntosClase II (riesgo bajo): 66-85 puntosClase III (riesgo intermedio): 86-105 puntosClase IV (riesgo alto): 106-125 puntosClase V (riesgo muy alto): >125 puntos | |
| Escala PESI simplificada | |
| Edad>80 años | 1 |
| Cáncer | 1 |
| Enfermedad cardiopulmonar crónica | 1 |
| Frecuencia cardiaca ≥ 110/min | 1 |
| Tensión arterial sistólica<100mm Hg | 1 |
| Saturación O2<90% | 1 |
| Estratificación de riesgoRiesgo bajo:0 puntosRiesgo alto: ≥1 punto(s) | |
PESI: Pulmonary Embolism Severity Index.
No ha sido completamente aclarado el valor de la combinación de las escalas clínicas y de algunos marcadores bioquímicos (particularmente el péptido natriurético cerebral [BNP] o la troponina de alta sensibilidad) o pruebas de imagen (ecocardiograma transtorácico o ED) para la identificación de este grupo de pacientes de bajo riesgo.
- •
Se recomienda utilizar escalas clínicas pronósticas bien validadas (PESI o PESIs) como primer escalón para la identificación de pacientes con TEP de bajo riesgo.
El método más utilizado en la práctica clínica para evaluar la función del ventrículo derecho es la ecocardiografía transtorácica. Se han usado diferentes parámetros cuantitativos (diámetro telediastólico de ventrículo derecho en eje paraesternal largo, cociente telediastólico de diámetros ventriculares en la proyección apical 4C, pico de velocidad de regurgitación tricuspídea, diámetro de la vena cava inferior, tiempo de aceleración de la eyección pulmonar, o tricuspid planne systolic excursion [TAPSE]) para estimar el grado de disfunción ventricular. Su uso para la identificación de los pacientes con TEP de riesgo intermedio está limitado por la dependencia del operador, el coste, y la falta de disponibilidad continuada en muchos centros. Además, no existe un patrón ecocardiográfico de disfunción ventricular derecha suficientemente fiable como para justificar, de forma aislada, la utilización de tratamiento fibrinolítico16.
Las imágenes que genera la angioTC permiten no solo confirmar o descartar el diagnóstico de TEP, sino también valorar la extensión de la obstrucción arterial y la presencia o no de dilatación ventricular derecha17,18. Aunque los estudios con reconstrucción volumétrica del tamaño ventricular pueden ofrecer una valoración pronóstica más exacta, los trabajos más recientes utilizan el cociente entre diámetros ventriculares como parámetro de disfunción ventricular (con puntos de corte diferentes). No se recomienda su uso aislado para identificar a pacientes con TEP de riesgo intermedio que se podrían beneficiar de tratamiento fibrinolítico.
Varios metaanálisis han demostrado el valor pronóstico de la isquemia miocárdica (identificada mediante la elevación de troponina I o T) en los pacientes hemodinámicamente estables con TEP, aunque la potencia de la asociación no es suficientemente robusta como para justificar la escalada terapéutica19,20. El estrés del miocito cardiaco produce la liberación de péptidos natriuréticos a la circulación (BNP y NT-pro-BNP)21,22. Varios estudios y metaanálisis sugieren que poseen utilidad para la identificación de pacientes con TEP de riesgo intermedio. Sin embargo, la sensibilidad para muerte por TEP de estos biomarcadores cardiacos es insuficiente para establecer la indicación de tratamiento trombolítico.
Se ha demostrado una asociación entre la persistencia de material trombótico en el sistema venoso profundo de EEII y la mortalidad a corto y medio plazo de los pacientes con TEP23. La presencia de TVP concomitante podría servir para identificar, junto con otras pruebas de imagen y biomarcadores cardiacos, un perfil de paciente con riesgo especialmente elevado de complicaciones asociadas a la propia TEP.
- •
Se sugiere la combinación de pruebas pronósticas (que identifiquen disfunción del ventrículo derecho, isquemia miocárdica, estrés del miocito cardiaco o carga trombótica) para identificar a los pacientes con TEP de riesgo intermedio.
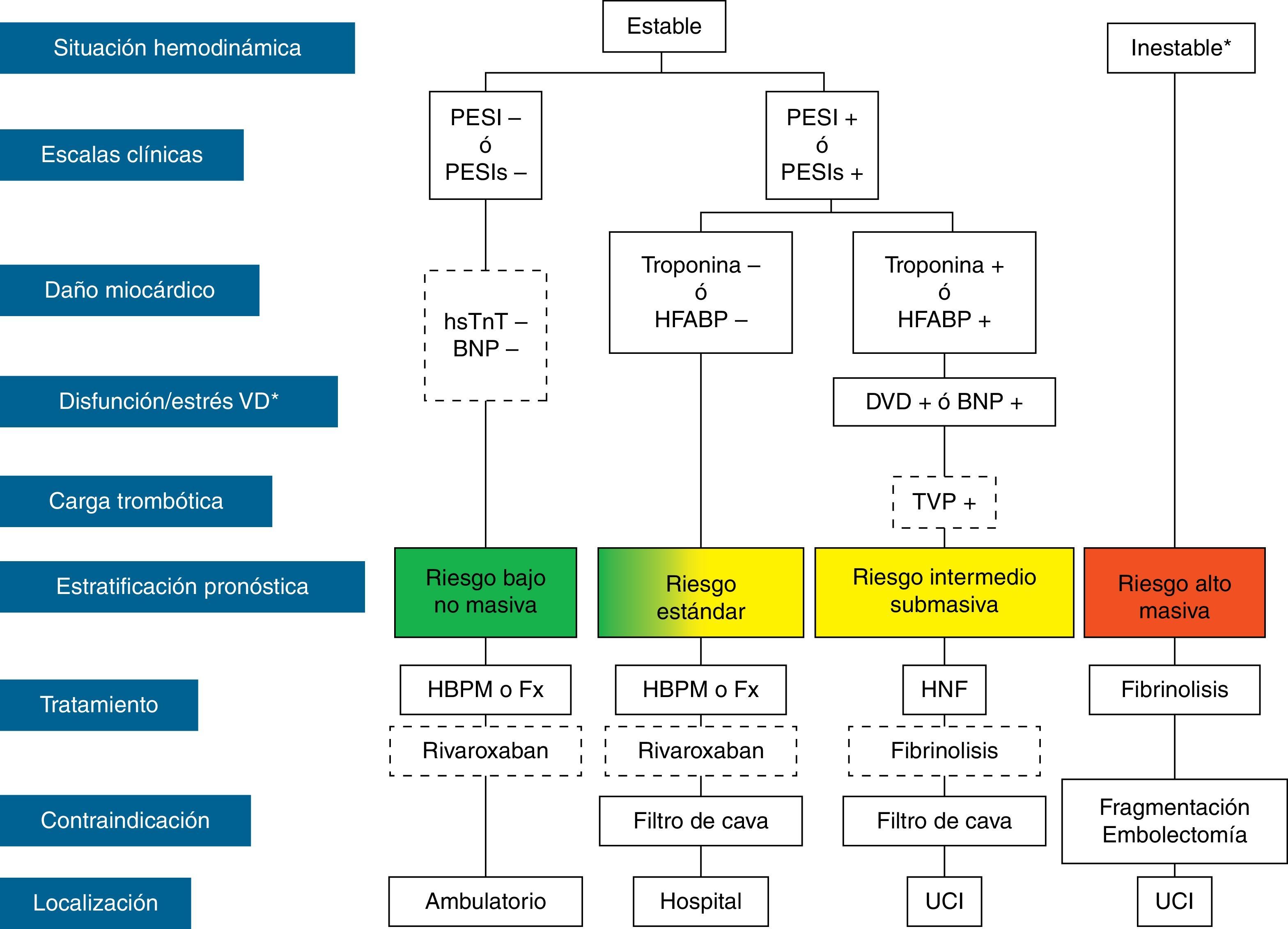
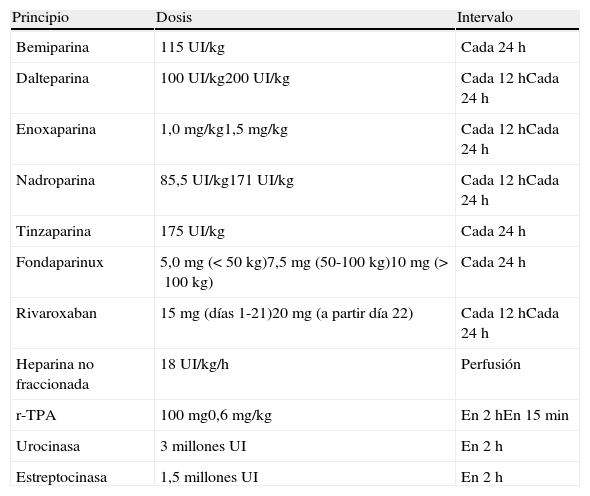
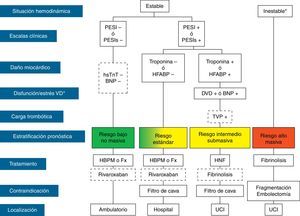
El tratamiento inicial de la TEP tiene como objetivos la estabilización médica del paciente y el alivio de los síntomas, la resolución de la obstrucción vascular y la prevención de las recurrencias. La prioridad a la hora de conseguir estos objetivos depende de la gravedad del paciente. En la mayoría de las ocasiones, todos los objetivos se alcanzan con el tratamiento anticoagulante convencional, que evita la progresión del trombo mientras el sistema fibrinolítico endógeno resuelve la obstrucción vascular y se desarrolla la circulación colateral. En una minoría de pacientes, habitualmente aquellos con inestabilidad hemodinámica (TEP de alto riesgo) o con contraindicación para la anticoagulación, se requieren otros tratamientos farmacológicos (trombolíticos) o medidas mecánicas (filtros de vena cava) para acelerar la lisis del coágulo o prevenir su embolización a los pulmones1 (fig. 3). En la tabla 7 se recogen las pautas de administración de los fármacos aprobados para el tratamiento de la fase aguda de la TEP.
Estratificación pronóstica y tratamiento de la tromboembolia pulmonar en fase aguda. BNP: péptido natriurético cerebral; DVD: disfunción ventricular derecha; Fx: fondaparinux; HBPM: heparina de bajo peso molecular; HFABP: proteína ligadora de ácidos grasos cardiacos; HNF: heparina no fraccionada; hsTnT: troponina T de alta sensibilidad; PESI: Pulmonary Embolism Severity Index; PESIs: PESI simplificada; TVP: trombosis venosa profunda; UCI: unidad de cuidados intensivos.*Shock cardiogénico o presión arterial sistólica<90mm Hg mantenida, no debida a hipovolemia, sepsis o arritmias cardiacas.
La línea discontinua indica ausencia de evidencia definitiva (fibrinólisis) o de experiencia clínica amplia (rivaroxaban).
Para aquellas situaciones no contempladas en el algoritmo, se recomienda hospitalización y tratamiento anticoagulante convencional.
Pautas de tratamiento de la fase aguda de la tromboembolia pulmonar*
| Principio | Dosis | Intervalo |
| Bemiparina | 115UI/kg | Cada 24h |
| Dalteparina | 100UI/kg200UI/kg | Cada 12hCada 24h |
| Enoxaparina | 1,0mg/kg1,5mg/kg | Cada 12hCada 24h |
| Nadroparina | 85,5UI/kg171UI/kg | Cada 12hCada 24h |
| Tinzaparina | 175UI/kg | Cada 24h |
| Fondaparinux | 5,0mg (<50 kg)7,5mg (50-100 kg)10mg (>100 kg) | Cada 24h |
| Rivaroxaban | 15mg (días 1-21)20mg (a partir día 22) | Cada 12hCada 24h |
| Heparina no fraccionada | 18UI/kg/h | Perfusión |
| r-TPA | 100mg0,6mg/kg | En 2hEn 15min |
| Urocinasa | 3 millonesUI | En 2h |
| Estreptocinasa | 1,5 millonesUI | En 2h |
r-TPA: activador tisular del plasminógeno recombinante; UI: unidades internacionales.
Durante décadas la heparina no fraccionada (HNF) ha sido el fármaco de elección para el tratamiento de la TEP. Ejerce su acción anticoagulante uniéndose y potenciando a la antitrombina en la inactivación de una serie de factores de coagulación activados, principalmente la trombina (iia). Habitualmente se utiliza por vía intravenosa en infusión continua, pero también es eficaz y segura por vía subcutánea. Requiere monitorización mediante el tiempo parcial de tromboplastina activado (TTPA), que debe ser 1,5 a 2,5 veces el control. Para ello, se emplea un ritmo de infusión inicial de 18U/kg/h. Además de la infusión continua, se suele administrar un bolo de 80U/kg para conseguir un efecto anticoagulante más rápido. En pacientes que son tratados con dosis inferiores y no alcanzan un TTPA terapéutico durante los primeros días de tratamiento aumenta el riesgo de recurrencia tromboembólica. No se conoce si hay una relación entre niveles de TTPA infraterapéuticos y recurrencias en pacientes que son tratados inicialmente con las dosis recomendadas. Actualmente la HNF se reserva para pacientes en los que se considera la utilización de tratamiento fibrinolítico (TEP de riesgo intermedio o alto), y para pacientes con alto riesgo de sangrado que van a ser anticoagulados. Para pacientes con insuficiencia renal grave (aclaramiento de creatinina<30mL/min) algunas evidencias indirectas sugieren que las heparinas de bajo peso molecular (HBPM) (a las dosis recomendadas en cada ficha técnica) podrían ser más eficaces y seguras que la HNF24.
Las HBPM proceden del fraccionamiento de la HNF por métodos químicos o enzimáticos. Poseen una elevada acción antiXa (superior a la de la HNF). La mayoría de los estudios sugieren que las HBPM y la HNF son equivalentes en términos de eficacia (recurrencias tromboembólicas) y seguridad (sangrados mayores) para el tratamiento de la fase aguda de la ETEV. En un metaanálisis que incluyó 1.951 pacientes de 12 estudios que compararon la HBPM con la HNF, las HBPM se asociaron a menos recurrencias tromboembólicas (odds ratio [OR] 0,63; IC 95%: 0,33-1,18) y menos sangrados mayores (OR 0,67; IC 95%: 0,36-1,27), sin diferencias en la mortalidad (OR 1,20; IC 95%: 0,59-2,45)25.
Fondaparinux es un pentasacárido sintético que inhibe de forma selectiva el factor Xa sin inactivar la trombina. Se administra una vez al día por vía subcutánea a dosis ajustadas al peso corporal, sin necesidad de monitorización. El programa Matisse evaluó su eficacia y seguridad para el tratamiento de la fase aguda de la TVP y la TEP26. Comparado con la HNF no se observaron diferencias en la tasa de recurrencia tromboembólica (1,3 vs. 1,7% en la fase aguda), sangrados mayores (1,3 vs. 1,1%) o mortalidad en los 3 primeros meses de seguimiento. Una ventaja potencial de este fármaco es que no se asocia a trombocitopenia inducida por heparina.
- •
En pacientes estables hemodinámicamente con TEP aguda se sugiere la utilización de HBPM o fondaparinux frente a la HNF.
- •
En pacientes con TEP aguda e insuficiencia renal grave se sugiere el uso de HBPM a dosis ajustadas a la HNF.
Los estudios que han demostrado que el tratamiento con heparina durante 5 días en lugar de 10 es una práctica eficaz y segura, también comprobaron que los anticoagulantes orales podían ser iniciados el primer día de anticoagulación, sin perder eficacia. Dos ensayos clínicos realizados con warfarina demuestran que: 1) se deben evitar dosis de carga (que pueden producir hemorragias) sin que ello implique un retraso a la hora de alcanzar niveles terapéuticos de ratio internacional normalizado (INR); 2) comenzar los antagonistas de la vitamina K (AVK) a dosis más bajas evita caídas excesivas de los niveles de proteína C, lo que induciría teóricamente un estado de hipercoagulabilidad.
- •
En pacientes estables hemodinámicamente con TEP se recomienda mantener la anticoagulación parenteral como mínimo 5 días, y hasta que el INR sea>2 durante 24h.
Recientemente se han introducido nuevos anticoagulantes orales que actúan de forma diferente a los AVK, entre los que se incluyen dabigatran (inhibidor directo de la trombina), rivaroxaban y apixaban (inhibidores del factor Xa). Rivaroxaban es un inhibidor directo y selectivo del factor Xa. En el análisis conjunto de 2 ensayos clínicos (para TVP y para TEP), rivaroxaban se asoció a una eficacia similar a la del tratamiento estándar (hazard ratio [HR] 0,87; IC 95%: 0,66-1,19) y una reducción a la mitad en las hemorragias graves (HR 0,54, IC 95%: 0,37-0,79)27,28. Su administración por vía oral, a dosis de 15mg 2 veces al día durante 3 semanas seguido de 20mg una vez al día, podría facilitar un abordaje simple y con un único fármaco del tratamiento agudo y a largo plazo de la TEP.
Apixaban ha sido evaluado en un ensayo clínico para el tratamiento de pacientes con TVP o TEP (34%) durante los 6 primeros meses después del evento trombótico29. Comparado con el tratamiento estándar, apixaban demostró una eficacia similar (riesgo relativo [RR] 0,84; IC 95%: 0,60-1,18), y una reducción estadísticamente significativa de las hemorragias graves (RR 0,31; IC 95%: 0,17-0,55) y de las hemorragias no graves clínicamente relevantes (RR 0,48; IC 95%: 0,38-0,60). Se administró por vía oral, a dosis de 10mg 2 veces al día los primeros 7 días seguido de 5mg 2 veces al día.
La eficacia y seguridad de dabigatran no ha sido evaluada durante los primeros 10 días (de media) de tratamiento de la TEP aguda sintomática.
- •
En pacientes estables hemodinámicamente con TEP se sugiere el tratamiento con rivaroxaban en monoterapia.
Los resultados de un ensayo clínico y algunos estudios de cohorte sugieren que, comparado con la hospitalización, el tratamiento ambulatorio en pacientes de bajo riesgo es igual de eficaz y seguro en términos de recurrencias tromboembólicas, sangrados y mortalidad30. Se podría considerar el tratamiento ambulatorio de pacientes con TEP que cumplan los siguientes requisitos: 1) clínicamente estables con buena reserva cardiopulmonar, y una escala clínica validada de bajo riesgo (p. ej., PESI o PESIs), 2) buen soporte social con rápido acceso a atención médica, y 3) cumplimentación esperable del tratamiento.
- •
En pacientes con TEP de bajo riesgo y condiciones domiciliarias adecuadas se sugiere el alta precoz en lugar del alta estándar (más de 5 días de ingreso).
Varios metaanálisis han demostrado que la movilización precoz es una práctica segura en pacientes con TVP proximal31. Para los pacientes con TEP sintomática las evidencias son menos consistentes. La presencia de TVP concomitante empeora el pronóstico de los pacientes con TEP, particularmente cuando se asocia a disfunción del ventrículo derecho e isquemia miocárdica32.
- •
Se sugiere la movilización precoz de los pacientes con TEP de bajo riesgo.
- •
En pacientes con TEP de riesgo intermedio se sugiere reposo durante los primeros días de tratamiento.
El tratamiento trombolítico acelera la lisis del coágulo y produce una mejoría hemodinámica más rápida que el tratamiento con HNF, aunque no hay diferencias en la trombosis residual después de 5 a 7 días. El análisis de un subgrupo de pacientes del ensayo Urokinase Pulmonary Embolism Trial (UPET), que comparó urocinasa seguida de HNF o HNF solamente, demostró que el tratamiento fibrinolítico disminuye la mortalidad en pacientes con shock secundaria a TEP masiva33. En función de estos hallazgos, y en ausencia de riesgo de sangrado alto, el tratamiento trombolítico está indicado en pacientes con TEP aguda sintomática e inestabilidad hemodinámica (definida como shock cardiogénico o presión arterial sistólica<90mm Hg mantenida, no debida a hipovolemia, sepsis o arritmias cardiacas)34. La inestabilidad hemodinámica es poco frecuente, pero hasta la mitad de los pacientes con TEP sin inestabilidad hemodinámica tienen signos clínicos o ecocardiográficos de disfunción del ventrículo derecho (TEP de riesgo intermedio). Aunque no se recomienda rutinariamente35, y a la espera de la publicación de los resultados del ensayo clínico Pulmonary Embolism Thrombolysis Study (PEITHO)36, la decisión de utilizar tratamiento trombolítico en un grupo muy seleccionado de pacientes dependerá de su riesgo de sangrado y de la gravedad del cuadro clínico.
El tratamiento trombolítico administrado durante 2h es más eficaz y seguro que las pautas de 12 a 24h. Con esta pauta corta de administración, la estreptocinasa y el r-TPA son igual de eficaces. Se debe administrar por una vía periférica. La administración a través de un catéter central no es más eficaz y aumenta el riesgo de sangrado en el punto de inserción del acceso venoso.
- •
En pacientes con TEP y shock cardiogénico se recomienda la administración de tratamiento fibrinolítico sistémico.
- •
En pacientes con TEP e hipotensión arterial sin riesgo alto de sangrado se sugiere la administración de tratamiento fibrinolítico sistémico.
- •
En la mayoría de los pacientes estables hemodinámicamente con TEP se recomienda no administrar tratamiento fibrinolítico.
- •
En pacientes estables hemodinámicamente con TEP de riesgo intermedio y con riesgo de sangrado bajo, particularmente en los menores de 75 años, se sugiere valorar la administración de tratamiento fibrinolítico.
Lo filtros de vena cava están indicados en pacientes con TEP y con contraindicación para la anticoagulación. Decousus et al. publicaron un ensayo clínico que evaluó la utilidad de los filtros de vena cava, como complemento a la anticoagulación convencional, en pacientes con TVP proximal y alto riesgo de TEP37. Los filtros redujeron la frecuencia de TEP durante los primeros 12días de tratamiento, y se detectó una tendencia a un menor número de episodios mortales. A los 2 años no hubo diferencias entre los 2 grupos en términos de mortalidad o de recurrencias trombóticas, debido a un incremento de la frecuencia de TVP en el grupo tratado con filtros. De forma indirecta, estos hallazgos apoyan el uso de los filtros de vena cava en pacientes en los que la anticoagulación está contraindicada en la fase aguda. Siempre que sea posible se deberá colocar un filtro recuperable, y este deberá ser retirado tan pronto como se pueda iniciar la anticoagulación.
- •
En pacientes estables hemodinámicamente con TEP y contraindicación para la anticoagulación, se recomienda la colocación de un filtro recuperable de vena cava inferior.
En centros con experiencia, la fragmentación mecánica del trombo se realiza en pacientes con TEP de alto riesgo y contraindicación para el uso de fibrinolíticos. La embolectomía pulmonar es otra modalidad de tratamiento para la TEP de alto riesgo. Está indicada en casos de trombos en cavidades derechas, alto riesgo de embolia arterial paradójica o en aquellos pacientes con TEP de alto riesgo en los que la fibrinólisis no ha sido efectiva38. Los resultados mejoran si los pacientes son intervenidos antes de desarrollar un shock cardiogénico.
- •
En pacientes con TEP de alto riesgo y que i) tienen contraindicación para la fibrinólisis, ii) ha fracasado la fibrinólisis, o iii) es probable que el shock produzca el fallecimiento del paciente antes de que la fibrinólisis sea efectiva, se sugiere el uso de técnicas de cateterismo intervencionista o de embolectomía pulmonar si se dispone de experiencia y recursos adecuados.
Los pacientes con TEP aguda sintomática deben recibir oxígeno suplementario para conseguir saturaciones mayores del 92%. La oxigenoterapia, especialmente en pacientes con sobrecarga de cavidades derechas, actúa como vasodilatador y puede contribuir a la disminución de la presión en las arterias pulmonares.
El dolor torácico pleurítico es un síntoma frecuente en los pacientes con TEP. Se puede aliviar en la mayoría de las ocasiones con la administración de antiinflamatorios no esteroideos en un plazo no mayor de 24 a 48h. La administración de estos fármacos no aumenta el riesgo de sangrado en la fase aguda de la TEP.
La administración de fluidos (<500mL) puede ser beneficiosa para aumentar el gasto cardiaco en pacientes con TEP, bajo gasto y presiones sistémicas mantenidas. La dopamina o dobutamina se pueden emplear en pacientes con bajo gasto y presiones sistémicas mantenidas. Para pacientes hipotensos con TEP, la adrenalina combina los efectos beneficiosos de la noradrenalina y la dobutamina.
Tratamiento de la tromboembolia pulmonar subsegmentaria aisladaUn metaanálisis de estudios que realizaron angioTC de tórax por sospecha de TEP encontró que la incidencia de TEP subsegmentaria fue del 4,7% (IC 95%: 2,5-7,6) y del 9,4% (IC 95%: 5,5-14,2) en pacientes sometidos a TC unidetector y multidetector respectivamente39. No hubo diferencias entre los 2 grupos en la incidencia de eventos trombóticos durante los 3 primeros meses de seguimiento cuando los pacientes no fueron anticoagulados en función de una angioTC negativa.
Tratamiento de la tromboembolia pulmonar incidentalSe detecta una TEP incidental (no sospechada) en aproximadamente un 2% de los pacientes (la mayoría con cáncer) a los que se realiza una TC torácica por razones distintas a la sospecha de TEP. Algunas evidencias indirectas sugieren que la TEP incidental empeora el pronóstico de estos pacientes40. La recomendación para indicar la anticoagulación es más consistente cuando la TEP incidental se asocia a TVP concomitante, la TEP es lobar o de arterias principales y el riesgo de sangrado no es alto.
- •
Se sugiere anticoagular a los pacientes con TEP incidental de localización segmentaria, lobar o principal.
La presencia de trombos en cavidades derechas, particularmente cuando son móviles, empeora significativamente el pronóstico de los pacientes con TEP. Algunas evidencias indirectas sugieren que la fibrinólisis o la embolectomía quirúrgica son más efectivas que la anticoagulación convencional en estos pacientes.
Tratamiento de la tromboembolia pulmonar a largo plazo (después de los primeros 3-6 meses)Duración del tratamientoLa duración adecuada del tratamiento anticoagulante requiere un balance entre el riesgo de recurrencia trombótica y el riesgo de complicaciones hemorrágicas.
Riesgo de recurrenciaEl riesgo de recurrencia trombótica depende de: 1) la eficacia del tratamiento del episodio agudo, 2) una duración mínima de tratamiento a largo plazo, y 3) la posibilidad de que el paciente tenga un factor de riesgo intrínseco para sufrir un nuevo episodio de ETEV.
En un metaanálisis que incluyó a 2.925 pacientes que habían sufrido un primer episodio de ETEV no secundaria a cáncer y que habían recibido distintas duraciones de tratamiento, el riesgo de recurrencia aumentó de forma significativa para duraciones de tratamiento inferiores a 3 meses (HR 1,52; IC 95%: 1,14-2,02)41. No hubo diferencias en el riesgo de recurrencia para duraciones de tratamiento de 3 meses comparadas con duraciones de 6 o más meses (HR 1,19; IC 95%: 0,86-1,85). Con estas evidencias se acepta que el tratamiento a largo plazo de pacientes con TEP debe tener una duración mínima de 3 meses.
En el metaanálisis mencionado41, el riesgo de recurrencia fue significativamente menor para los eventos provocados por un factor de riesgo transitorio que para los eventos no provocados (HR 0,55; IC 95%: 0,41-0,74). En una revisión sistemática42 que incluyó 15 ensayos clínicos el riesgo de recurrencia trombótica durante el seguimiento para pacientes con ETEV no provocada fue 2,3 a 2,5 veces superior al de los pacientes con ETEV provocada; 7,9 a 10,6 veces superior al de los pacientes con ETEV provocada por un factor de riesgo quirúrgico; y 1,4 a 1,8 veces superior al de los pacientes con ETEV provocada por un factor de riesgo no quirúrgico.
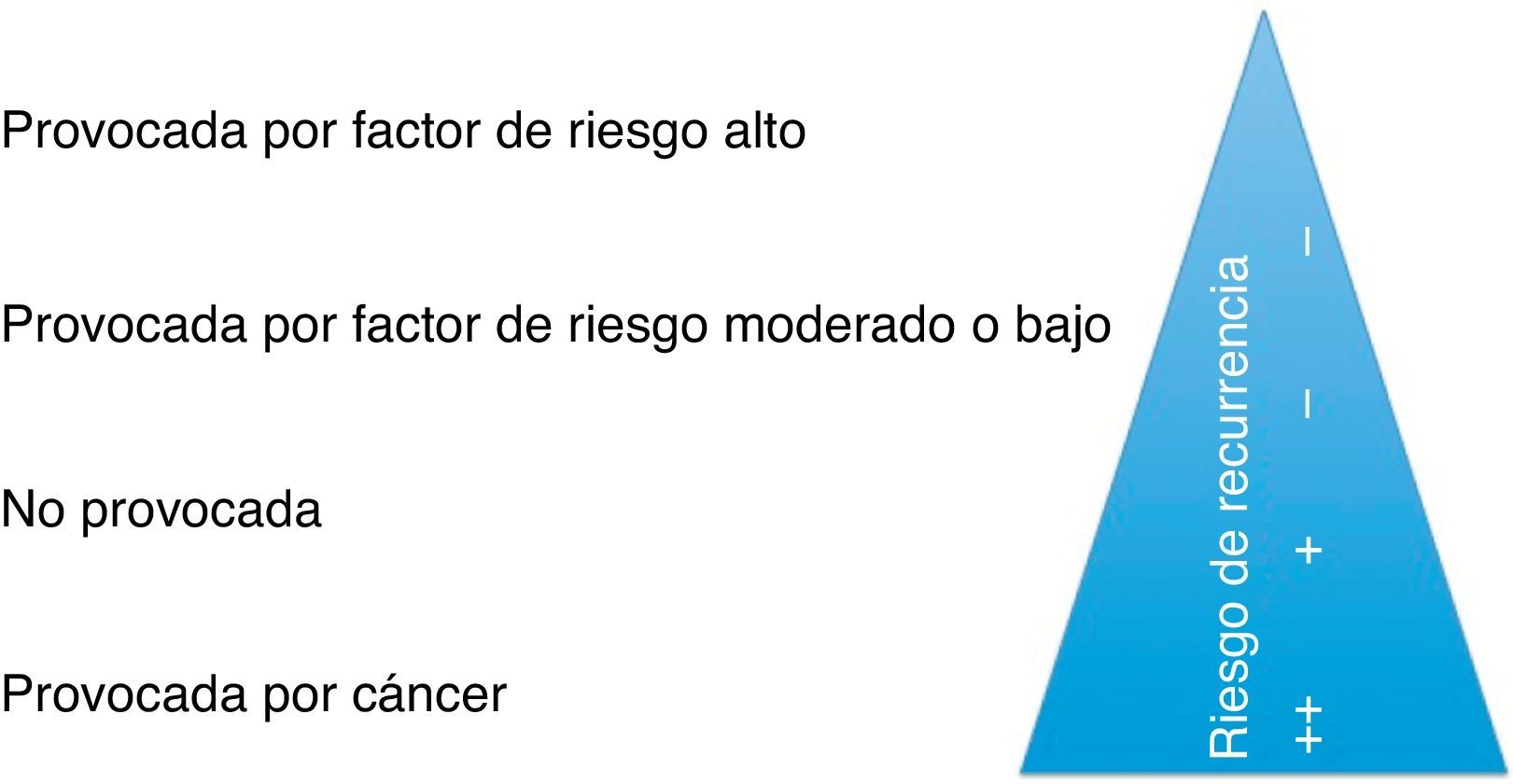
Aunque no hay uniformidad en la literatura, a los efectos de decisión sobre la duración del tratamiento, esta normativa estratifica la TEP como provocada por un factor de riesgo mayor, provocada por un factor de riesgo menor, no provocada o secundaria a cáncer (fig. 4).
Riesgo de hemorragiaNo hay escalas de riesgo hemorrágico suficientemente validadas en pacientes anticoagulados por un episodio de ETEV. El registro RIETE43 derivó una escala de predicción de riesgo hemorrágico durante los 3 primeros meses de tratamiento anticoagulante a partir de 19.274 pacientes con diagnóstico de TVP o TEP (tabla 8). En función del peso de cada una de las variables de la escala, los pacientes son clasificados en 3 grupos de riesgo: bajo, intermedio y alto. El porcentaje de sangrados mayores en la cohorte de validación interna fue del 0,1; 2,8 y 6,2%, respectivamente.
Escala RIETE de riesgo hemorrágico en pacientes con enfermedad tromboembólica venosa durante los 3 primeros meses de tratamiento anticoagulante
| Escala RIETE | Puntuación |
| Hemorragia mayor reciente (un mes) | 2,0 |
| Creatinina>1,2mg/dL | 1,5 |
| Anemia | 1,5 |
| Cáncer | 1 |
| Presentación clínica como TEP (vs. TVP) | 1 |
| Edad>75 años | 1 |
| Riesgo bajo: 0-3 puntosRiesgo intermedio: 1-4 puntosRiesgo alto: >4 puntos | |
RIETE: Registro Internacional para la Enfermedad TromboEmbólica venosa; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
A partir del tercer mes de tratamiento anticoagulante la evidencia es más limitada. La 9.a edición del American College of Chest Physicians1 propone una escala de riesgo hemorrágico a partir de una serie de variables que se han asociado a sangrados en la literatura (tabla 9). Según este modelo, el riesgo de sangrado mayor es bajo (0,3%) en ausencia de cualquier factor de riesgo, moderado (0,6%) en presencia de un factor de riesgo, y alto (≥2,5%) si hay 2 o más factores de riesgo. Este modelo no ha sido validado en una cohorte externa de pacientes con ETEV.
Escala ACCP de riesgo hemorrágico en pacientes anticoagulados más de 3 meses por enfermedad tromboembólica venosa*
| Variable |
| Edad>65 años |
| Edad>75 años |
| Hemorragia previa |
| Cáncer |
| Cáncer con metástasis |
| Insuficiencia renal |
| Insuficiencia hepática |
| Trombocitopenia |
| Ictus previo |
| Diabetes |
| Anemia |
| Antiagregantes |
| Control deficiente de la anticoagulación |
| Comorbilidad y capacidad funcional reducida |
| Cirugía reciente |
| Caídas frecuentes |
| Abuso de alcohol |
| Riesgo bajo: 0 factores de riesgoRiesgo moderado: un factor de riesgoRiesgo alto: ≥2 factores de riesgo |
ACCP: American College of Chest Physicians.
Se han desarrollado 2 estrategias de decisión sobre la duración de la anticoagulación a largo plazo en los pacientes con TEP: una estrategia poblacional y una estrategia individualizada. La primera de ellas solo considera la TEP provocada, la TEP no provocada o la TEP secundaria a cáncer para realizar recomendaciones fijas sobre la duración del tratamiento anticoagulante. La segunda tiene en cuenta las características clínicas de cada paciente (edad, sexo, comorbilidad, presentación del evento) y algún otro factor adicional (dímero D) para sugerir planes individualizados de duración del tratamiento anticoagulante. Los autores de esta normativa sugieren una aproximación mixta para la toma de decisiones.
- •
En pacientes con TEP provocada por factores de riesgo transitorios quirúrgicos se recomienda tratamiento anticoagulante durante 3 meses.
- •
En pacientes con TEP provocada por factores de riesgo transitorios no quirúrgicos se sugiere tratamiento anticoagulante durante 3 meses.
- •
En pacientes con TEP no provocada se recomienda tratamiento anticoagulante durante un mínimo de 3-6 meses, y se sugiere valorar tratamiento indefinido en función del balance entre el riesgo de recurrencia y el riesgo de hemorragia.
- •
En pacientes con cáncer se recomienda tratamiento anticoagulante un mínimo de 3-6 meses, y se sugiere prolongar el tratamiento mientras el cáncer esté activo.
- •
En pacientes con un segundo episodio de TEP no provocada se recomienda tratamiento anticoagulante indefinido.
- •
En pacientes con indicación de anticoagulación indefinida se recomienda la reevaluación periódica de esta indicación.
En un metaanálisis que incluyó a 2.554 pacientes con TEP o TVP que fueron seguidos durante 5 años, la presentación inicial del evento trombótico en forma de TEP multiplicó por 3 el riesgo de que la recurrencia trombótica fuera de nuevo una TEP (vs. TVP) (HR 3,1: IC 95%: 1,9-5,1)44. Estos resultados resaltan la importancia de la presentación del evento, puesto que la mortalidad de la TEP es significativamente mayor que la de la TVP.
Dímero DEn el ensayo PROLONG45 se realizó una determinación de dímero D un mes después de suspender la terapia anticoagulante a pacientes con un primer episodio de ETEV no provocada que habían recibido un mínimo de 3 meses de tratamiento con AVK. Los pacientes con dímero D negativo no fueron anticoagulados, mientras que aquellos con dímero D positivo fueron aleatorizados a reiniciar o a suspender definitivamente el tratamiento anticoagulante. La tasa de recurrencias trombóticas durante el seguimiento fue del 15% en el grupo con dímero D positivo que no fue anticoagulado, del 6,2% en el grupo con dímero D negativo, y del 2,6% en el grupo con dímero D positivo que fue anticoagulado. Estos resultados se han confirmado en revisiones sistemáticas y metaanálisis posteriores.
Trombosis venosa profunda residualLa TVP residual se define como la persistencia en el tiempo del trombo organizado y adherido a la pared venosa. En una revisión sistemática y metaanálisis sobre 9 estudios de cohortes y 5 ensayos aleatorizados46 se concluyó que la TVP residual estaba modestamente asociada al aumento del riesgo de recurrencia para todos los pacientes con TVP (tanto provocada como no provocada) (OR 1,5; IC 95%: 1,1-2,0), pero el efecto desaparecía cuando se consideraba exclusivamente el subgrupo de pacientes con TVP no provocada (OR 1,2; IC 95%: 0,9-1,7). Su limitación radica en que la evaluación es operador dependiente y la variabilidad interobservador es alta.
Primer versus segundo episodio de tromboembolia pulmonarDespués de un segundo episodio de ETEV, el riesgo de recurrencia es aproximadamente 1,5 veces mayor que después del primer episodio47. El riesgo de recurrencia es particularmente alto cuando el segundo episodio se produce al poco tiempo de suspender la anticoagulación.
Trombofilia hereditaria y adquiridaEn un metaanálisis el riesgo de recurrencia trombótica fue del 1,6 (IC 95%: 1,1-2,1) para pacientes heterocigotos para el factor v Leiden (1,2; IC 95%: 0,6-2,2 para el subgrupo de pacientes con ETEV no provocada); 2,6 (IC 95%: 1,2-6,0) para pacientes homocigotos, y 1,4 (IC 95%: 1,0-2,2) para pacientes heterocigotos para el gen de la protrombina 20210A48. Dado que la asociación entre trombofilia hereditaria y riesgo de recurrencia es débil (si es que existe), no se aconseja su determinación para decidir la duración del tratamiento anticoagulante.
Los estudios que han evaluado la asociación entre la presencia de anticuerpos antifosfolípido y el riesgo de recurrencia trombótica no aportan datos consistentes para decidir la duración de la anticoagulación en función de su detección.
Otros factores de riesgo de recurrenciaLa edad avanzada, el sexo varón, la obesidad, el síndrome postrombótico secundario a TVP concomitante a la TEP, algunos fármacos antipsicóticos y ciertas enfermedades crónicas como la enfermedad inflamatoria intestinal se han asociado a un riesgo aumentado de recurrencias al suspender el tratamiento anticoagulante.
Modelos predictivos de recurrencia para pacientes con tromboembolia pulmonar no provocadaSe han desarrollado varios modelos predictivos que podrían identificar a pacientes con TEP no provocada y bajo riesgo de recurrencia. Sin embargo, ninguno ha sido validado prospectivamente. Los modelos más utilizados son la escala D-Dimer, Age, Sex, Hormonal treatment (DASH)49; el normograma de Viena50, elaborado con 3 variables asociadas de forma independiente al riesgo de recurrencia: sexo mujer, TVP proximal vs. TEP, y cifra de dímero D determinado tras la suspensión del tratamiento anticoagulante; y el modelo canadiense51, válido para mujeres, y que incluye las siguientes variables: edad, índice de masa corporal, dímero D determinado tras suspender el tratamiento anticoagulante y presencia de síntomas o signos postrombóticos en EEII.
Fármacos para el tratamiento a largo plazoEn esta normativa solo se hacen recomendaciones o sugerencias para los fármacos aprobados en España para esta indicación.
Antivitaminas KEl acenocumarol y la warfarina son los 2 derivados del dicumarol disponibles en España. Interfieren competitivamente en el metabolismo de la vitamina K e inhiben la producción de las proteínas de la coagulación dependientes de esta vitamina (factores ii, vii, ix y x y proteínas C, S y Z). El acenocumarol tiene una vida media más corta y un aclaramiento metabólico más rápido que la warfarina. El control de la acción terapéutica requiere una monitorización expresada en forma de INR. Un rango de INR entre 2,0 y 3,0 es el que presenta un mejor balance entre eficacia y seguridad52, y reduce un 80% el riesgo de recurrencia. Después de haber completado un mínimo de 6 meses con un rango entre 2,0 y 3,0, un ensayo clínico encontró que la administración de AVK con un rango más bajo (entre 1,5-1,9) redujo el riesgo de recurrencia en un 64% (HR 0,36; IC 95%: 0,19-0,67) sin incrementar el riesgo de sangrado mayor (HR 2,53; IC 95%: 0,49-13,03)53. En otro ensayo clínico, cuando esta pauta (rango entre 1,5 y 1,9) se comparó con la pauta convencional (rango entre 2,0 y 3,0), el riesgo de recurrencia fue significativamente mayor (HR 2,8; IC 95%: 1,1-7,0), sin diferencias en el riesgo de sangrado mayor (HR 1,2; IC 95%: 0,4-3,0)52.
En pacientes con dificultad para la monitorización periódica o para mantener un INR estable con AVK (más del 50% de determinaciones en rango durante un periodo de 6 meses), el balance entre eficacia y seguridad de los AVK no está garantizado.
Heparinas de bajo peso molecularEstán indicadas durante al menos los 3 primeros meses de tratamiento de la ETEV en pacientes con cáncer activo, donde se han mostrado más eficaces que los AVK. Sin embargo, como las dosis para el tratamiento a largo plazo no están bien establecidas y su administración es parenteral, no se recomienda su uso como primera elección en pacientes con ETEV no secundaria a cáncer, aunque podrían constituir una alternativa para pacientes con dificultad para controlar adecuadamente los niveles de AVK o INR inestable.
Nuevos anticoagulantes oralesEn el momento de la redacción de este consenso la Agencia Europea del Medicamento solo ha aprobado rivaroxaban para la prevención secundaria de ETEV tras un primer episodio de TVP o TEP. Otros anticoagulantes ya comercializados para otras indicaciones, como dabigatran o apixaban están pendientes de aprobación.
El estudio EINSTEIN-Extension27 asignó al azar a 1.197 pacientes que habían completado 6 a 12 meses de anticoagulación (con AVK o con rivaroxaban) a recibir rivaroxaban a dosis de 20mg/día o placebo. Durante el periodo de estudio rivaroxaban redujo significativamente el riesgo de recurrencias trombóticas (HR 0,18; IC 95%: 0,09-0,39). No hubo diferencias significativas en la incidencia de hemorragias mayores, pero rivaroxaban incrementó el riesgo de hemorragias graves o hemorragias no graves clínicamente relevantes (HR 5,19; IC 95%: 2,3-11,7).
En el ensayo AMPLIFY-EXT54 se compararon 2 dosis de apixaban (2,5 y 5mg, 2 veces al día) con placebo en pacientes con ETEV que habían completado 6 a 12 meses de tratamiento anticoagulante (con AVK o con apixaban). Durante el periodo de estudio apixaban redujo significativamente el riesgo de recurrencias trombóticas (RR 0,19; IC 95%: 0,11-0,33 para la dosis de 2,5mg; RR 0,20; IC 95%: 0,11-0,34 para la dosis de 5mg) sin diferencias en la incidencia de hemorragias graves o no graves clínicamente relevantes (RR 1,20; IC 95%: 0,69-2,10 para la dosis de 2,5mg; RR 1,62; IC 95%: 0,96-2,73 para la dosis de 5mg).
En 2 ensayos clínicos, RE-MEDY y RE-SONATE55, dabigatran a dosis de 150mg 2 veces al día fue comparado con AVK y con placebo (respectivamente) en pacientes con ETEV que habían completado un mínimo de 3 meses de anticoagulación (con AVK o con dabigatran). Durante el periodo de estudio dabigatran fue igual de eficaz que los AVK (HR 1,44; IC 95%: 0,78-2,64) y más eficaz que placebo (HR 0,08; IC 95%: 0,02-0,25) en la reducción de las recurrencias trombóticas. Dabigatran redujo la incidencia total de hemorragias graves o no graves clínicamente relevantes cuando se comparó con AVK (HR 0,54; IC 95%: 0,41-0,71), pero aquellas aumentaron cuando se comparó con placebo (HR 2.92; IC 95%, 1.52-5.60).
AspirinaSe han publicado 2 ensayos clínicos en 2012, WARFASA56 y ASPIRE57, que evaluaron la eficacia y seguridad de aspirina frente a placebo en la prevención secundaria de la ETEV en pacientes con un primer episodio no provocado de TEP o TVP. En el estudio WARFASA la aspirina fue comparada con placebo en pacientes con ETEV que habían completado un periodo de tratamiento con AVK de 6-18 meses (TVP 63%; TEP 37%). Durante 2 años de seguimiento la aspirina redujo significativamente el riesgo de recurrencia trombótica (HR 0,55; IC 95%: 0,33-0,92), sin incrementar los episodios hemorrágicos (HR 0,98; IC 95%: 0,24-3,96). En el estudio ASPIRE la aspirina fue comparada con placebo en pacientes con ETEV que habían completado un periodo de tratamiento con AVK de 6 semanas a 24 meses. No se observaron diferencias en la proporción de recurrencias trombóticas (HR 0,74; IC 95%: 0,52-1,09), aunque sí se produjo un beneficio clínico global en la reducción del evento compuesto de episodios cardiovasculares, hemorragias y muerte por cualquier causa (HR 0,67; IC 95%: 0,49-0,91).
- •
Para la mayoría de los pacientes con TEP se recomienda el uso de AVK, con una diana de INR 2,5 (rango 2,0-3,0), para el tratamiento anticoagulante a largo plazo.
- •
Se sugiere no utilizar AVK con una diana de INR 1,5-1,9 para el tratamiento anticoagulante a largo plazo.
- •
Para pacientes con TEP secundaria a cáncer se recomienda el uso de HBPM durante todo el tratamiento.
- •
En pacientes con dificultad para la monitorización periódica o para mantener un INR estable con AVK se sugiere el uso de rivaroxaban para el tratamiento anticoagulante a largo plazo.
- •
En pacientes con TEP no provocada en los que se suspenda la anticoagulación oral se sugiere valorar el uso de aspirina, a dosis de 100mg/día, una vez completada la duración mínima de tratamiento (3 meses).
En una revisión de 4 estudios en los que se realizaron pruebas seriadas de imagen, el porcentaje de pacientes con TEP residual fue del 87% a los 8 días, 68% a las 6 semanas, 65% a los 3 meses, 57% a los 6 meses y 52% a los 11 meses58. Sin embargo, en un estudio de 673 pacientes procedentes de un único centro que fueron seguidos durante 3 meses, la tasa de recurrencias trombóticas sintomáticas fue de solo el 3%59. Por tanto, existe una discordancia entre el porcentaje de pacientes con trombosis residual y el porcentaje de pacientes con recurrencias trombóticas.
La incidencia de hipertensión pulmonar tromboembólica crónica (HPTEC) sintomática en pacientes que han sufrido un episodio de TEP oscila según las series y el periodo de seguimiento, y ha llegado hasta un 3,8%60. Algunas características del episodio inicial de TEP (edad>70 años, edad joven, sexo mujer, presión sistólica pulmonar>50mm Hg, TEP masiva o submasiva, TEP recurrente o idiopática) aumentan el riesgo de desarrollar HPTEC61.
- •
En pacientes con antecedentes de TEP se recomienda no realizar pruebas torácicas de imagen para evaluar la persistencia de trombosis residual o la reperfusión de los defectos iniciales.
- •
En pacientes con antecedentes de TEP y síntomas o signos sugestivos de HPTEC se recomienda realizar una ecocardiografía transtorácica de control.
La ETEV se asocia a una neoplasia oculta en aproximadamente el 10% de los pacientes. El estudio Trousseau62 comparó la utilidad del despistaje ampliado de cáncer mediante TC toracoabdominal y mamografía (en mujeres) con el despistaje limitado. Los resultados no mostraron diferencias en la incidencia de neoplasias ni en la mortalidad entre los 2 grupos de pacientes. El despistaje ampliado aumentó significativamente el gasto sanitario debido al proceso diagnóstico adicional asociado a los resultados falsos positivos.
- •
En pacientes con un episodio de TEP no provocada se sugiere no realizar pruebas específicas para la búsqueda de neoplasia si no hay clínica o exploraciones complementarias básicas que orienten a la presencia de dicha enfermedad.
Fernando Uresandi declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals.
Manuel Monreal declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; Daiichi Sankyo, Inc; Pfizer; ROVI; Sanofi-Aventis.
Ferrán García-Bragado declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; Bristol-Myers Squibb Company; Daiichi Sankyo, Inc; ROVI; Sanofi-Aventis.
Ramón Lecumberri declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; Bristol-Myers Squibb Company; Leo Pharma; ROVI; Sanofi-Aventis.
Sonia Jiménez declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; ROVI; Sanofi-Aventis.
Pedro Ruiz-Artacho declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Leo Pharma; Sanofi-Aventis.
Francisco Lozano declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Bristol-Myers Squibb Company; Leo Pharma; ROVI; Sanofi-Aventis.
Antonio Romera declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Leo Pharma; ROVI; Sanofi-Aventis.
David Jiménez declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; Bristol-Myers Squibb Company; Daiichi Sankyo, Inc; Leo Pharma; ROVI; Sanofi-Aventis.
Pere Domenech declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; Bristol-Myers Squibb Company; Leo Pharma; ROVI; Sanofi.
SEACV: Sergi Bellmunt, Jorge Cuenca, Álvaro Fernández, Fidel Fernández, Vicente Ibáñez, Francisco Lozano, José Ramón March, Antonio Romera; SEC: Luis Almenar, Antonio Castro, Pilar Escribano, María Lázaro, José Luis Zamorano; SEMES: José Ramón Alonso, José Ramón Casal, José Miguel Franco, Sonia Jiménez, Marta Merlo, Ramón Perales, Pascual Piñera, Pedro Ruiz-Artacho; Coral Suero; SEMI: Raquel Barba, Carmen Fernández-Capitán, Ferrán García-Bragado, Vicente Gómez, Manuel Monreal, José Antonio Nieto, Antoni Riera-Mestre, Carmen Suárez, Javier Trujillo-Santos; SEPAR: Francisco Conget, Luis Jara, David Jiménez, José Luis Lobo, Javier de Miguel, Dolores Nauffal, Mikel Oribe, Remedios Otero, Fernando Uresandi; SETH: Pere Domenech, José Ramón González-Porras, Ramón Lecumberri, Pilar Llamas, Eva Mingot, Elena Pina, Javier Rodríguez-Martorell.
Coordinadores generales: Fernando Uresandi y David Jiménez.
En este documento de consenso han participado las siguientes sociedades científicas: Sociedad Española de Neumología y Cirugía Torácica (SEPAR); Sociedad Española de Medicina Interna (SEMI); Sociedad Española de Trombosis y Hemostasia (SETH); Sociedad Española de Cardiología (SEC); Sociedad Española de Medicina de Urgencias y Emergencias (SEMES); Sociedad Española de Angiología y Cirugía Vascular (SEACV).