En la actualidad no disponemos de una definición de solapamiento asma-EPOC (ACO) universalmente aceptada.
ObjetivoComparar la prevalencia del ACO en pacientes con asma o EPOC, valorar sus características clínicas y la capacidad predictiva de riesgo de agudización de las diferentes definiciones.
MétodoEstudio prospectivo observacional con seguimiento de 12 meses sobre una cohorte de asma y otra con EPOC. Se comparan 4 criterios diagnósticos: A) el consenso español del 2012; B) el consenso internacional del 2016; C) el consenso entre la guía española de la EPOC (GesEPOC) y la del asma (GEMA) del 2017; y D) el criterio único de ≥300eosinófilos/μl, propuesto por GOLD 2019. En cada grupo se evaluó el riesgo de agudizaciones.
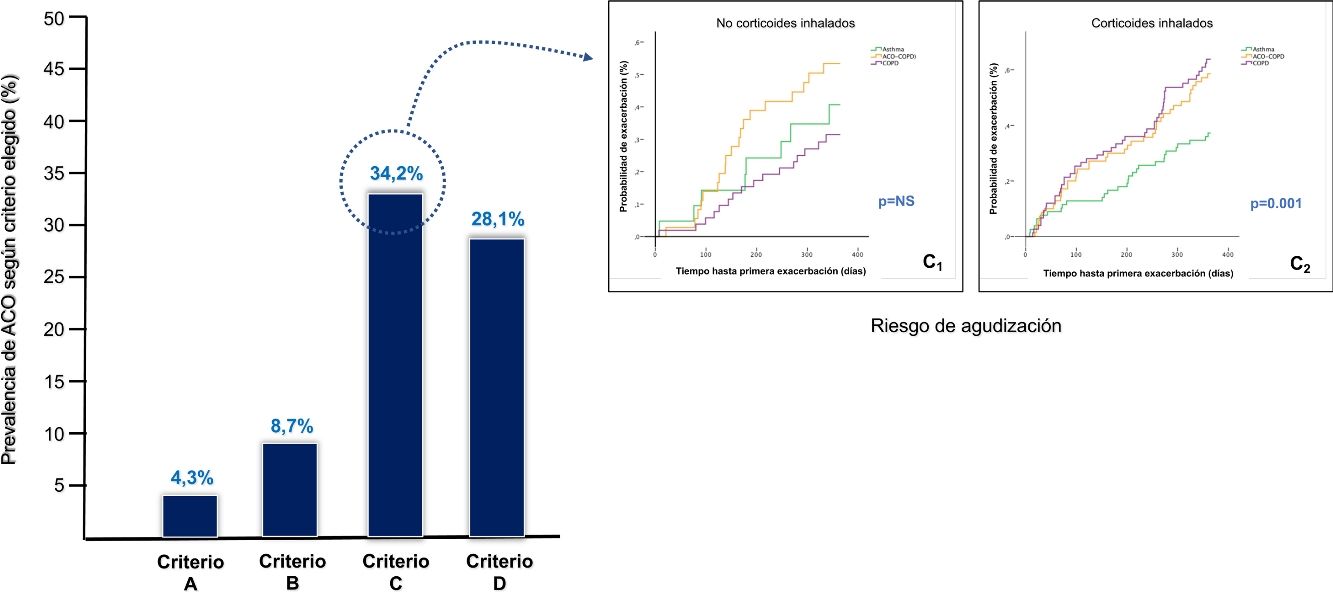
ResultadosSe incluyeron 345 pacientes, 233 (67,5%) con EPOC y 112 (32,5%) con asma, con una edad de 63±14 años; el 70,4% eran hombres. Quince (4,3%) pacientes cumplían criterios de ACO con criterios A; 30 (8,7%) con los B; 118 (34,2%) con los C; y 97 (28,1%) con el criterio D. El subtipo ACO-EPOC presentó más edad, peor función pulmonar y mayor riesgo de agudización que los ACO-asma. De todas las definiciones evaluadas, las que presentaron mayor riesgo de agudizaciones fueron la del consenso GesEPOC-GEMA y la propuesta de GOLD.
ConclusionesLa prevalencia de ACO varía enormemente en función del criterio diagnóstico utilizado. La población de ACO es heterogénea, con un subtipo ACO-EPOC muy diferente al ACO-asma. Las definiciones que incluyen la eosinofilia identifican a los ACO de más riesgo de agudización.
There is currently no universally accepted definition of asthma-COPD overlap (ACO).
ObjectiveTo compare the prevalence of ACO in patients with asthma or COPD, and to assess their clinical characteristics and the capacity of the different definitions to predict the risk of exacerbation.
MethodProspective observational study with a 12-month follow-up in an asthma cohort and a COPD cohort. Four diagnostic criteria were compared: A) the Spanish 2012 consensus; B) the 2016 international consensus; C) the 2017 consensus between the Spanish COPD guidelines (GesEPOC) and GEMA asthma guidelines; and D) the single criterion of ≥300eosinophils/μL, proposed by GOLD 2019. The risk of exacerbations was evaluated in each group.
ResultsA total of 345 patients were included, 233 (67.5%) with COPD and 112 (32.5%) with asthma, aged 63±14 years, 70.4% men. Fifteen (4.3%) patients met the criteria for ACO according to the criteria described under A above; 30 (8.7%) with the criteria of B; 118 (34.2%) with the criteria of C; and 97 (28.1%), with the D criterion. The ACO-COPD subtype were older, had worse lung function, and an increased risk of exacerbation compared with the ACO-asthma group. Of all the definitions evaluated, those which distinguished a higher risk of exacerbations were the GesEPOC-GEMA consensus and the GOLD proposal.
ConclusionsThe prevalence of ACO varies enormously depending on the diagnostic criteria used. The ACO population is heterogeneous, and the ACO-COPD subtype is very different from the ACO-asthma subtype. The definitions that include eosinophilia identify ACO patients with a greater risk of exacerbation.
El asma y la enfermedad pulmonar obstructiva crónica (EPOC) son dos enfermedades inflamatorias crónicas de la vía aérea de alta prevalencia1. Ambas enfermedades son distintas, tanto en su etiopatogenia como en el diagnóstico, tratamiento y pronóstico. A pesar de ello, en la práctica clínica es frecuente encontrar pacientes que comparten características. Son los conocidos como solapamiento asma y EPOC (también identificados por el acrónimo ACO, de las siglas en inglés Asthma COPD Overlap). Diversos estudios sugieren que los enfermos con ACO presentan más síntomas, peor calidad de vida y mayor riesgo de agudizaciones que los pacientes con EPOC, aunque con mejor supervivencia2–5. La respuesta al tratamiento con corticoesteroides inhalados (ICS) en el ACO también se ha mostrado intermedia entre la de la EPOC y la del asma6,7.
La prevalencia del ACO en la población general oscila entre el 1,6 y el 4,5%. En los pacientes con EPOC se sitúa entre el 12,1 y el 55,2%, y en pacientes con asma, entre el 13,3 y el 61%7–10. Estas amplias variaciones están relacionadas con el tipo de población analizada, la definición de asma o de EPOC y especialmente los diferentes criterios empleados para la identificación de ACO. De hecho, todavía no existe una definición de ACO universalmente aceptada.
En el 2012 un documento de consenso español11 propuso por primera vez unos criterios diagnósticos de ACO. Desde entonces han surgido varias propuestas de clasificación, con diferente nivel de aceptación. Las más reconocidas son la de Sin et al.12 o el reciente consenso entre la guía española de la EPOC (GesEPOC) y la guía española para el manejo del asma (GEMA)13. Todas estas propuestas combinan parámetros clínicos, funcionales y/o analíticos con cierto parecido entre sí, aunque con pequeños matices diferenciales que pueden condicionar los resultados (tabla 1). Frente a estos criterios combinados, diversos estudios recientes sugieren una asociación entre el recuento de eosinófilos en sangre periférica, el riesgo de agudización y la respuesta a los ICS en la prevención de agudizaciones14–17. De este modo, el uso de la eosinofilia podría simplificar el reconocimiento del ACO. La Global Obstructive Lung Disease initiative (GOLD) del 2019 recomienda el uso del recuento de eosinófilos en sangre periférica en pacientes con alto riesgo de agudizaciones para identificar a los casos con respuesta a los ICS18.
Criterios diagnósticos de ACO
| A | B | C | D |
|---|---|---|---|
| Soler-Cataluña et al.11 | Sin et al.12 | Consenso GesEPOC y GEMA13 | ACO eosinofílico |
| 2012 | 2016 | 2017 | 201918 |
| Criterios mayores: | Criterios mayores: | – Diagnóstico EPOC (según GesEPOC) + diagnóstico actual de asma (según GEMA) | – Diagnóstico EPOC+eosinofilia en sangre ≥300cél/μl |
| – PBD con aumento FEV1≥15% y ≥400ml | – FEV1/FVC posbd <0,70 | ||
| – Eosinofilia en esputo | – Tabaquismo >10 años-paquete | ||
| – Antecedentes personales de asma (previos a los 40 años) | – Historia de asma antes de los 40 años o PBD>400ml | – Diagnóstico EPOC+PBD≥15% y 400ml | |
| Criterios menores: | Criterios menores: | ||
| – IgE total elevada | – Historia de atopia o rinitis alérgica | ||
| – Antecedentes personales de atopia | – PBD≥200ml y 12% | – Diagnóstico EPOC+eosinofilia en sangre ≥300cél/μl | |
| – PBD con aumento FEV1≥12% y ≥200ml en 2 o más ocasiones | – Eosinofilia periférica ≥300cél/μl | ||
| Se necesitan 2 criterios mayores o uno mayor y 2 menores para el correcto diagnóstico de esta entidad clínica en un paciente con diagnóstico de EPOC | Se necesita la presencia de los 3 criterios mayores y al menos uno menor | Se puede cumplir cualquiera de los 3 criterios |
ACO: solapamiento asma-EPOC; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado el primer segundo; FVC: capacidad vital forzada; GEMA: guía española del asma; GesEPOC: guía española de la EPOC; IgE: inmunoglobulina E; PBD: prueba broncodilatadora; posbd: posbroncodilatación.
La falta de un patrón oro para el diagnóstico de ACO comporta la necesidad de analizar el impacto de diversas clasificaciones para con ello sugerir los criterios que mejor identifiquen a esta población. El objetivo principal de nuestro estudio ha sido comparar la prevalencia del ACO y sus subtipos ACO-asma y ACO-EPOC, en una cohorte bien definida de pacientes con asma y otra con EPOC, de acuerdo con diferentes criterios diagnósticos. Como objetivos secundarios nos planteamos evaluar: a) si el perfil ACO es diferente entre asma y EPOC; y b) comparar la capacidad predictiva de riesgo de exacerbaciones de acuerdo con el criterio diagnóstico empleado, la cohorte de procedencia y su respuesta al tratamiento con ICS.
MetodologíaDiseñoEstudio prospectivo observacional con seguimiento de 12 meses, sobre una cohorte de pacientes con asma y otra con EPOC. En ambas cohortes, se comparan 4 criterios diagnósticos de ACO: A) los descritos por Soler-Cataluña et al.11; B) el consenso internacional de Sin et al.12; C) el consenso español entre GesEPOC y GEMA13; y D) el uso de una eosinofilia periférica ≥300células/μl propuesto por GOLD18 (tabla 1). A partir de estos criterios los pacientes fueron clasificados en 4 grupos: 1) Asma; 2) EPOC; 3) ACO procedente de la cohorte EPOC (ACO-EPOC); y 4) ACO procedente de la cohorte asma (ACO-asma). El estudio se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité de ética e investigación clínica del Hospital Arnau de Vilanova (Valencia). Todos los pacientes firmaron el consentimiento informado.
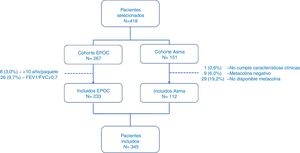
PacientesSe incluyeron pacientes diagnosticados de asma y/o EPOC, de acuerdo con los criterios diagnósticos de GEMA y de GesEPOC, respectivamente19,20, procedentes de consultas ambulatorias de neumología. Los pacientes se incluyeron en fase estable, al menos tras 6 semanas de la resolución de la última agudización. Todos los casos que no firmaron el consentimiento informado y aquellos con diagnóstico previo de bronquiectasias primarias, neoplasia activa o imposibilidad para el seguimiento posterior fueron excluidos del estudio.
MedidasPara evaluar los criterios diagnósticos de ACO, se recogieron datos demográficos, historia tabáquica y características clínicas de asma (sintomatología, antecedentes personales y familiares, clínica de rinitis y/o atopia) y se realizó una espirometría forzada con prueba broncodilatadora, de acuerdo con la normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)21. En el momento de la visita inicial también se valoró la fracción exhalada de óxido nítrico (FeNO) utilizando el FeNO NiOX®(Aerocrine, Solna, Suecia) y se realizó una determinación de eosinofilia periférica e IgE total sérica. No se realizó análisis citológico del esputo.
En todos los casos se recogió el COPD Assesment Test (CAT)22 y el Asthma Control Test (ACT)23, tanto en situación basal como al finalizar el estudio. También se evaluó el grado de disnea evaluada con la escala modificada de la Medical Research Council (mMRC)24 y el número y gravedad de exacerbaciones en el año previo.
Para evaluar la capacidad predictiva de riesgo de exacerbación de cada criterio se analizó el tiempo hasta primera exacerbación, el tiempo hasta hospitalización y la tasa de exacerbaciones durante el año de seguimiento. Para definir agudización de EPOC y/o de asma, utilizamos las definiciones preceptivas que recogen tanto GEMA como GesEPOC19,20. Finalmente, se registró el tratamiento prescrito, con especial atención a la presencia o ausencia de ICS. El médico prescriptor desconocía el criterio de ACO utilizado y fue libre para emplear el tratamiento farmacológico más adecuado según su práctica clínica habitual.
Análisis estadísticoPara comparar medias entre distintos grupos se realizó un análisis de la varianza y para comparar proporciones una Ji-cuadrado con ajuste de Bonferroni. El riesgo de eventos (agudizaciones u hospitalizaciones) se evaluó mediante un análisis de supervivencia de Cox. Se empleó el método de Kaplan-Meier para obtener las curvas de supervivencia y se calculó el estadístico C para poder comparar la capacidad predictiva de cada uno de los criterios diagnósticos. Para calcular el tamaño muestral se estimó que la diferencia en prevalencia de ACO entre criterios fuese de al menos un 10%, con un error tipo I del 5% (alfa=0,05), aproximación unilateral y potencia mínima exigida del 80% (β=0,20). Con estas estimaciones el tamaño muestral calculado para la cohorte EPOC fue de 232 pacientes (para una prevalencia máxima del 25% y una mínima del 15%), mientras que el tamaño de la muestra para la cohorte asma fue de 130 pacientes (prevalencia estimada máxima del 15% y mínima del 5%). Los resultados se definieron como estadísticamente significativos con una p<0,05. Todos los análisis se realizaron con el paquete estadístico SPPS versión 20.0 (IBM Analytics, Arkomm, NY, EE.UU.).
ResultadosPacientesDesde enero a septiembre del 2017 se seleccionaron un total de 418 pacientes, de los que se excluyeron 73 (17,5%) por diferentes motivos (fig. 1). Finalmente fueron incluidos en el estudio 345 pacientes, 233 (67,5%) con EPOC y 112 (32,5%) con asma. La tabla 2 muestra las características descriptivas del total de la muestra.
Descripción de los pacientes incluidos en el estudio
| Total (n=345) | EPOC (n=233) | Asma (n=112) | p | |
|---|---|---|---|---|
| Edad (años) | 63±14 | 68±9 | 53±16 | <0,001 |
| Sexo | ||||
| Hombres | 243 (70,4%) | 198 (85,0%) | 45 (40,2%) | <0,001 |
| Tabaquismo | <0,001 | |||
| Nunca | 70 (20,3%) | 0 (0,0%) | 70 (62,5%) | |
| Exfumador | 176 (51,0%) | 152 (65,2%) | 24 (21,4%) | |
| Fumador activo | 99 (28,7%) | 81 (34,8%) | 18 (16,1%) | |
| Años-paquete | 52±33 | 58±32 | 18±14 | <0,001 |
| FVC posbd (ml) | 1.872±886 | 2.997±878 | 3.520±1.230 | <0,001 |
| FVC posbd (%) | 68±23 | 83±19 | 95±15 | <0,001 |
| FEV1posbd (ml) | 3.167±1.034 | 1.529±552 | 2.583±1.017 | <0,001 |
| FEV1posbd (%) | 87±19 | 57±18 | 89±18 | <0,001 |
| FEV1/FVC posbd | 58±16 | 51±12 | 73±12 | <0,001 |
| Prueba broncodilatadora (ml) | 158±188 | 116±171 | 244±192 | <0,001 |
| Prueba broncodilatadora (%) | 9±11 | 8±11 | 12±9 | 0,002 |
| Prueba broncodilatadora ≥12% y ≥200ml | 117 (39,2%) | 42 (18,0%) | 75 (66,9%) | <0,001 |
| Prueba broncodilatadora ≥15% y ≥400ml | 29 (8,4%) | 13 (5,6%) | 16 (14,3%) | 0,006 |
| FeNO (ppb) | 28±29 | 23±17 | 44±40 | <0,001 |
| FeNO ≥50ppb | 48 (13,9%) | 18 (7,7%) | 30 (26,8%) | <0,001 |
| Eosinofilia periférica (cél/ml) | 304±335 | 256±189 | 402±508 | 0,004 |
| Eosinofilia periférica (%) | 4,9±4,7 | 3,1±1,8 | 4,5±3,6 | <0,001 |
| Eosinofilia periférica ≥300cél/μl | 156 (45,2%) | 89 (38,2%) | 67 (59,8%) | <0,001 |
| IgE | 232±425 | 227±455 | 240±363 | NS |
| IgE≥100kUA/l | 159 (46,1%) | 105 (45,1%) | 54 (48,2%) | <0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; FeNO: fracción exhalada de óxido nítrico; FEV1: volumen espiratorio forzado el primer segundo; FVC: capacidad vital forzada; IgE: inmunoglobulina E; NS: no significativo; posbd: posbroncodilatación.
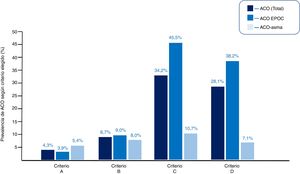
Quince (4,3%) pacientes cumplían criterios de ACO al emplear los criterios A; 30 (8,7%) con los B; 118 (34,2%) con los C; y 97 (28,1%), con el criterio D (p<0,001, para cada comparación entre criterios). La tabla 1s (material adicional) desglosa el grado de cumplimiento de cada uno de los criterios exigidos.
En la cohorte con EPOC, los pacientes con ACO-EPOC fueron 9 (3,9%), 21 (9,0%), 106 (45,5%) o 89 (38,2%), según se empleasen los criterios A, B, C o D, respectivamente (p<0,001). Entre los pacientes con asma, el ACO-asma se observó en 6 (5,4%), 9 (8,0%), 12 (10,7%) y 8 (7,1%), para los criterios A, B, C y D, respectivamente (p<0,001). La figura 2 muestra la prevalencia de ACO global, ACO-EPOC y ACO-asma, según cada criterio.
Perfil clínico diferencial del solapamiento asma-EPOCLas tablas 2As-Ds (material adicional) recogen las características diferenciales de cada grupo, según los diferentes criterios empleados. En líneas generales, los pacientes con ACO tuvieron un perfil intermedio entre el asma y la EPOC. No se observaron diferencias en las puntuaciones de ACT y CAT entre los grupos, para ninguna de las 4 definiciones. La proporción de pacientes tratados con ICS fue similar en los 4 grupos, siendo más frecuente el uso de beta2-agonistas adrenérgicos de acción prolongada (LABA)/ICS entre los casos con asma o ACO-asma y más frecuente la triple asociación, long-acting antimuscarinic antagonist (LAMA)/LABA/ICS, entre los casos con EPOC o ACO-EPOC.
Subtipos de solapamiento asma-EPOCLos pacientes con ACO-EPOC presentaron una edad más avanzada, mayor proporción de varones, peor función pulmonar, más síntomas y mayor tasa de agudizaciones en los últimos 12 meses que los ACO-asma.
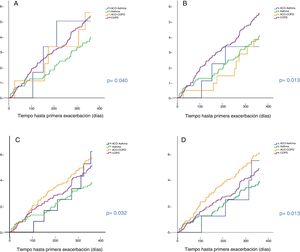
Capacidad predictiva de riesgo de las diferentes definicionesTiempo hasta primera exacerbaciónLa figura 3 muestra el tiempo hasta primera exacerbación según las 4 definiciones de ACO evaluadas. Los pacientes con ACO-EPOC mostraron el mayor riesgo de agudización al utilizar los criterios C y D. Este riesgo fue superior a los casos con asma (p<0,05). No se encontraron diferencias estadísticamente significativas entre ACO-EPOC y EPOC, ni entre ACO-asma y ACO-EPOC para el criterio C. Al emplear el criterio D, se observó un mayor riesgo de agudización para el ACO-EPOC frente al grupo EPOC, aunque no significativo (p=0,094). El estadístico C fue de 0,64 para los criterios C y 0,62 para el criterio D. La probabilidad acumulada de presentar una agudización fue del 57% y 61% para ACO-EPOC frente al 51% y 49% entre los pacientes con EPOC para los criterios C (p=NS) y D (p=0,094), respectivamente.
Los pacientes con ACO-asma presentaron similar comportamiento a los pacientes con asma, sin encontrar diferencias significativas entre ellos para ninguna de las 4 definiciones.
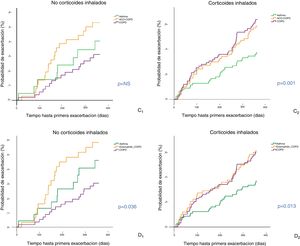
Análisis según tratamiento con corticoides inhaladosLa figura 4 muestra las curvas de Kaplan-Meier al emplear los criterios C y D, en función del uso o no de ICS. En la cohorte que no recibió ICS, los pacientes con ACO-EPOC presentaron mayor riesgo de agudización, con diferencias significativas frente a EPOC (p<0,01 en D y p=0,059 en C). Entre los que recibieron ICS (bien en forma de LABA/ICS o como triple asociación [LAMA/LABA/ICS]), el riesgo de agudización fue menor únicamente para asma (p<0,01).
Tiempo hasta primera exacerbación de los pacientes con EPOC, asma y ACO-EPOC, de acuerdo con el uso o no de corticoides inhalados (ICS). Se excluyen de la figura los casos con ACO-asma por su baja prevalencia entre los subgrupos. C: criterios de Plaza et al.13 (C1: pacientes que no utilizan ICS; C2: pacientes tratados con ICS); D: GOLD 201918 (D1: pacientes que no utilizan ICS; D2: pacientes tratados con ICS).
En la cohorte EPOC, los pacientes tratados con ICS mostraron un historial previo de agudizaciones en los últimos 12 meses superior (1,3±2,1 vs. 0,6±1,0, p<0,001), y una tendencia global a presentar mayor riesgo de agudización durante el año de seguimiento (HR: 1,35, p=0,063). Pese a ello, el riesgo de agudización fue similar entre EPOC y ACO-EPOC.
Análisis multivariadoAl realizar el análisis multivariado, ajustando el modelo por edad, FEV1% posbroncodilatación, exacerbaciones en el último año y tratamiento inicial con ICS, ninguna de las definiciones de ACO demostró ser predictor independiente de agudizaciones. La tabla 3 muestra el riesgo ajustado de los criterios C y D.
Influencia de los criterios diagnósticos C y D en el riesgo de agudizaciones. Análisis multivariado
| HR | IC95% HR | p | |
|---|---|---|---|
| Edad | 1,021 | 1,007-1,036 | 0,004 |
| FEV1posbroncodilatación (%) | 0,989 | 0,980-0,998 | 0,019 |
| N.oexacerbaciones en año previo | 1,160 | 1,090-1,235 | <0,001 |
| Criterio C | NS | ||
| Asma | -- | -- | -- |
| ACO-asma | 1,209 | 0,501-2,915 | NS |
| ACO-EPOC | 1,094 | 0,641-1,869 | NS |
| EPOC | 0,892 | 0,588-1,588 | NS |
| Edad | 1,021 | 1,006-1,036 | 0,005 |
| FEV1posbroncodilatación (%) | 0,989 | 0,980-0,998 | 0,013 |
| N.oexacerbaciones en año previo | 1,160 | 1,091-1,234 | <0,001 |
| Criterio D | NS | ||
| Asma | -- | -- | -- |
| ACO-asma | 0,930 | 0,286-3,030 | NS |
| ACO-EPOC | 1,126 | 0,679-1,866 | NS |
| EPOC | 0,879 | 0,543-1,425 | NS |
ACO: solapamiento asma-EPOC; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado el primer segundo; HR: hazard ratio; IC: intervalo de confianza; NS: no significativo.
La tabla 4 recoge la tasa media de agudizaciones durante el año de seguimiento, para cada uno de los grupos de estudio, de acuerdo con los diferentes criterios evaluados. La principal diferencia entre los 4 criterios se aprecia para la tasa de agudizaciones al año de los grupos C y D. No se observan diferencias estadísticamente significativas entre la tasa de hospitalizaciones.
Tasa de agudizaciones/año. Comparativo entre los 4 criterios
| Asma | ACO-asma | ACO-EPOC | EPOC | p | |
|---|---|---|---|---|---|
| Número de exacerbaciones/año | |||||
| Criterio A | 0,63±1,01 | 0,67±0,81 | 0,89±0,93 | 1,11±1,56 | 0,035 |
| Criterio B | 0,65±1,02 | 0,44±0,72 | 0,52±0,86 | 1,16±1,59 | 0,006 |
| Criterio C | 0,63±1,04 | 0,67±0,65 | 1,13±1,47 | 1,08±1,60 | 0,037 |
| Criterio D | 0,63±1,02 | 0,62±0,74 | 1,20±1,48 | 1,03±1,58 | 0,027 |
| Número de hospitalizaciones/año | |||||
| Criterio A | 0,03±1,67 | 0,17±0,41 | 0,00±0,00 | 0,12±0,47 | NS |
| Criterio B | 0,03±1,70 | 0,11±0,31 | 0,00±0,00 | 0,13±0,48 | NS |
| Criterio C | 0,02±0,14 | 0,17±0,39 | 0,07±0,25 | 0,16±0,58 | 0,056 |
| Criterio D | 0,02±0,14 | 0,25±0,46 | 0,07±0,25 | 0,15±0,58 | 0,053 |
ACO: solapamiento asma-EPOC; EPOC: enfermedad pulmonar obstructiva crónica; NS: no significativo.
Nuestro estudio compara diferentes criterios propuestos para definir ACO en una cohorte de pacientes con EPOC y otra con asma, evaluando específicamente la prevalencia global y por subtipos de ACO, el riesgo de agudizaciones de estos pacientes y su respuesta al tratamiento con ICS. Como principales hallazgos del estudio destacamos: 1) la proporción de pacientes con ACO varió sustancialmente según la definición utilizada, entre un 4,3 y un 34,2%; 2) los pacientes ACO-EPOC presentaron un perfil completamente diferente al ACO-asma; 3) de todas las propuestas clasificatorias, las que identificaron a pacientes ACO-EPOC con mayor riesgo de agudizaciones fueron la del consenso español GesEPOC-GEMA y la del ACO eosinofílico. Sin embargo, y como hallazgo no esperado, este mayor riesgo desapareció al ajustar por variables de confusión; y 4) entre los pacientes no tratados con ICS el riesgo de agudización fue sensiblemente superior para los ACO-EPOC que para los EPOC. Este riesgo se equiparó entre los pacientes que utilizaron ICS.
Prevalencia del solapamiento asma-EPOCLas prevalencias descritas en la literatura de ACO varían enormemente de unos estudios a otros, atribuyéndose tal variación a diferencias en la población incluida, diferentes criterios para definir asma y/o EPOC y especialmente a diferencias en los criterios de ACO utilizados13. En nuestro estudio, la población sobre la que se aplicaron los diferentes criterios fue la misma y la definición de EPOC y asma se ajustó escrupulosamente a GEMA y GesEPOC19,20, por lo que las diferencias observadas únicamente se pueden justificar con base en los criterios empleados. De todos ellos, los más restrictivos son los del documento de consenso español del 201211, con una prevalencia observada tan solo del 4,5%. Calle et al.25, en un estudio transversal realizado sobre 647 pacientes con EPOC, encontraron una prevalencia de ACO del 6,5%, similar a la nuestra. Sin embargo, tras introducir una pequeña modificación en estos criterios, consistente en incluir la eosinofilia periférica >5% como criterio menor y exigir tan solo un criterio mayor o 2 menores para definir ACO, la prevalencia asciende al 15%3. En ninguno de estos 2 estudios3,25, y tampoco en el nuestro, se determinó la eosinofilia en esputo, por lo que no podemos descartar una infraestimación de la prevalencia del ACO. Sin embargo, el análisis citológico del esputo es, desafortunadamente, una técnica realizada en muy pocos centros, por lo que las prevalencias referenciadas creemos que se acercan más a lo que la mayoría de los clínicos pueden encontrar en su práctica asistencial.
La propuesta realizada por Sin et al.12 ha sido validada recientemente en un estudio coreano26. Aplicando estos criterios, los autores solo encontraron una prevalencia del ACO del 1,9%, que además no afectó al riesgo de agudización al año. En nuestra serie, la prevalencia del ACO fue del 8,7% y al igual que sucede con el estudio coreano, la capacidad predictiva de riesgo tampoco fue diferente para los pacientes con ACO.
Frente a estos resultados, las propuestas más recientes elevan sustancialmente la proporción de ACO. Empleando los criterios propuestos por el consenso GesEPOC-GEMA13, la prevalencia de ACO en nuestro estudio fue del 34,2% y con el criterio único de una eosinofilia ≥300células/μl alcanzó el 28,1%. La proporción de casos con ≥300eosinófilos/μl fue del 45,2% (59,8% en la cohorte asma y 38,2% en la cohorte EPOC), lo que sin duda contribuye a elevar sustancialmente la prevalencia de ACO, para los criterios C y D. A pesar de lo elevado de estas cifras, otras series presentan resultados similares. Pérez de Llano et al.27 encontraron que el 29,8% de los 292 pacientes incluidos en un estudio multicéntrico español cumplían criterios de ACO según el documento de consenso de SEPAR13. Más recientemente, Toledo-Pons et al.28, en un análisis retrospectivo sobre 603 pacientes de la cohorte Majorica en las Islas Baleares, también han reportado resultados similares, con una prevalencia del ACO del 27,4% al utilizar estos mismos criterios13. Aproximadamente la mitad de los casos fueron diagnosticados exclusivamente por presentar ≥300eosinófilos/μl en sangre periférica.
Subtipos de solapamiento asma-EPOCDatos recientes sugieren que los pacientes con ACO no son un grupo homogéneo, sino que existen diferencias clínicas y biológicas entre los asmáticos fumadores y los EPOC con eosinofilia28–30. Nuestros datos refuerzan esta hipótesis por cuanto, con independencia de los criterios diagnósticos utilizados, los pacientes con ACO-EPOC mostraron un perfil clínico diferencial con mayor proporción de varones, edad más avanzada, peor función pulmonar, más síntomas y también mayor riesgo de agudización que el ACO-asma. Uno de los puntos de debate actual gira alrededor de la importancia que tiene la eosinofilia periférica aislada en pacientes sin otros criterios de ACO. Para Song et al.31, el recuento de eosinófilos en pacientes sin ACO no se asoció a cambios en el FEV1, ni a cambios en la calidad de vida relacionada con la salud o la frecuencia de agudizaciones, por lo que la implicación de este tipo de eosinofilias periféricas aisladas, sin otras características acompañantes de ACO, está por determinar.
Riesgo futuro de agudizacionesDe las 4 definiciones de ACO evaluadas, las que identificaron a pacientes ACO con mayor riesgo de agudizaciones fueron las propuestas C y D. Ambas propuestas son relativamente parecidas por contener un criterio común, la presencia de eosinofilia periférica elevada. Diferentes estudios han asociado el recuento de eosinófilos a un incremento del riesgo de agudizaciones moderadas-graves32–35. Sin embargo, en ninguno de estos estudios se ajusta el riesgo de agudización por otras variables de confusión. De forma sorprendente y tras realizar este ajuste por edad, FEV1, exacerbaciones en el último año y tratamiento inicial con ICS, el riesgo de agudización atribuible al ACO y/o a la eosinofilia periférica desapareció en el análisis multivariado. Sin embargo, al ser un estudio observacional no podemos descartar cierta interacción con otras variables de confusión. Diversos estudios han demostrado que el ACO y/o la eosinofilia periférica se asocia a mejor pronóstico3,9,36, aunque tampoco en ellos se realizaron ajustes por gravedad.
Respuesta al tratamiento con esteroides inhaladosEn ausencia de diferencias en los desenlaces clínicos más relevantes, la única opción para seguir categorizando al ACO como fenotipo clínico pasa porque exista una respuesta diferencial al tratamiento. En este sentido, algunos estudios sugieren una mejor respuesta a los ICS en los pacientes con ACO, especialmente en aquellos que presentan eosinofilia periférica14–16,37–39. Al ser un estudio observacional, no podemos enjuiciar directamente en nuestra serie el papel de los ICS. De hecho, los pacientes que recibieron tratamiento antiinflamatorio fueron en líneas generales más graves y con mayor proporción de agudizaciones previas. No obstante, al revisar el riesgo de agudización entre los casos que no recibieron ICS, los pacientes ACO-EPOC demostraron mayor riesgo de agudización que los pacientes con EPOC. Este riesgo diferencial desapareció entre los tratados con ICS, lo que sugiere, de forma indirecta, un efecto beneficioso.
LimitacionesNuestro estudio está realizado en un único centro, por lo que no podemos descartar condicionantes regionales que expliquen la elevada eosinofilia periférica. Sin embargo, como ya se ha comentado, diversos estudios españoles presentan datos parecidos27,28,36. El seguimiento fue de un año, por lo que tampoco nos permite evaluar adecuadamente la supervivencia. Finalmente, el diseño del estudio fue observacional, de tal suerte que el potencial beneficio del tratamiento con ICS sobre el ACO debe ser enjuiciado con precaución.
ConclusionesSe observan enormes variaciones en prevalencia de ACO, en función del criterio diagnóstico utilizado. Los criterios más antiguos son muy restrictivos y no se relacionan con el riesgo de agudizaciones, mientras que la propuesta más reciente de GesEPOC-GEMA o el recuento de eosinófilos son más amplios. Con independencia de la propuesta utilizada, se confirma que la población con ACO es heterogénea, con un subtipo ACO-asma y otro de ACO-EPOC muy diferenciados.
Conflicto de interesesJuan José Soler-Cataluña ha recibido honorarios como ponente de AstraZeneca, Boehringer Ingelheim, Bial, Ferrer, Laboratorio Esteve, Menarini, Mundipharma, Novartis, Rovi y TEVA; honorarios de consultoría de AirLiquide, AstraZeneca, Boehringer Ingelheim, Chiesi, Ferrer, GlaxoSmithKline, Laboratorios Esteve, Mundipharma, y Novartis y ayudas para la investigación de GlaxoSmithKline y Boehringer Ingelheim.
Marc Miravitlles ha recibido honorarios como ponente de AstraZeneca, Boehringer Ingelheim, Chiesi, Cipla, AstraZeneca, Menarini, Rovi, Bial, Zambon, CSL Behring, Grifols y Novartis; honorarios de consultoría de AstraZeneca, Boehringer Ingelheim, Chiesi, Ferrer, GlaxoSmithKline, Bial, Gebro Pharma, CSL Behring, Laboratorios Esteve, Ferrer, Mereo Biopharma, Verona Pharma, TEVA, pH Pharma, Novartis y Grifols; y ayudas para la investigación de GlaxoSmithKline y Grifols.
Fernando José Sánchez-Toril Lopez ha recibido honorarios como ponente de Almirall, AstraZeneca, Boehringer Ingelheim, Bial, Ferrer, GSK, Laboratorio Esteve, Menarini, Mundipharma, Novartis y TEVA y honorarios de consultoría de AstraZeneca y TEVA.
Laura Novella, Cristina Soler, María Luisa Nieto y Violeta Esteban declaran no tener conflicto de interés.