Apenas existe evidencia si la dependencia para las actividades básicas de la vida diaria (ABVD) o instrumentales (AIVD) son predictores de mortalidad tras una agudización grave de EPOC (AEPOC). Además, no se ha evaluado si su inclusión en un score multidimensional puede mejorar esta predicción.
MetodologíaEstudio prospectivo de cohortes, con seguimiento de pacientes tras un alta por AEPOC y análisis multivariante de variables clínico-demográficas y de dependencia (índices de Barthel y de Lawton y Brody) predictoras de mortalidad. Se generaron 3 scores (con/sin dependencia para ABVD y AIVD) que se compararon entre ellos y con otros índices multidimensionales habituales (BODEx, ADO, DOSE, CODEx).
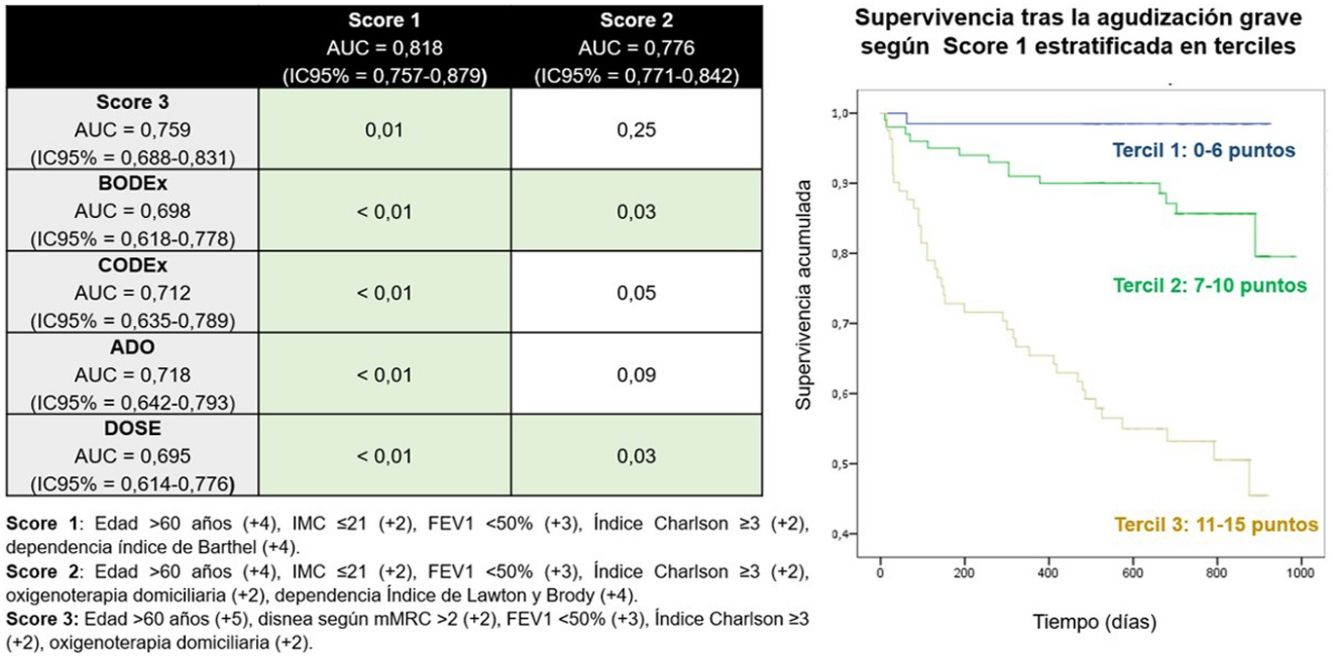
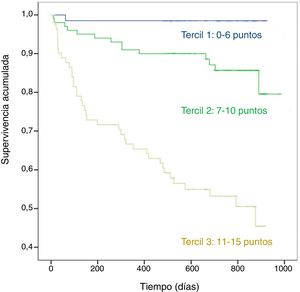
ResultadosSe incluyó a 247 pacientes, 112 (45%,3) presentaron alguna dependencia para ABVD y 195% (72,4%) para AIVD. Supervivencia 631,7 (258,8) días, intervalo de confianza del 95% (IC del 95%), 60-912. Fallecieron 54 (21,9%, IC del 95%, 17-27) pacientes. La edad> 60 años, el FEV1<50% y puntuación en Charlson ≥ 3 fueron predictores independientes en los 3 modelos. La dependencia para las ABVD y las AIVD lo fueron en los modelos en los que se incluyeron estas variables. El score que incluía la dependencia para las ABVD presentó la mejor capacidad predictiva (área bajo la curva 0,818; IC del 95%, 0,757-0,879) y su estratificación en terciles permitió diferenciar grupos de mayor riesgo desde el inicio del seguimiento (p <0,01).
ConclusionesLa dependencia para las actividades de la vida diaria, especialmente las más elementales, es un predictor independiente de mortalidad tras una AEPOC grave, comparable con variables clínicas. Su inclusión en scores multidimensionales mejora de forma clara su capacidad predictiva.
Scant evidence is available on whether dependency for basic (BADL) or instrumental (IADL) activities of daily living can be predictors of mortality after severe COPD exacerbation (COPDE). In addition, it is as yet unclear whether the inclusion of this parameter in a multidimensional score can improve the prediction of mortality.
MethodologyProspective cohort study, with follow-up of patients discharged after COPDE and multivariate analysis of clinical-demographic and dependency variables (Barthel and Lawton and Brody indices) as predictors of mortality. Three scores were generated (including or not including dependency for BADL and IADL) that were compared with each other and with other commonly used multidimensional indices (BODEx, ADO, DOSE, CODEx).
ResultsIn total, 247 patients were included, 112 (45%, 3); and 195 (72.4%) had some dependency for BADL and IADL. Survival was 631.7 (258.8) days, 95% confidence interval (95% CI), 60-912 days. Fifty-four (21.9%, 95% CI 17-27) patients died. Age> 60 years, FEV1 <50% and Charlson score ≥ 3 were independent predictors in the 3 models generated. Dependency for BADL and IADL were predictors in each of the models in which they were included. The score that included the dependency for BADL presented the best predictive capacity (area under the curve 0.818, 95% CI 0.757-0.879). Stratification into tertiles differentiated groups with a higher risk of death from the beginning of the follow-up (P<.01).
ConclusionsDependence for activities of daily living, especially the most elementary ones, is an independent predictor of mortality after a severe COPDE that is comparable to clinical variables. Its inclusion in multidimensional scores clearly improves predictive capacity.
La enfermedad pulmonar obstructiva crónica (EPOC) constituye una de las enfermedades respiratorias más frecuentes, con una elevada morbimortalidad y una importante carga social y económica que se prevé que empeorará en las próximas décadas1-3. Se caracteriza por su cronicidad y por presentar exacerbaciones (AEPOC), que contribuyen a un deterioro significativo del estado de salud, afectan a la progresión de la enfermedad y aumentan el riesgo de muerte2-4. En pacientes con la enfermedad avanzada, la EPOC suele tener una trayectoria evolutiva compleja y heterogénea, poco predecible en algunos casos, lo que implica dificultades para establecer un pronóstico ajustado y señalar el punto en que las necesidades paliativas deben sustituir progresivamente al tratamiento convencional4,5.
La detección de factores que permiten predecir de forma fiable la mortalidad ha sido motivo de múltiples investigaciones, aunque la evidencia disponible es muy heterogénea al obtenerse de estudios con diferente metodología, tiempo de seguimiento y ámbito de inclusión de sujetos (fase estable o tras una hospitalización)4,5. Tras una AEPOC, las variables predictoras descritas hasta ahora pueden agruparse en características del paciente antes del ingreso (edad, comorbilidades, disnea, capacidad funcional, desnutrición e ingresos previos) o según la gravedad clínica en el momento de la hospitalización o a lo largo de la misma5,6-13. Sin embargo, como la capacidad predictiva de estas variables es limitada, se ha investigado la validez pronóstica de varios índices multidimensionales formados simultáneamente por algunas de ellas5,13. Los más reconocidos son BODE, BODEx, ADO, DOSE y CODEx, que incluyen variables como la edad, el grado de obstrucción bronquial y de disnea, la situación nutricional, la capacidad de esfuerzo, la frecuencia de AEPOC graves previas, el número de comorbilidades significativas o la persistencia del tabaquismo4,13-18. Aunque también su valor es limitado5, su utilización se recomienda en la mayoría de las de las directrices de manejo de la EPOC2,3. Recientemente, un documento de consenso entre las sociedades europea y americana de Respiratorio señalan como objetivo de investigación prioritario la realización de estudios comparativos entre los diversos índices pronósticos19.
Las actividades de la vida diaria (AVD) son uno de los elementos principales de la medida de la salud y la calidad de vida en las personas20-25. Conocer cómo un paciente puede vivir de forma autónoma dentro de la comunidad es además necesario para poder adecuar los cuidados y establecer prioridades de intervención. Al contrario que en otras enfermedades, en la EPOC, sorprendentemente, casi no se ha analizado la capacidad predictiva de la dependencia para la realización de las AVD y en los escasos estudios en los que sí se ha hecho los resultados no son homogéneos6,7,12. Actualmente, desconocemos la potencia predictiva de la capacidad funcional determinada por las AVD, que incluyen tareas básicas (ABVD) o de cuidado personal (comer, asearse, vestirse, trasladarse, etc.) e instrumentales (AIVD) o del entorno (hacer compras, preparar comida, limpiar la casa, etc.). Además, estas variables no han sido incluidas en ninguno de los índices pronósticos desarrollados hasta el momento5.
El objetivo del presente trabajo ha sido evaluar la capacidad predictiva de mortalidad de la dependencia para las ABVD y las AIVD tras una hospitalización por AEPOC y analizar si su inclusión en un score multidimensional mejora esta predicción en comparación con índices reconocidos, como BODEx, ADO, DOSE o CODEx.
MetodologíaDiseño y asentamiento del estudioSe realizó un estudio prospectivo de cohortes, con reclutamiento consecutivo de pacientes con el primer ingreso que tuvieron con diagnóstico primario de AEPOC en el periodo de estudio en el Servicio de Neumología de un hospital de tercer nivel a lo largo de 2017. No se incluyó a los que no aceptaron participar o se excluyó el diagnóstico de EPOC, ya que no cumplían todos los criterios diagnósticos o se hizo un diagnóstico alternativo de AEPOC como embolia pulmonar, neumonía u otras enfermedades cardiorrespiratorias descompensadas significativas2,3. El material y los métodos han sido publicados anteriormente26,27. El estudio fue aprobado por el Comité de Ética e Investigación de Galicia (código 2016/524).
Recogida de informaciónVariables clínicas y demográficasDe forma resumida, al 3.er-4.° día desde el ingreso personal sanitario y una trabajadora social entrenada recogían de forma sistematizada, revisando la historia clínica electrónica y entrevistando al paciente y sus cuidadores, información demográfica, clínica y social. Se recogieron datos demográficos, peso, altura, consumo activo de tabaco, inmunizaciones, número de AEPOC graves, resultados de la analítica sanguínea del ingreso, número y tipo de comorbilidades mediante el índice de Charlson28 y la escala de Goldberg de ansiedad (puntuación ≥ 4) y depresión (puntuación> 2)29, el impacto de la enfermedad mediante el cuestionario COPD Assessment Test (CAT)30, nivel de disnea basal (escala modificada de la Medical Research Council [mMRC]), función pulmonar (FEV1) y necesidad en domicilio de oxigenoterapia continua o ventilación no invasiva y tratamiento médico recomendado al alta.
Variables de dependenciaLa capacidad para la realización de ABVD en situación basal (previa a la agudización) fue determinada por el índice de Barthel31 y la de las AIVD por el índice de Lawton y Brody32. El primero recoge 10 actividades (alimentación, baño, vestido, aseo, uso de retrete, defecación, micción, deambulación, subir/bajar escaleras y transferencia). Los valores asignados a cada actividad se basan en el tiempo y en la cantidad de ayuda física requerida o si el paciente realiza dicha actividad (0, 5, 10 o 15 puntos). El rango de posibles valores está entre 0 y 100. Entre 20 y 60 puntos supondría dependencia grave, entre 61 y 90 puntos moderada, entre 91 y 99 leve y 100 independencia31. El segundo valora 8 ítems (capacidad para utilizar el teléfono, hacer compras, preparar adecuadamente la comida, cuidado del hogar, lavado de la ropa, independencia en el uso de medios de transporte, responsabilidad y control respecto a la medicación. y una correcta administración de la economía), a los que se les asigna un número, 1 (independiente) o 0 (dependiente). La puntación final es la suma del valor de todas las respuestas. Respecto a la valoración total, se mide de 0 a 8, siendo 0 dependencia absoluta y 8 independencia total32.
SeguimientoEn el momento del análisis todos los pacientes disponían de un seguimiento mínimo de 500 días o hasta su fallecimiento. Este se realizó revisando la historia clínica electrónica mensualmente. Se registró con base en la revisión de la misma la posible causa de la defunción. Ante cualquier duda o ausencia de información se contactó telefónicamente con el paciente o familiares.
Análisis estadísticoEl tiempo de supervivencia se definió como el intervalo entre la fecha del alta hospitalaria y el fallecimiento o el final de seguimiento en los que sobrevivieron. No hubo pérdidas en el seguimiento. Las variables cuantitativas se expresaron como media y desviación estándar (DE), y las cualitativas como número y porcentaje, incluyéndose el intervalo de confianza del 95% (IC del 95%) en la incidencia de fallecimientos. La variable tiempo de seguimiento se expresó además por su mediana.
Para la comparación de todas las variables tiempo-dependientes cualitativas, en el análisis bivariado se utilizaron las curvas de Kaplan-Meier la y la prueba de rangos logarítmicos, y en las cuantitativas el análisis de riesgos proporcionales de Cox. Todas las variables numéricas fueron dicotomizadas (tabla 1) en función del punto de corte en el que se observaba un incremento significativo de la mortalidad encontrada en las clasificaciones recomendadas habitualmente (mMRC, CAT, FEV1 según GOLD, dependencia Barthel,y Lawton y Brody) o en la tabla de contingencia creada para las otras variables (edad o número de ingresos por AEPOC). Con todas las variables que mostraron una asociación con una p ≤ 0,10, además de la variable género, se realizó un análisis multivariante mediante diferentes modelos de regresión de Cox con covariables fijas. Se realizaron varios modelos, el primero incluyendo la dependencia para las ABVD (modelo 1), el segundo incluyendo en su lugar la dependencia para las AIVD (modelo 2) y el tercero sin la inclusión de ninguna de las variables de dependencia (modelo 3). Los resultados se expresaron mediante su valor de p y las hazard ratio (HR) con su IC del 95%, y se aceptó que hubo diferencias significativas cuando la p fue <0,05.
Descripción de las variables recogidas en la muestra total y fallecidos/vivos durante el periodo de seguimiento y comparación entre las variables
| Total (N=247) | Fallecidos (N=54) | Vivos (N=193) | p | |
|---|---|---|---|---|
| Sexo varón (%) | 189 (76,5) | 43 (79,6) | 146 (75,6) | 0,77 |
| Edad (años)a | 68,8 ± 9,6 | 72,1 ± 7,9 | 67,6 ± 9,9 | 0,04 |
| Edad> 60 años | 204 (82,6) | 52 (96,3) | 152 (78,8) | 0,01 |
| IMC (kg/m2)a | 27,5 ± 6,4 | 25,7 ± 6,2 | 28,01 ± 6,2 | 0,01 |
| IMC ≤ 21 kg/m2 (%) | 49 (19,8) | 16 (29,6) | 33 (17,1) | 0,03 |
| Tabaquismo activo (%) | 96 (38,9) | 15 (27,8) | 81 (42,0) | 0,07 |
| Índice paquetes-añoa | 54,2 ± 29,1 | 55,1 ± 29,5 | 54,3 ± 35,7 | 0,93 |
| N.° de ingresos por AEPOC año previoa | 0,7 ± 1,1 | 1,17 ± 1,4 | 0,6 ± 1,0 | 0,03 |
| ≥ 2 ingresos por AEPOC año previo (%) | 49 (19,8) | 17 (31,5) | 32 (16,6) | 0,06 |
| Vacunación gripe año previo (%) | 205 (83,0) | 44 (81,5) | 161 (83,4) | 0,75 |
| Vacunación antineumocócica previa (%) | 135 (54,7) | 27 (50,0) | 108 (56,0) | 0,46 |
| Cifra de eosinófilos en sangre (totales/μl)a | 110 ± 225 | 94 ± 117 | 117 ± 250 | 0,53 |
| Puntuación en cuestionario CATa | 18,8 ± 7,2 | 20,5 ± 7,0 | 18,4 ± 7,3 | 0,04 |
| Puntuación cuestionario CAT> 10 (%) | 214 (86,6) | 50 (92,6) | 164 (85,0) | 0,10 |
| Disnea según mMRCa | 2,2 ± 0,8 | 2,7 ± 0,7 | 2,1 ± 0,7 | <0,01 |
| Disnea según mMRC> 2 (%) | 90 (36,4) | 30 (55,6) | 60 (31,1) | <0,01 |
| Valor de FEV1 (% valor de referencia)a | 42,1 ± 14,2 | 35,6 ± 11,5 | 43,9 ± 14,0 | <0,01 |
| Valor de FEV1 <50% de referencia (%) | 177 (71,4) | 48 (88,9) | 126 (66,3) | <0,01 |
| Puntuación índice de Charlsona | 1,7 ± 0,9 | 1,9 ± 0,9 | 1,7 ± 0,8 | 0,10 |
| Puntuación índice Charlson ≥ 3 (%) | 44 (17,8) | 15 (27,8) | 126 (66,3) | 0,04 |
| Puntuación cuestionario Goldberg (total)a | 5,6 ± 3,9 | 6,04 ± 3,7) | 5,6 ± 3,9 | 0,46 |
| Ansiedad según cuestionario de Goldberg (%) | 110 (44,0) | 24 (45,3) | 86 (44,6) | 0,97 |
| Depresión según cuestionario de Goldberg (%) | 129 (52,4) | 34 (64,2) | 95 (49,2) | 0,04 |
| Pauta de tratamiento con corticoides inhalados | 154 (63%) | 38 (71%) | 114 (60%) | 0,16 |
| Oxigenoterapia continua domiciliaria (%) | 99 (40,4) | 33 (62,3) | 66 (34,4) | <0,01 |
| Ventilación no invasiva domiciliaria (%) | 42 (16,7) | 11 (20,4) | 31 (16,1) | 0,26 |
| Puntuación en cuestionario de Barthela | 88,7 ± 17,3 | 79,9 ± 19,6 | 91,2 ± 15,8 | <0,01 |
| Dependencia según cuestionario de Barthel (cualquiera) (%) | 112 (45,3) | 41 (75,9) | 71 (36,8) | <0,01 |
| Puntuación según cuestionario de Lawton y Brodya | 4,8 ± 2,4 | 3,6 ± 1,8 | 5,2 ± 2,4 | <0,01 |
| Dependencia según Lawton y Brody (%) | 195 (72,9) | 51 (94,4) | 144 (74,6) | <0,01 |
Se conformó un score pronóstico para los diferentes modelos (score 1, score 2 y score 3), asignando un valor (en función del valor de HR) a cada una de las variables teniendo en cuenta la magnitud de la asociación con la mortalidad en el análisis de regresión de Cox.
Se calcularon las curvas receiver operating characteristic (ROC), comparándose el área bajo la curva (AUC) del estadístico C para los 3 diferentes scores, que se compararon además con otros índices pronósticos que se pudieron calcular (BODEx, CODEx, ADO o DOSE) con base en las variables de las que se disponían, analizando su significación con el método DeLong. También se construyeron curvas de supervivencia de Kaplan-Meier entre el número de eventos el score con mejor capacidad predictiva. El análisis se hizo con los programas estadísticos IBM SPSS Statistics 21 SPSS versión 21 (IBM Corp., Armonk, NY, EE. UU.) y Software estadístico R, versión 4.3 (R Core Team, 2017).
ResultadosDescripción de la muestraSe incluyó a 247 pacientes, 189 (76,5%) varones con una edad de 68,8 ± 9,6 años. Los valores de las variables recogidas se expresan en la tabla 1. El tiempo de supervivencia de toda la muestra fue de 631,7 (258,8) días, mediana 712 e IC del 95% 60-912 días. El seguimiento de los no fallecidos fue de 744,2 (136), mediana 771 e IC del 95% 516-915 días.
Durante el seguimiento fallecieron 54 (21,9%, IC del 95%, 17-27) pacientes, 38 (15,4%, IC del 95%, 11-20) en el primer año de seguimiento. La supervivencia media de los fallecidos fue de 129,1±109,6 días. No hubo pérdidas de seguimiento.
En 52 de 54 pacientes se pudo acceder a información fiable de la causa del fallecimiento. En 29 (55%) se debió exclusivamente a insuficiencia respiratoria crónica descompensada refractaria en relación con una AEPOC o fase avanzada de su EPOC, en 5 (9,6%) se añadió una insuficiencia cardíaca significativa, 3 (6%) neumonías, 10 (19,2%) una neoplasia avanzada (6 de pulmón), en 3 (6%) enfermedad abdominal (2 oclusión intestinal de causa incierta y uno isquemia intestinal) y en 2 (3,8%) un accidente cerebrovascular.
Variables que predicen la mortalidadEn la tabla 1 se representan los resultados del análisis bivariante. Las variables que fueron diferentes entre fallecidos y no fallecidos fueron: edad, IMC bajo, número de AEPOC graves en el año previo, FEV1, grado de disnea, puntuación en CAT, depresión según Goldberg, puntuación en Charlson y la dependencia para las ABVD y las AIVD. Con las variables dicotómicas que tuvieron una asociación con una p ≤ 0,10 y la variable género se crearon varios modelos multivariantes, que se presentan en la tabla 2. La edad> 60 años, un FEV1 <50% y una puntuación en Charlson ≥ 3 fueron predictores independientes en los 3 modelos, el IMC ≤ 21 lo fue en los modelos 1 y 2, y la necesidad de oxigenoterapia domiciliaria en el 2 y en el 3, mientras que un grado de disnea> 2 lo fue únicamente en el modelo 3. La dependencia para las ABVD y las AIVD fueron predictores en cada uno de los modelos en los que se incluyeron.
Modelos multivariantes predictores de mortalidad y puntuación asignada a cada variable incluida en los scores
| Modelo 1 (score 1) | Modelo 2 (score 2) | Modelo 3 (score 3) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HR | IC del 95% | p | Puntuación asignada | HR | IC del 95% | p | Puntuación asignada | HR | IC del 95% | p | Puntuación asignada | |
| Sexo varón | 0,85 | 0,40-1,71 | 0,69 | – | 0,81 | 0,38-1,72 | 0,58 | – | 0,85 | 0,39-1,83 | 0,68 | – |
| Edad>60 años | 3,96 | 1,01-17,49 | 0,04 | 4 | 4,15 | 1,01-18,04 | 0,04 | 4 | 4,87 | 1,12-20,10 | 0,03 | 5 |
| IMC ≤ 21 kg/m2 | 2,53 | 1,20-5,04 | 0,01 | 2 | 1,95 | 1,01-5,04 | 0,04 | 2 | 1,81 | 0,91-3,59 | 0,09 | – |
| Tabaquismo activo | 0,74 | 0,45-1,76 | 0,74 | – | 0,79 | 0,41-1,54 | 0,50 | – | 0,73 | 0,37-1,40 | 0,34 | – |
| ≥ 2 ingresos por AEPOC año previo | 0,91 | 0,48-1,71 | 0,77 | – | 0,96 | 0,50-1,82 | 0,90 | – | 1,03 | 0,54-1,97 | 0,91 | – |
| Puntuación cuestionario CAT>10 | 0,86 | 0,40-1,82 | 0,69 | – | 0,88 | 0,29-2,63 | 0,82 | – | 1,11 | 0,37-3,28 | 0,84 | – |
| Disnea según mMRC>2 | 1,56 | 0,82-2,93 | 0,17 | – | 1,59 | 0,87-2,91 | 0,12 | – | 1,84 | 1,01-3,37 | 0,04 | 2 |
| Valor de FEV1 <50% de referencia | 3,48 | 1,33-5,04 | 0,01 | 3 | 3,10 | 1,26-7,65 | 0,01 | 3 | 2,90 | 1,17-7,13 | 0,02 | 3 |
| Puntuación índice Charlson ≥ 3 | 2,05 | 1,02-4,15 | 0,04 | 2 | 2,12 | 1,07-4,19 | 0,03 | 2 | 2,18 | 1,1-4,33 | 0,02 | 2 |
| Depresión según cuestionario de Goldberg (%) | 1,22 | 0,67-2,49 | 0,51 | – | 1,37 | 0,74-2,54 | 0,31 | – | 1,28 | 0,70-2,35 | 0,42 | – |
| Oxigenoterapia continua domiciliaria | 1,30 | 0,70-2,45 | 0,43 | – | 1,82 | 1,02-3,32 | 0,04 | 2 | 1,95 | 1,07-3,56 | 0,02 | 2 |
| Alguna dependencia según el índice de Barthel | 3,95 | 1,88-8,31 | <0,01 | 4 | NI | NI | NI | – | NI | NI | NI | – |
| Alguna dependencia según el índice Lawton y Brody | NI | NI | NI | – | 3,82 | 1,12-12,94 | 0,03 | 4 | NI | NI | NI | – |
NI: no incluida.
Con el resultado de estos 3 modelos se crearon 3 scores, asignándoles un valor similar a la HR de cada variable que se asoció de forma independiente con la predicción de mortalidad.
En la figura 1 se representan gráficamente las AUC de todos los scores predictivos calculados y en la tabla que incluye se representa su valor con su IC del 95% y el de la p calculada mediante la prueba de DeLong, al comparar el de los scores que incluyen dependencia (score 1 y 2, en las columnas) con aquellos que no incluyen ninguna variable de dependencia (score 3, BODEx, CODEx, ADO, DOSE, en las filas). La AUC del score 1 fue significativamente mejor que la de todos los demás scores o índices incluidos, mientras que el score 2 lo fue solo con respecto a BODEx y DOSE. El valor de p entre la AUC del score 1 y la del 2 fue de 0,04.
Representación gráfica de las áreas bajo la curva ROC de cada uno de los scores e índices pronósticos y comparación (valor de p) de los scores que incluyen variables de dependencia (scores 1 y 2, en las columnas) con los que no la incluyen (score 3, BODEx, CODEx, ADO y DOSE, en las filas).
Score 1: edad> 60 años (+4), índice de masa corporal ≤ 21 (+2), FEV11 <50% (+3), puntuación en Charlson ≥ 3 (+2), alguna dependencia según índice de Barthel (+4). Puntuación posible: 0-15
Score 2: edad> 60 años (+4), índice de masa corporal ≤ 21 (+2), FEV1 <50% (+3), puntuación en Charlson ≥ 3 (+2), oxigenoterapia domiciliaria (+2), alguna dependencia según índice de Lawton y Brody (+4). Puntuación posible: 0-17.
Score 3: edad> 60 años (+5), disnea según mMRC> 2 (+2), FEV1 <50% (+3), puntuación en Charlson ≥ 3 (+2), oxigenoterapia domiciliaria (+2). Puntuación posible: 0-14.
En la figura 2 se representa la curva de supervivencia de Kaplan-Meier para el score 1 estratificado en terciles, observándose que desde el inicio del seguimiento permite distinguir 3 grupos con marcadas diferencias en la probabilidad de fallecimiento (p <0,01).
DiscusiónEl presente estudio aporta información novedosa ya que demuestra que la limitación para la realización de AVD, especialmente las más elementales, es un potente predictor de mortalidad en los siguientes meses tras una hospitalización por AEPOC, equivalente a la edad y superior a variables clínicas como el grado de obstrucción o disnea, el bajo peso y el número de comorbilidades. Además, es el primero que demuestra que la inclusión de esta variable en un score de mortalidad tras una AEPOC grave puede mejorar significativamente la clasificación pronóstica de estos pacientes.
En la EPOC, la evidencia existente sobre la capacidad predictiva de mortalidad de la dependencia funcional de los pacientes es muy escasa33. Almagro et al.7 y Sanjaume et al.12, en 2pequeñas cohortes, describieron que la limitación para las ABVD medidas por la escala de Katz, que refleja la dependencia para 7 funciones sociobiológicas también incluidas en el índice de Barthel, es un predictor de mortalidad tras una AEPOC grave únicamente en los análisis bivariantes, pero no cuando se ajustaban por otras variables incluidas en el índice BODEx o factores como la actividad física y las comorbilidades. Connors et al.6, en un trabajo publicado hace más de 20 años, demostraron que la dependencia para las ABVD medida por este mismo índice sí era un predictor independiente, especialmente cuando existía limitación para al menos 2de ellas. Algo similar encontramos en el presente estudio, en el que el porcentaje de fallecidos en el tiempo de seguimiento tras una AEPOC fue del 9,6, el 25, el 36 y el 47% (p <0,01), según la dependencia para el índice de Barthel fuese ninguna, independencia leve, moderada o grave, respectivamente (datos no mostrados). Esto significaría que a mayor grado de dependencia, mayor probabilidad de fallecer. Sin embargo, con el fin de una mayor simplificación y facilidad de obtención del score, hemos optado por no hacer una estratificación del grado de dependencia para las ABVD, a pesar de lo cual esta variable ha mostrado una gran potencia predictora, tanto de forma individual como al incluirla en un score multidimensional.
No hemos encontrado estudios que hayan analizado la capacidad predictiva de mortalidad en pacientes EPOC de la limitación para las AIVD, que en nuestro trabajo también se han relacionado. Sin embargo, aunque de forma individual su asociación parece similar a la dependencia para las ABVD, cuando se combina en un score multidimensional la capacidad predictiva es menor que esta, aunque sí es superior a algunos de los índices previamente validados como BODEx o DOSE. Las AIVD son más dependientes de factores socioculturales o de género32, aspectos que pueden haber influido en estos hallazgos. Además, incluyendo en los modelos predictores multivariantes ambos índices (Barthel y Lawton y Brody), los resultados son muy similares a los descritos en el modelo 1 (datos no mostrados), lo que indica que es la limitación para ABVD la mejor predictora y que no aporta valor para este fin la evaluación de ambas.
Las otras variables predictoras que hemos encontrado en los diferentes modelos (edad, comorbilidades, función pulmonar, disnea, bajo IMC, AEPOC graves previas) también lo han sido en otros estudios y forman parte de muchos índices conocidos, incluyendo los que se han podido determinar en el presente estudio4,5,13-18. Llama la atención que en nuestro trabajo el score que no incluye dependencia para las AVD (score 3) parece ser un mejor predictor que los ya descritos, aunque esto puede explicarse porque está basado en el análisis de los factores que predicen mortalidad en la propia muestra.
El presente estudio presenta algunas limitaciones. La primera sería que se ha realizado en un único centro y con una casuística limitada, lo que puede limitar su validez externa y hace necesario que los hallazgos se confirmen en estudios multicéntricos y con un mayor número de pacientes. Sin embargo, la población incluida no parece muy diferente de la de otros centros o áreas nacionales, ya que presenta características clínico-demográficas similares a las descritas en amplias auditorias nacionales e internacionales34. Además, el número de fallecimientos ajustado por el tiempo de seguimiento y las causas de estos ha sido similar a los descritos en otras series de nuestro país7,12,35. Por otra parte, en ausencia de cuestionarios de determinación de la capacidad funcional específicos de EPOC validados para los objetivos del presente trabajo33, se han utilizado los recomendados en documentos institucionales36,37. Eso nos permitiría además la comparación con otras enfermedades crónicas y demostrar su utilidad también en esta enfermedad, dado que al no centrarse únicamente en la disnea como componente esencial de las limitación para las AVD, pueden permitir una visión más completa de la situación general del paciente, ya que su resultados están relacionados también con las alteraciones en otras esferas, como la cognitiva, locomotora o sensorial, que pueden ser claves en la predicción de eventos en los pacientes crónicos5,13,21. Por otra parte, la recogida durante una hospitalización de información de la situación en fase estable de unas semanas antes no está exenta de posibles imprecisiones.
Sin embargo, creemos que el trabajo tiene algunas fortalezas, como son su diseño, el muestreo consecutivo durante un año, la valoración de la dependencia por personal experto y la ausencia de pérdidas en el seguimiento. Los resultados indican que una evaluación muy sencilla de la capacidad funcional del paciente, con base en una única pregunta, al no precisar una medición completa de los índices y que el resto de las variables se hayan dicotomizado, por lo que no sería necesario utilizar valores intermedios, hacen que el score sea de muy fácil utilización. Además, no precisa la realización de otras pruebas funcionales como ocurre con el BODE u otras propuestas recientes14,38, no disponibles o valorables al ingreso en muchos pacientes y genera evidencia sobre la utilidad de variables de la vida diaria diferentes a las clínicas utilizadas habitualmente. Estratificado en terciles, permite diferenciar desde el inicio del seguimiento de forma muy clara 3 grupos con diferente probabilidad de fallecimiento, lo que puede ser de ayuda en la toma de decisiones cuando se recomienda el alta a un paciente tras una AEPOC grave.
En conclusión, la limitación para las AVD, especialmente las más básicas, es un predictor independiente de mortalidad tras una AEPOC grave y su inclusión en scores multidimensionales mejora su capacidad predictiva. Estos resultados deben ser validados en estudios multicéntricos y otras poblaciones de pacientes con EPOC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio ha sido financiado mediante fondos obtenidos de las ayudas SEPAR 456/2017, FIS-ISCII PI18/01317 (FEDER) y la una colaboración no condicionada de la empresa Menarini.