La bronquitis plástica (BP) es una entidad rara, infradiagnosticada1-7, caracterizada por la formación de tapones bronquiales obstructivos o cilindros de mucosidad espesa y tenaz que ocasionan el colapso de uno o más lóbulos o incluso de un pulmón completo1,4-7. Los moldes a menudo son expectorados, pero pueden descubrirse en la broncoscopia o encontrarse en el árbol bronquial tras una necropsia4,7. También se denomina «bronquitis fibrinosa», «bronquitis seudomembranosa» o «bronquitis de Hoffman»4,6. Se ha descrito en el asma, la fibrosis quística (FQ), las cardiopatías congénitas cianosantes, las infecciones respiratorias, las bronquiectasias, la aspergilosis broncopulmonar alérgica (ABPA), el dolor torácico agudo en la anemia de células falciformes, la alfatalasemia, etc1,4-7. La patogénesis de BP no se entiende bien1,4. Probablemente existan 2mecanismos para el desarrollo de la BP: 1) lesión de los bronquios o alteración de la función epitelial bronquial secundaria a inflamación o infección, como ocurre, por ejemplo, en el asma, bronquiectasias, FQ, anemia drepanocítica, y 2) deterioro del drenaje linfático pulmonar, como ocurre en las cardiopatías congénitas4,6,8. Presentamos un caso de BP en un paciente con FQ, excepcionalmente documentado en la bibliografía.
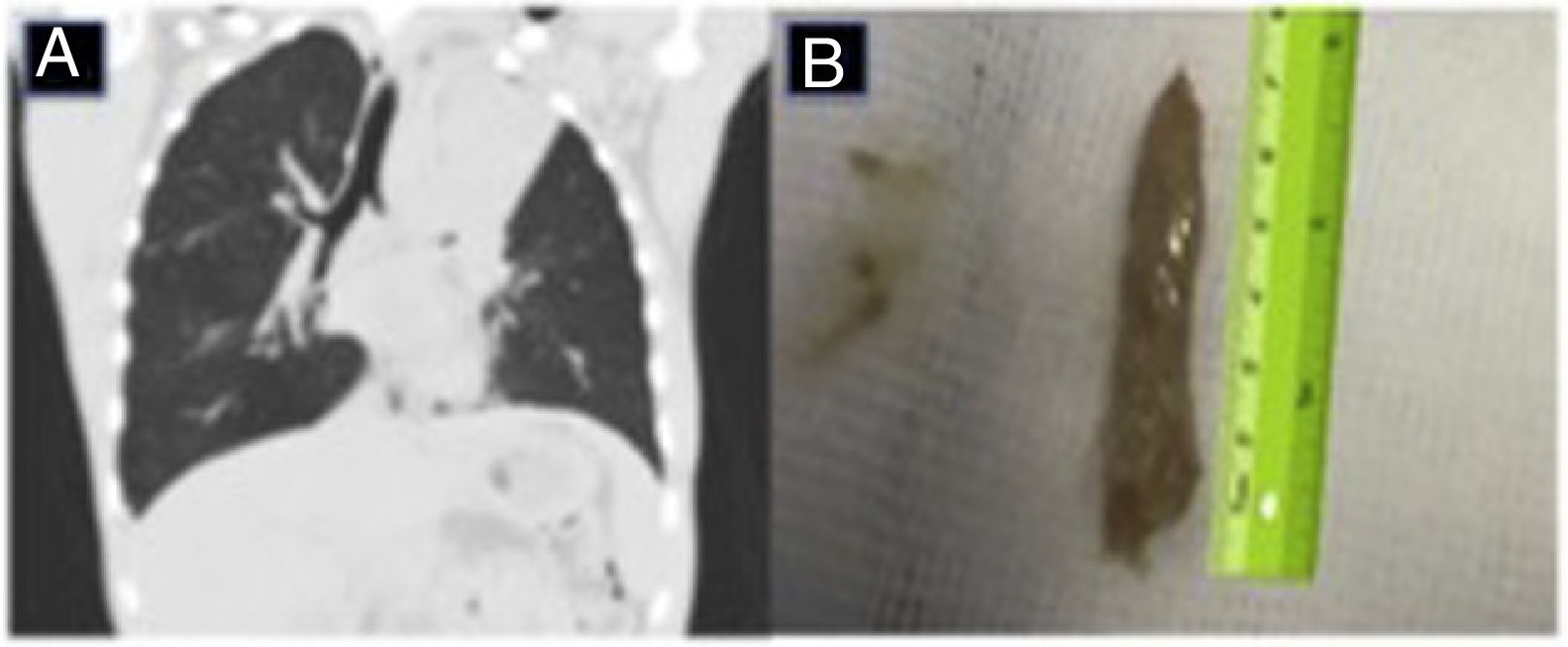
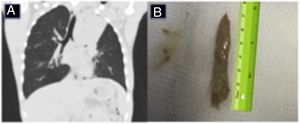
Se trata de un adolescente de 15 años de edad con antecedentes personales de FQ, colonizado crónicamente por Staphylococcus aureus oxacilin sensible, Haemophilus influenzae y Pseudomonas aeruginosa, que ingresa por fiebre de hasta 39°C, astenia, anorexia y dolor torácico en el hemitórax izquierdo. En la radiografía posteroanterior y lateral de tórax se observa una atelectasia de lóbulo superior izquierdo. Se decide ingreso para antibioterapia intravenosa con piperacilina-tazobactam y tobramicina. Se completa el estudio para descartar otras posibles causas de atelectasia asociada a la FQ, destacando la presencia de una IgE total de 2.500 UI/ml y una IgE específica a Aspergillus fumigatus (AF) de 38,80 UI/ml, IgG, precipitinas y prick cutáneos positivos a AF, añadiendo al tratamiento prednisona 60mg cada 24h y voriconazol 200mg cada 12h. Tras 15 días de tratamiento se observa mejoría clínica pero no radiológica, por lo que se decide realizar una tomografía computarizada pulmonar que evidencia la persistencia de la atelectasia completa del lóbulo superior izquierdo y la presencia de molde hiperdenso del árbol bronquial (fig. 1A). Ante estos hallazgos, se decide realizar una fibrobroncoscopia (FBC), donde se evidencia un stop en la entrada de bronquio de lóbulo superior izquierdo debido a la presencia de un gran tapón mucoso. Con fibrobroncoscopio de 4,6mm y aspiración mantenida, se consigue extraer un molde bronquial de 7×1cm (fig. 1B), diagnosticándose de BP. Al mes de la extracción del molde bronquial, tras comprobar mejoría clínica y radiológica, se inicia descenso y retirada progresiva de corticoides.
En la FQ las atelectasias ocurren como resultado de tapones mucosos y enfermedad parenquimatosa severa3. Típicamente, son tratadas con antibioterapia IV e intensificación de la fisioterapia respiratoria3. Cuando no se produce mejoría clínica ni radiológica, como ocurrió en nuestro paciente, debemos pensar en complicaciones tales como la BP. Se han propuesto varias clasificaciones de BP, unas basadas en la histología del molde1,4,9, separando BP inflamatorias y «no inflamatorias» y otra en la etiología asociada1 que define la BP secundaria a una enfermedad concreta o idiopática, cuando se desconoce1. Madsen et al. recomendaron una clasificación basada en la enfermedad asociada e histología del molde, cuando la etiología de la BP no está clara1,8. El tratamiento básico de la BP es sintomático, es decir, mejorar la ventilación alveolar y el aclaramiento mucociliar, y disminuir la inflamación y la carga bacteriana o fúngica1,4,6 en el caso de BP secundaria a infección bronquial o ABPA. El tratamiento tópico del molde bronquial no está bien definido y no hay ninguna recomendación para usar un agente mucolítico u otro1; puede ser difícil de eliminar con una instilación bronquial de suero salino fisiológico o succión broncoscópica1. Los broncodilatadores y mucolíticos pueden desintegrar las secreciones1,5. La DNasa recombinante humana (rhDNAse) se ha utilizado para disminuir la viscoelasticidad del esputo en pacientes con FQ3. En nuestro caso, se instiló rhDNasa bajo visión broncoscópica directa para tratar la BP. El uso de activador del plasminógeno tisular (0,7-1mg/kg cada 4 h) se ha descrito en la BP que ocurre después de intervención de Fontan en niños1,4,5,7,10. También se ha informado de que la heparina inhalada puede ser eficaz7,11 ya que, gracias a sus propiedades antiinflamatorias, puede disminuir la secreción de mucina, prevenir la activación del factor tisular de la vía de la fibrina y atenuar la filtración vascular. Los anticolinérgicos inhalados pueden reducir la formación de moldes y dosis bajas de macrólidos pueden disminuir la producción de mucina al inhibir la activación de la cinasa 1 y 2 y atenuar la severidad de BP7,12,13. En pacientes con anomalías linfáticas, la terapia más efectiva para la BP es la embolización linfática selectiva guiada por resonancia magnética con linfografía6,7. El papel de la FBC puede cuestionarse en nuestro paciente, pero se optó por su realización ante el fracaso del tratamiento médico conservador con antibioterapia IV, corticoides y antifúngicos. Además, la FBC no solo nos permitió diagnosticar la BP e instilar in situ rhDNasa, sino que también nos ayudó a la extracción de los moldes bronquiales, mejorando así la ventilación pulmonar y el aclaramiento mucociliar.
En resumen, el interés de mostrar nuestro caso de BP en un paciente con FQ y ABPA es alertar de esa posibilidad diagnóstica en pacientes con FQ y atelectasia persistente que no mejora con tratamientos habituales, como antibioterapia, antifúngicos y corticoterapia. Deben buscarse y tratarse factores de riesgo, como disminución del aclaramiento mucociliar, inflamación o infección de las vías respiratorias, hipereosinofilia y enfermedad aspergilar. Defendemos el uso precoz de FBC en paciente con FQ y atelectasias persistentes, para ayudar al diagnóstico etiológico, instilación de mucolíticos y para ayudar a la extracción de posibles moldes bronquiales.