En los pacientes con enfermedad pulmonar intersticial difusa (EPID) que presentan datos clínicos y radiológicos inconsistentes es recomendable la realización de una biopsia pulmonar quirúrgica (BPQ). La criobiopsia es una técnica endoscópica reciente menos invasiva que la BPQ que podría jugar un papel relevante en el diagnóstico de las EPID. El objetivo del presente estudio es analizar la rentabilidad diagnóstica, las complicaciones y los costes económicos derivados del uso de la criobiopsia en el diagnóstico de las EPID.
MétodosEstudio observacional retrospectivo en el que se incluyeron pacientes afectados de EPID tributarios de biopsia pulmonar, a los que se les practicaron criobiopsias desde enero de 2011 a enero de 2014. El procedimiento se realizó mediante videobroncoscopio, bajo anestesia general y ventilación mecánica. Se analizó la rentabilidad diagnóstica, las complicaciones producidas y los costes económicos derivados de esta técnica.
ResultadosSe analizaron las muestras de criobiopsia de un total de 33 pacientes. Se obtuvo un diagnóstico específico en 26, lo que representa una rentabilidad diagnóstica del 79%. Cinco pacientes hubieran requerido BPQ para confirmación histológica, aunque en 4 de ellos no pudo realizarse por presentar comorbilidades graves. Las complicaciones más frecuentes fueron el neumotórax (12%) y el sangrado moderado (21%). No hubo complicaciones graves. Considerando que a los pacientes con diagnóstico específico se les evitó una BPQ, la criobiopsia representó un ahorro económico estimado de hasta 59.846€.
ConclusionesLa criobiopsia es una técnica segura y potencialmente útil en el diagnóstico de las EPID que permite, además, un ahorro económico considerable.
Assessment of patients with suspected interstitial lung disease (ILD) includes surgical lung biopsy (SLB) when clinical and radiological data are inconclusive. However, cryobiopsy is acquiring an important role in the ILD diagnostic process. The objective of this study was to evaluate the diagnostic yield, safety and economic costs of the systematic use of cryobiopsy in the assessment of patients with suspected ILD.
MethodsThis was a retrospective observational study of patients who had undergone transbronchial cryobiopsy for evaluation of ILD from January 2011 to January 2014. The procedures were performed with a video bronchoscope using a cryoprobe for the collection of lung parenchyma specimens, which were analyzed by pathologists. Diagnostic yield, complications and economic costs of this technique were analyzed.
ResultsCriobiopsy specimens from a total of 33 patients were included. A specific diagnosis was obtained in 26, producing a diagnostic yield of 79%. In 5 patients, SLB was required for a histopathological confirmation of disease, but the procedure could not be performed in 4, due to severe comorbidities. The most frequent complications were pneumothorax (12%) and gradei (9%) or gradeii (21%) bleeding. There were no life-threatening complications. The systematic use of cryobiopsy saved up to €59,846.
ConclusionCryobiopsy is a safe and potentially useful technique in the diagnostic assessment of patients with ILD. Furthermore, the systematic use of cryobiopsy has an important economic impact.
El diagnóstico diferencial de las enfermedades pulmonares intersticiales difusas (EPID) es un proceso complejo. A menudo requiere un equipo multidisciplinar y la obtención de muestras de parénquima pulmonar utilizando diversas técnicas diagnósticas. Dentro de este grupo de enfermedades, la más frecuente y con peor pronóstico es la fibrosis pulmonar idiopática (FPI)1-3. El diagnóstico diferencial de esta entidad con el resto de las EPID constituye un gran reto.
Las guías internacionales de consenso de diagnóstico y tratamiento de la FPI1,2 señalan que en aproximadamente la mitad de los casos la tomografía computarizada de tórax de alta resolución (TACAR) es suficiente para el diagnóstico de la FPI en un contexto clínico adecuado4,5. En el resto, los criterios radiológicos no son concluyentes y se recomienda la realización de una biopsia pulmonar quirúrgica (BPQ). Esta prueba permite distinguir un patrón de neumonía intersticial usual (NIU) de otras EPID6,7. La biopsia transbronquial (BTB) a través del fibrobroncoscopio (FBS) puede aportar el diagnóstico de algunas EPID8-11. Sin embargo, el uso de esta técnica ha sido desestimado en las guías clínicas1-3. Esto es debido a que la frecuente naturaleza parcheada de las EPID, el pequeño tamaño de la muestra obtenida y su deficiente preservación en ocasiones hacen que la rentabilidad diagnóstica de la BTB no supere el 30%12,13.
Recientemente se ha demostrado que, a diferencia de la BTB convencional, la BTB mediante criosonda (también llamada criobiopsia) es una técnica viable y con mayor rendimiento diagnóstico para la obtención de muestras del parénquima pulmonar, con un número de complicaciones relativamente bajo14,15. La diferencia respecto a una BTB convencional es que permitiría una muestra de mayor tamaño y mejor preservada para el análisis histopatológico16-19. Además, a diferencia de la BPQ, no requiere quirófano y se puede realizar de manera ambulatoria. El papel de la criobiopsia en el algoritmo diagnóstico de la FPI y su diagnóstico diferencial con el resto de las EPID no está definido, y sus potenciales beneficios en el análisis de costes no han sido determinados específicamente.
El objetivo principal del presente estudio ha sido analizar la rentabilidad diagnóstica de la criobiopsia en el diagnóstico diferencial de las EPID. Como objetivo secundario se han analizado las complicaciones y los costes económicos derivados de la aplicación sistemática de la criobiopsia en las EPID.
MétodosPacientesSe trata de un estudio observacional retrospectivo en el que se analizaron los resultados de las criobiopsias pulmonares llevadas a cabo en la Unidad de Endoscopia Respiratoria de un hospital de tercer nivel desde enero de 2011 hasta enero de 2014. Los pacientes habían sido valorados previamente por un comité multidisciplinar de EPID donde se evalúan todos los casos remitidos desde los diferentes servicios del hospital, consultas externas y dispensarios de atención primaria dependientes. Las decisiones clínicas se tomaron por consenso de los miembros del equipo multidisciplinar, constituido por neumólogos, cirujanos torácicos, radiólogos, internistas especializados en enfermedades autoinmunes sistémicas y patólogos.
Se incluyeron los pacientes con un patrón de EPID en TACAR definidos como «posible NIU» o «inconsistente con NIU» en los que, de acuerdo con las recomendaciones de las guías de la ATS/ERS1, se requeriría una confirmación histológica. El lóbulo específico donde se realizó la criobiopsia se determinó siguiendo las recomendaciones de los radiólogos que tuvieron en cuenta los criterios de la ATS/ERS1 aplicados para la biopsia pulmonar quirúrgica. En resumen, la biopsia pulmonar debe abarcar un amplio espectro de afectación pulmonar, incluyendo focos de panal, ya que este hallazgo constituye un criterio de NIU. Sin embargo, si hay signos de fibrosis muy severa con apanalamiento muy grosero, la biopsia debe tomarse de áreas con panal menos afectadas, ya que en las áreas más afectadas suelen objetivarse cambios no específicos. Si el pulmón no muestra ningún signo de fibrosis o apanalamiento, debe tomarse muestra de áreas radiológicamente anormales. Siguiendo este esquema, en todos los casos se tomaron biopsias de diferentes subsegmentos del lóbulo diana, y cuando fue posible, de varios lóbulos. Todos los pacientes disponían de hemograma con estudio de coagulación, ecocardiografía y estudio de la función pulmonar que incluía espirometría forzada, determinación de volúmenes pulmonares y capacidad de transferencia de monóxido de carbono. En los pacientes en los que las criobiopsias no fueron diagnósticas se planteó la realización de una BPQ. Todos los pacientes firmaron un consentimiento informado específico para la realización de las criobiopsias.
ProcedimientoLas criobiopsias se realizaron en una sala de exploraciones equipada con monitorización hemodinámica, ventilador y brazo mecánico de radioscopia. El procedimiento se hacía bajo anestesia general utilizando una perfusión de propofol (3-6mg/kg/h) y remifentanilo (0,05-0,1mg/kg/h). Los pacientes eran intubados con un tubo flexible y anillado (Bronchoflex de 7,5mm, Rüsch, Teleflex Medical, Durham, NC, EE.UU.). Este tubo dispone de un canal accesorio que permite la introducción de un catéter con balón de oclusión FogartyTM (4F/5F/6F; Edwards Lifesciences CorporationTM, Irvine, CA, EE.UU.) que se colocaba en la entrada del lóbulo que iba a ser biopsiado y que se inflaba inmediatamente después de realizar la criobiopsia. De esta manera era posible tamponar las posibles hemorragias procedentes de la vía aérea biopsiada. Se utilizó un videobroncoscopio EB-1970K (diámetro externo: 6,2mm, diámetro del canal de trabajo: 2,8mm; Pentax Medical, EE.UU.). Tras la exploración del árbol bronquial se realizaba un lavado broncoalveolar en la zona seleccionada según las imágenes de la TACAR a aquellos pacientes a los que no se les había practicado previamente. A continuación se procedía a la realización de las BTB mediante criosonda de 1,9mm (Erbokryo CA, Erbe, Alemania) bajo control fluoroscópico, dirigiéndose a los segmentos previamente elegidos. La criosonda se introducía por el canal de trabajo del broncoscopio y, una vez confirmada la correcta posición mediante control fluoroscópico, se activaba el pedal de la criosonda durante 3-4s. Posteriormente se procedía a retirar la sonda junto con el broncoscopio, quedando la muestra adherida a la punta de la criosonda. Se tomaron un mínimo de 3 muestras, sin bien el número total de biopsias dependía del tamaño de las mismas, la tolerancia del paciente o las posibles complicaciones. Después de la finalización del procedimiento, y una vez extubado el paciente, se realizaba una radiografía de tórax de control.
Se registraron todas las complicaciones observadas, teniendo en cuenta especialmente el sangrado y el neumotórax. El sangrado pulmonar se clasificó según su gravedad en: gradoi: sangrado leve que no requiere maniobras endoscópicas; gradoii: sangrado moderado que cede en menos de 3min tras la realización de maniobras endoscópicas (oclusión bronquial y/o instilación de suero frío), y gradoiii: sangrado grave que no es posible controlar endoscópicamente, provocando inestabilidad hemodinámica o respiratoria, y que obliga a interrumpir el procedimiento20.
Evaluación histológicaLas muestras se fijaban en formol 4% y se remitían al laboratorio de anatomía patológica, donde se medían antes de su inclusión en parafina. Cada muestra se incluía en un bloque por separado realizándose tinciones de hematoxilina-eosina y tinción de tricrómico de Masson. Las muestras eran evaluadas por un patólogo perteneciente al equipo multidisciplinar con experiencia contrastada en patología respiratoria. La muestra se consideró no diagnóstica cuando dichos hallazgos no permitían establecer un diagnóstico específico. Se consideró muestra no válida cuando no se evidenciaba suficiente cantidad de alvéolos para ser evaluable.
Evaluación en el comité multidisciplinarLos parámetros clínicos, radiológicos y anatomopatológicos fueron revisados por los especialistas que participan habitualmente en el comité multidisciplinar de EPID de nuestro centro. Se consideró muestra diagnóstica aquella cuyos hallazgos histopatológicos permitían establecer el diagnóstico específico de la patología concreta. Una vez obtenido el informe histopatológico, en base a él y a las características clínicas y radiológicas del paciente, los miembros del comité multidisciplinar establecían el diagnóstico definitivo de la patología intersticial que le afectaba.
Análisis económicoPara el análisis de costes se calculó el valor económico de los diferentes procesos diagnósticos en euros. Se utilizaron datos basados en la Ley de tasas y precios públicos de la Generalitat de Catalunya aprobada por el Decreto Legislativo 3/2008 de 25 de junio y la Ley 26/2010 del 3 de agosto, y datos referidos por otros autores del mismo entorno21,22. El coste final por proceso se calculó sumando el coste de los diferentes procedimientos necesarios para alcanzar el diagnóstico definitivo.
Análisis estadísticoLos resultados de las variables cuantitativas se expresaron como media ±desviación estándar. Se utilizaron porcentajes y frecuencias absolutas para las variables cualitativas. El tratamiento estadístico de los datos se realizó con el paquete estadístico SPSS versión 17.0 para Windows® (SPSS, Chicago, IL, EE.UU.).
ResultadosRentabilidad diagnóstica y seguridad del procedimientoDurante el período de estudio, 33 pacientes fueron sometidos a criobiopsia pulmonar para la confirmación de EPID. Las características generales de los sujetos se resumen en la tabla 1. Los aspectos relacionados con la localización de las biopsias, el número de muestras obtenidas y las complicaciones observadas se resumen en la tabla 2. Los lavados broncoalveolares se realizaron en lóbulo medio o língula para evitar dificultades técnicas en la realización de la criobiopsia. En 2 pacientes se biopsió más de un lóbulo pulmonar; en los restantes 31 pacientes las biopsias se realizaron en varios segmentos de los lóbulos inferiores. Se obtuvieron una media de 2,7 biopsias por paciente, con un tamaño medio de 0,4cm (DE±0,17). En 26 pacientes (79%) se obtuvieron muestras de biopsia que se consideraron diagnósticas (fig. 1), en 5 de ellos (15%) las muestras se consideraron no diagnósticas y en solo 2 pacientes (6%) las muestras no fueron válidas. No hubo diferencias significativas en cuanto al tamaño de las muestras diagnósticas y no diagnósticas (0,5±0,19cm y 0,34±0,15cm, respectivamente). En general, no se evidenciaron artefactos por compresión de los alvéolos en las muestras analizadas. En la figura 2 se resume la orientación diagnóstica basada en las imágenes de la TACAR. Los diagnósticos definitivos se obtuvieron a partir de la anatomía patológica de las muestras de las criobiopsias y la deliberación del equipo multidisciplinar. De los 5 pacientes con muestras no diagnósticas, en solo un caso (3%) se realizó biopsia pulmonar quirúrgica que fue diagnóstica (metaplasia peribronquiolar). De los restantes 4 pacientes, 2 casos se diagnosticaron de NINE idiopática teniendo en cuenta fundamentalmente los criterios radiológicos. Dado que estos pacientes presentaban comorbilidades graves que contraindicaban la intervención, la BPQ fue desestimada tras el debate multidisciplinar. Los otros 2 casos presentaban imágenes radiológicas, clínica y hallazgos anatomopatológicos sugestivos de EPID sin poder alcanzar un diagnóstico más preciso, por lo que se diagnosticaron de EPID no filiada. De los 2 pacientes con muestras no válidas, uno de ellos presentaba imágenes radiológicas sugestivas de neumonía organizativa. Dado que la BPQ también estaba contraindicada por comorbilidades graves, se trató con corticoides orales, presentando buena respuesta clínica y radiológica. En el otro caso, también se tuvo en cuenta fundamentalmente la imagen radiológica y la clínica sugestivas de EPID para el diagnóstico final, orientándose como EPID no filiada. En un paciente, a pesar de que presentaba imágenes características de NIU en el TACAR, se le realizó criobiopsia por sospecha clínica de neumonitis por hipersensibilidad. En los pacientes que presentaban una EPID asociada a enfermedad autoinmune sistémica (EAS) se decidió realizar criobiopsias debido a la falta de criterios para un diagnóstico de certeza de EAS. Estos pacientes comenzaron con enfermedad pulmonar y posteriormente presentaron sintomatología extrapulmonar concordante, cumpliendo criterios suficientes para ser diagnosticados de esclerosis sistémica.
Características de los pacientes sometidos a criobiopsia pulmonar
| Características | n (%) o media (rango) |
|---|---|
| Edad, años | 64 (30-79) |
| Sexo | |
| Masculino | 11 (33) |
| Femenino | 22 (68) |
| Tabaquismo | |
| Nunca | 16 (49) |
| Exfumador | 13 (39) |
| Fumador activo | 4 (12) |
| IMC | 29 (22-37) |
| PFR pre-intervención (% referencia) | |
| FVC | 69 (43-103) |
| FEV1 | 73 (49-97) |
| FEV1/FVC | 79 (66-92) |
| TLC | 73 (49-102) |
| DLCO | 50 (23-82) |
| DLCO/VA | 72 (41-94) |
| Oxigenoterapia domiciliaria | 1 (3) |
| Presencia de HTP preintervención | 2 (6) |
DLCO: capacidad de difusión del monóxido de carbono corregida; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; HTP: hipertensión pulmonar; IMC: índice de masa corporal; PFR: pruebas funcionales respiratorias; TLC: capacidad pulmonar total; VA: volumen alveolar.
Características del procedimiento
| Características | n (%) |
|---|---|
| Localización de la biopsia | |
| LID | 24 (73) |
| LII | 7 (21) |
| LII y LID | 1 (3) |
| LII y língula | 1 (3) |
| Número de muestras (mediana, rango) | 2,7 (0-5) |
| Complicaciones | |
| Sangrado leve | 3 (9) |
| Sangrado moderado | 7 (21) |
| Sangrado grave | 0 (0) |
| Neumotórax | 4 (12)a |
LID: lóbulo inferior derecho; LII: lóbulo inferior izquierdo.
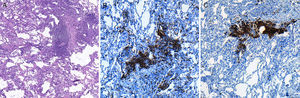
Imagen de microscopia óptica sobre corte histológico de biopsia pulmonar realizada mediante criobiopsia, donde se observa: A)el buen grado de conservación de las estructuras alveolares de la muestra, así como la presencia de infiltrado inflamatorio de predominio linfocitario localizado en el intersticio (hematoxilina-eosina, 40×). B)El estudio inmunohistoquímico muestra la presencia de linfocitosT (marcaje de CD3; 100×) y C)de linfocitosB (marcaje de CD20, 100×). El paciente fue diagnosticado de neumonía intersticial linfocitaria, sin evidencia de linfoma.
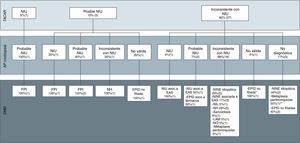
Diagnósticos finales del comité multidisciplinar en base a las imágenes radiológicas, clasificadas según las recomendaciones de las guías de la ATS/ERS de la fibrosis pulmonar idiopática en neumonía intersticial usual (NIU), posible NIU e inconsistente con NIU, y los resultados anatomopatológicos de las muestras realizadas con criobiopsia.
AP: anatomía patológica; DMD: diagnóstico del comité multidisciplinar; EAS: enfermedad autoinmune sistémica; EPID: enfermedad pulmonar intersticial difusa; FPI: fibrosis pulmonar idiopática; LAM: linfangioleiomiomatosis; NH: neumonitis por hipersensibilidad; NIL: neumonía intersticial linfocitaria; NINE: neumonía intersticial no específica; NIU: neumonía intersticial usual; NO: neumonía organizativa; TACAR: tomografía computarizada de alta resolución.
* Por las imágenes radiológicas, la sospecha diagnóstica era de NO.
** El diagnóstico final de metaplasia peribronquiolar se realizó mediante BPQ.
En cuanto a la seguridad de la técnica, se identificaron 4 casos de neumotórax (12%), de los cuales 3 se resolvieron espontáneamente y uno de ellos requirió drenaje torácico durante 2días, siendo dado de alta posteriormente. El 9% de los pacientes presentaron un sangrado gradoi y el 21% un sangrado gradoii. En ningún caso se objetivó un sangrado grave que obligara a suspender el procedimiento ni se precisaron medidas médicas o quirúrgicas adicionales para su control. Aunque 2 pacientes presentaban hipertensión pulmonar ligera como comorbilidad, ninguno de ellos presentó complicaciones.
Análisis de costesSiguiendo el esquema de Leiro Fernandez et al.22 y estableciendo el coste de una FBS en 250,45€, el de la criosonda en 54€ por caso y el análisis histopatológico en 253,69€, el coste total de las criobiopsias realizadas fue de [(250,45€ + 54€ + 253,69€) × 33] = 18.426,54€, lo que representa un total de 304,69€ por paciente. En 26 de los 33 pacientes evaluados la criobiopsia aportó el diagnóstico definitivo de la enfermedad, lo cual evitó la realización de una BPQ. Los costes derivados de esta técnica quirúrgica, tanto si se requiere o no ingreso hospitalario, se resumen en la tabla 3. En el caso de los 3 pacientes que presentaron neumotórax con resolución espontánea el coste añadido fue de 1.458,30€ (486.10€ por paciente). En el caso del paciente que requirió un tubo de drenaje para la resolución del neumotórax, el coste añadido fue de 2.229,98€. De esta manera, el ahorro estimado de utilizar de forma sistemática la criobiopsia pulmonar en la valoración de los pacientes con sospecha de EPID fue: 41.506,74€ − (10.054,77€ + 3.688,28€) = 27.763,69€ en el caso de la BPQ sin ingreso; 57.548,04€ − (10.054,77€ + 3.688,28€) = 43.804,99€ en el caso de realizar un ingreso hospitalario durante 24h, y de 73.589,34€ − (10.054,77€ + 3.688,28€) = 59.846,29€ en el caso de que dicho ingreso se prolongara hasta 48h.
DiscusiónEl presente estudio evidencia que la criobiopsia permite obtener muestras de calidad suficiente como para obtener un diagnóstico específico en la gran mayoría de los casos con sospecha de EPID cuando los hallazgos histológicos se combinan con los datos clínicos, radiológicos y de laboratorio. Además, esta técnica se ha demostrado segura y con un coste económico mucho menor que el de la BPQ, por lo que podría ser una alternativa a considerar en el manejo diagnóstico de estos pacientes.
Se calcula que aproximadamente un tercio de los pacientes con EPID requerirán biopsia pulmonar, si bien solo un 7,5-12% son sometidos a ella3,4,15, lo cual es un reflejo de la reticencia de algunos pacientes y médicos a dicha exploración. Por otra parte, aunque la BPQ permite obtener una muestra idónea para el estudio histopatológico23,24, no está exenta de inconvenientes notables, como es la necesidad de quirófano e ingreso hospitalario en la mayoría de los casos, una disponibilidad limitada y una morbimortalidad no desdeñable25-29. La aparición en los últimos años de la criosonda flexible, que gracias al efecto Joule-Thomson genera muy bajas temperaturas en su extremo distal (alrededor de −85°C), permite obtener muestras de BTB mejor preservadas y de un tamaño significativamente superior al de las BTB con pinzas14,30-33. Babiak et al.16 publicaron por primera vez en 2009 la utilidad potencial de la criobiopsia en las enfermedades pulmonares difusas. Aunque el estudio incluía un grupo muy heterogéneo de pacientes y el objetivo primario no era conocer la rentabilidad diagnóstica, se evidenció que en un número significativo de casos la información proporcionada por la criobiopsia contribuía de forma sustancial al diagnóstico definitivo.
Casoni et al.19 evaluaron 69 pacientes con una neumonía intersticial difusa no definida obteniendo un diagnóstico específico en el 76% de los casos. Además, muy recientemente, Pajares et al.14 evidenciaron, en un estudio aleatorizado que incluía 77 pacientes, que la criobiopsia conseguía diagnósticos específicos en el 74% de los pacientes con enfermedad intersticial, rentabilidad significativamente superior a la obtenida mediante BTB clásica, que es del 34%. En el presente estudio, la rentabilidad diagnóstica fue del 79%, muy similar a la de Casoni et al. y Pajares et al., confirmando la utilidad de la criobiopsia en este grupo de pacientes. De manera interesante, el diámetro de la sonda utilizada en el presente estudio (1,9mm) era inferior al reportado por Casoni et al. y Pajares et al. (2,4mm), y aunque existe evidencia experimental de que el tamaño de la muestra depende, entre otras variables, del diámetro de la sonda, lo cierto es que el número de diagnósticos específicos no parece ser muy diferente cuando se utiliza una u otra sonda30. Además, el número de complicaciones en nuestra serie fue aceptable, siendo lo más destacado la presencia de neumotórax en el 12% de los casos, requiriendo drenaje torácico durante 48h en tan solo un paciente y sangrado moderado en el 20% de los pacientes. El efecto hemostático de la congelación de la criosonda probablemente contribuyera a la baja incidencia de sangrado, que en ninguno de los casos requirió maniobras específicas o la interrupción del procedimiento.
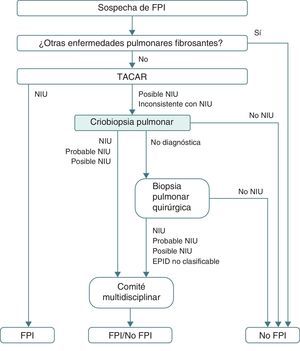
Aunque faltan estudios comparativos respecto a la rentabilidad de la criobiopsia y la BPQ, lo cierto es que la primera parece tener ventajas indudables que deberían hacer considerar su inclusión en los protocolos diagnósticos de las EPID (fig. 3). Además, el presente estudio aporta un aspecto adicional favorable de las criobiopsias respecto a la BPQ, como es el análisis de costes. La realización sistemática de criobiopsias podría permitir un ahorro económico que oscila entre un mínimo de 31.451,97€ (953,09€/paciente) cuando la BPQ se hace de forma ambulatoria y un máximo de 59.846,29€ (1.925,29€/paciente) cuando la BPQ supone un ingreso de 48h, hecho habitual en muchos hospitales de nuestro entorno.
Algoritmo diagnóstico de la fibrosis pulmonar idiopática propuesto tras la incorporación de la criobiopsia de manera sistemática antes de realizar una biopsia pulmonar quirúrgica.
EPID: enfermedad pulmonar intersticial difusa; FPI: fibrosis pulmonar idiopática; NIU: neumonía intersticial usual; TACAR: tomografía computarizada de alta resolución.
Deben considerarse una serie de limitaciones para la correcta interpretación de los resultados. En primer lugar, se trata de un estudio observacional y retrospectivo con un número de pacientes relativamente pequeño que procede de un único centro. En segundo lugar, los pacientes estaban probablemente en una fase inicial de la enfermedad, como evidencian los valores de función respiratoria. Es posible que la rentabilidad de la criobiopsia en pacientes en fases más avanzadas de la enfermedad no fuera la misma. En tercer lugar, la evaluación de las muestras por patólogos con experiencia en patología pulmonar es probablemente fundamental para alcanzar esta rentabilidad diagnóstica. Finalmente, la naturaleza «parcheada» de la mayoría de las EPID podría hacer que el análisis de muestras más amplia cambiara el diagnóstico en algunos casos. Además, las dificultades técnicas para alcanzar los lóbulos superiores podrían interferir también en el diagnóstico.
En conclusión, el uso de la criobiopsia en el algoritmo diagnóstico de las EPID es una alternativa viable y segura para obtener material que permita un diagnóstico anatomopatológico en un alto porcentaje de pacientes. En manos experimentadas, esta técnica evitaría la realización de una BPQ en un gran número de casos, con las implicaciones terapéuticas y económicas que de ello se derivan. Aunque existen todavía numerosos aspectos que deben ser estandarizados, como son el tamaño de la sonda, el tiempo de congelación, el número de biopsias o la localización de las mismas, los resultados obtenidos hacen que deba plantearse el uso de la criobiopsia en el manejo diagnóstico de las EPID. Por ello, son necesarios estudios prospectivos, comparativos, aleatorizados y multicéntricos, con una serie amplia de pacientes bien caracterizados y un protocolo y metodología común debidamente estandarizados, para definir mejor el papel de esta novedosa modalidad en el proceso diagnóstico de las EPID.
FinanciaciónEl presente estudio no ha recibido financiación de ningún tipo.
Contribución de autoresDiseño y realización del estudio: FHG, CL, MS, JR, MJJ, AX, JS, CA. Análisis de datos: FHG, CL, JS, CA. Contribución en la elaboración del manuscrito: FHG, CL, MS, JR, MJJ, AX, JS, CA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Sara Castillo y Maite Simó por su indispensable ayuda en la realización de los procedimientos endoscópicos.