Efectos de la CPAP
El empleo de la presión positiva continua sobre la vía respiratoria, conocido como CPAP, es el tratamiento de elección en el síndrome de apneas-hipopneas del sueño (SAHS) y la evidencia científica es ya, hoy día, incuestionable1-7. Así, en la última actualización de la Cochrane Library de 2002 se establece en sus conclusiones lo siguiente: "La CPAP es más efectiva que el placebo para mejorar la somnolencia y la calidad de vida medidas en pacientes con SAHS. Es más efectiva que los dispositivos orales para mejorar las apneas y las hipopneas"7.
La CPAP fue desarrollada por Colin Sullivan en 19818 y consiste en una turbina que transmite una presión predeterminada a través de una mascarilla nasal adaptada a la cara del sujeto y fijada con un arnés, con lo que se cierra el circuito. De esta forma se produce una auténtica "férula neumática" que trasmite la presión positiva a toda la Vía aérea superior (VAS) e impide su colapso, tanto estático (apneas) como dinámico (hipopneas) durante el sueño. El sistema genera un flujo constante, a través de una turbina, que por medio de un tubo corrugado se transmite a una mascarilla, habitualmente nasal. Teniendo en cuenta el flujo y la fuga se obtiene la presión. De ahí, esta presión se transmite a la VAS y provoca su estabilización y un incremento de su calibre.
La CPAP no actúa provocando ningún reflejo; es simplemente un fenómeno mecánico. La aplicación de la CPAP da lugar a un incremento de la sección de la VAS, con un especial aumento de los diámetros de izquierda a derecha más que de los anteroposteriores. La aplicación de CPAP causa un incremento en la capacidad residual funcional y se ha sugerido que ello podría causar, a su vez, un incremento de los diámetros de la VAS. Obviamente, la aplicación de CPAP modifica la activación de los músculos ventilatorios, en especial los músculos espiratorios, al igual que ocurre con la ventilación a presión positiva.
La CPAP corrige las apneas obstructivas, mixtas y, en no pocas ocasiones, las centrales (muchas de ellas porque, auque aparentemente centrales, son en origen obstructivo), elimina las hipopneas y debe suprimir el ronquido. Evita la desaturación de oxígeno, los despertares electroencefalográficos (arousal) secundarios a los eventos respiratorios y normaliza la arquitectura del sueño. La CPAP produce remisión de los síntomas del SAHS, disminución y/o eliminación de la excesiva somnolencia diurna (ESD) medida con escalas clínicas9,10 y con test de latencia múltiple del dueño1, recuperación de la capacidad de atención entre otras variables cognitivas y mejoría de la calidad de vida9,11-15. Además, el tratamiento con CPAP reduce el riesgo de accidentes de tráfico en los pacientes con SAHS2,16,17 y parece normalizar las cifras de presión arterial (PA) en un porcentaje relevante de sujetos hipertensos con SAHS5,18-23. Incluso se ha sugerido un papel de este tratamiento en la insuficiencia cardíaca24.
La importancia potencial de la CPAP en reducir las cifras de PA en pacientes hipertensos con SAHS es enorme y podría modificar las indicaciones actuales de este tratamiento.
Faccenda et al5 realizaron un estudio en 68 pacientes normotensos con SAHS (IAH medio de 35) a los que se administró de forma aleatorizada y cruzada CPAP o un placebo oral. La CPAP redujo significativamente los valores medios de la PA diastólica (PAD) (79,2 mmHg con placebo frente a 77,8 mmHg con CPAP; p = 0,04) y la PA sistólica (PAS) (133,1 mmHg con placebo frente a 129,1 mmHg con CPAP; p = 0,009). De forma complementaria, el descenso de la PA fue mayor en los pacientes que tenían una mayor desaturación durante el sueño y en los que cumplían más de 3,5 h por noche de tratamiento con CPAP. Estas modificaciones en la PA pueden parecer poco relevantes. Sin embargo, investigaciones llevadas a cabo con medicación hipotensora en sujetos con hipertensión arterial (HTA) sin SAHS han puesto de manifiesto que descensos de 5 mmHg en la PAD se asocian con una disminución del 42% en el riesgo de accidente cerebrovascular y del 14% en el de enfermedad coronaria en los 5 años siguientes25; a los 10 años de seguimiento, esta reducción es de un 31 y un 21%, respectivamente, para las citadas complicaciones. En el estudio de Faccenda et al5 se alcanzaba una reducción de la PAD en los pacientes con hipoxemia nocturna de 5 mmHg, lo que sugería que la CPAP podría estar justificada en estos pacientes debido a esta reducción. El problema es que todos los pacientes eran normotensos. Por tanto, desconocemos si esta reducción de la PA en normotensos tiene el mismo significado que la obtenida en sujetos con HTA.
Pepperrel et al20 estudiaron a 118 pacientes con sospecha de SAHS (puntuación en la escala de Epworth > 9 y con más de 10 desaturaciones por hora) tratados con CPAP en 2 grupos (presión óptima y presión subterapéutica). Los pacientes con presión óptima redujeron su PA media (PAM), medida con MAPA de 24 h, en 2,5 mmHg, mientras que el grupo con presión subterapéutica la aumentó en 0,8 mmHg (p = 0,0013). El beneficio se objetivó en la PAS y la PAD, y tanto de día como de noche. Las diferencias fueron mayores en los pacientes con SAHS más severos y fue particularmente alto en sujetos diagnosticados de HTA. Sin embargo, el hecho de que el número de sujetos con HTA fuera pequeño (22 pacientes) y que el diagnóstico de SAHS se basara en la escala de Epworth y una oximetría no permite elevar las conclusiones a definitivas.
Becker et al21 estudiaron a 32 pacientes con SAHS severo (IAH medio por polisomnografía de 62,5). Se aleatorizó a los pacientes para recibir CPAP óptima terapéutica (n = 16) y subterapéutica (n = 16) durante 9 semanas. La CPAP óptima redujo el IAH en un 95% y la subterapéutica en un 50%. La PA (MAPA de 24 h) se redujo una media de 9,9 ± 11,4 mmHg con la CPAP óptima y no hubo cambios relevantes con la presión subterapéutica (p = 0,01). La PAS y la PAD se redujeron significativamente en torno a unos 10 mmHg, tanto las diurnas como las nocturnas. Sin embargo, en este estudio había sólo 8 pacientes con HTA en el grupo de tratamiento óptimo y 13 en el grupo subterapéutico. En este estudio, de nuevo el número de pacientes estudiado fue pequeño y los autores no comunicaron si la modificación de la PA fue diferente en los pacientes con HTA y los normotensos.
Hla et al22, estudiaron con MAPA a 24 trabajadores (30-60 años) con HTA leve-moderada no tratada. Los pacientes con un IAH > 5 (n = 14) recibieron CPAP terapéutica óptima y los pacientes con un IAH < 5 (n = 10) recibieron CPAP a 5 cm. El tratamiento se mantuvo durante 3 semanas y se comprobó, tras ajustar por la edad y el índice de masa corporal (IMC), que en los sujetos con un IAH > 5 tuvieron una significativa reducción de la PAS y la PAD nocturnas frente a los sujetos con un IAH < 5 (7,8 frente a + 0,3 mmHg; p = 0,02, y 5,3 frente a 0,7 mmHg; p = 0,03, respectivamente). El estudio se realizó en trabajadores con HTA de nuevo diagnóstico y sin recibir tratamiento antihipertensivo. Por primera vez se comprueba que en los pacientes con un IAH anormal la PA se reduce de forma significativa. Los autores no encontraron diferencias significativas en la reducción de la PA diurna, lo que probablemente esté relacionado con el pequeño tamaño muestral y la escasa duración del tratamiento (3 semanas). Asimismo, hubiera sido deseable que, como control, en vez de usar una presión fija a 5 cm, que de por sí tiene algún efecto, hubieran empleado una sham CPAP.
Finalmente, Logan et al23 estudiaron a 11 pacientes con HTA refractaria y un IAH anormal (de 45,3) y comprobaron el efecto del tratamiento con CPAP óptima durante 2 meses. Encontraron una reducción de la PAS de 24 h de 11,0 ± 4,4 mmHg (nocturna de 14,4 ± 4,4 mmHg; diurna de 9,3 ± 3,9 mmHg). La PAD nocturna también se redujo significativamente (7,8 ± 3,0 mmHg). De nuevo, la pequeña muestra estudiada supone una limitación en la aplicación de los resultados.
Cumplimiento de la CPAP
La CPAP no es un tratamiento curativo, lo que implica que su aplicación debe de ser continuada; por ello, obtener un adecuado cumplimiento resulta clave. En Europa, donde la CPAP es sufragada por los sistemas nacionales de salud de financiación pública, con un buen control sobre los pacientes, el cumplimiento es superior al obtenido en las publicaciones norteamericanas26-36. De hecho, se puede afirmar que no hay ningún tratamiento crónico (fármacos, oxigenoterapia, etc.) con un perfil de incomodidad del tipo de la CPAP que tenga cumplimientos tan elevados, por encima del 70% de los pacientes que lo usan al menos 4 h por noche.
No hay forma precisa de establecer a priori el tipo de paciente que cumplirá adecuadamente con el tratamiento y las variables edad, sexo, nivel de instrucción, grado de hipersomnia, severidad de la enfermedad definida con el IAH, desaturación nocturna o presión de CPAP indicada no son buenos indicadores de predicción para un buen cumplimiento. Sin embargo, los pacientes que perciben una mayor mejoría con el tratamiento, con un buen control de los efectos secundarios, son los que presentan un mayor cumplimiento del tratamiento con CPAP34,35. Incluso en un estudio se sugirió que los pacientes diagnosticados con sistemas simplificados podrían tener un cumplimiento peor que aquellos cuyo diagnóstico se efectuó mediante polisomnografía (PSG)36. Sin embargo, lo que subyace a todos estos estudios es que no es posible obtener un buen cumplimiento del tratamiento con CPAP sin un adecuado control y seguimiento del paciente.
Este Documento de Consenso propone que todo paciente en tratamiento con CPAP sea controlado por su especialista/unidad de sueño. Este seguimiento es clave durante los primeros meses. Recomendamos que todo paciente con CPAP sea visitado dentro del primer mes, se continúen las revisiones cada 3 meses durante el primer año, y a continuación con una periodicidad cada 6 meses durante el segundo año. A partir de que se complete el segundo año, las revisiones se harán cada 2 o 3 años. Es imprescindible que haya una coordinación en el seguimiento entre los especialistas/unidad de sueño y los médicos de atención primaria. Asimismo, el paciente será revisado cuando lo requiera su médico de atención primaria por cambios en la sintomatología y/o aparición de efectos secundarios. De forma complementaria, durante el seguimiento, y especialmente durante las primeras semanas de tratamiento, se dispondrá de un sistema de atención inmediata de efectos secundarios y solución de problemas.
Efectos secundarios del tratamiento con CPAP y su solución
La CPAP fue primariamente descrita por Colin Sullivan en 19818, por lo que, aunque es usada por millones de pacientes en todo el mundo, aún es un tratamiento relativamente joven. La CPAP no es un tratamiento cómodo, por lo que es imprescindible tener en cuenta que el mejor sistema de control de los efectos secundarios es una buena relación médico-paciente en la que la indicación del tratamiento sea la correcta y la información al paciente sea suficiente. La aparición de efectos secundarios es frecuente durante las primeras semanas de uso de CPAP. En general serán leves, transitorios y con buena respuesta a medidas locales; por ello, los pacientes deberán ser seguidos estrechamente durante las primeras semanas de tratamiento.
Es importante señalar que una parte considerable de los efectos secundarios se debe a un uso inadecuado de la CPAP y sus complementos. Por tanto, nunca insistiremos lo suficiente en que hay que emplear el tiempo que sea necesario en explicar a los pacientes qué es la CPAP, cómo funciona y cómo debe emplearse, así como qué cosas no son aconsejables. Este tiempo es fundamental para evitar y prevenir muchos de los efectos secundarios.
La CPAP no tiene, en la práctica, contraindicaciones absolutas, salvo la fístula de líquido cefalorraquídeo. Debe ser manejada con precaución en cualquier situación que pueda empeorar por la administración de presión positiva. En todo caso, debe quedar claro que la cirugía por sí misma no es una contraindicación de la CPAP, sino más bien al contrario. Sin embargo, es un tratamiento incómodo, sobre todo las primeras semanas. Cerca del 50% de los pacientes tiene algún efecto secundario con la CPAP, habitualmente de grado leve y con carácter transitorio. Los principales esfectos secundarios son los siguientes:
Congestión y/o obstrucción nasal. La congestión nasal es el más frecuente y el tratamiento depende de la causa que la provoca. Se suele producir por edema e inflamación de la mucosa nasal y con frecuencia cede espontáneamente. Se trata con instilaciones locales o el empleo de corticoides en solución acuosa por vía nasal. El uso de vasoconstrictores nasales no debería utilizarse durante más de 72 h y en general los corticoides o las medidas locales son preferibles.
La obstrucción nasal y/o la rinorrea son dos de los problemas más frecuentes que pueden aparecer o agravarse con la aplicación de la CPAP y, por ende, condicionar su cumplimiento. La evaluación previa a la aplicación del tratamiento con CPAP por parte del ORL puede preverlas y aplicar medidas que reduzcan su aparición e incrementen las tasas de cumplimiento. Estos síntomas pueden producirse por un cuadro de rinitis aguda en el contexto de un cuadro catarral, por lo que el tratamiento de éste de forma sintomática puede conseguir su erradicación. Un problema mayor es su aparición dentro de un cuadro de rinitis crónica, agravado o desencadenado por la aplicación de la presión positiva continua, y en esos casos el tratamiento con corticoides tópicos por vía nasal es útil y pueden administrarse sin problemas durante largos períodos si se considera necesario. Ello puede suponer una reducción significativa o incluso el abandono del tratamiento. Aunque en algunos casos se ha observado que la aplicación de la CPAP puede conseguir una mejora de la obstrucción nasal previa, lo más común es lo contrario. La aplicación tópica de corticoides nasales es absolutamente inocua y puede resolver de forma muy satisfactoria la presencia de obstrucción nasal y la rinorrea mucosa o acuosa. Sin embargo, es altamente recomendable que, si el problema persiste, estos pacientes sean remitidos al especialista en ORL para valorar su tratamiento. Debe descartarse, si no se hizo previamente, la presencia de dismorfias septales, poliposis nasales, rinitis crónica y otras enfermedades que requieran tratamientos más específicos. Es también importante esta evaluación en los casos que precisen tratamientos tópicos nasales con corticoides para resolver su problema, ya que en determinados casos pueden aparecer sequedad nasal secundaria a este tratamiento e incluso epistaxis que compliquen aún más el problema.
Debe tenerse en cuenta que si el paciente presenta una congestión nasal secundaria a un cuadro infeccioso de vías respiratorias altas, lo más probable es que no tolere la CPAP. Con CPAP el paciente debe inspirar y espirar por vía nasal; si esto no es posible porque el paciente tiene una obstrucción nasal, lo intentará por la boca. Sin embargo, es muy frecuente que la propia presión de la CPAP empuje el paladar blando contra la base de lengua, con lo que el paciente se verá impedido para hacer respiración bucal y tendrá que quitarse la CPAP para respirar. Por ello, en estos casos deberá administrarse tratamiento o suspenderse la CPAP durante 1-3 días. A veces es la propia estimulación de los mecanorreceptores por la CPAP lo que provoca congestión nasal.
Se deben evitar fugas de presión en la máscara y eventualmente el paciente puede usar una mentonera para evitar la abertura de la boca, o una mascarilla orofacial. También se pueden emplear, con carácter transitorio, vasoconstrictores nasales, antihistamínicos, solución salina, esteroides tópicos y bromuro de ipratropio en aerosol; otros pacientes requieren humidificador, preferentemente asociado con un calentador (el aire, si no se calienta, no se humidifica). Según la experiencia del GES, en torno al 10% de los pacientes requiere la administración de CPAP a través de un humidificador-calentador.
Las personas con alteraciones nasales crónicas que impiden o dificultan un adecuado tratamiento con la CPAP deberán ser evaluadas por ORL y es una causa frecuente de indicación de cirugía nasal.
Irritación cutánea. Se produce en la zona de contacto con la mascarilla de CPAP. Con las modernas mascarillas es, en general, de escasa importancia y suele ceder con el tiempo al endurecerse la piel. En pieles sensibles se puede proteger con aditamentos, como gasas y otros protectores. En este sentido, el uso de los sistemas de prevención de las úlceras de decúbito puede ser aplicable a la CPAP. Así, sistemas como el config para proteger la zona de contacto y el empleo de geles con clorexidrina (Dexident®) pueden ser de utilidad. En caso de alergia se puede requerir el cambio a otro tipo de mascarilla y a la aplicación de medidas locales. Una opción alternativa para pieles sensibles es usar de manera secuencial 2 o 3 tipos de mascarillas que tengan apoyos en zonas diferentes. De esa manera se va rotando la zona de contacto con la piel y es más tolerable. En todo caso, con el paso del tiempo la piel se va adaptando. Sin embargo, en algunas ocasiones puede ser necesaria la consulta al dermatólogo y/o al alergólogo.
Sequedad faríngea. Suele ceder espontáneamente y es una queja frecuente de los pacientes con SAHS antes de ser tratados y se debe a la pérdida de agua del paladar blando como consecuencia de los ronquidos y las apneas. En estos casos, la sequedad desaparecerá con CPAP. Sin embargo, a veces es el propio flujo aéreo de la CPAP lo que provoca la sequedad faríngea. Si persiste más allá de 4 semanas es necesario ponerse en contacto con la empresa suministradora de CPAP para la instalación de un humidificador-calentador conectado a la CPAP. Aunque algunos estudios han evidenciado un mejor cumplimiento del tratamiento con CPAP cuando se emplea un humidificador-calentador37, en general no es necesario, salvo que el paciente tenga síntomas de sequedad, frío u obstrucción nasal.
Ruido. Especialmente en las primeras semanas, más que del ruido de la CPAP, los pacientes y acompañantes se quejan del cambio de tonalidad entre la inspiración y espiración que se produce en la mascarilla. No tiene un tratamiento especial y precisa la adaptación del paciente y el acompañante. Los modernos equipos de CPAP son muy silenciosos y las actuales mascarillas, bien aisladas, no deberían producir un sonido molesto. Otro punto de ruido es la fuga controlada. En algunos equipos es un simple orificio que genera ruido con armónicos muy altos y desagradables. Los modernos sistemas tienen la fuga dispersa con varios orificios, modulables en dirección, o mediante multiporo. Controlar el tipo y la dirección de la fuga es importante, no sólo para el paciente, sino también para su acompañante de cama, ya que le evita la llegada de "chorros" de aire sobre su rostro o espalda.
Conjuntivitis. En general se produce como consecuencia de la fuga de aire a través de la mascarilla, que impacta sobre la conjuntiva y produce cierto grado de irritación. Suele indicar que la mascarilla está mal ajustada. Desaparece con el adecuado ajuste de la mascarilla por parte del paciente. En las primeras semanas se podrían proteger los ojos con parches oculares de fabricación casera o el simple cierre de éstos con esparadrapo de papel.
Cefalea. No es frecuente. Su origen no está claro y, en general, suele desaparecer con el tiempo. Si el dolor es importante pueden pautarse analgésicos antes de acostarse durante los primeros días.
Epistaxis. Aunque no es muy frecuente, su aparición puede ser muy condicionante y, en determinadas circunstancias, entorpecer la aplicación de CPAP. La mayoría de las veces se origina en la parte anterior de las fosas nasales y su causa más frecuente es la sequedad nasal. El mejor tratamiento es evitar su aparición. Por ello es absolutamente recomendable mantener un ambiente adecuado de humidificación, especialmente en los casos con tendencia a su aparición. La correcta humidificación de la mucosa nasal puede conseguirse mediante un incremento en la ingesta de líquidos, la instilación nasal cuidadosa de suero fisiológico o agua marina, los humidificadores ambientales o directos en la CPAP y evitando calefacciones que resequen el ambiente. Puede ser muy útil la aplicación sistemática de pomadas nasales en los casos de sequedad nasal. La epistaxis puede ser un problema previsible gracias a la evaluación del ORL previa a la aplicación de CPAP, ya que, por ejemplo, determinadas alteraciones de las fosas nasales y el tabique como, por ejemplo, una dismorfia, pueden favorecer su aparición cuando se aplique la presión positiva.
En los casos de epistaxis suficientemente importante por su cantidad o frecuencia es altamente recomendable la evaluación por el especialista ORL, para que realice el tratamiento más adecuado que consiga anular la epistaxis y reducir al máximo los períodos de imposibilidad de aplicar el tratamiento con CPAP. Con relativa frecuencia requiere la cauterización de un pequeño vaso. De no hacerlo puede recidivar y llegar a ser una epistaxis importante.
Frío. Es especialmente importante en las regiones frías y en las casas sin calefacción, donde el aire de la CPAP en invierno puede entrar en la VAS a 15 ºC o menos (la temperatura de sueño recomendable está en torno a los 19 ºC). La solución es aumentar la temperatura de la habitación y/o usar un humidificador-calentador del sistema. Como medida transitoria y "casera" se puede añadir un tubo corrugado a la CPAP (2 m) y hacerlo pasar por el interior de la ropa de cama para que actúe a modo de calentador del aire antes de llegar a la VAS.
Insomnio. En general se produce en algunos pacientes durante la fase de adaptación. No es recomendable el empleo de inductores al sueño por esta causa. Es mejor introducir la CPAP de forma progresiva y favorecer la adaptación. No es imprescindible, ni mucho menos, que el paciente cumpla todas las horas de la noche nada más empezar. Se puede explicar al paciente que vaya aumentando de forma progresiva el número de horas de uso. De todas formas, en pacientes especialmente ansiosos o que se preocupen mucho por el empleo de la CPAP se considera aceptable usar, durante unos días, un ansiolítico o un hipnótico no benzodiacepínico, como zolpiden, zopiclona o zaleplón.
Aerofagia. Es muy poco frecuente. Se produce por la deglución de aire de la CPAP por el paciente al no estar bien adaptado a ella. En general se reduce con la adaptación del paciente y la desaparición de la ansiedad. Sin embargo, en algunos pacientes persiste y genera meteorismo y molestias disgestivas que producen insomnio de mantenimiento. En esos casos se puede utilizar medicación antiflatulencia, pero no suele ser muy eficaz. También se pueden utilizar ansiolíticos e incluso que el paciente duerma con la cama levantada para reducir la deglución aérea. Sin embargo, a veces la única solución es cambiar el tipo de CPAP o mascarilla.
Otros síntomas. La CPAP también puede provocar claustrofobia y favorecer el insomnio o la ansiedad. En ocasiones el paciente percibe la espiración como una exhalación laboriosa con incomodidad torácica. Se han descrito casos aislados de barotrauma y rotura timpánica en relación con la CPAP. También se ha observado, de manera ocasional, enfisema subcutáneo y neumomediastino, por lo que se debe tener especial cuidado en pacientes con antecedentes de neumotórax. Finalmente, y de manera excepcional, se ha descrito algún caso de neumoencéfalo. Por ello deberá prestarse mucha atención en casos con antecedente de traumatismo facial o craneal recientes, especialmente si ha habido antecedentes de fractura de la base del cráneo.
Otro aspecto que cabe señalar es la prescripción de la rampa de presión. Se indica para aumentar la adaptabilidad del paciente a la CPAP en función de un incremento progresivo de la presión hasta alcanzar el grado óptimo a partir de la cual no se producen eventos respiratorios obstructivos. La rampa, por tanto, es en alguna medida un retraso en el tiempo hasta alcanzar la presión eficaz. Su utilización, en ocasiones, en vez de facilitarlo, disminuye el cumplimiento, dado que los pacientes severos tienen latencias muy cortas y una rampa larga les obligará a presentar apneas durante casi todo el tiempo de aumento de la presión. Por tanto, y sobre todo en pacientes graves, no es recomendable el empleo de rampas fijas superiores a 10 min. Lo ideal sería que, pasado un período corto, los pacientes no utilizaran la rampa. Es aconsejable, especialmente en los pacientes graves, emplear rampas inferiores a 5 min. Lo óptimo sería calcular la rampa en función del tiempo de latencia al sueño.
Un tema importante, sobre el que hay mucha menos experiencia, es el referente a qué ocurrirá con la CPAP después de ser usada durante 20 años o más. La experiencia con CPAP se limita, para las unidades de sueño más antiguas, a unos 20 años. Este tiempo, aunque relevante, no es suficiente a la hora de evaluar los efectos secundarios de un tratamiento a largo plazo. La VAS fue diseñada para estar sometida a presión negativa y la CPAP cambia ese principio fisiopatológico introduciendo presión positiva. Desconocemos los efectos a muy largo plazo que esto pueda causar, como una potencial influencia para producir alteraciones en los senos nasales y paranasales que pudieran causar fenómenos de sinusitis crónica o facilitar la aparición de tumores. Por otra parte, la presión de la mascarilla sobre la cara y la zona periodontal podría tener alguna influencia en la génesis de los problemas dentales.
En general, el manejo adecuado de los efectos secundarios es imprescindible y, con una buena relación médico-paciente y medidas locales, se solucionan en su gran mayoría. Sin embargo, la CPAP es un tratamiento que tiene sus problemas. Unos son bien conocidos y fácilmente solventables. Pero desconocemos los efectos reales de la CPAP a largo plazo. Por ello, la indicación siempre debe ser precisa.
El ajuste del nivel óptimo de presión de la CPAP
Preparación del paciente
Cada paciente precisa una presión determinada de CPAP, por lo que ésta debe de adecuarse de un modo individualizado. Sea cual fuere el método elegido para ajustar el nivel de presión de CPAP, en absolutamente todos los pacientes debe haber un paso previo, que consiste en la información y preparación del paciente para recibir la CPAP y su posterior ajuste.
La adecuada preparación del paciente es un aspecto importantísimo que, probablemente, va a definir la futura tolerancia y el cumplimiento del tratamiento con CPAP. Comprende dos apartados fundamentales: el entrenamiento y la educación del paciente en la utilización de la CPAP, y el uso de las mascarillas y el material adecuado para cada paciente.
El SAHS y su tratamiento con CPAP reúne muchos condicionantes para que el cumplimiento sea deficiente. En primer lugar, es un tratamiento de por vida, o al menos indefinido; es, además, una técnica terapéutica que tiene una serie de características que no lo hacen precisamente simple: hace ruido, produce o puede producir molestias nasales e incluso claustrofobia, da lugar en ocasiones a rinitis, lesiones en la región nasal, etc. Por otra parte, en determinados casos el paciente no es consciente de su enfermedad y atribuye sus síntomas (ronquidos, cierta somnolencia, HTA) a sus hábitos personales. Todos estos aspectos deben ser abordados antes de prescribir la CPAP.
Es aconsejable que antes de medir durante la noche el nivel preciso de CPAP para un determinado sujeto se sigan los siguientes pasos: a) explicar de manera amplia a los pacientes las características de su enfermedad, el tratamiento con CPAP y la importancia de seguirlo adecuadamente; b) explicar el aparato de CPAP que se va a utilizar (modo de funcionamiento, utilidad de la rampa, utilidad de la válvula o el sistema que evita la reinhalación, características de la mascarilla y sistema de sujeción), y 3) permitir que se entrene y experimente con la utilización de la CPAP. Sin embargo, no hay un único sistema para llevar a cabo esto y cada unidad de sueño desarrolla su propia escuela de CPAP.
Por la noche, cuando el técnico de sueño que va a hacer el ajuste del nivel de presión de CPAP con una PSG, es conveniente que el paciente ya esté acostumbrado al sistema, bien porque haya practicado en las horas previas (escuela de CPAP) o en los días previos en su domicilio. Esto favorece la adaptación y la tolerancia y evita la realización de una segunda prueba de sueño de ajuste. Es importante que las mascarillas sean adecuadas a las características de cada sujeto. Por ello deben de probarse diversos modelos hasta que los pacientes se sientan cómodos. Hay diferentes mascarillas comerciales que pueden ser utilizadas. Las de tipo "cazoleta", que tapan totalmente la nariz, son las más habituales y, en general, pasados los primeros días son bien toleradas. Las llamadas tipo ADAMSTM son las que están diseñadas de modo que conectan directamente con los orificios nasales sin cubrir por completo la nariz, y ello puede ser útil en los claustrofóbicos o en los pacientes que desarrollan úlceras por presión. Un aspecto trascendental son las fugas, en especial a través de la boca, ya que reducen la eficacia del sistema. En estos casos pueden utilizarse mentoneras, aunque no siempre van bien. Otra posibilidad es utilizar máscaras nasobucales, que son más aparatosas y pueden producir problemas de aerofagia y/o vómitos. La fuga a través de los laterales de la mascarilla puede reducirse utilizando las mascarillas adecuadas y con una buena fijación del sistema. Todos estos aspectos deben haber sido identificados por el técnico de sueño a la hora de aplicar el sistema más adecuado para el paciente.
Una vez que el sujeto está acostumbrado a la utilización de la CPAP debe medirse durante la noche el nivel de presión necesario para eliminar las apneas, las hipopneas, el ronquido, los desfases toracoabdominales, los microdespertares respiratorios y las desaturaciones cíclicas debidas a eventos respiratorios. Con todo ello se consigue una normalización en la arquitectura del sueño y se garantiza que éste sea reparador, con lo que sujeto a los pocos días experimentará, habitualmente, una mejoría espectacular. Hay varios sistemas para adecuar el nivel de CPAP a cada sujeto. El clásico, que no siempre se usa en la actualidad debido a la aparición de las CPAP automáticas, se realiza través de una PSG convencional. Las CPAP automáticas pueden ser muy útiles, siempre que se conozcan sus limitaciones y se tenga experiencia. Además, hay que tener en cuenta y considerar la medición de CPAP en lo que se llama "noche partida" (split-night), las ecuaciones de predicción y la medición domiciliaria. Antes de proceder a describir cada uno de los sistemas mencionados es importante tener en cuenta que, aunque sea muy importante el método empleado para medir el nivel de CPAP, probablemente lo serán mucho más otros aspectos, como: a) la adecuada indicación del tratamiento con CPAP; b) la adecuada preparación del paciente, y c) el correcto control y seguimiento.
Ajuste del nivel de CPAP por polisomnografía convencional
Hasta muy recientemente se recomendaba realizar el ajuste del equipo por medio de una PSG convencional38-40, por lo que, en general, los pacientes con SAHS que iban a ser tratados con CPAP requerirían dos estudios: uno diagnóstico y otro para el ajuste de la CPAP.
La PSG es el mejor método para medir el nivel necesario de CPAP que permita eliminar las apneas, las hipopneas, el ronquido, los desfases toracoabdominales, los microdespertares respiratorios y las desaturaciones cíclicas debidas a eventos respiratorios41. Para ello, en primer lugar, una vez preparado el paciente, se le permite que se duerma con la CPAP colocada a una presión mínima de 4 cm de H2O.
Una vez aparecen los eventos respiratorios claros (apneas, hipopneas, ronquidos o limitaciones prolongadas del flujo aéreo) se sube la presión de CPAP 1 cm de H2O cada 2-5 min (en caso de duda seguir con la misma presión unos cuantos minutos más). En caso que los eventos iniciales sean apneas, habitualmente se observará que éstas se tornan hipopneas y luego habrá períodos prolongados de limitación con o sin ronquidos. En general se tarda unos 30 min en alcanzar una presión subóptima o casi óptima (en algunos casos difíciles o con dudas, el incremento de presión puede durar hasta 2-3 h).
Cuando se alcanza una normalización de los eventos respiratorios se observa si la presión de CPAP es la adecuada en la fase REM del sueño y en decúbito supino. Finalmente, cuando el sujeto ya lleva un buen período con una arquitectura del sueño normalizada y no hay eventos respiratorios (alrededor de 30 min), se reduce la CPAP lentamente centímetro a centímetro (durante 10 min cada centímetro de reducción) para observar si con una menor presión, la CPAP es efectiva (fenómeno de histéresis de la VAS).
Una vez hallada la presión adecuada para el paciente, se observa su evolución hasta la finalización del estudio. A efectos prácticos es importante tener en cuenta una serie de consideraciones: a) durante la medición del nivel de CPAP, para medir el flujo nunca debe utilizarse el termistor; se pueden utilizar diversos métodos, como el swing de la presión de CPAP, la señal procedente del propio aparato de CPAP o, idealmente, un neumotacógrafo colocado entre la mascarilla y la válvula de fuga; b) hay que tener en cuenta que en la fase REM del sueño la respiración puede ser irregular e incluso pueden aparecer periodos de incoordinación, por lo que se debe de ir con mucho cuidado antes de aumentar la presión de CPAP y no confundirlo con las hipopneas, y c) con los modernos sistemas informatizados es posible comprimir y descomprimir la pantalla del ordenador en el sentido de utilizar pantallas de 3 min ya que, de esta manera, la visualización de las señales respiratorias es mucho mejor. Así, el técnico puede utilizar pantallas de 30 s cuando quiera observar las variables neurológicas y de 3 min, por ejemplo, cuando quiera observar las variables respiratorias. De todos ellos, el más recomendable es la medición del flujo mediante un neumotacógrafo, pues el análisis de la amplitud del flujo y su morfología es muy preciso42.
Por último, un aspecto que a menudo no se tiene suficientemente en cuenta es que la noche de ajuste de la CPAP con la PSG es una "noche de trabajo" para el paciente, en la cual a veces se subirá la presión de un modo lento o, en caso de duda, se bajará y se iniciará de nuevo. En consecuencia, el objetivo final es tener una presión adecuada de un modo muy fiable en todas las posiciones y fases del sueño. En la estadificación del estudio polisomnográfico de un ajuste de CPAP puede ser que haya un número elevado de microdespertares y eventos respiratorios que estén causados por los diferentes cambios de presión más que por los eventos respiratorios. Lo mismo podemos decir con los estadios de sueño en los que estos pueden artefactarse, precisamente por ser una "noche de trabajo". Por todo ello, la valoración de la estadificación de sueño debe contemplarse bajo estas consideraciones. No obstante, y a pesar de estas limitaciones, si se ha hecho una buena adaptación y preparación del paciente, lo habitual es observar que la mejor presión es la que obtiene los mejores resultados en cuanto a calidad y cantidad de sueño.
Ajuste del nivel de CPAP mediante polisomnografía en modo noche partida (split-night)
Los estudios de noche partida son una alternativa para evitar la duplicidad que supone hacer una PSG diagnóstica y otra de ajuste. Estos estudios consisten en establecer el diagnóstico en la primera mitad de la noche y ajustar el nivel óptimo de presión de la CPAP en la segunda mitad, con lo que se ahorra un estudio41,43,44. Para aplicar esta técnica se requiere que el período diagnóstico tenga una duración de al menos 2 h de sueño y que el IAH sea de al menos 40, o de > 20 pero con largas apneas o importantes desaturaciones. El período posterior de ajuste de la CPAP debe documentar una disminución importante o la desaparición de los eventos respiratorios durante el sueño no REM y REM, tanto en decúbito lateral como supino. La aplicación de esta técnica, que es especialmente útil en casos con un IAH > 2041,45, es beneficiciosa porque busca que el paciente se adapte apropiadamente a la administración de CPAP y evita problemas de intolerancia que interfieren con la prueba. Diversos estudios han mostrado que tanto la adaptación al tratamiento como su posterior cumplimiento son similares en pacientes evaluados mediante este protocolo de noche partida y en los evaluados en 2 noches separadas46,47.
Un posible inconveniente de los estudios de noche partida reside en que la segunda parte de la noche puede ser insuficiente para un adecuado ajuste de la CPAP, a menos que se prolongue su duración. Es recomendable evaluar los eventos durante las primeras horas de estudio y pasar al tratamiento sólo si los datos sugieren un número de eventos superior a 20/h; en caso contrario se continuará con el estudio basal toda la noche.
Otra indicación actual para los estudios de noche partida sería la de los sujetos que son ingresados en situación aguda en los que hay una fuerte sospecha de SAHS y en los que, sin embargo, no es posible, por la razón que sea, realizar una prueba de sueño que permita confirmar o descartar un SAHS. En esos casos podría estar indicado hacer un estudio de noche partida que evite la realización de una prueba de diagnóstico y otra posterior de ajuste de la CPAP. En estos pacientes no es infrecuente, dada la gravedad de la situación de partida, que el paciente mejore sustancialmente al instaurar el tratamiento con CPAP.
En cualquier caso, esta técnica ha sido validada en muchos trabajos y ha sido reconocida como una técnica con una buena relación coste/eficacia47-49. Así, por ejemplo, el Departamento de Salud Publica de la Universidad de Adelaida (Australia), en una revisión de unos 56.000 estudios PSG la considera una técnica coste-eficaz, con demostrada utilidad según la medicina basada en la evidencia49.
Otro aspecto que se debe tener en consideración es el de los estudios con fines diagnósticos que se realizan por medio de PSG de siestas durante 2-3 h, realizados en casos seleccionados. Son altamente específicos, pero pueden infravalorar la severidad del SAHS50. Los estudios de siesta, como es lógico, tienen los mejores resultados en los pacientes con SAHS más severo51.
Tratamiento del SAHS con auto-CPAP
En recientes publicaciones se ha documentado la posibilidad de titular la CPAP con equipos autoajustables en el domicilio del paciente, denominados auto-CPAP52-55. Aunque hay varios sistemas, los más aceptados son los que modifican la presión en función de la medición de la onda de flujo inspiratorio. La hipótesis de partida en el desarrollo de estos equipos fue que la presión de la CPAP fija, obtenida por ajuste convencional, no representa las necesidades reales del sujeto durante la noche, todas las noches de su vida y en todas las posiciones que utiliza al dormir. Incluso, algunos trabajos han demostrado que la presión de CPAP requerida con ajuste convencional por PSG se reduce con el tiempo, de forma que a los 3 meses de haber iniciado el tratamiento con CPAP, la presión necesaria se reduce en torno a 1,5-2 cm de H2O menos que la prescrita por PSG convencional al inicio del tratamiento56,57. Estos sistemas proporcionan una presión individualizada, dentro de ciertos márgenes, que se adapta a las necesidades del sujeto con la finalidad de suprimir los eventos respiratorios. Disponen en su interior de un neumotacógrafo y un transductor de presión que permiten registrar la presión, el flujo, el volumen y las fugas del sistema. Además, tienen una capacidad de memorización de hasta 200 noches para su comparación y control.
Su mayor inconveniente radica en que, por ahora, tienen un precio más elevado que la CPAP convencional y aún no se ha demostrado que sean superiores al tratamiento con presión fija. Con estos equipos se debería lograr que los pacientes que los emplean a medio-largo plazo cumplan mejor el tratamiento, con menores efectos secundarios, son preferidos por los pacientes y son coste-efectivos. Este estudio aún no se ha realizado; sin embargo, parece evidente que estos sistemas son el futuro en el tratamiento con CPAP58,59.
Las auto-CPAP están potencialmente indicadas en el tratamiento de los pacientes que presentan efectos secundarios con la CPAP a presión fija que no han podido ser corregidos. En estos pacientes parece justificado ensayar el empleo de las auto-CPAP.
Las auto-CPAP como forma de ajustar la presión óptima de la CPAP
Las evidencias más importantes con las auto-CPAP son que estos sistemas pueden ser empleados para ajustar el nivel de CPAP óptima que el paciente necesita52-55. En este sentido, en el último trabajo español realizado por Masa et al55, en el que se estudió a 360 pacientes con SAHS, con un índice de IAH medio de 60, candidatos a recibir tratamiento con CPAP, en un ensayo aleatorizado de grupos paralelo, los resultados del ajuste del nivel de presión de la CPAP mediante PSG no fueron estadísticamente diferentes de los obtenidos con un sistema automático (Autoset-T) o con una fórmula matemática (basada en el IAH, el IMC y el perímetro cervical del paciente) para el ajuste empírico de la presión, aunque el ajuste empírico dejó un 11% de los pacientes con un IAH > 20, frente a un 3% del Autoset-T y un 4% de la PSG. En un 10% de los pacientes, el estudio con Autoset-T tuvo que ser repetido 1 o 2 noches. Este trabajo sugiere que el ajuste de la CPAP probablemente puede realizarse en la mayoría de los pacientes de SAHS con cualquiera de los 3 métodos, aunque debe reseñarse que el ajuste empírico deja un IAH residual relativamente importante en comparación con los otros métodos. Por tanto, este documento recomienda que el ajuste empírico, si se decide su realización, sea considerado un paso provisional en el ajuste de la CPAP, considerando recomendable que el ajuste definitivo sea llevado a cabo con PSG o auto-CPAP validada.
Si se va a ajustar el nivel de presión con auto-CPAP validada, este documento recomienda que se opte por el análisis visual de la gráfica, en vez de por el análisis automático que ofrece el equipo, que es el que ha obtenido los mejores resultados54,55. Nuestra recomendación es que se evalúe la gráfica y se escoja la presión mínima que, sin tener en cuenta los picos de fuga, cubre en torno al 90% de toda la gráfica de presión. En este sentido, deberá tenerse en cuenta que las fugas por encima de 0,4 l/min, si superan más de un tercio de la noche, hacen el registro no válido para el análisis. Asimismo, este documento recomienda que al menos haya 5 h válidas para el análisis54,55. Finalmente, este documento de consenso considera que no todas las auto-CPAP funcionan del mismo modo ni obtienen los mismos resultados60, por lo que la elección adecuada del sistema de auto-CPAP utilizados resulta imprescindible.
Algunos autores han sugerido que el ajuste de la CPAP también es posible llevarlo a cabo con éxito mediante poligrafía respiratoria61. Sin embargo, la Academia Americana del Sueño desaconseja esta opción41,62. Por otra parte, la introducción de las auto-CPAP validadas prácticamente ha descartado la poligrafía respiratoria para su empleo en el ajuste del nivel óptimo de CPAP.
A pesar de los buenos resultados de las auto-CPAP para realizar el ajuste de la presión de CPAP óptima, estos sistemas tienen algunas limitaciones; así, su empleo no es recomendable, al menos por ahora y hasta tener un mayor conocimiento, en pacientes con comorbilidad importante (enfermedades neurológicas, cardíacas, respiratorias, etc.). Debe tenerse en cuenta que las auto-CPAP responden fundamentalmente a la limitación del flujo y el ronquido. En pacientes con comorbilidad severa puede haber episodios de hipoventilación, apneas centrales y otros hallazgos de solapamiento que podrían condicionar una respuesta de la auto-CPAP no totalmente predecible. Por tanto, en esos casos es mejor realizar el ajuste con PSG. De la misma manera, los pacientes con problemas nasales o intolerancia flagrante al equipo de auto-CPAP deberían ser ajustados con PSG. Lo mismo sucede en los casos en que, tras varios intentos de ajuste con auto-CPAP, ésta no haya podido llevarse a cabo de una manera adecuada por fugas o imposibilidad de lectura adecuada de la gráfica de presión. Por tanto, esta situación nos lleva a plantear un nuevo paradigma, y es que los ajustes actuales con PSG son mucho más complejos que en el pasado, cuando se ajustaba a la mayoría de los pacientes con PSG y, en general, era relativamente fácil alcanzar la presión óptima. En la actualidad, los pacientes a los que se les va a ajustar el nivel de CPAP con PSG son especialmente complejos y requieren un técnico de polisomnografía mucho más preparado y entrenado para dedicar toda la atención al paciente durante la noche.
Finalmente, hay que decir que en la década de los noventa se sugirió que, en algunos pacientes que requerían presiones de CPAP especialmente altas, se podría alcanzar una mejor tolerancia con el empleo de sistemas de bipresión63. Estos sistemas alcanzarían la presión necesaria para suprimir los eventos respiratorios en inspiración (presión inspiratoria), que es donde habitualmente ocurren las apneas e hipopneas, y esta presión se reduciría durante la espiración (presión espiratoria), en la que, por lo general, no hay eventos respiratorios. Sin embargo, en estudios posteriores no se consiguió demostrar que el empleo de sistemas de bipresión condicionara un mejor cumplimiento o tolerancia por parte de los pacientes64,65. Hoy día, los sistemas de bipresión, salvo excepciones, desempeñan un papel muy importante en la ventilación mecánica no invasiva, pero prácticamente han desaparecido como indicación en el SAHS.
Indicaciones de la CPAP en el SAHS
A pesar de que hay plena unanimidad de criterio en la decisión de que un paciente portador de un SAHS severo, con sintomatología florida y/o comorbilidad asociada, deberá ser tratado con CPAP como primera opción1-7,66-69, el criterio es menos uniforme y mucho más variable cuando se trata de pacientes con grados de severidad menor o ausencia de sintomatología y/o comorbilidad asociada66-69. De hecho, la evaluación de los diferentes criterios para la prescripción de CPAP difiere de unos países a otros e, incluso, dentro de un mismo país tampoco es uniforme en todas las unidades de sueño. Por tanto, aunque se ha probado que el tratamiento con CPAP tiene una buena relación coste-efectividad70-73 y se ha demostrado que el consumo de recursos sanitarios entre los pacientes con SAHS es más del doble antes de ser tratados que tras recibir tratamiento con CPAP74,75, aún no tenemos completamente resueltas las indicaciones de este tratamiento en todas las situaciones.
En 1998, la Sociedad Española de Patología Respiratoria (SEPAR) elaboró unas recomendaciones para el tratamiento del SAHS68 que pueden resumirse del modo siguiente:
1. En los pacientes con un número elevado de eventos respiratorios durante el sueño (IAH ≥ 30), que presenten somnolencia en una situación activa clínicamente significativa y limitante de las actividades, y/o enfermedad cardiovascular y/o cerebrovascular relevante, o enfermedades que cursen con insuficiencia respiratoria, el tratamiento consistirá en medidas higieno-dietéticas y CPAP. En caso de que presenten alteraciones anatómicas manifiestas en la VAS se considerará la opción quirúrgica. En los casos con indicación de la CPAP, si ésta da lugar a una mejoría clínica evidente, la indicación de tratamiento con CPAP se considerará definitiva. Si se consigue una reducción de peso acusada, se valorará de nuevo al paciente.
2. En los pacientes con un IAH < 30 sin clínica acusada o enfermedad cardiovascular asociada se aconsejarán las medidas higiénico-dietéticas del sueño y control de la evolución.
3. En los pacientes con síntomas claros secundarios a las apneas o hipopneas y/o con enfermedad cardiovascular asociada pero con un IAH < 30, una vez excluidas otras causas de somnolencia (hábitos de sueño inadecuados, toma de medicamentos, ingesta de alcohol, depresión, movimientos periódicos de las piernas, narcolepsia, hipersomnia diurna idiopática, etc.) aparte de las medidas generales, la aplicación de CPAP se individualizará en cada caso. En este grupo, la indicación de CPAP, si así se decide, se llevará a cabo siempre después de una cuidadosa aplicación de las medidas higiénico-dietéticas y se considerará provisional hasta que después de 3 meses se compruebe una resolución manifiesta de los síntomas que pueda ser claramente atribuida a la CPAP. En este grupo podrían incluirse los pacientes portadores de un síndrome de resistencia aumentada de la vía aérea, en el que la prescripción de tratamiento con CPAP dependerá de la asociación con una sintomatología relevante y claramente relacionada con la enfermedad, así como de la comprobación de su control y/o su desaparición con este tratamiento.
4. En los casos con un elevado número de eventos respiratorios durante el sueño (IAH ≥ 30), sin síntomas referidos por el paciente o sus familiares o sin factores de riesgo importantes, en principio, el tratamiento con CPAP no está indicado en la actualidad. Deberá individualizarse y aplicarse sólo en casos muy concretos y, al principio, de un modo provisional.
De forma complementaria, en unas guías clínicas también realizadas en 1998 en las que, además de la SEPAR, también particiaron la Sociedad Española de Neurología y la Sociedad Española de Neurofisiología Clínica69, se plantearon unos criterios de indicación de CPAP superponibles a los mencionados, pero el límite, en vez de ser un IAH ≥ 30 fue un IAH ≥ 20.
Estos criterios de tratamiento con CPAP son, en algunos aspectos, ciertamente restrictivos, por lo que fueron objeto de diversos debates76,77. Por ello, las recomendaciones ya contemplaban la posibilidad de individualizar las situaciones, de forma que el médico responsable pudiera prescribir CPAP a pacientes con menor severidad en el IAH si la sintomatología o la comorbilidad así lo justificaba68,69. Estas recomendaciones se establecieron por consenso de expertos. Sin embargo, en posteriores estudios multicéntricos realizados en la población española pudieron ser refrendadas78,79. De éstos, uno incluye a pacientes asintomáticos78 y 3 a paucisintomáticos79-81.
Barbé et al78 plantearon el problema de tratar o no a los pacientes sin ESD medida por una escala de Epworth < 10 (7 ± 0,4) que, sin embargo, tenían un IAH > 30 (54 ± 3). Aleatorizaron a los pacientes en dos grupos para recibir CPAP efectiva (n = 29) o sham CPAP (n = 25). Tas un seguimiento de 6 semanas no objetivaron diferencias entre los dos grupos en los tests cognitivos, las escalas de somnolencia, el test de latencia múltiple de sueño, el test de calidad de vida y presión arterial medida por Holter de 24 horas. Por tanto, estos autores concluyeron que la CPAP no parecía producir beneficios a corto plazo en pacientes con IAH elevado pero sin síntomas.
Monasterio et al79 se propusieron conocer los beneficios de tratar con CPAP a pacientes con un IAH de 10-30 (20 ± 4) con pocos síntomas determinados mediante la escala de Epworth (13 ± 4). Estudiaron a 125 pacientes (24 mujeres), a los que aleatorizaron para recibir tratamiento higiénico-dietético (n = 59) frente a tratamiento higiénico-dietético más CPAP (n = 66). El cumplimiento de CPAP fue adecuado, con una media de 4,8 ± 2,2 h por día. Los autores no encontraron diferencias entre ambos grupos en cuanto a ESD medida por la escala de Epworth y el test de latencia múltiple de sueño, el test de calidad de vida y los tests cognitivos o las cifras de PA. Sin embargo, se pudo observar que el grupo que recibió CPAP refería sentirse mejor en cuanto a la valoración de una escala clínica que incluía síntomas relacionados con el SAHS.
Barnes et al80 encontraron resultados superponibles al estudiar a un grupo de 28 pacientes (8 mujeres) con un IAH de 5-30 (13 ± 6) y escasa somnolencia medida por la escala de Epworth (11 ± 5). Con una metodología muy similar a la del estudio de Monasterio et al79, estos autores únicamente encontraron mejoría significativa en el tratamiento con CPAP, frente al tratamiento conservador, en una escala de síntomas clínicos.
Engleman et al3,81 tambien estudiaron a sujetos con IAH de 5-15 (10 ± 3 y 11 ± 1) y paucisintomaticos (Epworth 13 ± 3 y 14 ± 1). Estos autores encontraron que los pacientes que recibieron tratamiento con CPAP tuvieron una mejoría significativa en los síntomas y los tests cognitvos frente a los que únicamente recibieron tratamiento conservador.
En una nueva actualización de los conocimientos realizada por la SEPAR en 200282 se mantienen las recomendaciones de 1998 y se confirma la eficacia del tratamiento con CPAP en los casos de SAHS moderados y severos. En esta revisión se mantiene que la eficacia del tratamiento con CPAP en los casos leves es menos clara, por lo que su indicación debería restringirse a los pacientes con más síntomas y, en todo caso, debería individualizarse.
Algunos autores recomiendan tratar con CPAP por encima de un IAH ≥ 30, con independencia de los síntomas o la comorbilidad, basándose exclusivamente en el mayor riesgo de HTA83. Esta asociación con la hipertensión y su potencial reducción con CPAP está bien sustentada por múltiples trabajos de investigación17-19,21-24,84-89. Sin embargo, no sabemos "exactamente" qué significa ese riesgo. Es decir "cuánto vale" ese riesgo y cuál es el potencial valor de la CPAP como prevención en cuanto al desarrollo de HTA. No obstante, es evidente que la asociación entre el SAHS no tratado y la HTA deberá tenerse en cuenta a la hora de tomar la decisión de comenzar el tratamiento. Por otra parte, este riesgo debería considerarse como especialmente elevado en los pacientes que ya tienen SAHS, puesto que en ellos el SAHS actuaría como un factor agravante e incluso mantendría la propia HTA, por lo que el tratamiento con CPAP podría contribuir a su reducción17-19,21-24.
De forma complementaria, en los últimos años se ha encontrado en diferentes estudios que el SAHS está asociado con un mayor riesgo, tanto cardiovascular90-98 como cerebrovascular99,100. Bien es cierto que algunos de estos estudios fueron retrospectivos, las series fueron pequeñas y no todos tuvieron suficientemente en cuenta la influencia de las variables de confusión en sus resultados. Sin embargo, en los últimos años se empieza a acumular un cuerpo de evidencia que sugiere que la presencia de un IAH > 15 y, especialmente, > 30 es un factor de riesgo cardiovascular, con independencia de la presencia de síntomas. Por tanto, considerar la necesidad de tratar a los pacientes con IAH elevado comienza a ser un planteamiento con visos de realidad.
En la misma línea, y aunque aún no conocemos bien la historia natural de la enfermedad, la evidencia acumulada sugiere que hay un exceso de mortalidad asociado al SAHS no tratado100-112. En este sentido, en 2 recientes trabajos aún se pone más de manifiesto que la presencia de un IAH elevado está relacionada con la mortalidad cardiovascular. Así, Gami et al113 estudiaron las PSG y los certificados de defunción de 112 pacientes y encontraron que los sujetos con un IAH > 40 tenían un pico significativo de mortalidad durante las horas de sueño en comparación con los sujetos sin SAHS, y que esta mortalidad se debía a causas cardíacas. Además, pudieron comprobar un efecto dosis-respuesta, de forma que la mayor severidad del SAHS implicaba un mayor riesgo. En otro trabajo relevante realizado por Marin et al114 en Zaragoza se incluyó a un grupo de pacientes varones remitidos a su unidad de sueño por sospecha de SAHS y a una base poblacional, que fue seguida durante 10 años. Los pacientes fueron divididos en roncadores simples (IAH < 5), con SAHS leve-moderado (IAH 5-30) y con SAHS severo (IAH > 30). En los pacientes con un IAH > 30 se recomendó la CPAP, con independencia de los síntomas, y también a los pacientes con un IAH entre 5 y 30 si tenían somnolencia o comorbilidad relevante. Los autores comprobaron que los pacientes con un IAH > 30 que no aceptaron el tratamiento con CPAP tuvieron un aumento significativo del riesgo de presentar episodios cardiovasculares fatales (odds ratio [OR] = 2,87; intervalo de confianza [IC] del 95%, 1,17-7,51) y no fatales (OR = 3,17; IC del 95%, 1,12-7,51). Este trabajo tiene la limitación de no ser un estudio controlado y, por tanto, los sujetos que no aceptaron la CPAP podrían constituir un especial subgrupo que también podría rechazar otras recomendaciones relacionadas con su salud. A pesar de ello, los autores controlaron las potenciales variables de confusión. Por ello, ambos estudios apuntan hacia el hecho de que los pacientes con un IAH elevado deben ser tratados, tengan o no síntomas, al menos en las edades medias y en el caso de los varones.
En esta línea parecen ir las últimas recomendaciones de la Academia Americana de Medicina del Sueño del 200541, en las que acepta la indicación de CPAP para pacientes con índice de alteración respiratoria (IAR) ≥ 15 (que incluye el IAH más los esfuerzos respiratorios asociados a microdespertares), independientemente de los síntomas, y para los pacientes con un IAR ≥ 5 asociado a ESD.
A pesar de estos recientes hallazgos, aún hay algunos aspectos controvertidos. Es muy posible que un IAH y/o un IAR, considerado como anormal a los 30 años, no lo sea a los 80. Todos los estudios han puesto de manifiesto que el SAHS aumenta con la edad, de forma que la prevalencia de un IAH anormal puede triplicarse en los ancianos con respecto a las edades medias114-118. Por otra parte, el significado clínico del aumento del IAH con la edad es incierto100,102,103,115,116,119-126. De hecho, algunos autores119 han planteado que quizá las características clínicas de las apneas-hipopneas durante el sueño en las edades avanzadas sean diferentes de las observadas en las edades medias. Incluso se ha propuesto un modelo relacionado con la edad y otro dependiente de la edad. El primero tendría un pico de incidencia en torno a los 55 años y correspondería a los pacientes con SAHS que habitualmente son diagnosticados y tratados en las unidades de sueño. El modelo dependiente de la edad ocurriría sobre todo en las edades avanzadas y sería menos habitual en las unidades de sueño, aunque podría ser detectado en estudios epidemiológicos, y podría no tener consecuencias clínicas relevantes. Es decir, las apneas-hipopneas durante el sueño detectadas en la población anciana podrían representar a los "supervivientes" de una población previamente "cribada" en las edades medias o ser una consecuencia del propio envejecimiento y tener, por tanto, una menor relevancia clínica.
En un reciente trabajo de Lavie et al127 también se sugiere una reducción del riesgo de muerte por SAHS con la edad. Estos autores evaluaron a 372 pacientes fallecidos que habían sido seguidos previamente durante una media de 4,6 años. Encontraron que los varones < 50 años con un IAH > 30 tenían un significativo aumento del riesgo de muerte en comparación con los varones con IAH ≤ 10. Este riesgo no se observó en los pacientes > 50 años, lo que apoya las teorías previas de que es posible que en esta población el riesgo cardiovascular sea menor que en las edades medias.
A pesar de lo atractivo de estas hipótesis, algunos estudios apuntan que los sujetos de edad también están sujetos a riesgo cardiovascular90,91,94,122,128,129. Por todo ello, a pesar de que las evidencias sugieren que es posible que los pacientes ancianos con apneas-hipopneas durante el sueño puedan diferir, en algunos aspectos, de los observados en sujetos más jóvenes, aún no disponemos de datos concluyentes. Por tanto, este Documento de Consenso recomienda que, aunque el tratamiento con CPAP deba aplicarse con más rigor en las edades medias que en los ancianos, en ningún caso debería negarse este tratamiento a un paciente en el que esté claramente indicado basándose exclusivamente en un criterio de edad.
Otro aspecto controvertido es el relacionado con el SAHS y las mujeres. Apenas estamos conociendo su prevalencia89,130 y aún es mucho mayor nuestra ignorancia sobre sus consecuencias130-133. Así, la mayoría de los estudios sobre los riesgos cardiovasculares del SAHS y su potencial reducción con CPAP se han llevado a cabo en varones, por lo que nuestro desconocimiento sobre el impacto de esta entidad en las mujeres resulta casi escandaloso. De manera generalizada, se han aplicado los mismos criterios de tratamiento que se han recomendado para los varones. Sin embargo, hay muchos aspectos que sugieren que podrían tener un comportamiento diferente, tanto por su influencia hormonal como por no compartir ni responder de la misma forma ante la exposición a los factores de riesgo. Por tanto, este Documento de Consenso no pude pronunciarse con firmeza en cuanto a las indicaciones de la CPAP en mujeres con SAHS. Ante la ausencia de otras evidencias, parece razonable aplicar las indicaciones empleadas en el caso de los varones, pero debemos hacer una llamada de atención a la urgente necesidad de generar conocimiento sobre las consecuencias del SAHS en las mujeres y las indicaciones de tratamiento con CPAP.
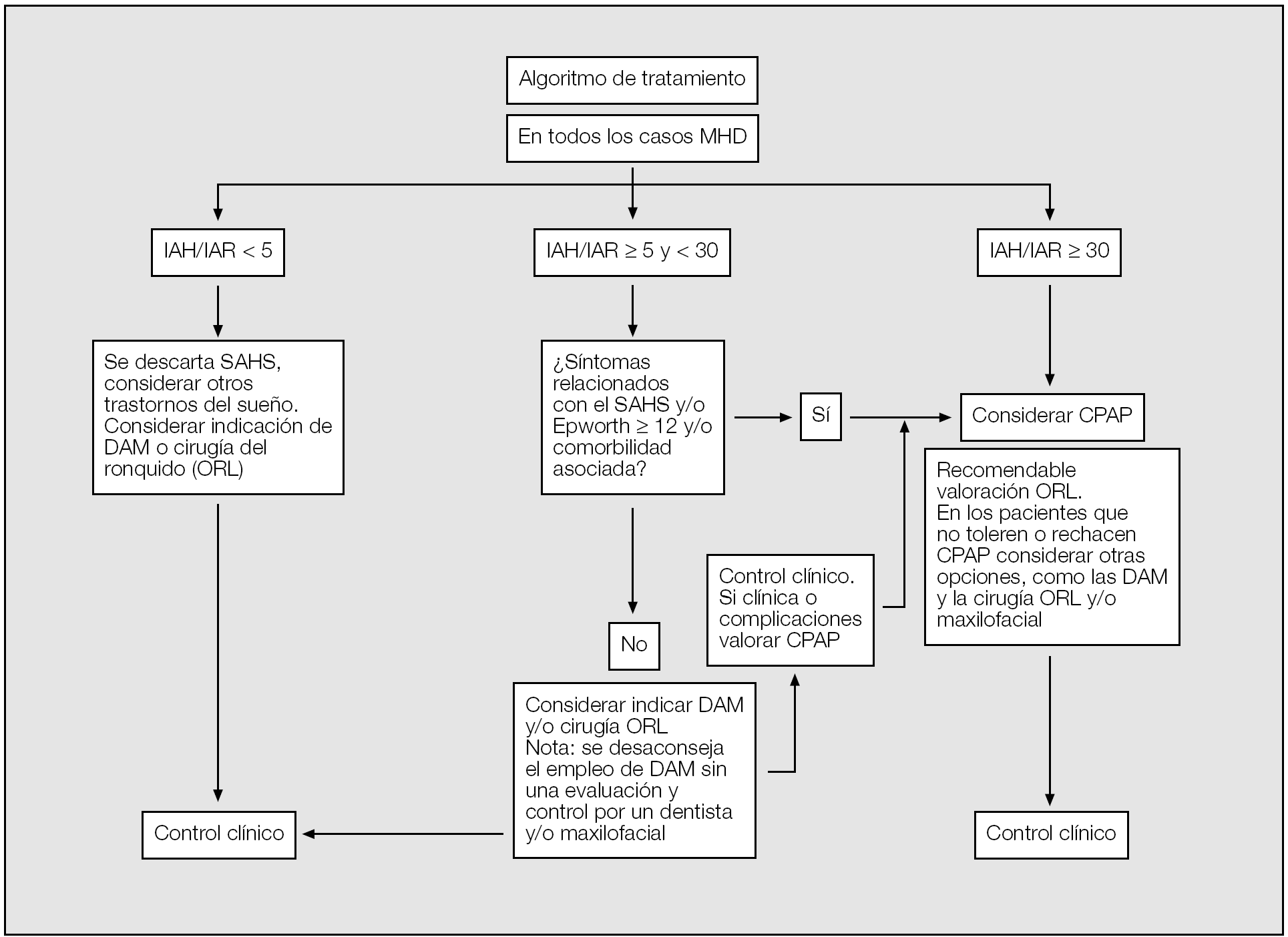
Por tanto, y a modo de conclusión, este Documento de Consenso recomienda las pautas de tratamiento que se describen en la figura 1.
Fig. 1. Algoritmo de tratamiento en el síndrome de apneas-hipopneas del sueño (SAHS). Aunque la evidencia aún no es contundente, este documento de consenso recomienda considerar la prescipción de CPAP en pacientes con un IAH > 30, teniendo en cuenta las premisas del algoritmo.MHD: medidas higiénico-dietéticas; IAH: índice de apneas-hipopneas por hora de sueño; IAR: índice de alteración respiratoria (IAH + número de esfuerzos respiratorios asociados a microdespertares por hora de sueño); DAM: dispositivos de avance mandibular; ORL: otorrinolaringología; CPAP: presión positiva continua en la vía respiratoria superior.
Cada paciente deberá ser indivualizado por el médico prescriptor, especialmente en la población anciana y las mujeres, y todo tratamiento con CPAP no se considerará definitivo hasta pasados 3 meses y tras evaluar al paciente.
Cuándo retirar la CPAP
Como con cualquier tratamiento, si una vez prescrita la CPAP por estar indicada el paciente presentara una franca y probada intolerancia, deberá considerarse su retirada. Siempre tendremos que diferenciar el rechazo de la intolerancia. Nos referimos al rechazo cuando el paciente se niega a aceptar el tratamiento o cuando lo ha intentado durante un período < 4 semanas sin conseguirlo. En estos casos siempre habrá que estar seguros de que se ha insistido lo suficiente, se ha suministrado la información adecuada, se han respondido todas las preguntas del paciente y se han intentado controlar los efectos secundarios. La intolerancia se define cuando el paciente ha intentado usar la CPAP durante más de 4 semanas y, por las razones que sean, no ha conseguido adaptarse a ella. En ambos casos, y si a pesar de reconducir la situación esto no es posible, deberán considerarse otras alternativas terapéuticas, desarrolladas suficientemente en otros apartados de ese documento.
Otra causa bastante frecuente de retirada de la CPAP es el incumplimiento horario. Aunque no hay datos que definan con exactitud el tiempo necesario de sueño en cada individuo, se ha demostrado la eficacia del tratamiento con CPAP en cumplimientos superiores a las 3-4 h/noche. Por ello, este Documento de Consenso considera que, aunque idealmente la CPAP debería emplearse durante todo el período de sueño, el cumplimiento mínimo para aceptar un tratamiento deberá ser > 3,5 h/noche y, sobre todo, que presente una clara mejoría de sus síntomas atribuible al tratamiento con CPAP. Es decir, todo paciente que cumpla menos de 3 h por noche deberá ser considerado un mal cumplidor. En estos casos, y antes de retirar la CPAP, se deberá evaluar al paciente y tratar de detectar posibles causas intercurrentes solucionables. En todo caso, de manera ocasional se ha observado que algunos pacientes que cumplen menos de 3 h por noche refieren, sin embargo, notables mejorías en los síntomas. Estos casos deberán individualizarse por el médico que es, en última instancia, quien deberá decidir si continuar o no con el tratamiendo con CPAP. En estos pacientes con malos cumplimientos horarios con CPAP es importante identificar el problema. En no pocas ocasiones son pacientes que usan la CPAP la mayor parte del horario nocturno, pero sólo 4-5 noches por semana, por lo que la media total será baja. En esos casos, las CPAP que guardan memoria del cumplimiento de más de 200 noches permiten trazar un mejor control del perfil del cumplimiento del paciente. Asimismo debe tenerse en cuenta que las auto-CPAP podrían contribuir a mejorar el cumplimiento en casos seleccionados.
Un aspecto controvertido y, desde luego, no resuelto es qué hacer con el tratamiento con CPAP cuando el paciente se vuelve anciano. Estos casos, aún sólo presentes en las unidades de sueño que llevan funcionando muchos años, se refieren a pacientes en los que, por ejemplo, se prescribió el tatamiento con CPAP cuando tenían 65 años y 15 o 20 años después el paciente ha cumplido ya 80 u 85 años. No es infrecuente que estos pacientes refieran que, tras haber dejado de usar la CPAP unas semanas (viaje, vacaciones, enfermedad, etc.), los síntomas que tenían cuando se indicó la CPAP no reaparezcan e, incluso, que su pareja comente que ya no observa pausas respiratorias durante el sueño. En estos casos, la realización de una PSG puede proporcionar resultados variables, con un IAH que puede no haber cambiado, haber disminuido o incluso haber aumentado. No hay una decisión unánime y no se dispone de ningún estudio en este campo. Es posible que estos pacientes mayores de 80 años sean una cohorte de supervivientes y, por tanto, la necesidad de continuar con CPAP sea menor. Sin embargo, esto no está plenamente demostrado. Por tanto, nuestra actitud ante un paciente anciano de estas características será individualizar la situación y tomar la decisión de común acuerdo con él, teniendo en cuenta su situación clínica y social.
Este Documento de Consenso rechaza absolutamente la práctica de algunas administraciones sanitarias que deciden por su cuenta retirar la CPAP a los pacientes que no son buenos cumplidores del tratamiento. La decisión de retirada de la CPAP, como cualquier otro tratamiento médico, deberá ser llevada a cabo por el médico especialista responsable del paciente. No obstante, es deseable que se produzca una colaboración adecuada entre la administración y el médico responsable del paciente, de manera que éste reciba toda la información referente al cumplimiento del tratamiento y los potenciales efectos secundarios derivados de él.
Se considera imprescindible una colaboración y coordinación entre el médico responsable como prescriptor y seguidor del tratamiento con CPAP, la adminsitación sanitaria como financiadora y reguladora del servicio, y las empresas suministradoras de CPAP como proveedoras de los equipos. Esta colaboración ha sido muy escasa hasta el momento actual. Sin embargo, no se concibe que con el previsible crecimiento exponencial de las prestaciones de CPAP no haya una adecuada colaboración entre todos los estamentos implicados para conseguir el máximo beneficio del paciente.
Financiación de la CPAP
En los últimos años se ha producido un importante aumento del número de CPAP/BPAP, ya que de 8.202 en 1994 se ha pasado a 109.222 en 2003. Esta cifra, aunque sólo alcanza al 5-10% de los pacientes con SAHS relevante, supone un incremento de 13,3 veces con respecto a 1994, con unas tasas de 267 CPAP/ 100.000 habitantes. No obstante, estas cifras aún quedan muy lejos de lo que podría considerarse como una aproximación razonable (el 50% de la población con SAHS clínicamente relevante), que implica entre 1.102 y 2.203 CPAP/100.000 habitantes134.
Este incremento de las prescripciones de CPAP debería verse acompañado de una reflexión profunda sobre su financiación pública. El sistema actual de alquiler a las empresas suministradoras, según el cual 1 año de alquiler equivale al 100% del coste del equipo, no puede ser coste-efectivo, salvo que las empresas se impliquen de una manera directa en el control y el cuidado de los pacientes e, incluso, que ayuden en el proceso diagnóstico, pero siempre trabajando en colaboración con los médicos prescriptores, a quienes compete la decisión final de tratamiento. Otra opción sería un sistema de compra por las autoridades sanitarias o los hospitales, con un contrato de mantenimiento. Sin embargo, esta opción tendría que contemplar soluciones para la sustitución o el envejecimiento de los equipos y ofertar a los pacientes los sistemas más eficaces y confortables. Siendo realistas y conociendo la inercia de la Administración, es muy posible que se continúen adjudicando las empresas suministradoras de CPAP mediante concursos públicos. Sin embargo, en estas adjudicaciones se debería tener en cuenta la opinión técnica cualificada de los profesionales que trabajan en las unidades de sueño, tanto en lo que corresponde a la oferta de equipos y complementos como a las potenciales prestaciones en recursos humanos por parte de las empresas suministradoras. Los especialistas deberían poder elegir el sistema y la prestación.
Otro aspecto importante es que el mercado de sistemas de CPAP, mascarillas, arneses, humidificadores, etc., está en continua renovación y crecimiento. Los equipos actuales son capaces de almacenar y registrar lo que ocurre con el paciente cada noche e, incluso, pueden introducir modificaciones. Asimismo, cada vez son más cómodos, estéticos, ergonómicos, silenciosos y confortables, aunque con un coste mayor. Con los contratos actuales, la mayor parte de las empresas evita la entrega de equipos y complementos costosos, optando por una calidad estándar sobre la que el médico prescriptor tiene escaso control. Sin embargo, si un paciente desea una calidad mayor tiene enormes dificultades para acceder, incluso privadamente, a los nuevos sistemas. Por otra parte, algunas veces esta mayor calidad es necesaria para evitar efectos secundarios y solucionar problemas específicos. No obstante, pretender que los recursos públicos cubran completamente todas las posibilidades del mercado no es posible. Por ello, una aproximación razonable podría ser que el Sistema Nacional de Salud financie una calidad aceptable y suficiente que garantice la salud y que el paciente tuviera la posibilidad, si ése es su deseo, de acceder a calidades superiores abonando las diferencias. Este sistema ya se emplea con otros mercados de gran innovación, como el de las sillas de ruedas. Sin embargo, el especialista, mediante un informe especial, siempre deberá poder prescribir un equipo específico y el sistema público financiarlo cuando esté médicamente justificado.
Otro apartado que debemos denunciar y al que nos oponemos enérgicamente es la existencia, en algunas comunidades autónomas, de los llamados "cupos" de tratamiento con CPAP. Son sistemas cerrados en los que el sistema público financia un "número" pactado de CPAP/año a un precio fijo. Si los médicos prescriben un número superior, las empresas suministradoras no reciben financiación por esos equipos. Este sistema es rechazable a todos los niveles. Es injusto para las empresas, que se ven obligadas a prescribir equipos por los que no perciben ninguna prestación. Es inadecuado para los pacientes que corren el riesgo de recibir equipos, complementos y controles de baja calidad por parte de las empresas. Es desalentador para los médicos, que ven dificultada la prescripción de equipos de CPAP y la obtención de sistemas de alta calidad y, finalmente, es una actitud paradójica por parte de las autoridades sanitarias, que parece más que intentan disuadir la prescripción de las CPAP que favorecerla. Esto resulta asombroso dado que son los principales responsables de la situación actual, en la que la prescripción de CPAP sólo alcanza al 5-10% de los pacientes con SAHS grave.
Otro aspecto relevante es la necesidad de un debate sobre la manera en que las empresas suministradoras de CPAP hacen el control de los pacientes en el domicilio. Es evidente que la administración sanitaria aplica un sistema que se utiliza desde hace décadas en el caso de la oxigenoterapia crónica domiciliaria, en el que las visitas a domicilio están justificadas por tratarse de pacientes con insuficiencia respiratoria crónica y movilidad, en general, muy limitada, así como de edad avanzada en muchos casos. Esta situación nada tiene que ver con los pacientes en tratamiento con CPAP con una edad media de 45-55 años, en general con un buen estado de salud y una vida laboral activa. De hecho, se da la paradoja de que, en los controles domiciliarios, las empresas controlan "máquinas de CPAP" y no a pacientes, dado que éstos están trabajando. Lo mismo podemos decir del hecho de instalar los equipos en los propios domicilios de los pacientes, lo que carece completamente de sentido. El sistema más adecuado debería ser que la instalación y la explicación del tratamiento con CPAP debería llevarse a cabo en las unidades de sueño y/o por los especialistas y deberían ser los pacientes, y no las empresas, quienes se desplacen (al hospital, la consulta o la empresa) para hacer los controles del tratamiento, la sustitución de piezas, las consultas, etc. Este sistema, además de ser más económico, favorece una necesaria corresponsabilidad del paciente en su tratamiento y control.
Quiénes están autorizados a prescribir CPAP
Este Documento de Consenso considera que la prescripción de la CPAP debe ser realizada en una unidad de sueño por los médicos que la integran o por los especialistas que trabajen en coordinación con ella, con objeto de garantizar que se ha llevado a cabo un diagnóstico correcto y una precisa indicación del tratamiento.
Este documento de consenso define una unidad de sueño como una entidad, habitualmente interdisciplinaria, formada por personal especializado y equipos médicos cuyo objetivo es el diagnóstico y el tratamiento de los trastornos del sueño, así como su seguimiento y control.
Por tanto, cualquier médico que trabaje en una unidad de sueño y tenga como actividad profesional el diagnóstico y/o el tratamiento del SAHS está cualificado para prescribir CPAP.
Listas de espera
Las listas de espera constituyen un grave problema de nuestro Sistema Nacional de Salud. En el caso del SAHS, éstas se ven agravadas por una dotación insuficiente de las unidades de sueño, tanto en recursos instrumentales como humanos. Esto condiciona que no sea infrecuente que las listas de espera para recibir un diagnóstico puedan llegar a 1 o 2 años en algunas comunidades autónomas. Esta situación no puede considerarse aceptable desde el punto de vista de la salud pública.
Este documento de consenso, teniendo en cuenta la grave situación en la que están las listas de espera, propone un período transitorio para su solución que no debería ser superior a 2 años. Durante este período transitorio, este documento de consenso considera que las listas de espera no deberían pasar los siguientes límites:
1. Pacientes para ser visitados en la consulta por sospecha de SAHS:
Vía normal: máximo 6 meses.
Vía preferente: máximo 4-6 semanas.
Vía urgente: inferior a 1-2 semanas.
2. Pacientes para realizar una prueba de sueño:
Vía normal: máximo 6 meses.
Vía preferente: máximo 4 semanas.
Vía urgente: máximo 1-2 semanas.
3. Pacientes para la entrega de los resultados de las pruebas:
Vía normal: máximo 3 meses.
Vía preferente: máximo 4-6 semanas.
Vía urgente: máximo 1-2 semanas.
Estos tiempos de espera se consideran como los mínimos aceptables durante el período transitorio, teniendo en cuenta cuál ha sido hasta ahora la realidad sanitaria de nuestro país en lo concerniente a esta enfermedad y la insuficiente capacidad de las unidades de sueño, tanto en número como en dotación. Debe tenerse en cuenta que, con este esquema, un paciente citado por vía normal esperará hasta 6 meses para ser visitado en la consulta, más hasta 6 meses para realizar la prueba de sueño, más hasta un máximo de 3 meses para entrega de resultados. Es decir, se está aceptando hasta un máximo de 15 meses para completar el proceso por vía normal, hasta un máximo de 4 meses por vía preferente y hasta un máximo de 1 mes y medio por vía urgente.
Aunque estos tiempos de espera se consideren los "mínimos aceptables" durante el período transitorio, es evidente que están lejos de ser óptimos. Este documento de consenso, sin embargo, es consciente de que no es posible llevar los tiempos de espera a una situación más adecuada a corto plazo. Por ello, se decanta por un acuerdo de mínimos, teniendo en cuenta la realidad actual, para poder avanzar y que en un período de 2 años se puedan dejar los tiempos de espera en la situación que realmente nos corresponde, considerando el desarrollo del país y la relavancia de la enfermedad. Estas cifras "adecuadas" deberían ser de 2 meses para la evaluación de pacientes nuevos y la realización de pruebas de sueño por vía normal y un plazo no superior a 2 semanas en el caso de los preferente y 1 semana para los urgentes.