La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por dificultad para respirar. El factor genético mejor documentado es la deficiencia de alfa-1 antitripsina (A1AT). La A1AT está codificada por el gen SERPINA1. Se considera que las variantes PiZ (rs28929474) y PiS (rs17580) causan una deficiencia grave de A1AT y que están relacionadas con un alto riesgo de desarrollar EPOC. En este estudio se busca identificar si los polimorfismos genéticos rs28929474 y rs17580 conllevan a la predisposición a la EPOC y su relación con los valores de función pulmonar en la población mestiza mexicana.
MétodosPara el estudio actual se incluyeron 558 fumadores, de los cuales 279 padecían EPOC y 279 no (fumadores sin EPOC [FSE]). Se genotiparon las variantes PiS y PiZ por discriminación alélica. Se evaluó la comparación entre poblaciones independientes y los valores de función pulmonar mediante la prueba de Kruskal-Wallis. Además, se realizó un análisis de regresión logística bivariada.
ResultadosLos pacientes con EPOC en estadio i y iv presentaron diferencias significativas en cuanto a las frecuencias de ambos genotipos heterocigotocigotos en comparación con los FSE. Para PiS, los sujetos con el genotipo heterocigotocigoto AT presentaron una reducción del cociente FEV1/FVC en comparación con los sujetos con el genotipo homocigoto AA (p=0,037). Se detectó una relación significativa entre el valor FEV1/FVC y el genotipo AA para PiS (OR=0,982; coeficiente=–0,019; IC 95%=0,966-0,997).
ConclusionesLos alelos con riesgo de deficiencia de A1AT que causan EPOC son poco frecuentes entre la población mestiza mexicana. Aunque en nuestra población de estudio no tienen relación directa con la predisposición genética a la enfermedad, estos alelos de riesgo se asocian a peores niveles de función pulmonar. Es importante describir con qué frecuencia aparecen estas variantes genéticas de riesgo en otras poblaciones latinoamericanas.
Chronic obstructive pulmonary disease (COPD) is characterized by restricted airflow. The best-documented genetic factor is alpha-1 antitrypsin (AAT). AAT is encoded by the SERPINA1 gene. The PiZ (rs28929474) and PiS (rs17580) variants are believed to cause severe AAT deficiency and are linked to a high risk of developing COPD. This study sought to identify whether genetic polymorphisms rs28929474 and rs17580 are associated with COPD susceptibility and lung function values in a Mexican mestizo population.
MethodsIn this study, 558 smokers were included, of whom 279 had COPD and 279 did not (smokers without COPD - SWC). The PiS and PiZ variants were genotyped by allelic discrimination. Independent populations and lung function values were compared using the Kruskal-Wallis test. A bivariate logistic regression analysis was also conducted.
ResultsStage I and iv COPD patients showed significant differences in the frequencies of both heterozygous genotypes compared to SWC. For PiS, individuals with the heterozygous genotype AT demonstrated a decreased FEV1/FVC ratio compared to subjects with the homozygous genotype AA (P=0.037). A significant association was found between the FEV1/FVC ratio and genotype AA for PiS (OR=0.982, β coefficient=–0.019, 95% CI=0.966-0.997).
ConclusionsCOPD-causing AAT deficiency risk alleles exist at a very low frequency among Mexican mestizo population. Although they are not directly linked in our study population with disease susceptibility, these risk alleles are associated with poorer lung function measurements. It is important to characterize how often these genetic risk variants occur in other Latin American populations.
La Global Initiative for Chronic Obstructive Lung Disease (GOLD) define la enfermedad pulmonar obstructiva crónica (EPOC) como una afección evitable y tratable con efectos extrapulmonares que aumentan su gravedad. El componente pulmonar se caracteriza por limitación al flujo de aire (no es completamente reversible). La obstrucción respiratoria suele ser progresiva y se asocia a una respuesta inflamatoria anómala en el pulmón causada por partículas o gases tóxicos. La EPOC es una enfermedad con varios componentes genéticos, entre los cuales el mejor documentado hasta el momento es la deficiencia de alfa-1 antitripsina (A1AT)1.
La A1AT es una proteína que se sintetiza principalmente en el hígado y se segrega al torrente sanguíneo, aunque también la sintetizan en menor medida los macrófagos alveolares. La A1AT es un importante inhibidor de proteasas, con concentraciones plasmáticas de 120-220mg/dl. Además es la enzima responsable de mantener el equilibrio proteasa-antiproteasa en el pulmón2. De acuerdo con estudios recientes la A1AT tiene actividad antiinflamatoria3, inhibe la expresión genética del TNF4, así como la migración de monocitos y neutrófilos humanos activados in vitro con lipopolisacárido5.
El gen SERPINA1, que codifica la A1AT, se localiza en la banda q32.1 del cromosoma 14. Se transmite de forma codominante autosómica y se caracteriza por un gran número de variantes polimórficas6,7. El grupo de variantes de A1AT se denomina sistema inhibidor de proteasas (sistema Pi). La mayoría de estas variantes carecen de relevancia clínica y solo 30 tienen impacto patológico conocido8. La variante más habitual es PiM, que se considera un «fenotipo normal», puesto que el 90% de los sujetos sanos presentan el genotipo homocigoto (PiMM). Las variantes PiZ (rs28929474) y PiS (rs17580) dan cuenta del 90% de los casos de deficiencia de A1AT. Si se combinan, de estas variantes surgen los fenotipos PiSS, PiSZ y PiZZ. Los 2 últimos se consideran variantes de deficiencia grave y se asocian a concentraciones séricas bajas de proteína y a un alto riesgo de desarrollar EPOC a edad temprana9,10. La variante Z surge de una transición de G por A en el nucleótido 11,940 en el exón 5 del gen SERPINA1, lo que supone la sustitución del ácido glutámico por lisina en la posición 366 de la A1AT y genera una proteína con una función antiproteolítica anómala10,11. La variante S procede de una mutación de A por T en el nucleótido 9,628 en el exón 3, que conlleva la sustitución del ácido glutámico por valina en la posición 288 de la proteína11–13.
El genotipado de las variantes de SERPINA1 clínicamente relevantes no solo servirá para identificar a los sujetos con deficiencia grave de A1AT, sino que permitirá detectar casos con deficiencia intermedia. Este último tipo de deficiencia se ha relacionado también con un deterioro de la función pulmonar14.
En el presente estudio analizamos la frecuencia de los polimorfismos genéticos PiZ (rs28929474) y PiS (rs17580) asociados a la deficiencia de A1AT y su relación con los valores de función pulmonar en una población mestiza mexicana.
MétodosParticipantesSe realizó un estudio prospectivo exploratorio entre noviembre de 2008 y agosto de 2012; se incluyó a 279 fumadores sin EPOC (FSE) de la clínica de ayuda para dejar de fumar y a 279 pacientes con EPOC de la Clínica de EPOC. Ambas unidades pertenecen al Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas (INER) de México. Todos los sujetos eran mayores de 40 años, mestizos mexicanos por ascendencia (padres y abuelos nacidos en México), fumadores o exfumadores de al menos 10 cigarrillos diarios durante 10 años o más, y diagnosticados por neumólogos en la Clínica de EPOC del INER. El diagnóstico se basó en el historial clínico, la exploración física y los datos de la espirometría, teniendo en cuenta los criterios fijados por la Sociedad Torácica Americana (ATS). Se empleó un espirómetro modelo Vmax 2130 (Sensormedics, Yorba Linda, CA, EE. UU.) y se calibró con una jeringa 3-L a 588mmHg de presión (la altitud de Ciudad de México). Se utilizaron los valores calculados por Pérez Padilla15, ya que son ideales para la población mexicana. Para la espirometría posbroncodilatación se administraron 400mg de salbutamol mediante inhalador nebulizado y espaciador. Los técnicos de espirometría habían sido acreditados por el Instituto Nacional de Seguridad e Higiene Laboral de EE. UU. Los fumadores sin EPOC se usaron como control. A partir de los criterios diagnósticos de GOLD, los sujetos de control presentaron un valor FEV1/FVC posbroncodilatación igual o superior al 70%, mientras que los casos de EPOC diagnosticados tuvieron un cociente FEV1/FVC inferior al 70%. Se excluyó a los sujetos diagnosticados de asma bronquial, bronquiectasia, tuberculosis activa, cáncer de pulmón, fibrosis quística, alveolitis alérgica o fibrosis pulmonar idiopática. Se tomó una muestra de 6ml de sangre periférica en tubos con EDTA utilizado como agente anticoagulante. Todos los participantes cumplimentaron un cuestionario sobre datos antropométricos y antecedentes de enfermedades hereditarias. Los sujetos accedieron a participar de forma voluntaria y firmaron un consentimiento informado redactado específicamente para este estudio. El protocolo fue aprobado por los comités de bioética y bioseguridad en ciencia e investigación del INER.
Extracción del ADN genómico y ajuste de la concentraciónSe obtuvieron leucocitos de sangre periférica mediante punción venosa. Se extrajo el ADN genómico con el kit comercial de aislamiento de ADN BDtract (Maxim Biotech, San Francisco CA, EE. UU.). El ADN se cuantificó mediante microespectrofotometría de luz UV a 260nm con el espectrofotómetro ACTGene (ACTGene, Inc., Nueva Jersey, EE. UU.). La contaminación proteica se calculó a 280nm y se consideró que la muestra no presentaba contaminantes si el cociente 260/280 estaba entre 1,7 y 2,0. Se ajustaron todas las concentraciones de la muestra a 25ng/l para su ulterior genotipado.
Genotipado de los alelos PiS y PiZLas muestras se genotiparon por discriminación alélica con sondas comerciales TaqMan en un termociclador 7300 Real Time PCR System (Applied Biosystems, CA, EE. UU.). Para rs17580 (variante PiS) se utilizó una sonda prediseñada por el fabricante (ID: C_594695_20, Applied Biosystems, CA, EE. UU.). Para rs28929474 (variante PiZ) se emplearon las sondas y cebadores diseñados por Bartels et al.11 (se muestran en la tabla 1). Las condiciones para genotipar ambos alelos se optimizaron en el laboratorio. Las condiciones de ensayo de ambas sondas fueron las siguientes: incubación prelectura a 50°C durante 1min, cuantificación absoluta a 50°C durante 2min, seguido de un ciclo a 95°C durante 10min, un ciclo a 95°C durante 15seg y 40 ciclos a 60°C durante 1min; y una incubación poslectura a 50°C durante 1min. Los genotipos se asignaron teniendo en cuenta la discriminación alélica y se confirmaron por cuantificación absoluta. Además, se incluyeron 4 controles sin templado (controles de contaminación) en cada placa de genotipado. Los datos se interpretaron con Sequence Detection Software (SDS v. 1.4, Applied Biosystems, CA, EE. UU.). Para ambos SNP los fluoróforos empleados fueron VIC para el alelo A y FAM para el alelo B.
Análisis estadísticoSe utilizó el programa de estadística SPSS v. 15.0 para Windows para describir la población de estudio y establecer la mediana, el mínimo y el máximo de cada variable. Con EPI Info versión 6.04d se calcularon diferencias significativas entre los valores de frecuencia alélica y genotípica16. Se empleó Haploview 4.2 para evaluar el equilibrio de Hardy-Weinberg (HW) de los polimorfismos y generar el haplotipo17. Las comparaciones entre poblaciones independientes, a partir de los genotipos y los valores de función pulmonar obtenidos, se calcularon con la prueba de Kruskal-Wallis. Además, se realizó un análisis de regresión logística bivariado.
ResultadosLas características de ambos grupos de estudio se resumen brevemente en la tabla 2. Se halló una diferencia estadísticamente significativa al comparar la edad de los fumadores con EPOC con la edad de los fumadores sin EPOC (p<0,05). La representación de género fue homogénea entre los grupos. Al comparar los hábitos de tabaquismo entre los pacientes con EPOC y los FSE, se vio que los pacientes fumaban más cigarrillos y tenían una peor función pulmonar que el grupo de control.
Datos de edad, sexo, hábitos de tabaquismo y función pulmonar para pacientes con EPOC y fumadores sanos (FSE) incluidos en el estudio
| Variables | EPOC (n=279) | FsE (n=279) | p |
|---|---|---|---|
| Edad (años) | 65 (50-88) | 53 (40-83) | <0,05 |
| Sexo | |||
| Varón (%) | 157 (56,6) | 147 (52,7) | 0,396 |
| Mujer (%) | 122 (43,7) | 132 (47,3) | |
| Hábitos de tabaquismo | |||
| Años de fumador | 40 (10-68) | 30 (10-64) | <0,01 |
| Cigarrillos/día | 20 (10-80) | 18 (10-80) | <0,01 |
| Paquetes/año | 39 (5-200) | 24 (5-168) | <0,01 |
| Función pulmonar | |||
| FVC, ref (%) | 77 (22-144) | 96 (52-155) | <0,001 |
| FEV1, ref (%) | 50 (13-144) | 96 (50-162) | <0,001 |
| FEV1/FVC (%) | 52 (16-69) | 84 (71-107) | <0,001 |
Se muestra la mediana y los valores mínimo y máximo.
Las frecuencias genotípicas y alélicas (FG y FA respectivamente) de los polimorfismos rs17580 (PiS) y rs28929474 (PiZ) se muestran en la tabla 3. No se detectó ninguna diferencia estadísticamente significativa ni para los genotipos ni para los alelos al comparar ambos grupos. Los datos genéticos de los polimorfismos estudiados, así como la comparación entre las frecuencias alélicas para ambos SNP aparecen en la tabla 4. La comparación de la FA se realizó entre una población del norte de México,18 3 poblaciones registradas en HapMap19 y nuestro grupo de FSE que representa a los mestizos mexicanos. Para rs17580 el alelo menor se encontró con una FA de 0,05 (5%) en la población caucásica, pero no se detectó en las poblaciones asiáticas o yorubas. Por el contrario, cuando se comparó la población mexicana estudiada por Sánchez-Domínguez18 con nuestro grupo de control se hallaron distintas FA para el alelo T (0,015 vs. 0,037). El rs28929474 estaba presente solo en la población caucásica (FA=0,017, 1,7%) de entre todas las poblaciones estudiadas en HapMap. El alelo menor no se encontró en la población del norte de México previamente registrada, mientras que en nuestro grupo de control, este alelo alcanzó una FA de tan solo 0,002 (0,02%).
Frecuencias genotípicas y alélicas para rs28929474 (PiZ) y rs17580 (PiS) en pacientes con EPOC y fumadores sin EPOC (FSE)
| SNP | EPOC (n=279) | FSE (n=279) | p | OR | IC 95% | ||
|---|---|---|---|---|---|---|---|
| N | FG (%) | N | FG (%) | ||||
| rs28929474 | |||||||
| Genotipo | |||||||
| GG | 273 | 0,978 (97,85) | 278 | 0,99 (99,64) | 0,122* | 0,16 | (0,00-1,37) |
| GA | 6 | 0,021 (2,15) | 1 | 0,003 (0,35) | 0,11 | (0,73-282,03) | |
| AA | 0 | 0 | 0 | 0 | |||
| Alelo | FA (%) | FA (%) | |||||
| G | 552 | 0,989 (98,94) | 557 | 0,998 (99,82) | 0,123* | 0,17 | (0,00-1,37) |
| A | 6 | 0,010 (1,06) | 1 | 0,002 (0,20) | 6,05 | (0,73-278,97) | |
| rs17580 | |||||||
| Genotipo | |||||||
| AA | 251 | 0,899 (89,97) | 258 | 0,924 (92,47) | 0,369 | 0,73 | (0,38-1,37) |
| AT | 28 | 0,100 (10,03) | 21 | 0,075 (7,52) | 1,37 | (0,73-2,61) | |
| TT | 0 | 0 | 0 | 0 | |||
| Alelo | FA (%) | FA (%) | |||||
| A | 530 | 0,949 (94,98) | 537 | 0,962 (96,24) | 0,381 | 0,74 | (0,39-1,37) |
| T | 28 | 0,050 (5,02) | 21 | 0,037 (3,73) | 1,35 | (0,73-2,54) | |
Las frecuencias genotípicas y alélicas se muestran como datos absolutos y porcentuales. Los genotipos GG y AA corresponden a la variante PiM. GA y AA son genotipos que codifican PiZ. AT y TT codifican la variante PiS.
IC: intervalo de confianza; OR: odds ratio.
Comparación de frecuencia del alelo menor entre poblaciones registradas en HapMap, una población del norte de México y nuestro grupo de control
| Variante | SNP | Alelo | FqAM | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Cambio | Ancestral | Menor | CEU | ASIA | YRI | Norte Méxicoa | Mestizos mexicanosb | ||
| PiZ | rs28929474 | A/G | G | A | 0,017 | NR | NR | 0 | 0,002 |
| PiS | rs17580 | A/T | A | T | 0,05 | 0 | 0 | 0,015 | 0,037 |
CEU: caucásico; FqAM: frecuencia del alelo menor; NR: sin registrar; YRI: yoruba nigeriano.
El equilibrio de HW y la formación del haplotipo se establecieron con Haploview 4.2; y se observó que tanto rs17580 como rs28949474 estaban en equilibrio de HW (p=0,7277 y 1,0 respectivamente). En cuanto a haplotipos no encontramos ninguna estructura de haplotipo relacionada entre casos y controles (r2<0,80).
El análisis de asociación genética mostró diferencias estadísticamente significativas entre los estadios GOLD i y iv en pacientes con EPOC para ambos genotipos heterocigotos. Sin embargo, los intervalos de confianza eran amplios e incluían el valor nulo (1,0), específicamente para rs28929474 (PiZ), y la frecuencia heterocigótica era demasiado baja en ambos grupos de estudio (tabla 5). No se hallaron diferencias estadísticamente significativas al comparar los estadios ii y iii (no se muestran datos).
Frecuencias genotípicas de EPOC en pacientes con enfermedad en estadio GOLD I o IV y fumadores de control sin EPOC (FSE)
| SNP | N | FG (%) | N | FG (%) | p | OR | IC 95% |
|---|---|---|---|---|---|---|---|
| rs28929474 | GOLD I (n=30) | FSE (n=279) | |||||
| GG | 28 | 0,933 (93,33) | 278 | 0,996 (99,64) | 0,0257 | 0,05 | 0,00-1,02 |
| GA | 2 | 0,066 (6,66) | 1 | 0,003 (0,35) | 19,86 | 0,98-1175,35 | |
| AA | 0 | 0 | 0 | 0 | |||
| rs17580 | GOLD IV (n=30) | FSE (n=279) | |||||
| AA | 258 | 0,924 (94,47) | 0,0342 | 0,33 | 0,11-1,09 | ||
| AT | 6 | 0,200 (20,00) | 21 | 0,075 (7,53) | 3,07 | 0,92-8,86 | |
| TT | 0 | 0 | 0 | 0 | |||
Nomenclatura de SNP: rs28929474 corresponde a la variante PiZ sérica y rs17580 a PiS. Los genotipos GG y AA corresponden a la variante PiM. GA y AA son gentotipos que codifican PiZ. AT y TT codifican la variante PiS.
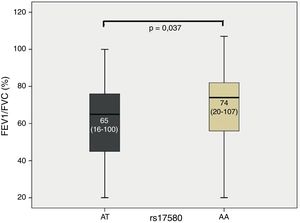
La población de estudio (EPOC y FSE) se dividió en función de los genotipos detectados, dando como resultado sujetos con el genotipo común y sujetos con el genotipo de riesgo para cada SNP. Se empleó la prueba de Kruskal-Wallis para comparar los valores de función pulmonar. Al comparar la mediana FEV1/FVC el genotipo heterocigoto para rs17580 (PiS) mostró un valor p de 0,037 (fig. 1). El diagrama de cajas, que indica la mediana para cada grupo y sus respectivos límites, muestra que los sujetos con el genotipo heterocigoto AT presentaban un cociente FEV1/FVC menor que los sujetos con el genotipo homocigoto AA, que corresponde a la variante PiM sérica. Además, la regresión logística bivariada reveló una asociación significativa entre el valor FEV1/FVC y el genotipo AA para rs17580 (OR=0,982, coeficiente=–0,019: IC 95%=0,966-0,997). Estos resultados sugieren que los genotipos (que no sean AA) son factores de riesgo, ya que el genotipo AA codifica la proteína normal. No encontramos relación alguna con otras medidas de función pulmonar.
DiscusiónLa aparición de EPOC suele ser variable en un contexto de deficiencia de A1AT. Los factores específicos del sujeto, como modificaciones genéticas, probablemente interactúan con factores ambientales y contribuyen al cuadro clínico individual. Nuestro estudio ha sido el primero en evaluar la frecuencia de los 2 principales alelos de riesgo para la deficiencia de A1AT (SERPINA1), PiS (rs17580) y PiZ (rs28929474) en una población mestiza latinoamericana con aportación genética amerindia y caucásica. Estudiamos a 558 fumadores agrupados según su estado de salud como pacientes con EPOC y pacientes sin la enfermedad. Nuestros hallazgos indicaron que la frecuencia de los genotipos de riesgo (homocigotos TT y AA) fue inexistente, mientras que el genotipo heterocigoto PiS (rs17580 AT) se detectó con una frecuencia de hasta el 10% en pacientes con EPOC y el 7,52% en fumadores sin la enfermedad. Por su parte, el genotipo heterocigoto PiZ (rs28929474 GA) se halló en el 2,15% de los pacientes, pero solo en el 0,35% de los controles. Las diferencias en cuanto a la frecuencia de los genotipos de riesgo se debe casi con total seguridad al origen ancestral de cada variable genética.
El tabaquismo es la principal causa de más del 90% de casos de EPOC. Sin embargo, se ha calculado que solo el 10-20% de los fumadores desarrollan la enfermedad, lo que podría deberse a factores genéticos o ambientales que modulan el efecto tóxico de los cigarrillos20. El estudio PLATINO mostró que la prevalencia de EPOC en América Latina varía desde el 5,6% en mujeres mexicanas al 27,2% en varones uruguayos, habiéndose registrado la prevalencia más baja de la enfermedad en México. Una hipótesis atribuye esta diferencia a la altitud sobre el nivel del mar21,22. Sin embargo, la población de Ciudad de México se distingue de la de otras ciudades principalmente por su composición étnica, lo que sugiere que los factores genéticos podrían estar implicados en la baja prevalencia de EPOC observada entre los mexicanos. En este sentido, la deficiencia de A1AT es el factor genético más claramente asociado a la EPOC y aumenta el riesgo de desarrollar enfisema pulmonar en fumadores, especialmente a temprana edad20. Las pautas de la Organización Mundial de la Salud y las sociedades científicas ATS/ERS han indicado explícitamente que es preciso cuantificar la concentración sérica de A1AT en todos los pacientes con EPOC como parte del proceso diagnóstico convencional. También es importante indicar cuándo y cómo se deben realizar otras pruebas diagnósticas de laboratorio, como los análisis de fenotipo o genotipo23. No obstante, para cuantificar la A1AT sérica no puede haber procesos inflamatorios transitorios, ya que podrían alterar las concentraciones.
Se calcula que la deficiencia de A1AT afecta a 100.000 sujetos en Estados Unidos y se han registrado tasas similares en Europa24. Hay al menos 116 millones de portadores (PiMS y PiMZ) y 3,4 millones de sujetos con una combinación de alelos deficientes (PiSS, PiSZ, PiZZ). Asimismo, se ha descrito que la deficiencia de A1AT afecta a sujetos de todos los subgrupos raciales del mundo25. Sin embargo, hay pocos datos en cuanto a la frecuencia de estos alelos deficientes en población mestiza mexicana. Por motivos históricos esta población contiene un gran componente genético caucásico, principalmente español26. En este sentido, el uso de clasificaciones raciales o étnicas en medicina ha sido objeto de múltiples estudios27. En la actualidad, las mediciones de la función pulmonar son una de las pocas aplicaciones clínicas en las que se tiene en cuenta la definición de raza (etnicidad) para determinar los parámetros de referencia del estado de salud. Los modelos de predicción de la función pulmonar a partir de la ascendencia han demostrado ajustar mejor los datos que los modelos convencionales28.
Los estudios de mapeo genómico han sugerido que el alelo PiZ surgió en el norte de Europa29,30 y se considera que esta variante existe desde hace 107 a 135 generaciones. El alelo PiS ha existido desde hace 279 a 470 generaciones, y se cree que se originó en la región europea, por su gran incidencia en la península ibérica30,31.
Los bajos niveles de función pulmonar entre los homocigotos PiZ están bien documentados. Sin embargo, el papel de los denominados genotipos de deficiencia intermedia (PiMZ y PiMS) no se ha estudiado con detenimiento. En nuestro estudio encontramos un valor FEV1/FVC (%) menor entre los portadores heterocigotos AT para rs17580 (PiS) que en los sujetos homocigotos AA. Otros estudios han encontrado un efecto similar para el genotipo PiZ. Primero en 200131, y después en 200232, Morten Dahl et al. estudiaron el efecto de los genotipos de deficiencia intermedia en la función pulmonar en una población danesa. Al realizar mediciones espirométricas (FEV1 y FVC) y genotipar los alelos de SERPINA1, estos autores hallaron que los heterocigotos PiSZ presentaban menores cocientes FEV1/FVC que los sujetos sin el genotipo de riesgo (PiMM). Aunque los homocigotos PiZ tenían menores porcentajes de FEV1 y cocientes FEV1/FVC que el resto de genotipos (MS y MZ), la estratificación de los resultados según el nivel de tabaquismo mostró que el deterioro de la función pulmonar en SZ y ZZ vs. MM solo era estadísticamente significativa entre fumadores y exfumadores. Es más, se observó que los sujetos MZ presentaban menor función pulmonar que los pacientes MM, lo que sugiere que el genotipo heterocigoto MZ (rs28929474 GA) solo actúa en ciertos contextos que todavía es necesario establecer. Estos estudios muestran que el genotipo MZ, al compararlo con el genotipo MM, se asocia a un descenso de la función pulmonar en sujetos con EPOC. Además, los genotipos SZ y ZZ se asocian a una obstrucción de las vías respiratorias y a un descenso de la función pulmonar, en especial en los fumadores31.
Es importante que se realice un estudio apropiado de los subgrupos poblacionales para identificar los factores destacados relativos a la prevención y el tratamiento a tiempo de las enfermedades pulmonares asociadas a una deficiencia total o parcial de A1AT, en especial en la EPOC.
ConclusionesLos alelos con riesgo de deficiencia de A1AT que causan EPOC son poco frecuentes entre la población mestiza mexicana. Aunque en nuestra población de estudio no tienen relación directa con la predisposición a la enfermedad, estos alelos de riesgo se asocian a peores niveles de función pulmonar. Es importante describir con qué frecuencia aparecen estas variantes genéticas de riesgo en otras poblaciones latinoamericanas.
FinanciaciónEl presente estudio ha sido financiado parcialmente por el Consejo Nacional de Ciencia y Tecnología (CONACyT) de México, clave FOSIS S0008-87380.
AutoríaDiseño del estudio y ejecución técnica a cargo de GPR, LOJV, RFV; análisis estadístico y redacción del original a cargo de GPR, LOJV, ARV, AC, RHS, FFT, JMRH, RFV.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que manifestar.