Desde la publicación, hace ya 9 años, de la última normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) sobre asma de control difícil (ACD), se han producido avances en los conocimientos de la enfermedad asmática, que hacen necesario realizar una puesta al día de los datos disponibles e incorporarlos tras su análisis en el nivel de evidencia y recomendación más adecuado. Recientemente han aparecido documentos de consenso y guías de práctica clínica (GPC) que abordan este problema. En esta normativa se hará mención explícita a lo que la previa guía de ACD definía como «verdadera asma de control difícil»; es decir, al asma que tras haber verificado su diagnóstico, realizado un abordaje sistematizado para descartar factores ajenos a la propia enfermedad que conducen a un mal control de la misma («falsa asma de control difícil»), y realizar una estrategia de tratamiento adecuado (escalones 5 y 6 de la Guía española para el manejo del asma [GEMA]), no se consigue alcanzar el control: «asma grave no controlada» (AGNC). En esta línea la normativa propone una revisión de la definición, un intento de clasificación de las diferentes manifestaciones de este tipo de asma, una propuesta del abordaje diagnóstico por pasos y un tratamiento dirigido según fenotipo, conjuntamente con un apartado específico sobre este arquetipo de asma en la infancia, con el objetivo de que pueda servir de ayuda a los profesionales sanitarios y repercutir en el cuidado de estos pacientes.
Since the publication, 9 years ago, of the latest SEPAR (Spanish Society of Pulmonology and Thoracic Surgery) Guidelines on Difficult-to-Control Asthma (DCA), much progress has been made in the understanding of asthmatic disease. These new data need to be reviewed, analyzed and incorporated into the guidelines according to their level of evidence and recommendation. Recently, consensus documents and clinical practice guidelines (CPG) addressing this issue have been published. In these guidelines, specific mention will be made of what the previous DCA guidelines defined as «true difficult-to-control asthma». This is asthma that remains uncontrolled after diagnosis and a systematic evaluation to rule out factors unrelated to the disease itself that lead to poor control («false difficult-to-control asthma»), and despite an appropriate treatment strategy (Spanish Guidelines for the Management of Asthma [GEMA] steps 5 and 6): severe uncontrolled asthma. In this respect, the guidelines propose a revised definition, an attempt to classify the various manifestations of this type of asthma, a proposal for a stepwise diagnostic procedure, and phenotype-targeted treatment. A specific section has also been included on DCA in childhood, aimed at assisting healthcare professionals to improve the care of these patients.
El asma constituye un problema de transcendencia global, especialmente el asma grave no controlada (AGNC), principal responsable de su enorme impacto socioeconómico. Por este motivo, es imprescindible que todos los profesionales que atienden a estos enfermos sean conscientes de esta realidad y dispongan de las herramientas oportunas que proporcionen la mejor actuación ante este problema.
El primer obstáculo lo constituye la terminología exacta para denominar a este tipo de pacientes, pues no existe un acuerdo unánime.
«Asma difícil de tratar» se utiliza para referirse a los pacientes con dificultad para alcanzar el control, como consecuencia de una pobre adherencia, técnica inhalatoria inadecuada, exposición alergénica o a desencadenantes y comorbilidades asociadas. El término «asma refractaria o resistente al tratamiento» hace referencia a los sujetos que tras haber confirmado un diagnóstico de asma, identificadas y tratadas las comorbilidades, requieren de un tratamiento con altas dosis de corticosteroides inhalados (CSI) más un segundo fármaco controlador (agonista β2 de acción larga [LABA] y/o corticosteroides sistémicos [CSS]) para prevenir una pérdida del control de la enfermedad, o que permanece sin control a pesar de este, mientras que AGNC incluye pacientes con asma refractaria y aquellos en los que la respuesta al tratamiento de las comorbilidades es incompleta1.
MetodologíaEl método utilizado para el desarrollo de esta normativa ha seguido las recomendaciones SEPAR para su elaboración. Todas las citas utilizadas por los diferentes autores, expertos en asma grave, se han registrado en una base de datos EndNote y catalogado según los niveles de evidencia de acuerdo a las Grading of Recommendations (GRADE)2.
Los trabajos elegidos para la elaboración de esta normativa, tras una búsqueda sistemática, han identificado pocos ensayos aleatorizados controlados que carezcan de un bajo nivel de sesgos, que proporcionarían un efecto directo del nivel de evidencia consistente. La mayoría de las recomendaciones que se sugieren están basadas en evidencias indirectas, proporcionadas por estudios realizados sobre asma persistente moderada y, en un escaso número, por trabajos dirigidos a pacientes con asma grave, lo que aporta niveles de evidencia y recomendaciones imprecisos, si bien todos los trabajos han sido evaluados con la sistemática GRADE para su clasificación.
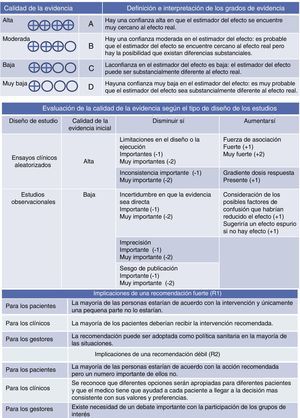
La calidad de la evidencia ha sido categorizada como: alta, moderada, baja y muy baja, basada en las diferentes consideraciones para la existencia de sesgos directos, y dirección, consistencia y orientación de las estimaciones (fig. 1).
DefiniciónEste documento se adhiere a la definición aportada por el consenso ATS/ERS1, que define el asma grave como: «aquella asma que requiere tratamiento con altas dosis de CSI, más una segunda medicación controladora y/o el uso de CSS para prevenir la pérdida de control de la enfermedad, o que permanece sin control a pesar del uso de este tratamiento» (evidencia D-R2). En la tabla 1 se define qué es asma grave mal controlada.
Definición de asma grave para pacientes mayores de 6 años
| El consenso ATS/ERS define el asma grave como el asma que requiere tratamiento por las guías en la práctica clínica en escalones 4 a 5 de la Global Initiative for Asthma (GINA), es decir altas dosis de corticosteroides inhalados y un beta agonista de larga duración, o un modificador de los leucotrienos, o el uso de teofilina durante el año previo, o el uso de corticosteroides sistémicos durante al menos la mitad del año previo o de mayor duración para prevenir la pérdida del control de la enfermedad o que permanece sin control a pesar de este tratamiento |
| El consenso define el asma mal controlada como al menos uno de los siguientes puntos: |
| Pobre control de los síntomas: medida mediante escalas que valoran el control de la enfermedad como el ACT y ACQ. Considerándose un mal control cuándo ACQ >1,5 o ACT≤19 o criterios de mal control de acuerdo a las guías de la práctica clínica como la GINA/National Asthma Education and Prevention Program (NAEPP) |
| Exacerbaciones graves frecuentes: 2 o más exacerbaciones que requieran el uso de corticosteroides sistémicos durante más de 3 días cada una durante el año previo |
| Exacerbaciones que requieran: al menos una hospitalización, ingreso en UCI o necesidad de ventilación mecánica no invasiva durante el año previo |
| Limitación al flujo aéreo: después del uso de un tratamiento broncodilatador adecuado se mantiene un FEV1 menor del 80% del predicho con un cociente FEV1/FVC por debajo del límite inferior de la normalidad (siempre y cuando el mejor FEV1 sea superior al 80%) |
| Asma controlada que empeora al reducir altas dosis de corticoides inhalados o sistémicos o nuevas terapias biológicas |
| Corticoide inhalado | Dosis umbral en μg considerada como alta | |
| Edad de 6-12 años | Edad mayor de 12 años | |
| Beclometasona dipropionato | ≥800 (DPI or CFC MDI)≥320 (HFA MDI) | ≥2.000 (DPI or CFC MDI)≥1.000 (HFA MDI) |
| Budesonida | ≥800 (MDI or DPI) | ≥1.600 (MDI or DPI) |
| Ciclesonida | ≥160 (HFA MDI) | ≥320 (HFA MDI) |
| Fluticasona dipropionato | ≥500 (HFA MDI o DPI) | ≥1.000 (HFA MDI or DPI) |
| Mometasona furoato | ≥500 (DPI) | ≥1.000 (DPI) |
| Triamcinolona acetonida | ≥1.200 | ≥2.000 |
ACQ: Asthma Control Questionnaire; ACT: Asthma Control Test; CFC: clorofluorocarbonos; DPI: inhalador de polvo seco; FEV1: volumen de flujo espirado en 1 segundo; FVC: capacidad vital forzada; GINA: Global Initiative for Asthma; HFA: hidrofluoroalcanos; MDI: inhalador de dosis medida NAEPP: National Asthma Education and Prevention Program; UCI: unidad de cuidados intensivos.
Modificado de ATS/ERS1.
Los datos disponibles sobre la epidemiología del asma grave son dispares, especialmente en adultos, al carecer de estudios bien diseñados que hayan utilizado una definición homogénea. La prevalencia del asma grave varía de un país a otro (18% en Europa occidental, 19% en Estados Unidos y 32% en Europa central)3, estimándose que un 50% de estos pacientes graves tienen un mal control de su enfermedad3. En nuestro país, en un estudio realizado en 2011, la prevalencia del asma grave con mal control según criterio médico fue de un 3,9% del total de asmáticos4 (evidencia C). Además, este pequeño porcentaje es el responsable de un elevado consumo de recursos comparado con el resto de pacientes asmáticos5 (evidencia D-R2).
GenéticaEl asma es un síndrome complejo consecuencia de la interacción de numerosos genes y exposiciones ambientales. Existen pocos estudios relacionados con el asma grave que permitan determinar con precisión qué genes son los responsables para que un individuo sea susceptible de expresar una forma grave de la enfermedad. En la actualidad los estudios del genoma completo (genome wide association approaches [GWAS]) analizan cientos de miles de polimorfismos repartidos por todo el genoma en busca de variantes que estén asociadas a la susceptibilidad de desarrollar un asma grave6 (evidencia C-R2). Mutaciones de polimorfismos de un solo nucleótido (SNP) en el receptor alfa de la interleucina 4 (IL4Rα) se asocian con una peor función pulmonar, niveles más altos de inmunoglobulina E (IgE), exacerbaciones graves del asma e inflamación tisular7 (evidencia C-R2). La variación en el receptor de la IL-6 (IL6R) se relaciona con fenotipos de asma grave y una función pulmonar más baja8 (evidencia C-R2). Otras mutaciones genéticas descritas en conexión con el asma grave se corresponden con alteraciones en los genes implicados en el factor de necrosis tumoral (TNF), y alteraciones múltiples en los SNP localizadas en las regiones RAD50-IL13 del cromosoma 5q31.1 y de la región HLA-DR/DQ del cromosoma 6p21.3 respectivamente9 (evidencia C-R2).
Fenotipos en asma graveLos clínicos han identificado subtipos o perfiles de pacientes con asma, con marcadas diferencias entre sí, constatando que el asma es un síndrome todavía mal categorizado.
Se han realizado diversos estudios que han fusionado variables clínicas objetivas, para intentar agrupar a los pacientes según fenotipos clínicos, o en relación con las bases fisiopatológicas (endotipos)10 que, en el caso del AGNC, tendrá consecuencias terapéuticas (evidencia D-R2).
Estos trabajos comparten el uso de diversas técnicas estadísticas multivariadas y, particularmente, los análisis de grupos (clusters)11–13 (evidencia C-R2). De su lectura global cabe concluir la existencia de al menos 4 fenotipos/endotipos en el asma grave razonablemente bien definidos, atendiendo a la historia natural, patobiología, peculiaridades clínicas y respuesta terapéutica.
Asma alérgica graveEste grupo supone un 40-50% de todos los casos de asma grave. Comienza en la infancia, tiene una clara base atópica y parece ser el resultado de la progresión de un asma alérgica leve-moderada, aunque algunos pacientes presenten ya una forma grave desde su inicio. Dentro de este cluster los más graves son aquellos que presentan un número mayor de pruebas cutáneas positivas o valores más altos de IgE en sangre, los que refieren una historia familiar de asma y una duración más prologada de la enfermedad. Sin embargo, no en todos los pacientes hay un predominio de eosinófilos; de hecho, las formas más graves del fenotipo (considerando función pulmonar, frecuencia e intensidad de los síntomas y el uso de recursos sanitarios) se acompañan de eosinofilia y neutrofilia en el esputo14 (evidencia C-R2).
Desde el punto de vista patobiológico el asma alérgica grave viene orquestada por la activación de las células T helper tipo 2 (Th2), la producción de citocinas específicas, IL 4, IL-5 e IL-13 y el cambio de isotipo en las células B hacia la producción de IgE; si bien hay que señalar que no todas las asmas atópicas tienen un componente Th2 muy activo (endotipo Th2 «alto»). Se ha comprobado que la periostina y la fracción exhalada del óxido nítrico (FeNO) son buenos biomarcadores de esta variante Th2 «alto»15 (evidencia C-R2).
Asma eosinofílica grave de comienzo tardíoSe considera que algo más del 25% de los casos de asma grave pertenecen a este fenotipo, caracterizado por la persistencia de eosinófilos en las biopsias bronquiales y en el esputo inducido, a pesar de un tratamiento con dosis elevadas de CSI o CSS. La cifra de eosinófilos y los niveles de cisteinil-leucotrienos están más elevados que en el asma alérgica grave. De manera general, la enfermedad se manifiesta después de los 20 años, y puede estar precedida de síntomas de rinosinusitis crónica y poliposis nasal. Un subgrupo de estos pacientes desarrolla adicionalmente intolerancia a los antiinflamatorios no esteroideos (AINE), designado con el término «enfermedad respiratoria exacerbada por aspirina» (EREA). La clínica es florida desde el principio, el grado de obstrucción de la vía aérea es notable y las exacerbaciones frecuentes. Además, aunque son menos atópicos que aquellos en los que la enfermedad aparece en etapas más tempranas de la vida, y tienen pocos antecedentes familiares de asma, los niveles de IgE y las determinaciones de FeNO pueden encontrarse igualmente elevados. En su patogenia están implicadas alteraciones en el metabolismo del ácido araquidónico (disminución en la producción de prostaglandina E2 y aumento en la síntesis de cisteinil-leucotrienos), asociados a inflamación aparentemente relacionada con la activación Th215.
Asma no atópica grave del adulto asociada con obesidadConstituido mayoritariamente por mujeres, con un índice de masa corporal elevado y clínica profusa. Comienza en la quinta década de la vida o incluso después. No siempre se detecta eosinofilia en el esputo; presenta exacerbaciones frecuentes, muestra una función pulmonar moderadamente conservada. No se conocen bien sus bases genéticas o su etiopatogenia, ni el papel que desempeñan los factores hormonales, aunque con frecuencia se describe su comienzo tras la menopausia natural o quirúrgica. De cualquier modo, la relación asma-obesidad plantea numerosos interrogantes y los mecanismos propuestos son múltiples: factores inmunoinflamatorios, determinantes mecánicos, disminución de la eficacia de los corticosteroides (CS), déficit de vitamina D y coexistencia adicional de otras comorbilidades, como el síndrome de apnea-hipoapnea del sueño16 (evidencia D-R2).
Asma neutrofílica de inicio en la edad adultaNo se conoce bien su historia natural. Se ha observado un incremento en el lavado broncoalveolar de la metaloproteinasa de la matriz MMP-9, así como antecedente de tabaquismo y limitación crónica al flujo aéreo (LCFA) con importante atrapamiento. Los CS aportan poco al control de la enfermedad. El predominio de los neutrófilos en las vías aéreas podría ser debido a modificaciones en la expresión de genes relacionados con su activación y movilidad, a la coexistencia de otras enfermedades (bronquiolitis obliterante), o que sea el resultado de la inflamación residual que queda en la vía aérea tras el uso continuado de CS, los cuales inhiben la apoptosis del neutrófilo15.
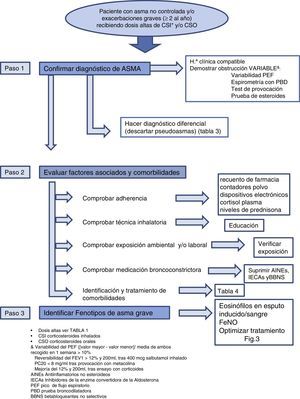
Aproximación diagnóstica al paciente con asma grave no controladaEl diagnóstico de AGNC precisa llevar a cabo una evaluación sistematizada por pasos que asegure no dejar a un lado aspectos relevantes. De acuerdo con la anterior normativa SEPAR17 (evidencia D-R2) y las recomendaciones de los actuales consensos1,18,19 (evidencia D-R2), esta valoración debería ser realizada en unidades acreditadas o de referencia, por profesionales con experiencia clínica contrastada en el manejo de este tipo de pacientes, mediante visitas de seguimiento durante un tiempo no inferior a 6 meses (fig. 2).
Paso 1: determinar si el paciente tiene asmaNo se debe asumir el diagnóstico aportado por el paciente y realizado en el pasado por otros facultativos sin que se proporcionen las pruebas objetivas necesarias que lo confirmen. Diferentes estudios avalan esta situación, en los que se demuestra que en casi un tercio de los pacientes con un diagnóstico previo de asma, tras una nueva evaluación sistemática, el diagnóstico resulta erróneo20 (evidencia D-R2).
Historia clínica y pruebas que confirmen asmaEs conveniente un abordaje nuevo y realizar una adecuada historia clínica indagando sobre la aparición de los primeros síntomas, su variabilidad en el tiempo y su relación con desencadenantes específicos, que conduzcan hacia la sospecha de asma o de otra enfermedad confusora. Se debe intentar confirmar la existencia de una obstrucción variable al flujo aéreo, mediante las pruebas de función pulmonar (PFP) habituales, según criterios recientemente revisados en la actualización de la GINA21 (evidencia D-R2GPC).
Diagnóstico diferencialRealizar un correcto diagnóstico diferencial (DD) con otras enfermedades que puedan simular asma y no lo sean, también denominadas «seudoasmas o falsas asmas». Los procesos que pueden simular un asma se muestran en la tabla 2.
Diagnóstico diferencial de asma en adultos y niños
| Adultos | Niños |
|---|---|
| Enfermedades de las vías aéreas superioresCausas orgánicasTumores traquealesAnomalías congénitas de las vías aéreasAnomalías congénitas vascularesTraqueobroncomalaciaPolicondritis recidivante idiopáticaAmiloidosis traquealEstenosis de vías aéreas asociadas a EIIBocio endotorácicoMediastinitis fibrosantes crónicasCausas funcionalesDisfunción de cuerdas vocalesOcasionados por enfermedades de las vías aéreas inferioresEnfermedad pulmonar obstructiva crónicaBronquiolitis obliterantesDisneas funcionales o psicógenasEnfermedades de otros órganosInsuficiencia cardíaca izquierda | Enfermedades de las vías aéreas superioresHipertrofia adenoamigdalarLaringomalacia, parálisis de cuerdas vocales, membrana laríngeaDisfunción de cuerdas vocalesObstrucción de las grandes vías aéreasTraqueomalacia, broncomalaciaEstenosis traqueal o bronquialCuerpo extrañoAnillos vascularesAdenopatías, tumoresEnfermedad supurativa pulmonarFibrosis quísticaBronquiectasiasDiscinesia ciliar primariaBronquitis bacteriana persistenteInmunodeficienciasSíndromes aspirativosReflujo gastroesofágicoIncoordinación de la degluciónFístula traqueoesofágicaHendidura laríngeaMisceláneaDisplasia broncopulmonarBronquiolitis obliteranteEdema pulmonarTos psicógena |
EII: enfermedad inflamatoria intestinal.
Las «falsas asmas» suelen ser diagnosticadas meses o incluso años después del inicio de sus manifestaciones clínicas. Este retraso en el diagnóstico suele comportar el uso excesivo de medicación antiasmática (incluidos los CSS), que causan efectos secundarios importantes (osteoporosis, glaucoma, obesidad, hipertensión). Además, es frecuente que en estos casos el paciente acuda reiteradamente al servicio de urgencias y reciba tratamiento con combinaciones de fármacos antiasmáticos a dosis elevadas, a pesar de que se perciba que el tratamiento es ineficaz para controlar la enfermedad18.
En la tabla 3 se muestran las pruebas diagnósticas a realizar en el DD.
Diagnóstico diferencial en asma grave no controlada en adultos. Seudoasmas y pruebas diagnósticas
| Enfermedad orgánica vía superiorObstrucción bronquial | Espirometría con asa inspiratoriaTAC en inspiración/espiración vía superiorFibrobroncoscopia |
| Disfunción de cuerdas vocales | Laringoscopia durante la crisis o tras provocación con metacolina o tras ergometría |
| Enfermedad pulmonar obstructiva crónica (enfisema) | TACAR de tóraxPletismografía y difusión |
| Bronquiolitis obliterante | TACAR de tórax en inspiración/espiraciónPletismografía/atrapamiento aéreoBiopsia transbronquial/pulmonar |
| Disneas funcionales | Cuestionario de hiperventilación (de Nijmegen)Valoración psicológica |
| Insuficiencia cardíaca izquierda | TACAR de tóraxEKG/ecocardiograma |
| BronquiectasiasFibrosis quísticaABPA | TACAR de tóraxTest del sudorIgE total y específica a Aspergillus/precipitinas |
| Síndrome de Churg-StraussEosinofilias pulmonares | ANCAp/biopsia de órgano(s) afectado(s)Fibrobroncoscopia (LBA) |
ABPA: aspergilosis broncopulmonar alérgica; ANCAp: anticuerpos perinucleares anticitoplasma de los neutrófilos; EKG: electrocardiograma; IgE: inmunoglobulina E; LBA: lavado broncoalveolar; TAC: tomografía axial computarizada. TACAR: TAC de alta resolución.
En este grupo hay que diferenciar las que tienen un origen orgánico y las funcionales.
Causas orgánicasEl síntoma que debe alertar sobre la localización de la obstrucción en las vía aéreas superiores es la presencia de estridor. La morfología de las asas de flujo volumen puede mostrar alteraciones (aplanamiento). Ante su sospecha en un paciente con asma que no responde al tratamiento, está justificado recurrir a la exploración radiológica mediante la tomografía computarizada (TAC), en inspiración y espiración profunda, que permita calibrar el grado de malacia de la tráquea y los grandes bronquios, o la exploración mediante fibrobroncoscopia.
Causas funcionalesEn algunas personas, por razones desconocidas, las cuerdas vocales permanecen parcialmente cerradas durante la inspiración, lo que ocasiona una sensación disneica en forma de asfixia aguda, que suele ir asociada a un estridor. La disfunción de cuerdas vocales puede presentarse sin desencadenante evidente, o por estímulos diversos, entre ellos el ejercicio físico, observándose con frecuencia en atletas22 (evidencia D-R2). Se puede observar en niños y adultos, y afecta con más frecuencia a mujeres y personas que puntúan alto en los cuestionarios de ansiedad. A pesar de la aparente gravedad de algunos episodios, es excepcional que ocasionen pérdida de conciencia y suelen ceder espontáneamente en minutos en la gran mayoría de los casos. Representan hasta en un 50% de los enfermos remitidos a una consulta especializada en ACD23 (evidencia C-R2). Idealmente, la confirmación diagnóstica se realiza observando el mal funcionamiento de las cuerdas, coincidiendo con uno de los episodios mediante laringoscopia o videolaringoestroboscopia, lo que no siempre es posible, por lo que se ha propuesto recurrir a la inducción mediante la inhalación de metacolina. Cuando la disfunción se produce con el ejercicio se puede llegar a reproducir en el laboratorio mediante una prueba de esfuerzo22.
Estos pacientes a menudo son sometidos a intubación endotraqueal innecesaria; al comprobar que una vez colocado el tubo no existe resistencia a la ventilación, el paciente puede ser extubado a los pocos minutos y su recuperación es rápida.
Enfermedades de las vías aéreas inferioresLa enfermedad pulmonar obstructiva crónica (EPOC) es un proceso que cursa con exacerbaciones que simulan un asma persistente con componente obstructivo parcialmente reversible. Un paciente asmático fumador puede desarrollar de forma simultánea EPOC (síndrome de solapamiento ASMA-EPOC: ACOS)21. La historia clínica, los estudios radiológicos y las PFP pueden ayudar a diferenciar lo que es asma y lo que es EPOC. En estos casos, una TAC permite detectar lesiones propias de enfisema que están ausentes en el asma. Las PFP pueden mostrar reversibilidad marcada, asociado a otros hallazgos más propios de una EPOC/enfisema, como pueden ser el atrapamiento aéreo o la disminución de la capacidad de difusión del monóxido de carbono (DLCO). También se puede realizar una prueba de CS18.
La afectación de las vías aéreas inferiores por otras enfermedades, como la bronquiolitis obliterante, se deben sospechar en pacientes con un patrón en mosaico en la TAC o signos compatibles con hiperinsuflación en las PFP. La confirmación diagnóstica en estos casos obliga a considerar la realización de una biopsia pulmonar.
Disnea funcionalLa disnea es una sensación subjetiva de dificultad respiratoria que el paciente puede describir de forma variada (dificultad para inspirar, dificultad para espirar, opresión torácica). Cuando la disnea no está asociada a ninguna enfermedad orgánica se conoce como disnea funcional24 (evidencia C-R2).
La disnea funcional puede ser muy variable en su intensidad, desde una sensación de dificultad moderada para llenar los pulmones hasta una crisis intensa de hiperventilación. La disnea suspirosa se detecta en un 10-20% de la población general, aunque en el asma puede llegar a afectar al 30-40% de los pacientes, sin que se sepa el motivo de esta diferencia. Es más frecuente en mujeres, en especial en aquellas que puntúan alto en los cuestionarios de ansiedad24. Cuando se asocia al asma ocasiona una valoración equivocada de su gravedad, lo que origina un sobretratamiento. Para diferenciar si el síntoma (disnea) es debido al asma o se trata de un trastorno funcional, es recomendable recoger información objetiva del grado de afectación de la función pulmonar y realizar mediciones del flujo pico espiratorio que ayuden a correlacionar síntomas y cambios en la función pulmonar. La disnea funcional y la disfunción de cuerdas vocales pueden darse asociadas en algunos pacientes.
Enfermedades de otros órganosLa insuficiencia cardíaca izquierda puede ocasionar un aparente empeoramiento de un asma. El inicio de una fibrilación auricular o la ligera descompensación de una cardiopatía hipertensiva o coronaria puede trasformar un asma bronquial bien controlado en una asma rebelde al tratamiento. En estos casos el control de la arritmia o de la insuficiencia cardíaca logran dar de nuevo estabilidad al asma.
Paso 2: identificar factores que contribuyen a un mal control y evaluar enfermedades asociadasComprobar adherenciaNumerosos estudios confirman que las tasas de incumplimiento terapéutico o pobre adherencia al tratamiento son mayores de lo esperado. Hasta un 46% de los pacientes con asma no cumple adecuadamente con el tratamiento prescrito25 (evidencia C-R2).
La medida de la adhesión terapéutica es una tarea compleja en toda enfermedad crónica siempre, y quizás todavía más cuando se trata de evaluar la adherencia a la medicación inhalada. En la práctica se utiliza el juicio clínico, la respuesta terapéutica o cuestionarios validados, si bien es conocido que todos estos métodos sobrevaloran el grado de adhesión terapéutica. Se ha propuesto el uso de la FENO como medida para evaluar la cumplimentación, dada la buena respuesta de este marcador a los corticoides inhalados. Así mismo, se han descrito diversos procedimientos para su medición (fig. 2).
Comprobar técnica inhalatoriaLos errores en la técnica de inhalación son un hecho mucho más frecuente de lo que se podría pensar. En un reciente estudio26 (evidencia D-R2) se comprobó que se cometían errores críticos en un 12% con metered dose inhaler (MDI), 35% con Diskus® y HandiHaler® y 44% con Turbuhaler®. La mala utilización de los inhaladores se asoció a un incremento de las hospitalizaciones, visitas a urgencias, ciclos de CSS y antibióticos y a una peor puntuación en el cuestionario de control de asma (ACT).
En esta línea GEMA recomienda el uso de los MDI con cámara para mejorar la distribución y la cantidad de fármaco que llega al árbol bronquial27 (evidencia D-R2GPC).
La comprobación de la técnica inhalatoria y su adiestramiento es un paso obligado en la educación de los pacientes con asma. La elección del dispositivo de inhalación debe tener en cuenta varios aspectos (preferencias del paciente, pico de flujo inspiratorio, resistencia del dispositivo y aparición de efectos adversos locales).
Comprobar exposición ambiental y/o laboralAunque no existe un consenso establecido que ayude a identificar la exposición a desencadenantes ambientales, es conocido que en los pacientes con asma grave pueden desempeñar un papel importante, sin olvidar la actuación que pueden tener los agentes de exposición laboral (se han identificado más de 200), sobre todo en el asma de comienzo en la edad adulta. Se debe aconsejar la evitación a alérgenos desencadenantes probados, aunque no se dispone de evidencia suficiente21.
Comprobar medicación broncoconstrictoraEn algunos pacientes la falta de control del asma puede ser debida a la toma de medicamentos (AINE, inhibidores de la enzima conversora de angiotensina [IECA], bloqueadores beta no selectivos) que pueden favorecer la persistencia de sintomatología asmática18.
Valorar la presencia de comorbilidadesEn el asma existen condiciones o enfermedades que aparecen asociadas en mayor medida que en la población general (tabla 4). Si bien la relación entre estas y el asma no se conoce con exactitud, es un hecho que contribuyen a un inadecuado control de la misma, por lo que resulta necesaria su identificación.
Evaluación y tratamiento de comorbilidades
| Comorbilidad | Pruebas diagnósticas | Tratamiento |
|---|---|---|
| Enfermedad rinosinusal | RinoendoscopiaTAC de senos paranasales | AntileucotrienosCorticoides intranasalesLavados nasales con salinoCirugía endoscópica nasal |
| Reflujo gastroesofágico | pH-metría/manometría esofágicaEnsayo terapéutico con IBP | Consejos higiénico-dietéticosIBPIntervención quirúrgica |
| Obesidad | IMC | Pérdida de pesoCirugía bariátrica |
| SAHS | Polisomnografía | CPAPPérdida de peso si procede |
| Psicopatología | Evaluación por psicólogo/psiquiatra | PsicoterapiaTratamiento específico |
| Disnea funcional | Cuestionarios específicos(cuestionario de Nijmegen) | PsicoterapiaReeducación respiratoria |
| Disfunción de cuerdas vocales | Laringoscopia en la crisis o provocación con:metacolina/ejercicio | Rehabilitación logofoniátrica |
CPAP: presión positiva continua en la vía aérea; IBP: inhibidores de la bomba de protones; IMC: índice de masa corporal; SAHS: síndrome de apnea-hipoapnea del sueño; TAC: tomografía computarizada.
A pesar de que el impacto de los diferentes tratamientos de las comorbilidades no se encuentra bien establecido, cuando estas se hallan presentes se recomienda su tratamiento para mejorarlas en lo posible1.
Paso 3: identificar fenotipos de asma graveAunque no existe aún una definición aceptada sobre lo que se ha dado a conocer como fenotipos en asma, sí parece haber consenso en cuanto a determinados perfiles clínicos de pacientes con características fisiopatológicas diferenciadas que les hacen responder mejor a determinados medicamentos. El realizar una aproximación a dichos «fenotipos» puede ser de ayuda para optimizar el tratamiento. Para ello, pueden ayudar algunas características clínicas (edad de comienzo, obesidad, intolerancia a AINE) así como la medición de eosinófilos en esputo inducido y sangre, la determinación de la FeNO y los prick-test (fig. 2).
Tratamiento de asma grave no controladaHasta la fecha pocos ensayos clínicos han sido diseñados específicamente para valorar la eficacia de los diferentes tratamientos en la población con AGNC, si bien en la actualidad la identificación de nuevas dianas terapéuticas ha conducido al diseño de estudios con alguna evidencia científica de eficacia, aunque de corto seguimiento, en este tipo de pacientes.
Insensibilidad a los corticosteroidesAunque los CS son muy efectivos en el control de la inflamación en el asma, existe todo un espectro de respuesta a los mismos entre los asmáticos, y un pequeño porcentaje de pacientes no responde aunque se empleen dosis elevadas de los mismos. La resistencia total a los CS es un hecho poco frecuente; es más común entre los asmáticos graves que exista una resistencia parcial o «insensibilidad», lo que hace necesario emplear dosis elevadas de estos, con las que no se consigue un control completo. Algunos pacientes sí mejoran notablemente con el uso de CSS, pero cuando estos se retiran el asma empeora (asma dependiente de los corticoides o corticodependiente). En un estudio con 102 niños con AGNC solo el 11% no respondió a una dosis de triamcinolona intramuscular (IM), lo que significa que el 89% mostraba algún grado de respuesta a los CS28 (evidencia D-R2). Por ello, el reciente consenso ATS/ERS1 adopta el término de insensibilidad en lugar de resistencia a los CS, nomenclatura a la que se adhiere esta normativa.
Desde el punto de vista clínico el asma insensible a los CS se define por un volumen espiratorio forzado en el primer segundo (FEV1) menor del 75% del valor de referencia, y una respuesta menor del 15% y 200ml tras la administración de un ciclo de 40mg/día de prednisona o prednisolona durante 2 semanas29 (evidencia D-R2). Estos pacientes tienen una respuesta de cortisol plasmático y de supresión adrenal normal al cortisol exógeno, por lo que sufren los efectos secundarios de estos. Los factores que contribuyen a que el asma sea insensible a los CS no son bien conocidos. Algunos estudios establecen asociaciones débiles entre determinadas alteraciones genéticas y factores ambientales (exposición continua a alérgenos, tabaquismo, intolerancia a AINE, niveles bajos de vitamina D e infecciones víricas por Chlamydia o Mycoplasma), sin que se puedan considerar determinantes de riesgo claramente establecidos. El factor ambiental más importante que contribuye al componente de insensibilidad a los CS es la exposición al humo del tabaco, que puede actuar por diversos mecanismos: alterando el patrón inflamatorio (incremento de neutrófilos y linfocitos CD8 y descenso en el número de eosinófilos), deteriorando la función mucociliar, favoreciendo el depósito excesivo de moco en la vía aérea, o mediante el estrés oxidativo inducido por el tabaco que inactiva las histonas de acetilasa, deteriorando la traslocación nuclear y reduciendo el número de receptores corticoideos y su afinidad30 (evidencia D-R2).
Los CS actúan a distintos niveles, pero su mayor efecto antiinflamatorio se produce mediante la inhibición de la transcripción genética de numerosos genes que codifican proteínas proinflamatorias (citoquinas, quimiocinas, moléculas de adhesión) y mediante el aumento de la trascripción de mediadores antiinflamatorios. Realizan sus acciones a través de su unión a un receptor intracitoplasmático específico con 2 isoformas moleculares (α y β), siendo la β incapaz de unirse a la hormona y, por tanto, inactiva31 (evidencia D-R2). La insensibilidad a los CS no puede explicarse por alteraciones farmacocinéticas o de malabsorción, y probablemente se produce por mecanismos heterogéneos32 (evidencia C-R2) (tabla 5).
Mecanismos de resistencia a los glucocorticoides en el asma grave
| Reducción del número de receptores de GC |
| Aumento de la expresión del receptor GC β |
| Citoquinas que inducen la supresión de la actividad de los GC |
| Alteración de la afinidad del receptor GC |
| Deterioro de la traslocación nuclear del receptor GC |
| Redución de la acetilación de histonas y activación aumentada de la vía activated protein-1 (AP-1) y del factor nuclear κB (NF-κB) |
| Predominio de la inflamación neutrofílica |
GC: glucocorticoides.
Tomada de Reddy y Little32.
Existe una marcada variabilidad individual en la respuesta a los CSI11 (evidencia C-R2). Sin embargo, se ha constatado alguna evidencia de que en los pacientes con AGNC puede haber una respuesta a dosis más altas de las recomendadas habitualmente33 (evidencia A-R1). Aunque algunos estudios avalan la mayor eficacia terapéutica de los CSI de partícula fina (relacionada con su efecto en vías aéreas periféricas) no hay evidencias de su superioridad en AGNC34 (evidencia C-R2).
Dentro de los nuevos corticoides la ciclesonida tiene menos efectos locales y sistémicos debido a que el profármaco es activado en el parénquima pulmonar a su forma activa35 (evidencia B-R2). Los nuevos esteroides denominados disociados (mapracorat), que intentan separar los mecanismos antinflamatorios de los efectos secundarios están actualmente en desarrollo36 (evidencia D-R2).
Corticosteroides sistémicosNo está bien definido el momento óptimo para iniciar tratamiento de mantenimiento con CSS, ni existe evidencia de que un tratamiento continuo con dosis bajas de CSS sea más eficaz que ciclos de CSS para disminuir el número de exacerbaciones. La administración intramuscular de triamcinolona (Trigón® depot 40mg) en asmáticos con insensibilidad a corticoides mejora el control, reduce los eosinófilos en el esputo, aumenta el FEV1 y previene las exacerbaciones. Las razones para su eficacia pueden incluir el refuerzo de la adherencia o la mayor potencia de la triamcinolona comparada con otros corticoides de uso clínico37 (evidencia C-R2).
Agonistas β2 adrenérgicos de acción largaLa adición de un LABA a un CSI ha demostrado ser más eficaz que doblar la dosis de CSI o añadir un antileucotrieno, aunque pueda existir una marcada variabilidad en la respuesta que precisa ser monitorizada38 (evidencia A-R1). El formoterol como agonista completo posee una mayor eficacia intrínseca y causa mayor número de efectos adversos39 (evidencia D-R2). Los más frecuentes son la taquicardia y la hipopotasemia, que pueden ser más pronunciados en individuos homozigóticos para arginina en la posición 16 del β2-AR.
Anticolinérgicos de acción prolongadaEstudios recientes han demostrado que los anticolinérgicos de acción prolongada (LAMA) pueden tener utilidad en los pacientes asmáticos graves que cursan con LCFA40 (evidencia B-R2);,en casos de ACOS, en asma grave con perfil inflamatorio no eosinofílico41 (evidencia D-R2) y en asmáticos con la variante ArgGly en el codón 16 del receptor β242 (evidencia B-R2). Existe la tendencia de un uso cada vez mayor de LAMA como tratamiento en el asma bronquial y alguna GPC los posiciona en los escalones más altos de gravedad cuando no se consigue el control.
Vitamina DLos niveles de 25-hidroxivitamina D<30ng/ml se relacionan con la gravedad del asma, un aumento del riesgo de exacerbaciones y una baja función pulmonar, además de estar implicados en el mecanismo de insensibilidad a los esteroides. Sin embargo, no existen resultados definitivos para recomendar la administración de esta vitamina43 (evidencia D-R2).
MacrólidosEl tratamiento con macrólidos en asma grave durante 3 o más semanas no está asociado a una mejoría significativa del FEV1, aunque sí del PEF matutino, de los síntomas, la hiperrespuesta bronquial y la calidad de vida relacionada con la salud (CVRS)44 (evidencia D-R2). No existe suficiente evidencia en referencia al uso generalizado para disminuir el número de exacerbaciones, si bien algunos estudios recomiendan su utilización en el fenotipo de asma grave neutrofílico45 (evidencia B-R2).
AntileucotrienosLos pacientes con EREA por lo general presentan una producción basal excesiva de leucotrienos, motivo por el cual parecen ser los candidatos ideales al tratamiento con antileucotrienos46 (evidencia C-R2); algunos estudios recientes registran que montelukast puede ser útil, de manera general, en pacientes asmáticos graves, a la vista de los hallazgos objetivados en el atrapamiento aéreo y alteraciones radiológicas encontradas en la TAC, por lo que puede ensayarse como terapia adicional en estos pacientes47 (evidencia C-R2).
OmalizumabLa terapia anti-IgE ha demostrado su eficacia clínica en marcadores de la respuesta inflamatoria, frecuencia de exacerbaciones, visitas a servicios de urgencias, gravedad de síntomas, uso de CSI y CVRS. Omalizumab está indicado para mejorar el control del asma cuando se administra como tratamiento adicional en pacientes adultos y adolescentes (mayores de 6 años) con asma alérgica persistente grave no controlada que presentan sensibilización a alérgenos perennes, con función pulmonar reducida, así como exacerbaciones graves documentadas, a pesar de utilizar tratamiento adecuado a su nivel de gravedad48 (evidencia B-R2). Se han publicado datos de pacientes no atópicos tratados, lo que puede abrir en el futuro una nueva vía de indicación en este grupo de pacientes49 (evidencia D-R2).
TermoplastiaAunque los primeros estudios clínicos realizados en pacientes asmáticos clasificados como moderados y graves no han mostrado resultados del todo favorables debido a los acontecimientos adversos y a la ausencia de efectos sobre la hiperrespuesta bronquial50 (evidencia B-R2), queda por definir qué subgrupo de pacientes pueden beneficiarse de esta técnica. Un reciente estudio, tras 5 años de seguimiento, demuestra un beneficio mantenido sobre el control de la enfermedad (reducción del número de exacerbaciones graves y visitas a urgencias) y la seguridad del procedimiento51 (evidencia B-R2). Actualmente se recomienda solo en centros con experiencia y en el contexto de investigación1,52 (evidencia D-R2)53 (evidencia B-R2).
Teofilina e inhibidores de fosfodiesterasa-4Aunque no existen ensayos controlados con teofilina en asma grave, esta de forma aislada posee una acción antiinflamatoria relativamente débil, administrada a dosis bajas, que es capaz de potenciar notablemente la acción de los corticoides sobre la expresión genética de la inflamación54 (evidencia D-R2).
Por otro lado, existen datos de la utilidad de los nuevos inhibidores de fosfodiesterasa 4 (roflumilast) en asmáticos55 (evidencia B-R2) y la actualización de la guía Gesepoc de 2014 sigue posicionando a estos fármacos como terapia añadida en pacientes con ACOS que no controlan sus síntomas56 (evidencia D-R2GPC).
Otras terapiasExisten estudios que han constatado el perfil desfavorable de riesgo/beneficio tanto para el etanercept como para el metotrexato y la ciclosporina.
En pacientes con asma eosinofílica se ha ensayado recientemente un Ac monoclonal anti-IL5, el mepolizumab, observándose mejorías significativas en CVRS, exacerbaciones y síntomas57 (evidencia A-R1)58 (evidencia B-R2) y descenso de CSS59 (evidencia B-R2). Estudios realizados con reslizumab y benralizumab (antirreceptor de IL-5) abren nuevas perspectivas60 (evidencia B-R2).
Otra vía de activación inmunitaria implicada en el asma, en la que existen moléculas en fase de desarrollo, es la de la IL-13 (tralokinumab y lebrikizumab con efecto anti-IL-13) y dupilumab61 (evidencia B-R2) que actúa contra la subunidad alfa del receptor de IL-4, que es una diana compartida por la IL-4 y la IL-13. En el caso de lebrikizumab el efecto positivo fue mayor en pacientes con niveles elevados pretratamiento de periostina circulante62 (evidencia B-R2). Se ha ensayado una versión muteína de la IL-4 (pitrakinra), que funciona como un antagonista al inhibir la unión de la IL-4 y de la IL-13 al complejo compartido IL-4Rα/IL-13Rα163 (evidencia B-R2). Daclizumab, un anticuerpo monoclonal humanizado IgG1 frente a la cadena IL-2R-α de linfocitos T activados (evidencia CD25), ha demostrado su utilidad en asmáticos moderados-graves no controlados con CSI64 (evidencia B-R2).
Actualmente se encuentran en investigación moléculas que actúan sobre el receptor de IL-17 (brodalumab) y la IL-17 propiamente dicha (secukinumab) en asma neutrofílica, debido a que la IL-17 induce la expresión de IL-8, principal factor atrayente de neutrófilos, pero los resultados hasta el momento no son satisfactorios65 (evidencia B-R2).
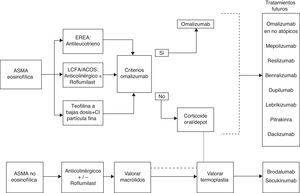
Tratamiento según fenotipoIdentificar el fenotipo inflamatorio predice la respuesta al tratamiento y, en este sentido, existen suficientes datos de que la presencia de inflamación eosinofílica tiene un alto valor predictivo de respuesta a los CSI en pacientes con enfermedad de la vía aérea, independientemente del diagnóstico. Existe evidencia para ajustar el tratamiento en los pacientes con AGNC guiado por esputo inducido (en centros con experiencia), si bien no se ha podido demostrar en el caso del FeNO66 (evidencia A-R1).
Existe un grupo de pacientes con eosinofilia refractaria en los que la triamcinolona puede ser una alternativa28, y su efecto podría potenciarse con teofilina a dosis bajas54. Disponemos de opciones terapéuticas como el omalizumab, y en un futuro próximo mepolizumab, reslizumab, lebrikizumab o dupilumab para este perfil de pacientes.
En el caso del asma neutrofílica, y en pacientes seleccionados, se puede probar tratamiento con macrólidos44.
El tiotropio constituye también una alternativa en pacientes con LCFA41. Finalmente, la termoplastia podría ser una alternativa en pacientes bien seleccionados y en centros experimentados (fig. 3).
Asma grave no controlada en la infanciaLa prevalencia de niños con AGNC no supera el 5% de todos los niños asmáticos. Sin embargo, su atención consume el doble de recursos directos (medicación, visitas a urgencias, hospitalizaciones) e indirectos (faltas escolares, días de trabajo perdidos por los padres, etc.) que los empleados en el resto67 (evidencia B-R1).
Dado que no existen estudios suficientes de seguimiento, no se ha podido establecer una relación clara entre los fenotipos de asma en el niño y en el adulto, aunque sí parece que la severidad del asma en la infancia continúa en la edad adulta, siendo pocos los que logran controlar la enfermedad5.
La mayoría de los niños remitidos al especialista por AGNC podrían corresponder a alguno de estos grupos, que pueden coexistir a la vez, o en diferentes edades, en el mismo paciente:
- 1.
Asma que persiste la mayoría de los días, durante al menos 3 meses, a pesar del tratamiento con CSI a altas dosis, además de otros controladores, como LABA, montelukast y, menos frecuentemente, teofilina oral a dosis bajas o CSS en pauta larga.
- 2.
Exacerbaciones graves recurrentes que han requerido al menos un ingreso en UCI o 2 ingresos hospitalarios, o más de 2 cursos de CSS en el último año, pese a recibir un tratamiento de fondo adecuado para el asma.
- 3.
LCFA por reducción anatómica del calibre de la vía aérea que ha sucedido, bien antes del nacimiento (tabaquismo materno, hipertensión o diabetes gestacional) o de forma posnatal (infecciones virales, aspiración por reflujo) y que se detectaría porque, tras la administración de una dosis de triamcinolona IM o 2 semanas de CSS orales, no se observa mejoría de la función respiratoria (FEV1<–1,96 del Z score), aunque existen dudas sobre la elección y dosis del corticoide a emplear68 (evidencia D-R2).
Al igual que sucede en el adulto, ante un niño que aparentemente presenta AGNC se deben realizar una serie de consideraciones:
¿El diagnóstico de asma es correcto?Se considerarán otras posibilidades diagnósticas, realizándose pruebas complementarias según el grado de sospecha (tabla 2).
¿El tratamiento prescrito y su cumplimiento son adecuados?Cuando se revisan las técnicas de inhalación y el cumplimiento terapéutico se descarta el diagnóstico de AGNC en el 75% de los niños69 (evidencia D-R2).
¿Existen factores ambientales que lo agraven?Tanto la exposición reiterada a neumoalérgenos, a los que el niño esté sensibilizado, como la exposición al humo de tabaco o la contaminación atmosférica contribuyen al mal control del asma, al aumentar la reactividad bronquial y disminuir la respuesta a los CS. La combinación de estos factores con una infección viral respiratoria puede desencadenar, con más facilidad, exacerbaciones asmáticas graves.
¿Coexisten otras enfermedades?La rinosinusitis, la obesidad, el RGE y los factores psicosociales empeoran el asma, aunque su grado de influencia y sus mecanismos de acción son controvertidos. La alergia alimentaria se comportaría más como un marcador de gravedad, mientras que los síndromes de disfunción de la respiración pueden coexistir y contribuir a tratar de forma exagerada al paciente si no son identificados correctamente.
Después de haber analizado los factores reseñados anteriormente se intentará determinar si el paciente presenta un AGNC sensible a corticoides (el más frecuente en pediatría), o si es insensible a los mismos (aunque presente un patrón de inflamación eosinofílica en la vía aérea), o tenga un patrón neutrofílico o mixto, o se trate de una LCFA.
Para ello se programarán una serie de visitas que incluirán diferentes pruebas que se detallan en la tabla 6. En la primera visita se podría realizar de nuevo pruebas alérgicas para determinar si el paciente se ha sensibilizado a otros neumoalérgeos y analizar la cotinina en saliva para detectar su exposición tabáquica70 (evidencia D-R2GPC).
Evaluación del asma grave no controlada en el niño
| Visita 1 | Visita 2 (a las 2 semanas) | Visita 3 (a las 2 semanas) | |
|---|---|---|---|
| Cuestionario ACT | √ | √ | √ |
| Espirometría y test de broncodilatación | √ | √ | √ |
| Esputo inducido | √ | √ | √ |
| FeNO | √ | √ | √ |
| BroncoscopiaLBA y biopsia endobronquial | √ | ||
| Administración de triamcinolona IM | √ |
ACT: test de control de asma; FeNO: fracción exhalada de óxido nítrico; IM: intramuscular; LBA: lavado broncoalveolar.
Para verificar la respuesta a corticoides, y dado que en los niños no existe acuerdo sobre la dosis, duración y ruta de administración óptimas, se sugiere emplear triamcinolona, 40-80mg en una dosis IM, según edad y peso71 (evidencia D-R2). A las 2 semanas se verifica si la respuesta ha sido favorable (tabla 7). Se considerarían respondedores a los que mejoran en 3 de los apartados, no respondedores a los que no mejoran en ninguno y respondedores parciales a los que lo hacen en uno o 2 puntos, siendo éeta la situación más habitual37.
Respuesta positiva tras la administración de triamcinolona en niños
| Respuesta clínica: puntuación en el cuestionario ACT | Puntuación >20-25 puntos o aumento≥5 puntos |
|---|---|
| Pruebas de función respiratoria | FEV1 normal o aumento>15%Test de broncodilatación negativo |
| Esputo inducido | Normalización del recuento de eosinófilos |
| FeNO | <24ppb |
ACT: test de control de asma; FeNO: fracción exhalada de óxido nítrico; FEV1: volumen espiratorio forzado en el primer segundo.
Los que responden a los CS pueden beneficiarse del tratamiento con omalizumab, aprobado para niños a partir de los 6 años, cuya seguridad y eficacia han sido contrastadas48. Además, se continuaría con el resto del tratamiento, incluido CSS, hasta controlar los síntomas.
Los niños no respondedores, que muestran una inflamación neutrófilica persistente de la vía aérea, pueden beneficiarse de un tratamiento con macrólidos, aunque no hay suficiente evidencia. Se ha sugerido utilizar azitromicina, como en la fibrosis quística (250mg/día en <40kg y 500mg/día>40kg) 3 veces en semana durante 6 meses y reevaluar su eficacia72 (evidencia A-R1). También se podría ensayar el tratamiento con teofilina oral a dosis bajas, con el propósito de alcanzar concentraciones en sangre de 5-10mg/l.
Conflicto de interesesCarolina Cisneros Serrano declara haber recibido honorarios por ponencias o por la articipación en advisory boards de Astra-Zeneca, GSK, Boheringer, Novartis, Takeda, ViforPharma y Chiesi. El resto de autores declara no tener ningún conflicto de intereses.