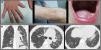
La disqueratosis congénita o síndrome de Zinsser Cole-Engman es una rara enfermedad hereditaria con afectación multisistémica. Al menos 12 genes relacionados con el mantenimiento de los telómeros han sido implicados en la patogénesis de la enfermedad.
En cuanto a la clínica, la distrofia ungueal, la pigmentación reticular y la leucoplasia oral son las más manifestaciones más comunes en esta enfermedad. La fibrosis pulmonar, aunque tan solo afecta al 20% de los pacientes, representa la causa de mayor morbimortalidad1.
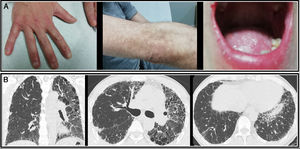
Presentamos el caso de un paciente varón de 49 años, remitido a consulta externa de Neumología por tos seca de 6 meses de evolución. Tenía rinoconjuntivitis estacional y alergia al polvo y trabajaba en una empresa de transporte en contacto frecuente con el humo de los camiones. Estaba diagnosticado de disqueratosis congénita ligada al cromosoma X desde el año 2000 por Dermatología, con clínica de distrofia ungueal, pigmentación reticular y leucoplasia oral (Figura A). Además, estaba en seguimiento en Hematología por anemia aplásica. El cariotipo en sangre periférica y en médula ósea fue compatible con la normalidad. Como antecedentes familiares, tan solo un primo materno había sido diagnosticado de disqueratosis congénita. Sus padres habían fallecido y sus hermanos también cuando eran jóvenes, sin causa conocida.
En la auscultación pulmonar destacaban crepitantes bibasales tipo velcro y la saturación basal de oxígeno por pulsioximetría era de 98%. La radiografía de tórax mostraba afectación reticular de predominio en ambos lóbulos superiores y la analítica de sangre no presentaba ninguna alteración, incluido el estudio de autoinmunidad.
El paciente presentó datos de restricción moderada y disminución de la capacidad de difusión de monóxido de carbono (DLCO) en las pruebas de función respiratoria (FEV1 71%; FVC 71%; FEV1/FVC 60%; TLC 66%; DLCO 62%). Además, en la prueba de la marcha de 6 minutos, presentó desaturación significativa, recorrió una distancia inferior a su teórica y presentó disnea moderada al final de la prueba.
Se amplió el estudio con la tomografía computarizada de alta resolución (TCAR), la cual mostraba afectación parenquimatosa difusa, con una mayor reducción de volumen en el hemitórax izquierdo y opacidades reticulares con bronquiectasias y bronquiolectasias de tracción en ambos lóbulos superiores y língula, lo cual era compatible con enfermedad fibrosante (figura).
Se realizó también una broncoscopia con aspirado y lavado broncoalveolar con resultados citológicos y microbiológicos negativos. Dados los hallazgos, se inició tratamiento antifibrótico con nintedanib, con buena tolerancia.
Se solicitó un análisis de telómeros al Servicio de Detección de Telomeropatías (Instituto de Investigaciones Biomédicas, CSIC). El estudio demostró que la longitud telomérica del paciente estaba por debajo del percentil 10% respecto a la población sana de su misma edad. En la secuenciación de los exones del gen DKC1, asociado a X-DC, se encontró la variante patogénica (NM_001363.4) c.203A>G; p.H68R en el exón 4 del gen DKC1 en homocigosis. No fue posible el estudio genético familiar, dado que sus hermanos y padres habían fallecido.
Se estableció así el diagnóstico de enfermedad fibrosante con afectación leve-moderada (GAP 3, estadio I), asociada a disqueratosis congénita con afectación hematológica y cutánea con acortamiento de telómeros.
En los últimos 3meses, el paciente presentó progresión desde el punto de vista funcional (FVC 57% y DLCO 26%) y radiológico en la TCAR. En esta última se observaban signos de panalización, con múltiples quistes de predominio en lóbulos superiores y en pulmón izquierdo, además de un aumento de calibre de la arteria pulmonar como signo de hipertensión pulmonar.
Dada la rápida evolución, con mala respuesta al tratamiento, se remitió a 3centros de referencia para valoración de trasplante pulmonar. En todos fue rechazado por alto riesgo, dada la escasa experiencia en este tipo de pacientes, así como el mal pronóstico y la morbilidad asociada postrasplante. Se intensificaron los cuidados paliativos, especialmente por disnea incapacitante. En junio del 2019, el paciente falleció por insuficiencia respiratoria.
La verdadera prevalencia de la disqueratosis congénita es desconocida. Se ha estimado que afecta aproximadamente a 1/1.000.000 personas de la población. Se han encontrado variantes genéticas con diferente grado de penetrancia y severidad y con trestipos de herencia genética: autosómica recesiva, ligada al cromosoma X y autosómica dominante2.
Hasta ahora, CTC1, ACD, NHP2, DKC1, PARN, NOP10, TERC, RTEL1, TINF2, TERT y WRAP53 son los genes que se han identificado con la disqueratosis congénita y con el acortamiento telomérico. El gen de la diskerina pseudouridina sintetasa 1 (DKC1) es el más común (30%) y se hereda ligado al cromosoma X: de él se han descrito cerca de 40 variantes patogénicas; sin embargo, hasta en un 20-30% de los casos no se llegan a identificar3.
Como se evidencia en el caso clínico que presentamos, a pesar de que las manifestaciones mucocutáneas son las más frecuentes, la fibrosis pulmonar constituye una de las manifestaciones más graves1. Afecta aproximadamente a 1 de cada 5 individuos con disqueratosis congénita4. Suele diagnosticarse en individuos de 20 a 40 años con motivo de estudio por síntomas respiratorios o por una infección respiratoria5. En algunos casos se desarrolla tras el trasplante de médula ósea. En otros es de causa no conocida.
La combinación de fibrosis pulmonar e insuficiencia de médula ósea es un potente predictor de alteración telomérica6. El acortamiento telomérico se describe hasta en el 25% de los casos de fibrosis pulmonar idiopática y en más del 50% de las formas familiares y contribuye al incremento de la apoptosis epitelial.
La media de supervivencia de los pacientes que asocian fibrosis pumonar idiopática es inferior a 3 años desde el diagnóstico7. Sin embargo, la principal causa de muerte de estos pacientes son las complicaciones derivadas de la insuficiencia de la médula ósea (60-70%).
El único tratamiento que ha demostrado alargar la supervivencia en estos pacientes es el trasplante pulmonar8. Sin embargo, cuando asocian acortamiento telomérico, presentan peor pronóstico y más morbilidad postrasplante que en los casos de fibrosis pumonar idiopática no familiar9-11 La experiencia es escasa, pero existen casos en la literatura con buena evolución y algunos autores lo consideran como un tratamiento factible en estos pacientes2,12.
Dada la rápida evolución de esta enfermedad, resulta de gran importancia el screening del acortamiento telomérico como herramienta para remitir al paciente al trasplante pulmonar de forma preferente13.