El berilio (Be) es un metal muy ligero, con una gran rigidez y un elevado punto de fusión. Se utiliza en aleaciones, principalmente con cobre, en la industria aeronáutica y también para la fabricación de ordenadores, teléfonos y dispositivos electrónicos, cerámicas, productos sanitarios, prótesis dentales, equipamientos deportivos y en talleres de joyería1. Entre los trabajadores expuestos puede provocar una neumonitis o beriliosis aguda, y de forma más habitual la formación de granulomas secundarios a un mecanismo de sensibilización especifica de linfocitos CD4, denominada beriliosis crónica2,3.
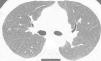
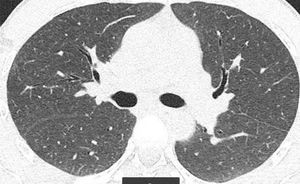
Presentamos el caso de un varón de 41 años, exfumador de 10 paquetes/año, pulidor de piedras preciosas en un taller de joyería desde hace 20 años, para lo cual utiliza material con una aleación de Be. Residente en entorno urbano, sin exposición a otras sustancias inhaladas. Fue remitido a neumología por referir disnea grado I (MRCm) en los últimos 4 meses, sin ningún síntoma respiratorio previo. El estudio de función pulmonar mostró FVC: 4.060ml (79%); FEV1: 3.330ml (81%); FEV1/FVC: 82%; RV: 2.430ml (116%); TLC: 6.570ml (89%); DLCO: 26,7ml/min/mmHg (79%) y KCO: 4,84ml/min/mmHg/l (91%). La tomografía computarizada de tórax permitió identificar un tenue patrón nodular de características centroacinares con densidad en vidrio deslustrado, de bordes mal definidos, bilateral y difuso, con un ligero predominio en lóbulos superiores. No se observó aumento de tamaño de ganglios hiliares ni mediastínicos (fig. 1). La biopsia transbronquial puso de manifiesto un tejido pulmonar con patrón preservado en zonas, con tabiques inter-alveolares finos, sin depósitos y que focalmente mostraba una infiltración inflamatoria con acúmulo de células epitelioides, bien delimitado, sin necrosis y con células multinucleadas, sin material extraño en su interior. El recuento celular del lavado broncoalveolar mostró el siguiente resultado: linfocitos 90%, neutrófilos 1%, macrófagos 8%, eosinófilos 0% y un cociente de linfocitos CD4/CD8 de 4. Se realizaron estudios microbiológicos completos del aspirado bronquial con resultados negativos.
Aunque los datos obtenidos eran muy sugestivos de sarcoidosis, la posible exposición a Be recogida en su historia laboral hizo necesario descartar beriliosis. El diagnóstico de beriliosis crónica se sustenta en la presencia de granulomas en el pulmón y una reacción inmunológica de sensibilización al Be. Para valorar esta sensibilización se estudió la respuesta de activación y proliferación de linfocitos TCD4+ frente al Be en sangre, de la siguiente forma: Se estimularon in vitro células mononucleares aisladas de sangre periférica del paciente con distintas concentraciones de Be (entre 10mM y 0,1μM). Al cabo de 18h de estimulación se cuantificó la expresión del marcador de activación CD69 y mediante ELISPOT la producción de IFN-?. La proliferación se midió por citometría de flujo con marcaje de Carboxyfluorescein succinimidyl ester (CFSE 8). Se utilizó estimulación con anti-CD3 como control positivo en todos los ensayos funcionales. Las células del paciente respondieron positivamente a la estimulación con Be en todos los análisis realizados, en 2 muestras diferentes, hasta la concentración de 1μM, lo que confirmó la sensibilización del paciente al Be4,5. El tipaje celular mostraba un alelo DPB1 positivo. El análisis mineralógico del material de pulir demostró la presencia de Be en concentración de 0,26mg/kg. El diagnóstico final fue de «beriliosis crónica». Dado que la afectación era leve no se inició tratamiento con corticoides y se recomendó reducir la exposición. El paciente trabajaba como autónomo y en un local poco ventilado por lo que se inició el uso de mascarilla y de aparatos extractores. El paciente se mantiene estable tras 2 años de seguimiento.
La presencia de granulomas pulmonares obliga al diagnóstico diferencial con varias entidades, tanto infecciosas como no infecciosas. De entre ellas, la sarcoidosis es la enfermedad más habitualmente confundible. La coexistencia de alveolitis, la menor afectación ganglionar y sistémica y el antecedente de exposición son los elementos más diferenciadores6,7. La hipersensibilidad inducida por metales es del tipo IV (inmunidad retardada) y está mediada por la clase II del complejo mayor de histocompatibilidad (MHCII). El Be induce la activación de ciertos elementos de la inmunidad innata y de la adaptativa, generando una respuesta inmune inadecuada en individuos genéticamente susceptibles. La combinación del Be con los péptidos del MHCII genera un «neoantígeno» que es reconocido por los linfocitos TCD4+ y en ciertas personas, produce la activación y migración de las células dendríticas hacia los ganglios linfáticos, donde se promueve la activación y regreso de los linfocitos TCD4+ sensibilizados hacia el pulmón para formar los granulomas8. La presencia de un alelo HLA-DPB1 en el cromosoma 6 se asocia con un alto riesgo de desarrollar sensibilización al Be y posterior aparición de enfermedad en los individuos expuestos9.
El ritmo de progresión desde la sensibilización hasta la enfermedad es lento, y depende de la magnitud de la exposición y de los elementos genéticos mencionados. Esta respuesta inmune de los linfocitos, junto a la descripción del tipo de granulomas, son los elementos que se utilizan para el diagnóstico de la enfermedad. El tipo de granuloma es superponible al de la sarcoidosis, y por este motivo la prueba diagnóstica específica es finalmente la de la activación y la proliferación de linfocitos que evidencia la sensibilización10. La beriliosis es una enfermedad respiratoria de origen ocupacional que, dada la amplia utilización del Be en la industria actual, seguirá produciendo enfermedad respiratoria. Aunque no tenemos datos disponibles, es de suponer que al igual que en nuestro entorno11, en España existan sectores productivos con amplia exposición al Be, y que dado el extenso tiempo de latencia producirá enfermedad respiratoria, que deberá ser atendida por neumólogos entrenados a diferenciarla de otras entidades más habituales como la sarcoidosis12. El caso que presentamos, probablemente el primero publicado en España, puede ser un excelente recordatorio para tener siempre presente el medio laboral y la ocupación del paciente en el momento de realizar su historia clínica.