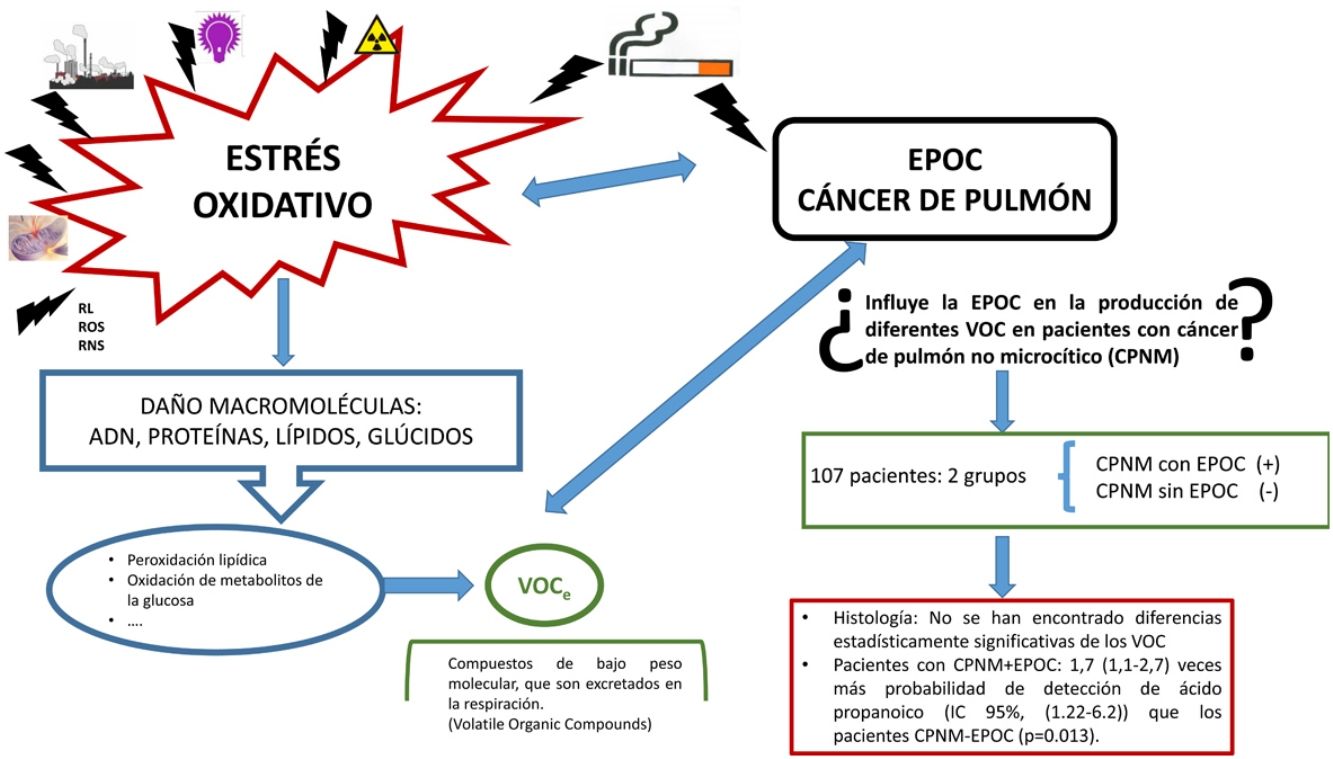
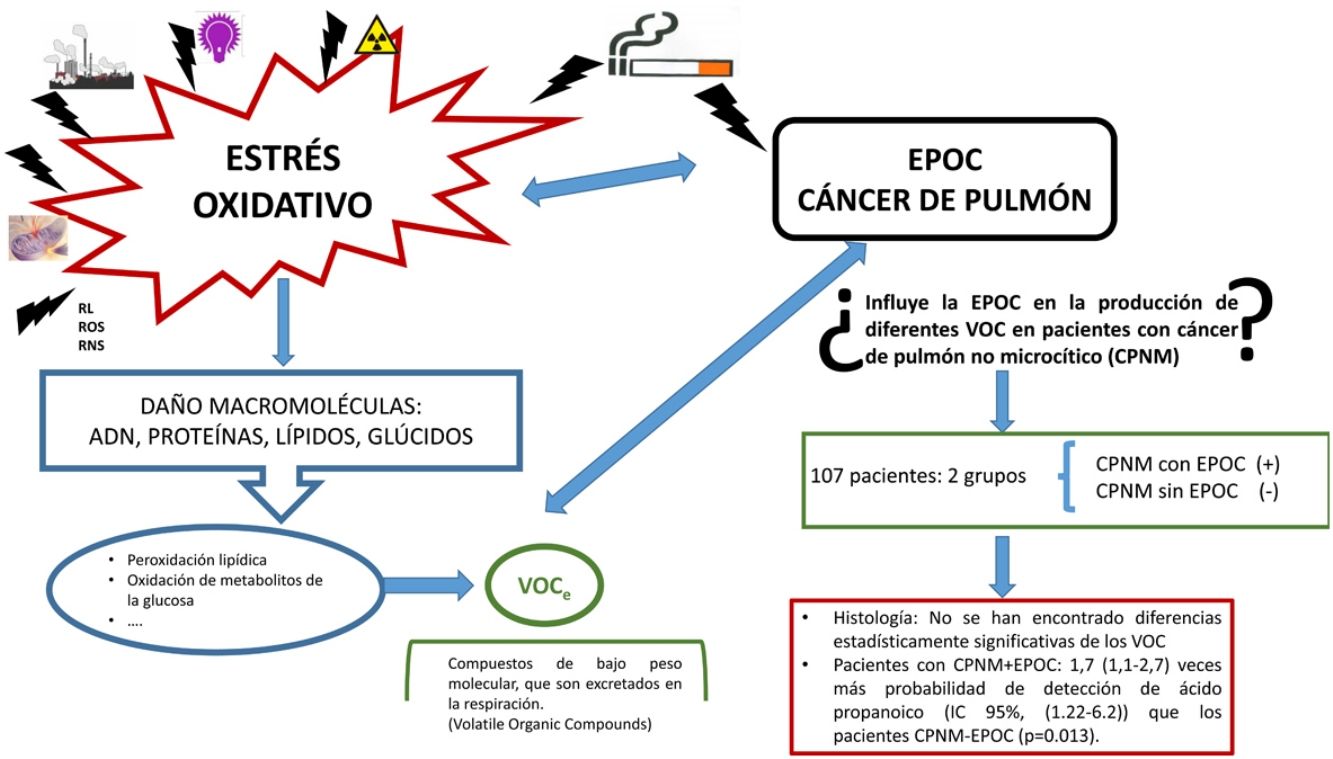
La etiología del cáncer de pulmón es multifactorial. La exposición al humo del tabaco y el papel que desempeñan los compuestos carcinógenos presentes en él explicarían la frecuente asociación de cáncer de pulmón con enfermedad pulmonar obstructiva crónica (EPOC), enfermedad igualmente muy ligada al tabaquismo. En ambas entidades se desencadena una inflamación mantenida debida al incremento del estrés oxidativo (por ejemplo, peroxidación lipídica), que genera sustancias de bajo peso molecular llamadas compuestos orgánicos volátiles (VOC), que son excretadas durante la respiración. La metabolómica de los VOC ofrece una medida indirecta del grado de estrés oxidativo.
ObjetivoEl objetivo de este trabajo es determinar la influencia relativa de la EPOC en el perfil de los VOC en pacientes con cáncer de pulmón no microcítico (CPNM), estudiando previamente la posible variación de los VOC en función de la histología.
Pacientes y métodosSe analizó el aire exhalado de 107 pacientes de CPNM, clasificados en 2 grupos: CPNM con EPOC y CPNM sin EPOC. La muestra de aire exhalado se recogió mediante BioVOC® y se traspasó a tubos de desorción para su posterior análisis por cromatografía de gases y espectrometría de masas. Los VOC analizados fueron aldehídos lineales y ácidos carboxílicos.
Resultados y conclusionesNo se han encontrado diferencias estadísticamente significativas de los VOC con respecto a la histología.
Los pacientes con CPNM con EPOC presentan 1,7 (1,1-2,7) veces más probabilidad de detección de ácido propanoico (IC 95%: 1,22-6,2) que los pacientes CPNM sin EPOC (p = 0,013).
The etiology of lung cancer is multifactorial. Exposure to tobacco smoke and the role played by the carcinogenic compounds that it contains would explain the common association between lung cancer and chronic obstructive pulmonary disease (COPD), a disease which is very much linked to tobacco use. In both diseases, sustained inflammation is caused by increased oxidative stress (for example, lipid peroxidation). This generates low molecular weight substances called volatile organic compounds (VOC) that are excreted during breathing. VOC metabolomics provides an indirect measure of oxidative stress.
ObjectiveThe aim of this study was to establish the relative influence of COPD on the VOC profile in patients with non-small cell lung cancer (NSCLC), by first studying the possible variation of VOC associated with lung cancer histology.
Patients and methodsExhaled air was tested in 107 NSCLC patients, who were divided into 2groups: NSCLC with COPD and non-COPD with NSCLC. The exhaled air sample was obtained with the BIOVOC® sampler, and transferred to desorption tubes for later analysis by thermal desorption-gas chromatography-mass spectrometry. The VOC analysis showed lineal aldehydes and carboxylic acids.
Results and conclusionsNo statistically significant differences were found in VOC associated with histology. NSCLC and COPD patients present a 1.7-fold (1.1-2.7) probability of detection of propionic acid (95% CI: 1.22- 6.2) than patients without COPD or NSCLC (P = 0.013).
La etiología del cáncer de pulmón (CP), como la de cualquier neoplasia, es multifactorial. Sin embargo, la componente genética hereditaria es muy escasa en el CP frente al papel que desempeñan los compuestos carcinógenos presentes en el humo del tabaco1. Esto explicaría la frecuente asociación de CP con enfermedad pulmonar obstructiva crónica (EPOC), entidad igualmente muy ligada al tabaquismo. Otros factores, como exposiciones a diversas sustancias, contaminación ambiental, radiaciones2,3, determinarán a su vez múltiples mutaciones genéticas (EGFR, proteína de fusión EML4-ALK, especialmente importantes en los adenocarcinomas4,5, alteraciones del p53, entre otras muchas6).
En diversos estudios7,8 la existencia de EPOC se considera un factor de riesgo de presentar CP, lo que obliga a plantearse, por el contrario, por qué un gran grupo de pacientes con EPOC no desarrollan CP en poblaciones que han soportado los mismos factores etiológicos de riesgo. En líneas generales, en los casos coincidentes, la EPOC antecede al CP, lo que resulta lógico tras valorar la etiopatogenia de ambas enfermedades.
La estirpe de cáncer de pulmón no microcítico (CPNM) más ligada al consumo de tabaco es el epidermoide, mientras el adenocarcinoma tiene una relación menor con él9,10. Durante las últimas décadas, la incidencia de adenocarcinomas ha aumentado frente a los epidermoides, porcentaje que varía según los países11. Algunos trabajos concluyen que las mujeres son más vulnerables a los efectos nocivos del tabaco12, lo que se ha atribuido al papel de los estrógenos en el crecimiento tumoral13.
La exposición al humo del tabaco y a otras sustancias ambientales desencadenan inflamación mantenida debida al incremento del estrés oxidativo, común a ambas enfermedades. Un ejemplo de sus efectos es la peroxidación lipídica14, que es la acción de los radicales libres o especies reactivas de oxígeno sobre los ácidos grasos poliinsaturados que forman parte de las membranas celulares. La rotura de estas moléculas genera sustancias de bajo peso molecular llamadas compuestos orgánicos volátiles (VOC), que son excretadas durante la respiración. La metabolómica de los VOC ofrece una medida indirecta del grado de estrés oxidativo.
Los primeros estudios relevantes que discriminaban pacientes con CP mediante patrones de VOC con alta especificidad y sensibilidad fueron los de Philips et al.15,16 y Poli et al.17, todos ellos muy criticados por no haber demostrado su origen biológico, a pesar de lo cual iniciaron una línea de investigación basanda en la determinación de alcanos.
En 2010, los estudios de Poli et al.18 y Fuch et al.19 de VOC en CP se centraron en la determinación de aldehídos como biomarcadores por su conocida relación con la peroxidación lipídica.
En 2017, Callol et al.20 publicaron un estudio en el que incluían un grupo de población sana, un grupo con EPOC y otro con CP, y analizaron aldehídos (hexanal, heptanal y nonanal) y ácidos carboxílicos (propanoico y nonanoico) en el aire exhalado que no habían sido estudiados hasta ese momento. Se concluyó que el ácido nonanoico discriminaba entre el grupo de CP y el resto de los grupos, sanos y con EPOC.
Dado lo anterior, nos planteamos la posibilidad de que la coexistencia de CP con EPOC dé lugar a un patrón de VOC de características diferentes.
El objetivo es determinar la influencia relativa de la EPOC en el perfil de los VOC en pacientes con CPNM (epidermoide, adenocarcinoma e indiferenciado de células grandes).
Pacientes y métodosPresentamos un estudio transversal, con muestreo consecutivo no probabilístico. Se seleccionó a 107 personas, divididas en 2 grupos: grupo CPNM con EPOC (n = 67) y grupo CPNM sin EPOC (n = 40).
Todos los pacientes incluidos procedían del Hospital Central de la Defensa Gómez Ulla y del Hospital Clínico San Carlos de Madrid.
El periodo de recogida de datos fue de octubre de 2010 a diciembre de 2017.
Los criterios de inclusión para los 2grupos exigieron: consentimiento informado, ser mayor de 40 años, ser no fumadores, exfumadores o fumadores activos, según criterios de la Organización Mundial de la Salud. No hubo limitación por género.
A todos se les realizaron las pruebas diagnósticas clínicas y analíticas protocolizadas para el diagnóstico y estatificación de CP y de EPOC (GOLD)21.
Se consideró como criterio de exclusión la existencia de enfermedad tumoral activa o previa de cualquier aparato o sistema.
Todos los participantes fueron informados del estudio de los objetivos, riesgos y beneficios, pruebas y técnicas empleadas. Los datos recogidos se hallaban sujetos a lo establecido en la Ley Orgánica de Protección de Datos 15/1999, de 13 de diciembre, y en la Ley 41/2002 de Autonomía del Paciente y de Derecho y Obligaciones en el Manejo de la Información y Documentación Clínica, de 14 de noviembre. El protocolo de estudio fue autorizado por el Comité de Ética e Investigación Clínica del Hospital Central de la Defensa Gómez Ulla (N.° R: IS-404030-S-06-000153).
Respecto a la técnica analítica, para la recogida del aire exhalado se tomaron 900ml de aire exhalado de cada paciente mediante 3 maniobras de espiración forzada, a través de un BioVOC, y se traspasó posteriormente el aire a tubos de desorción térmica. A continuación, se recogió la misma cantidad de aire ambiental de la sala en donde permaneció la persona estudiada, para comparar los niveles de VOC del aire ambiente y del exhalado. Las muestras se analizaron mediante la técnica desorción térmica-cromatografía de gases y espectrometría de masas, siempre en un plazo inferior a 24h desde su recogida, para minimizar las reacciones entre los compuestos y su oxidación. Definimos compuesto endógeno cuando está presente en el aire exhalado y no en aire ambiente o cuando, estando presente en ambos, la relación exhalado/ambiental es mayor a 1. Este protocolo está descrito en trabajos previos de nuestro grupo19,22,23.
Los compuestos estudiados fueron: hexanal, heptanal, nonanal, ácido propanoico y ácido nonanoico.
En el estudio estadístico, se consideraron variables independientes: edad, género, fumador, exfumador, no fumador, histología, personas con CPNM con EPOC y personas con CPNM sin EPOC. Como variables dependientes cualitativas, las derivadas de las determinaciones de los siguientes VOC: aldehídos y ácidos carboxílicos.
Tras la verificación del test de normalidad (Kolmogorov-Smirnov) de las distribuciones de los distintos VOC en aire exhalado, se emplearon como índice de tendencia central y dispersión para distribuciones paramétricas la media aritmética y desviación estándar, o la mediana y el rango intercuartílico para distribuciones no paramétricas.
Las asociaciones entre variables independientes dicotómicas y dependientes cuantitativas se realizaron mediante test de U de Mann-Whitney. Su efecto y su precisión se verificaron mediante la diferencia de medianas y sus correspondientes IC 95%.
La asociación entre variables categóricas independientes y dependientes se verificó mediante el test χ2 de Pearson. Se realizó la estimación del riesgo mediante las razones de prevalencia y su correspondiente IC 95%.
Se consideró como asociación estadísticamente significativa para todos los análisis estadísticos un valor de p < 0,05.
Se empleó el programa estadístico SPSS® v. 24. (SPSS inc. Chicago, IL, EE. UU.).
ResultadosNuestra población consta de 107 pacientes con una edad media (± DE) de 68 (± 11,4) años, el 77% hombres con una edad media de 70 (± 10) años, y el 23% mujeres con 65 (± 13) años.
En cuanto a la historia de tabaquismo, el 86% eran fumadores o exfumadores, con un valor mediano de índice de paquetes año (IPA) de 59 y rango intercuartílico (IQR) de (59). Por género, el 87% eran hombres con un valor mediano de IPA 59 (IQR: 59) y el 23% mujeres con un IPA de 35 (IQR: 34). Esta diferencia de medianas tiene significación estadística con p = 0,039.
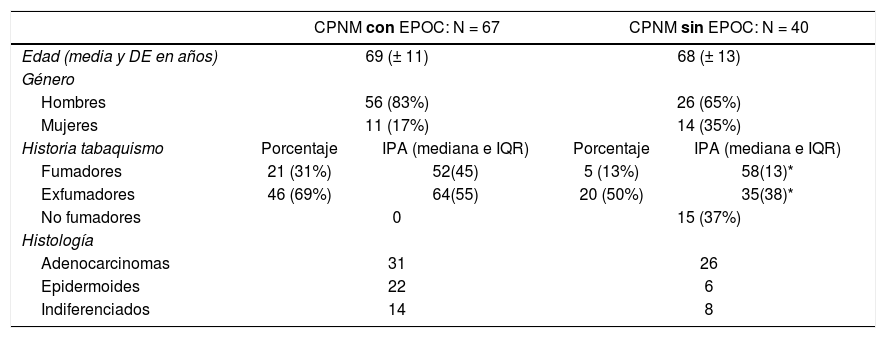
La población la hemos divididos en 2 grupos (67 con CPNM con EPOC y 40 con CPNM sin EPOC). Se seleccionaron las histologías no microcíticas más prevalentes, adenocarcinoma, epidermoide e indiferenciado de células grandes. Las características vienen definidas en la tabla 1.
Características demográficas de la población de estudio
| CPNM con EPOC: N = 67 | CPNM sin EPOC: N = 40 | |||
|---|---|---|---|---|
| Edad (media y DE en años) | 69 (± 11) | 68 (± 13) | ||
| Género | ||||
| Hombres | 56 (83%) | 26 (65%) | ||
| Mujeres | 11 (17%) | 14 (35%) | ||
| Historia tabaquismo | Porcentaje | IPA (mediana e IQR) | Porcentaje | IPA (mediana e IQR) |
| Fumadores | 21 (31%) | 52(45) | 5 (13%) | 58(13)* |
| Exfumadores | 46 (69%) | 64(55) | 20 (50%) | 35(38)* |
| No fumadores | 0 | 15 (37%) | ||
| Histología | ||||
| Adenocarcinomas | 31 | 26 | ||
| Epidermoides | 22 | 6 | ||
| Indiferenciados | 14 | 8 | ||
El grupo CPNM con EPOC está compuesto por 67 pacientes, cuya edad media es de 69 (± 11) años, siendo 56 de ellos hombres (83%) y 11 mujeres (17%). Todo el grupo era fumador activo con un valor mediano de IPA 52 e IQR (45) o exfumador con un IPA de 64 (IQR: 55).
El grupo de CPNM sin EPOC se compone de 40 pacientes cuya edad media es de 68 (± 13) años, siendo 26 hombres (65%) y 14 mujeres (35%). El 13% de ellos eran fumadores activos con un IPA de 58 (IQR: 13), mientras que el 50% eran exfumadores, con un IPA de 35 (IQR: 38).
En el total de los casos, los hombres presentaban 1,6 veces más EPOC (1-2,5) que las mujeres (p = 0,028).
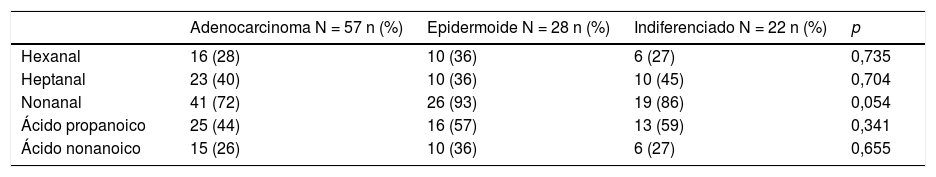
El estudio comparativo de los VOC según histología viene reflejado en la tabla 2. Se exponen el número de casos y el porcentaje de la detección de cada uno de los VOC estudiados, comparando los 3 grupos histológicos, así como los valores de p basados en el test de χ2 de Pearson.
Detección de VOC en las diferentes estirpes histológicas del CPNM
| Adenocarcinoma N = 57 n (%) | Epidermoide N = 28 n (%) | Indiferenciado N = 22 n (%) | p | |
|---|---|---|---|---|
| Hexanal | 16 (28) | 10 (36) | 6 (27) | 0,735 |
| Heptanal | 23 (40) | 10 (36) | 10 (45) | 0,704 |
| Nonanal | 41 (72) | 26 (93) | 19 (86) | 0,054 |
| Ácido propanoico | 25 (44) | 16 (57) | 13 (59) | 0,341 |
| Ácido nonanoico | 15 (26) | 10 (36) | 6 (27) | 0,655 |
Valor de p basado en el test de χ2 de Pearson.
Según los datos obtenidos en nuestra muestra no hemos encontrado diferencias estadísticamente significativas de los VOC con respecto a la histología. Es de valorar el tamaño de la muestra.
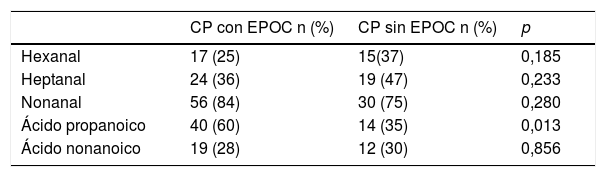
El estudio comparativo de los VOC entre los grupos CPNM con EPOC y CPNM sin EPOC queda recogido en la tabla 3.
Influencia de la EPOC en la determinación de VOC en pacientes con CPNM con EPOC y sin EPOC
| CP con EPOC n (%) | CP sin EPOC n (%) | p | |
|---|---|---|---|
| Hexanal | 17 (25) | 15(37) | 0,185 |
| Heptanal | 24 (36) | 19 (47) | 0,233 |
| Nonanal | 56 (84) | 30 (75) | 0,280 |
| Ácido propanoico | 40 (60) | 14 (35) | 0,013 |
| Ácido nonanoico | 19 (28) | 12 (30) | 0,856 |
Valor de p basado en el test de χ2 de Pearson.
Solo se observan diferencias estadísticamente significativas en el ácido propanoico. Los pacientes con CPNM con EPOC presentan 1,7 (1,1-2,7) veces más probabilidad de detección de ácido propanoico (IC 95%: 1,22-6,2) que los pacientes CPNM sin EPOC (p = 0,013).
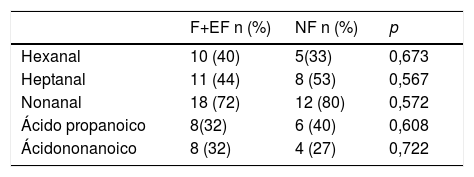
El subgrupo de CPNM sin EPOC está compuesto tanto por pacientes fumadores (fumadores y exfumadores) como no fumadores. Aun considerando que son grupos muy reducidos, estudiamos la influencia del tabaco en este subgrupo (tabla 4). En nuestra muestra no se objetiva influencia del tabaquismo en la detección de los VOC.
Detección de VOC en pacientes con CP sin EPOC en función del tabaquismo
| F+EF n (%) | NF n (%) | p | |
|---|---|---|---|
| Hexanal | 10 (40) | 5(33) | 0,673 |
| Heptanal | 11 (44) | 8 (53) | 0,567 |
| Nonanal | 18 (72) | 12 (80) | 0,572 |
| Ácido propanoico | 8(32) | 6 (40) | 0,608 |
| Ácidononanoico | 8 (32) | 4 (27) | 0,722 |
EF: exfumador; F: fumador; NF: no fumador.
El trabajo presentado trata de establecer diferencias entre los VOC exhalados en una población con CPNM con y sin EPOC.
Nos hemos centrado en los tumores no microcíticos, que presentan diferencias importantes en su comportamiento patocrónico, así como en determinaciones de VOC en trabajos previos19,20,22,23, Numerosos estudios publicados relativos a la determinación de VOC en CP muestran diversidad en cuanto a características de la población, recogida y tratamiento de la muestra, metodología, búsqueda y hallazgos de posibles marcadores24,25.
Nuestro estudio se ha centrado en aldehídos y en ácidos carboxílicos, dada la elevada frecuencia de aparición de estos 2grupos de compuestos en determinaciones previas19,20,22,23. El uso de estos compuestos se ha priorizado en función de su origen conocido, como metabolitos finales de procesos de peroxidación lipídica de los ácidos grasos de las membranas celulares y del metabolismo oxidativo de la glucosa. En nuestros trabajos se valora la interferencia de los VOC ambientales y los problemas en cuanto a la recogida de la muestra20,22,23.
Siendo la EPOC y las neoplasias resultado y causa de procesos oxidativos, su asociación puede tener importancia en la detección de VOC cuando coexisten ambas enfermedades.
Lo primero que se ha estudiado han sido las posibles diferencias en VOC en aire exhalado en función de la histología más prevalente (tabla 2), sin hallar diferencias estadísticamente significativas entre los 3grupos (adenocarcinoma, epidermoide e indiferenciado de células grandes). La p = 0,054 en el nonanal, próxima a la significación estadística, obliga a que se reevalúen, una vez incrementada, el número de epidermoides e indiferenciados. Los resultados son consecuentes con la procedencia de los VOC a partir de la peroxidación lipídica26 de las células tumorales, tal como se ha citado previamente, y que parece ser común con independencia de la histología, lo que difiere de otros autores27, quienes, con técnicas similares, establecen perfiles de VOC específicos de determinadas líneas celulares de CP28. No obstante, la utilización de los VOC propuestos por ellos (benzaldehído, 2-etilhexanol y 2,4-decadien-1-ol) tienen origen metabólico incierto. Este hecho ha sido criticado en otras publicaciones20,22,23,29.
En segundo lugar, se determinan los VOC en los grupos de pacientes con CPNM con EPOC y CPNM sin EPOC.
El CP es una variable que influye en la determinación del ácido nonanoico20, lo que indica su importancia como factor de peroxidación lipídica. Igualmente, conocemos que, en la EPOC, la frecuencia de hexanal es mayor23. Por otra parte, el hecho de fumar o haber fumado condiciona la existencia de nonanal, otro VOC secundario a la peroxidación lipídica, en este caso prolongada en el tiempo tras el cese del tabaquismo22.
No conocemos el resultado de la concatenación de las variables anteriores (CP, EPOC y tabaquismo). Cuando estudiamos a los pacientes con CPNM con EPOC y a los pacientes con CPNM sin EPOC, la presencia de ácido propanoico es estadísticamente significativa (p = 0,013. No hemos encontrado ningún trabajo en el que hayan sido estudiados grupos semejantes y que haga referencia a este hallazgo.
Aunque el ácido propanoico proviene tanto de procesos degradativos de los ácidos grasos de las membranas como de la oxidación de metabolitos de la glucólisis (glicerol y gliceroaldehído), no conocemos su importancia en el desarrollo de la enfermedad neoplásica ni en la EPOC.
El subgrupo de CPNM sin EPOC es heterogéneo en cuanto al hábito tabáquico. Los pacientes fumadores sin EPOC muestran diferencia significativa en el valor del IPA con relación a pacientes fumadores con EPOC (p = 0,035). Sin embargo, no se observa relación entre las determinaciones de VOC y el tabaquismo en este subgrupo.
Este hallazgo pudiera parecer contradictorio con los resultados de tabaquismo en población sana22, pero ha de tenerse en cuenta la influencia de la variable CP. Se puede concluir que el tabaco contribuye menos en el estrés oxidativo que el cáncer.
En resumen, no se ha demostrado que el tipo histológico tumoral influya en la determinación de VOC exhalado, pero sí existe asociación de ácido propanoico en CPNM con EPOC. Es necesario ampliar los estudios antes de su aplicación clínica.
FinanciaciónEste estudio fue financiado por el Instituto de Salud Carlos III (PI07/1116), SEPAR 2013 (registro n.°: 135).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.