El presente estudio pretende describir las características de los pacientes diagnosticados de déficit grave de alfa-1-antitripsina (AAT) en España, calcular la tasa de descenso del FEV1 con y sin tratamiento sustitutivo, e identificar factores asociados a una tasa de descenso acelerada del FEV1.
MétodoEstudio retrospectivo de la evolución de los individuos con déficit de alfa-1-antitripsina (DAAT) incluidos en el registro español. La variable principal evaluada en el estudio fue la tasa anual de descenso del FEV1.
ResultadosSe identificaron 303 pacientes con DAAT grave y fenotipo Pi ZZ. Se dispuso del seguimiento espirométrico de 117 pacientes. Ser fumador activo o ex fumador frente a nunca fumador (odds ratio [OR]=10,31; intervalo de confianza (IC) del 95%=1,8-58,8; p=0,008) y tener un mayor FEV1(%) posbroncodilatador (OR=1,03; IC del 95%=1,005-1,06; p=0,018), se asociaron de manera independiente a una tasa más acelerada de descenso del FEV1. Se apreció una tendencia entre tener un índice de masa corporal (IMC) bajo y experimentar una mayor tasa de deterioro del FEV1 (OR=1,14; IC del 95%=0,98-1,33; p=0,085).
ConclusionesSer fumador o ex fumador, tener una función pulmonar preservada y un bajo IMC fueron los principales factores de riesgo asociados a una tasa acelerada de descenso del FEV1. Este hallazgo justificaría la necesidad de efectuar un seguimiento estrecho de los pacientes jóvenes con un FEV1 más preservado.
The present study intends to describe the characteristics of patients diagnosed with severe alpha-1 antitrypsin deficiency (AATD) in Spain, to observe the rate of decline in forced expiratory volume in 1 second (FEV1) with and without substitutive therapy, and to identify factors associated with a rapid rate of decline in FEV1.
MethodA retrospective study of the evolution of individuals with AATD was carried out based on data collected from the Spanish registry. The primary response variable was the annual rate of decline in FEV1, calculated using the baseline and last postbronchodilator FEV1 values in an endpoint analysis.
Results303 patients with severe AATD and Pi ZZ phenotype were identified. Follow-up spirometric data were collected for 117 subjects. Being a smoker or ex-smoker versus never smoker (odds ratio [OR]=10.31; 95% confidence interval (CI)=1.8-58.8; p=0.008) and having a higher baseline postbronchodilator FEV1 (% predicted) (OR=1.03; 95% CI=1.005-1.06; p=0.018) were independently associated with a more rapid rate of decline in FEV1. There was also a trend towards a relationship between low body mass index (BMI) and a greater rate of deterioration in lung function (OR=1.14; 95% CI=0.98-1.33; p=0.085).
ConclusionBeing a smoker or ex-smoker, greater baseline lung function, and low BMI were the main risk factors associated with an accelerated rate of decline in FEV1. This finding warrants the close observation of younger patients with a better-preserved FEV1.
La alfa-1-antitripsina (AAT) es una glucoproteína altamente pleomórfica, perteneciente a la superfamilia de las serpinas, con más de 100 variantes cuya principal característica es su función antiproteasa, especialmente antielastasa del neutrófilo1,2.
El alelo normal, presente en más del 90% de la población, se denomina PI*M. Las variantes alélicas deficitarias más frecuentes son la PI*S y la PI*Z, las cuales son responsables de la producción de proteínas anormales que polimerizan dentro de los hepatocitos; así, los niveles plasmáticos se encuentran disminuidos de forma marcada en los sujetos portadores de al menos uno, y especialmente 2 alelos deficitarios Z3,4. El déficit de AAT (DAAT) es uno de los trastornos genéticos más comunes. Es el principal factor genético que contribuye al desarrollo de enfisema pulmonar en adultos, ya que la ausencia de AAT ocasiona un desequilibrio a favor de las proteasas, que causan daño tisular.
El DAAT, definido por unas concentraciones séricas de AAT inferiores al 35% del valor normal, es una condición rara que afecta a 1 de cada 2.000-5.000 individuos de raza caucasiana originarios del norte, del centro y del oeste de Europa5. Como ocurre con otras enfermedades raras, se han desarrollado registros de pacientes con la finalidad de recoger información y, de esta manera, mejorar el conocimiento de la enfermedad. Aunque los ensayos clínicos aleatorizados son considerados el patrón oro para establecer las intervenciones más eficaces, la información procedente de los registros y de otros estudios observacionales puede emplearse para completar importantes lagunas que, de lo contrario, quedarían descubiertas porque los ensayos clínicos no recogen situaciones de la vida real6.
Los registros poblaciones de DAAT a nivel mundial (Alpha One International Registry [AIR], el registro del National Heart, Lung and Blood Institute [NHLBI] en Estados Unidos y el Alpha One Foundation Research Network Registry [AOF-RNR]) han demostrado que la principal característica clínica de esta enfermedad es la disnea de esfuerzo7,8 y que la mayoría de pacientes son diagnosticados cuando ya han desarrollado enfermedad pulmonar grave, generalmente a una edad más precoz que los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) sin DAAT.
La evolución en términos clínicos y la esperanza de vida están directamente relacionadas con la pérdida acelerada de volumen espiratorio forzado en el primer segundo (FEV1) y se ha descrito que el deterioro de la función pulmonar es más rápido en individuos con DAAT que en pacientes EPOC sin DAAT9-13.
Varios estudios han mostrado que el tabaquismo y las agudizaciones respiratorias son los principales factores relacionados con el deterioro del FEV1 y han sugerido que el tratamiento sustitutivo (administración intravenosa de AAT purificada procedente de donantes de sangre y capaz de mantener los niveles plasmáticos de AAT por encima de 80mg/dl) podría frenar el descenso del FEV1, reducir la frecuencia de las exacerbaciones e incluso frenar la pérdida de densidad pulmonar14-17.
La historia natural del DAAT no es del todo bien conocida. Su repercusión clínica y funcional no es homogénea en todos los individuos y las series existentes incluyen poblaciones muy diversas y en ocasiones reducidas18. Las instituciones sanitarias y las sociedades científicas reconocen que la creación de registros de enfermedades raras es una estrategia imprescindible para poder desarrollar estudios clínicos y así poder esclarecer la historia natural de estas enfermedades. El registro español de pacientes con déficit de alfa-1-antitripsina o REDAAT recoge datos clínicos y funcionales de la población española con DAAT. El REDAAT es un registro de alcance nacional y se fundó en 1993 como grupo de trabajo de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)19.
El presente estudio describe la evolución del FEV1 en pacientes pertenecientes al REDAAT, centrándose en los parámetros que potencialmente podrían tener un valor predictivo de un deterioro rápido de la función pulmonar20.
MétodoA partir de la información recogida en la base de datos del REDAAT, realizamos un estudio retrospectivo en pacientes con DAAT. Los objetivos de este estudio fueron: a) describir las características de los pacientes diagnosticados de DAAT en España; b) observar la tasa de descenso del FEV1 de los pacientes que habían estado o están actualmente en tratamiento sustitutivo y los que no, y c) identificar los factores asociados a una mayor tasa de descenso del FEV1.
ParticipantesLos datos que se incluyen en este estudio proceden de los sujetos con DAAT incluidos en el REDAAT. Se puede acceder al REDAAT a través de su página web (www.redaat.es), que cumple todos los requisitos relacionados con la protección de datos personales de acuerdo con la legislación española. Su página tiene la certificación como Web Médica Acreditada por la comisión del Colegio de Médicos de Barcelona. Aunque la recomendación del REDAAT es incluir datos sobre las visitas de seguimiento de forma semestral, no se dispone del seguimiento evolutivo de la mayoría de los individuos registrados. Para lograr los objetivos del estudio, se contactó con todos los médicos colaboradores del registro por correo postal, correo electrónico y/o teléfono para solicitar datos relativos al seguimiento de sus pacientes. Los datos así obtenidos fueron incluidos de manera anónima a una base de datos en formato Access, y se comprobó su calidad y la frecuencia de datos ausentes. El estudio se llevó a cabo de acuerdo con los principios de la Declaración de Helsinki, las guías de buena práctica en investigación epidemiológica y las reglamentaciones locales para el empleo de bases de datos de estudios.
Los criterios de inclusión del estudio fueron: a) déficit grave de AAT, demostrado por unos niveles séricos de AAT inferiores a 50mg/dl con fenotipo Pi ZZ u otras variantes alélicas deficitarias, tales como PiBarcelona21, y b) disponer de al menos 2 espirometrías en un intervalo temporal de más de 6 meses con el fin de analizar la tasa de descenso del FEV1. Los criterios de exclusión fueron la presencia de otros fenotipos deficitarios no graves, pacientes heterocigotos Pi MZ, Pi MS, Pi SZ, y pacientes que se habían sometido a trasplante o cirugía de reducción de volumen pulmonar.
MedicionesLa base de datos del REDAAT contiene las mismas variables que el registro internacional (Alpha One International Registry [AIR])8 e incluye parámetros sociodemográficos (tales como edad, sexo, peso, hábito tabáquico y tasa de consumo acumulado de tabaco), la razón para la determinación de niveles de AAT en función de: existencia de alguna patología relacionada (enfermedad pulmonar, enfermedad hepática, otra), existencia de antecedentes familiares o motivado por programas de cribado poblacional.
Las espirometrías se realizaron en cada centro participante y fueron revisadas y remitidas por especialistas en Neumología. Las medidas repetidas para cada paciente se realizaron siempre en el mismo centro.
También se recogió información de las siguientes variables clínicas: presencia de enfisema, bronquiectasias y asma; edad de instauración de los síntomas; semiología principal, e historia previa de neumonía. Entre las comorbilidades más relevantes se incluyen diabetes mellitus, enfermedad cardiovascular e insuficiencia renal o hepática según la codificación de CIE-9. La base de datos comprende datos terapéuticos relacionados con la enfermedad pulmonar (tratamiento farmacológico y oxigenoterapia crónica) y procedimientos tales como trasplante pulmonar o hepático y cirugía de reducción de volumen pulmonar.
También se documentó si el paciente había recibido alguna vez o estaba recibiendo tratamiento sustitutivo. En España, las indicaciones de tratamiento sustitutivo son las siguientes: déficit grave de AAT (fenotipo ZZ u otra variante rara deficitaria) con función pulmonar deteriorada o evidencia de una pérdida acelerada de función pulmonar medidos por espirometría forzada22. Sobre la base de estudios farmacocinéticos, las dosis recomendadas son 60mg/kg/7 días, 120mg/kg/15 días y 180mg/kg/21 días, con ajuste de dosis en función de los niveles valle de AAT plasmáticos23.
Análisis estadísticoLa variable principal a analizar fue la tasa anual de descenso del FEV1 expresada en ml/año. Para el análisis de esta variable se calculó la diferencia entre FEV1 final y basal (ΔFEV1 final-basal). La diferencia, obtenida en ml, se dividió por el número de meses de seguimiento y se multiplicó por 12 para obtener la caída en ml/año, en un análisis inicial-final, según el método utilizado en el estudio de Dirksen et al.24. El valor basal se definió como el mayor de las primeras 2 mediciones, espaciadas por menos de 6 meses, dado que se observó que algunos pacientes experimentaron una mejoría significativa en la función pulmonar en el intervalo de tiempo entre 2 espirometrías consecutivas debido a la optimización del tratamiento de la EPOC posterior a su diagnóstico.
Las características basales se describieron en tablas de frecuencia (variables categóricas) y medidas de tendencia central o dispersión (variables continuas). Debido al pequeño tamaño muestral se emplearon test no paramétricos. Las variables continuas se compararon mediante el test de la U de Mann Whitney o los test de Wilcoxon/Kruskal-Wallis (método de análisis de la varianza empleando test no paramétricos) en función de los grupos de comparación. Las variables categóricas se compararon empleando la χ2 o la prueba exacta de Fisher.
Así mismo, se efectuó un análisis multivariante para identificar factores asociados con el descenso rápido de la función pulmonar mediante un modelo de regresión logística por pasos (stepwise). Para ello se creó la variable principal clasificando la muestra como el subgrupo de pacientes con pérdida acelerada (agrupando los valores inferiores al valor correspondiente al primer tercil) o pérdida lenta (valores superiores al valor correspondiente al tercer tercil). Se incluyeron las siguientes variables: edad, sexo, FEV1 basal posbroncodilatador (en % sobre el teórico), tabaquismo (activo o ex fumador) frente a nunca fumador, índice de masa corporal (IMC), historia de asma o neumonía, número de años de seguimiento, número de mediciones del FEV1 a lo largo del seguimiento, y el hecho de haber recibido o no tratamiento sustitutivo. El análisis estadístico se llevó a cabo con la versión 17 del programa SPSS® y el nivel de significación estadística fijado previamente fue de 0,05.
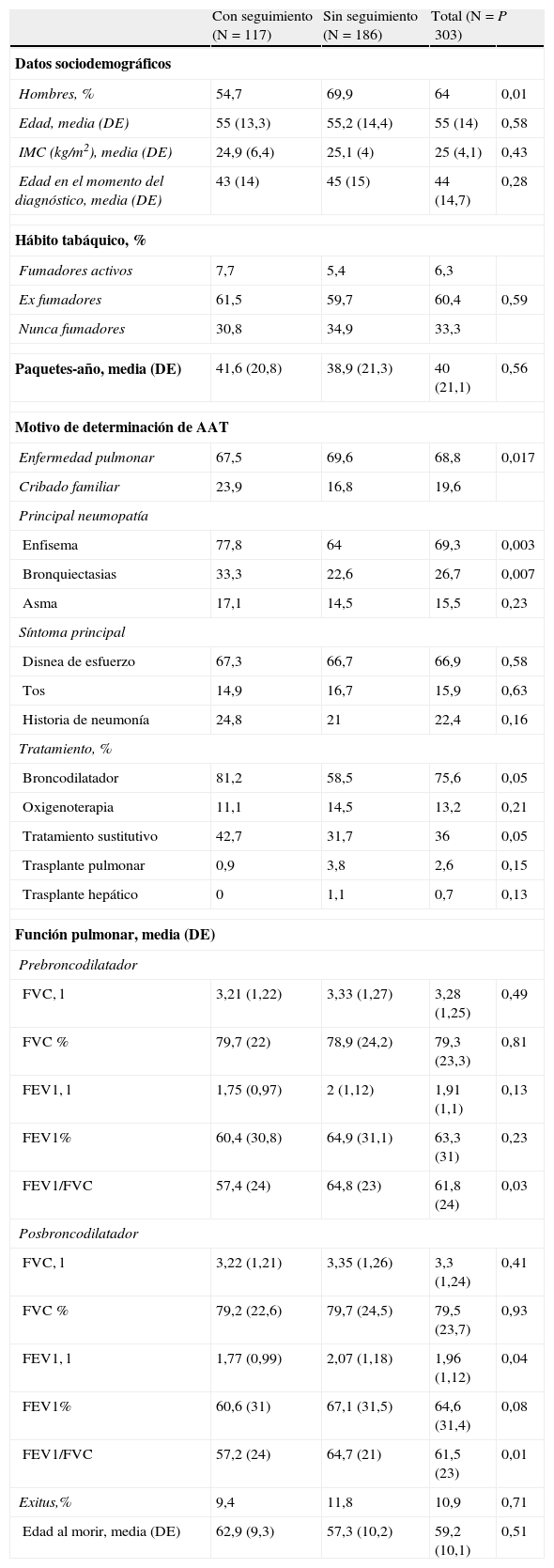
ResultadosCaracterísticas basalesDe la población de 348 pacientes incluidos en el registro español entre 1993 y junio de 2009, se identificaron 303 pacientes con fenotipo Pi ZZ. De estos, 194 (64%) eran hombres. La edad media fue de 54,9 años (DE=14 años), y la edad media en el momento del diagnóstico, 44,1 años (DE=14,7 años). Un total de 101 pacientes (33,3%) nunca fueron fumadores. La mayoría (68,8%) eran casos índice (diagnosticados tras un estudio a raíz de su patología pulmonar) y 59 (19,6%) fueron detectados por estudio familiar. Los pacientes mostraron un FEV1 medio de 1,91 L (DE=1,1 l) o 63,3% (DE=31%) de su FEV1 teórico. La prevalencia de comorbilidad significativa fue muy baja, tan solo 16 casos (5,3%), de los cuales 11 refirieron sufrir comorbilidad cardiaca (3,6%).
Un total de 109 pacientes (36%) habían recibido tratamiento sustitutivo en algún momento del período de seguimiento y 33 pacientes fallecieron durante el mismo (10,9%), con una edad media en el momento de la muerte de 59,2 años (DE=10,1 años). Las características basales de la población se presentan en la tabla 1.
Características basales de los pacientes en función del seguimiento
| Con seguimiento (N=117) | Sin seguimiento (N=186) | Total (N=303) | P | |
| Datos sociodemográficos | ||||
| Hombres, % | 54,7 | 69,9 | 64 | 0,01 |
| Edad, media (DE) | 55 (13,3) | 55,2 (14,4) | 55 (14) | 0,58 |
| IMC (kg/m2), media (DE) | 24,9 (6,4) | 25,1 (4) | 25 (4,1) | 0,43 |
| Edad en el momento del diagnóstico, media (DE) | 43 (14) | 45 (15) | 44 (14,7) | 0,28 |
| Hábito tabáquico, % | ||||
| Fumadores activos | 7,7 | 5,4 | 6,3 | |
| Ex fumadores | 61,5 | 59,7 | 60,4 | 0,59 |
| Nunca fumadores | 30,8 | 34,9 | 33,3 | |
| Paquetes-año, media (DE) | 41,6 (20,8) | 38,9 (21,3) | 40 (21,1) | 0,56 |
| Motivo de determinación de AAT | ||||
| Enfermedad pulmonar | 67,5 | 69,6 | 68,8 | 0,017 |
| Cribado familiar | 23,9 | 16,8 | 19,6 | |
| Principal neumopatía | ||||
| Enfisema | 77,8 | 64 | 69,3 | 0,003 |
| Bronquiectasias | 33,3 | 22,6 | 26,7 | 0,007 |
| Asma | 17,1 | 14,5 | 15,5 | 0,23 |
| Síntoma principal | ||||
| Disnea de esfuerzo | 67,3 | 66,7 | 66,9 | 0,58 |
| Tos | 14,9 | 16,7 | 15,9 | 0,63 |
| Historia de neumonía | 24,8 | 21 | 22,4 | 0,16 |
| Tratamiento, % | ||||
| Broncodilatador | 81,2 | 58,5 | 75,6 | 0,05 |
| Oxigenoterapia | 11,1 | 14,5 | 13,2 | 0,21 |
| Tratamiento sustitutivo | 42,7 | 31,7 | 36 | 0,05 |
| Trasplante pulmonar | 0,9 | 3,8 | 2,6 | 0,15 |
| Trasplante hepático | 0 | 1,1 | 0,7 | 0,13 |
| Función pulmonar, media (DE) | ||||
| Prebroncodilatador | ||||
| FVC, l | 3,21 (1,22) | 3,33 (1,27) | 3,28 (1,25) | 0,49 |
| FVC % | 79,7 (22) | 78,9 (24,2) | 79,3 (23,3) | 0,81 |
| FEV1, l | 1,75 (0,97) | 2 (1,12) | 1,91 (1,1) | 0,13 |
| FEV1% | 60,4 (30,8) | 64,9 (31,1) | 63,3 (31) | 0,23 |
| FEV1/FVC | 57,4 (24) | 64,8 (23) | 61,8 (24) | 0,03 |
| Posbroncodilatador | ||||
| FVC, l | 3,22 (1,21) | 3,35 (1,26) | 3,3 (1,24) | 0,41 |
| FVC % | 79,2 (22,6) | 79,7 (24,5) | 79,5 (23,7) | 0,93 |
| FEV1, l | 1,77 (0,99) | 2,07 (1,18) | 1,96 (1,12) | 0,04 |
| FEV1% | 60,6 (31) | 67,1 (31,5) | 64,6 (31,4) | 0,08 |
| FEV1/FVC | 57,2 (24) | 64,7 (21) | 61,5 (23) | 0,01 |
| Exitus,% | 9,4 | 11,8 | 10,9 | 0,71 |
| Edad al morir, media (DE) | 62,9 (9,3) | 57,3 (10,2) | 59,2 (10,1) | 0,51 |
AAT: alfa-1-antitripsina; IMC: índice de masa corporal; FEV1: volumen espiratorio forzado máximo en el primer segundo; FVC: capacidad vital forzada.
Se obtuvieron 2 o más determinaciones del FEV1 en una muestra de 117 pacientes (38,6% del total). En la tabla 1 se muestran las características demográficas y clínicas distintivas entre los pacientes con y sin datos de seguimiento funcional. Pocas variables mostraron diferencias significativas entre los pacientes con o sin seguimiento, incluso su FEV1 basal prebroncodilatador (en % del teórico) (60,4% [DE=30,8%] frente a 64,9% [DE=31,1%]; p=0,23, respectivamente) no fue significativamente diferente. Los pacientes con seguimiento espirométrico mostraron en cambio mayor probabilidad de haber sido diagnosticados por cribado familiar (23,9% frente a 16,8%; p=0,017) y experimentaron una mayor prevalencia de enfisema y bronquiectasias en comparación con los pacientes sin seguimiento espirométrico.
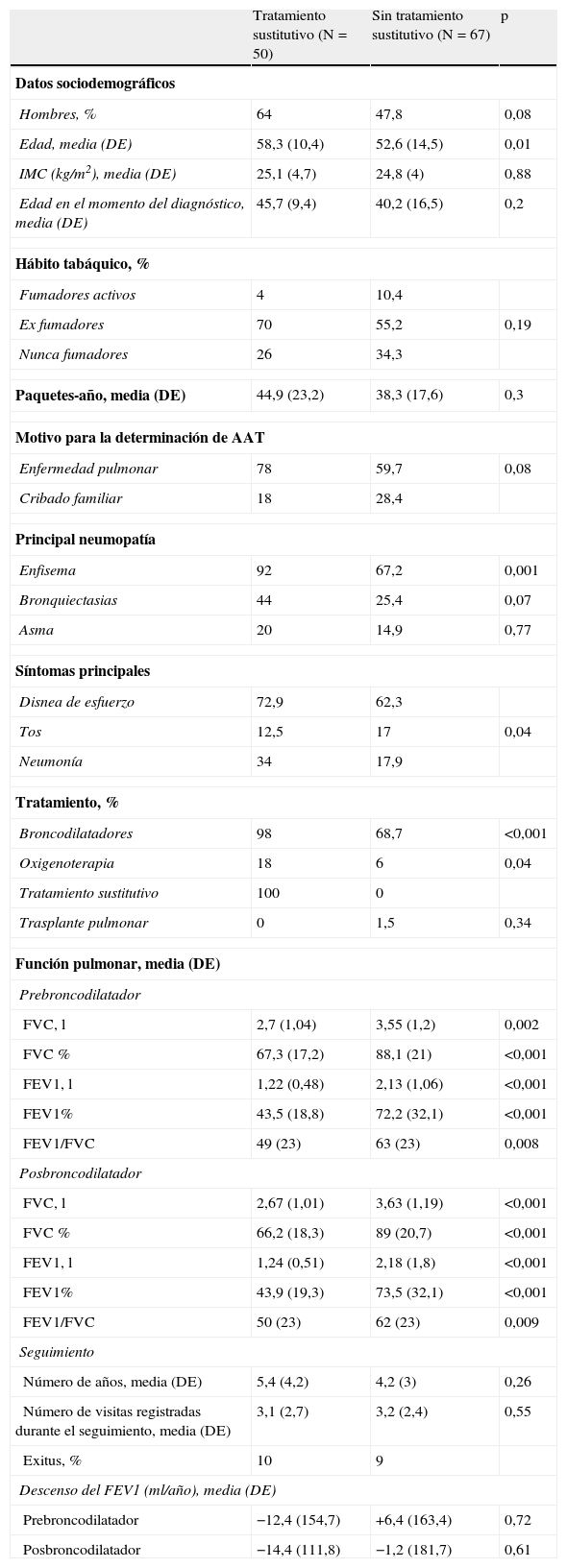
Tratamiento sustitutivoDe los 117 pacientes con datos espirométricos, 50 (42,7%) recibieron tratamiento sustitutivo en algún momento de su evolución. La tabla 2 resume las características de los pacientes con y sin tratamiento sustitutivo. Los pacientes en tratamiento sustitutivo fueron con mayor frecuencia hombres, tuvieron también mayor frecuencia de enfermedad pulmonar, particularmente enfisema, y mostraron mayor prevalencia de disnea de esfuerzo. Así mismo, se observó una incidencia más alta de neumonía, un mayor uso de broncodilatadores y demás medicación respiratoria, y una mayor probabilidad de precisar oxigenoterapia domiciliaria.
Pacientes con seguimiento: comparación en función de la prescripción de tratamiento sustitutivo
| Tratamiento sustitutivo (N=50) | Sin tratamiento sustitutivo (N=67) | p | |
| Datos sociodemográficos | |||
| Hombres, % | 64 | 47,8 | 0,08 |
| Edad, media (DE) | 58,3 (10,4) | 52,6 (14,5) | 0,01 |
| IMC (kg/m2), media (DE) | 25,1 (4,7) | 24,8 (4) | 0,88 |
| Edad en el momento del diagnóstico, media (DE) | 45,7 (9,4) | 40,2 (16,5) | 0,2 |
| Hábito tabáquico, % | |||
| Fumadores activos | 4 | 10,4 | |
| Ex fumadores | 70 | 55,2 | 0,19 |
| Nunca fumadores | 26 | 34,3 | |
| Paquetes-año, media (DE) | 44,9 (23,2) | 38,3 (17,6) | 0,3 |
| Motivo para la determinación de AAT | |||
| Enfermedad pulmonar | 78 | 59,7 | 0,08 |
| Cribado familiar | 18 | 28,4 | |
| Principal neumopatía | |||
| Enfisema | 92 | 67,2 | 0,001 |
| Bronquiectasias | 44 | 25,4 | 0,07 |
| Asma | 20 | 14,9 | 0,77 |
| Síntomas principales | |||
| Disnea de esfuerzo | 72,9 | 62,3 | |
| Tos | 12,5 | 17 | 0,04 |
| Neumonía | 34 | 17,9 | |
| Tratamiento, % | |||
| Broncodilatadores | 98 | 68,7 | <0,001 |
| Oxigenoterapia | 18 | 6 | 0,04 |
| Tratamiento sustitutivo | 100 | 0 | |
| Trasplante pulmonar | 0 | 1,5 | 0,34 |
| Función pulmonar, media (DE) | |||
| Prebroncodilatador | |||
| FVC, l | 2,7 (1,04) | 3,55 (1,2) | 0,002 |
| FVC % | 67,3 (17,2) | 88,1 (21) | <0,001 |
| FEV1, l | 1,22 (0,48) | 2,13 (1,06) | <0,001 |
| FEV1% | 43,5 (18,8) | 72,2 (32,1) | <0,001 |
| FEV1/FVC | 49 (23) | 63 (23) | 0,008 |
| Posbroncodilatador | |||
| FVC, l | 2,67 (1,01) | 3,63 (1,19) | <0,001 |
| FVC % | 66,2 (18,3) | 89 (20,7) | <0,001 |
| FEV1, l | 1,24 (0,51) | 2,18 (1,8) | <0,001 |
| FEV1% | 43,9 (19,3) | 73,5 (32,1) | <0,001 |
| FEV1/FVC | 50 (23) | 62 (23) | 0,009 |
| Seguimiento | |||
| Número de años, media (DE) | 5,4 (4,2) | 4,2 (3) | 0,26 |
| Número de visitas registradas durante el seguimiento, media (DE) | 3,1 (2,7) | 3,2 (2,4) | 0,55 |
| Exitus, % | 10 | 9 | |
| Descenso del FEV1 (ml/año), media (DE) | |||
| Prebroncodilatador | −12,4 (154,7) | +6,4 (163,4) | 0,72 |
| Posbroncodilatador | −14,4 (111,8) | −1,2 (181,7) | 0,61 |
AAT: alfa-1-antitripsina; IMC: índice de masa corporal; FEV1: volumen espiratorio forzado máximo en el primer segundo; FVC: capacidad vital forzada.
La función pulmonar fue peor en los pacientes que recibieron tratamiento sustitutivo, con un FEV1(%) medio de 43,5% (DE=18,8%) en comparación con el valor observado en los que no recibieron tratamiento sustitutivo, que fue del 72,2% (DE=32,1%) (p<0,001). No se detectaron diferencias estadísticamente significativas entre los 2 grupos respecto a la tasa de descenso del FEV1, tanto pre como posbroncodilatador (tabla 2).
Tasa de deterioro del FEV1De los 117 pacientes con seguimiento espirométrico, 16 fueron excluidos para el análisis de la variable principal, bien porque sus determinaciones no estaban espaciadas al menos 6 meses, o no se disponía de la fecha de la determinación. Por lo tanto, este análisis se llevó a cabo en 101 pacientes (33,3% del total de la población y 83,3% de los que disponían de seguimiento).
El tiempo medio de seguimiento fue 4,7 años (DE=3,6 años) y el promedio de mediciones del FEV1 por paciente fue de 3,1 (DE=2,5). El cambio medio observado en el FEV1 fue +6,9ml/año, con una amplia variabilidad (DE=154ml/año).
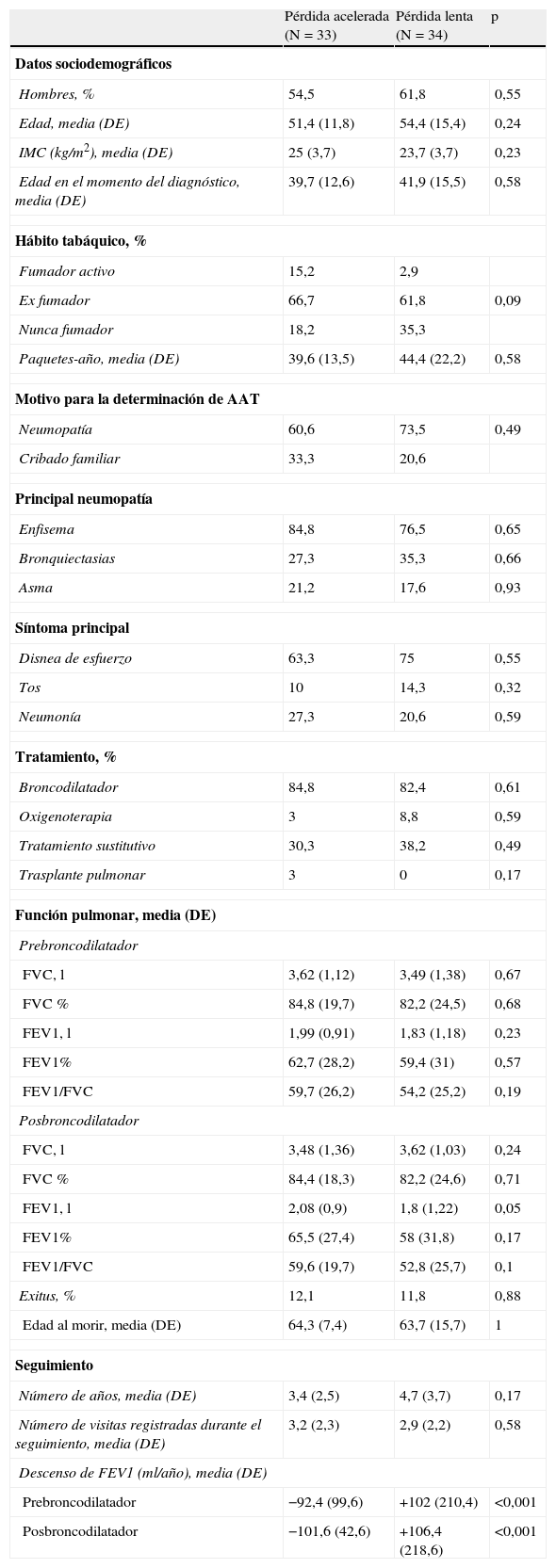
Para el análisis de los factores asociados a una tasa rápida de descenso del FEV1, la población se dividió en 3 terciles según su tasa de descenso del FEV1 posbroncodilatador. El primer tercil o «declinadores rápidos» experimentaron una tasa media de descenso del FEV1 de –101,6ml/año (DE=42,6ml/año), el tercer tercil o «declinadores lentos» experimentaron una tasa de descenso de FEV1 «positiva» (ganancia) de +106,4ml/año (DE=218ml/año), y el tercil intermedio mostró una tasa de media de descenso de su FEV1 de –28,4ml/año (DE=14ml/año). Para analizar las características de los pacientes con diferentes tasas de deterioro de la función pulmonar se compararon las características de los pacientes declinadores rápidos y lentos (primer y tercer tercil) (tabla 3).
Pacientes con seguimientos registrados: comparación entre los pacientes con pérdida acelerada y pérdida lenta
| Pérdida acelerada (N=33) | Pérdida lenta (N=34) | p | |
| Datos sociodemográficos | |||
| Hombres, % | 54,5 | 61,8 | 0,55 |
| Edad, media (DE) | 51,4 (11,8) | 54,4 (15,4) | 0,24 |
| IMC (kg/m2), media (DE) | 25 (3,7) | 23,7 (3,7) | 0,23 |
| Edad en el momento del diagnóstico, media (DE) | 39,7 (12,6) | 41,9 (15,5) | 0,58 |
| Hábito tabáquico, % | |||
| Fumador activo | 15,2 | 2,9 | |
| Ex fumador | 66,7 | 61,8 | 0,09 |
| Nunca fumador | 18,2 | 35,3 | |
| Paquetes-año, media (DE) | 39,6 (13,5) | 44,4 (22,2) | 0,58 |
| Motivo para la determinación de AAT | |||
| Neumopatía | 60,6 | 73,5 | 0,49 |
| Cribado familiar | 33,3 | 20,6 | |
| Principal neumopatía | |||
| Enfisema | 84,8 | 76,5 | 0,65 |
| Bronquiectasias | 27,3 | 35,3 | 0,66 |
| Asma | 21,2 | 17,6 | 0,93 |
| Síntoma principal | |||
| Disnea de esfuerzo | 63,3 | 75 | 0,55 |
| Tos | 10 | 14,3 | 0,32 |
| Neumonía | 27,3 | 20,6 | 0,59 |
| Tratamiento, % | |||
| Broncodilatador | 84,8 | 82,4 | 0,61 |
| Oxigenoterapia | 3 | 8,8 | 0,59 |
| Tratamiento sustitutivo | 30,3 | 38,2 | 0,49 |
| Trasplante pulmonar | 3 | 0 | 0,17 |
| Función pulmonar, media (DE) | |||
| Prebroncodilatador | |||
| FVC, l | 3,62 (1,12) | 3,49 (1,38) | 0,67 |
| FVC % | 84,8 (19,7) | 82,2 (24,5) | 0,68 |
| FEV1, l | 1,99 (0,91) | 1,83 (1,18) | 0,23 |
| FEV1% | 62,7 (28,2) | 59,4 (31) | 0,57 |
| FEV1/FVC | 59,7 (26,2) | 54,2 (25,2) | 0,19 |
| Posbroncodilatador | |||
| FVC, l | 3,48 (1,36) | 3,62 (1,03) | 0,24 |
| FVC % | 84,4 (18,3) | 82,2 (24,6) | 0,71 |
| FEV1, l | 2,08 (0,9) | 1,8 (1,22) | 0,05 |
| FEV1% | 65,5 (27,4) | 58 (31,8) | 0,17 |
| FEV1/FVC | 59,6 (19,7) | 52,8 (25,7) | 0,1 |
| Exitus, % | 12,1 | 11,8 | 0,88 |
| Edad al morir, media (DE) | 64,3 (7,4) | 63,7 (15,7) | 1 |
| Seguimiento | |||
| Número de años, media (DE) | 3,4 (2,5) | 4,7 (3,7) | 0,17 |
| Número de visitas registradas durante el seguimiento, media (DE) | 3,2 (2,3) | 2,9 (2,2) | 0,58 |
| Descenso de FEV1 (ml/año), media (DE) | |||
| Prebroncodilatador | −92,4 (99,6) | +102 (210,4) | <0,001 |
| Posbroncodilatador | −101,6 (42,6) | +106,4 (218,6) | <0,001 |
AAT: alfa-1 antitripsina; IMC: índice de masa corporal; FEV1: volumen espiratorio forzado máximo en el primer segundo; FVC: capacidad vital forzada.
Se apreciaron pocas diferencias entre los pacientes que experimentaron una «caída rápida» frente a los que mostraron una «caída lenta». En el primer grupo había menos no fumadores (18,2% frente a 35,3%; p=0,09) y la edad de instauración de los síntomas fue más precoz (31,2 frente a 38,6 años; p=0,034). La función pulmonar basal, representada por el FEV1 (%) medio prebroncodilator fue similar en ambos grupos: «caída rápida», 62,7% (DE=28,2%) frente a «caída lenta», 59,4% (DE=31%); p=0,57).
En el modelo de regresión logística por pasos (stepwise), con la variable dependiente «caída rápida», las siguientes variables se asociaron de manera significativa e independiente con una tasa de deterioro del FEV1 más acelerada: a) ser fumador o exfumador frente a no fumador (OR=10,31; intervalo de confianza (IC) del 95%=1,8-58,8; p=0,008) y b) tener un mayor FEV1 (%) posbroncodilatador basal (OR=1,03; IC del 95%=1,005-1,06; p=0,018). Además, se apreció una tendencia a la asociación entre el índice de masa corporal (IMC) y el hecho de experimentar una mayor tasa de pérdida de función pulmonar, que no llegó al nivel de significación estadística (OR=1,14; IC del 95%=0,98-1,33; p=0,085) (tabla 4). Para validar el modelo se empleó la prueba de Hosmer-Lemeshow, cuyo resultado confirmó la bondad del ajuste con un valor de p de 0,29 (si p>0,05, se acepta la hipótesis nula).
Identificación de variables asociadas al descenso del FEV1 posbroncodilatador mediante análisis de regresión logística por pasos (Stepwise Logistic Regression Analysis)
| Variable | OR | IC del 95% | Valor de p |
| Hábito tabáquico (activo y ex fumador frente a nunca fumador) | 10,31 | 1,85-58,82 | 0,008 |
| FEV1 posbroncodilator basal (% predicho) | 1,03 | 1,005-1,06 | 0,018 |
| IMC | 1,14 | 0,98-1,33 | 0,085 |
IMC: índice de masa corporal; FEV1: volumen espiratorio forzado máximo en el primer segundo; OR: odds ratio; IC: intervalo de confianza.
Este estudio retrospectivo realizado a partir de los datos incluidos en el REDAAT ha mostrado que existe una gran variabilidad en la tasa anual de caída del FEV1 en pacientes con DAAT y que los factores de riesgo asociados a una tasa acelerada de descenso del FEV1 fueron la historia de tabaquismo, una mejor función pulmonar al inicio del seguimiento y un bajo IMC. Cuando se procedió a comparar la tasa de descenso del FEV1 en los pacientes que recibieron alguna vez o recibían tratamiento sustitutivo frente a los que nunca lo recibieron, no se apreciaron diferencias estadísticamente significativas en su tasa anual de caída del FEV1.
Todavía no ha sido posible reclutar el número suficiente de pacientes con DAAT para llevar a cabo un estudio aleatorizado, con suficiente potencia estadística, para demostrar la eficacia del tratamiento sustitutivo en reducir la velocidad de deterioro de la función pulmonar. Con la finalidad de superar las dificultades metodológicas planteadas debido a la baja prevalencia del DAAT y la probabilidad tan variable de desarrollar síntomas relacionados a pesar de padecer el DAAT, se han creado un serie de registros para recoger y analizar datos clínicos de individuos con DAAT ajustándose a la vida real8,25,26. Estos registros brindan la oportunidad de evaluar grandes cohortes de individuos de una manera casi experimental y más próxima a las condiciones reales, a lo largo de extensos períodos de tiempo. Sus criterios de exclusión son menos estrictos que los ensayos clínicos, y no existe el requisito de la prescripción de un determinado tratamiento para la participación de los individuos incluidos. En consecuencia, los estudios observacionales con pacientes reclutados en registros han permitido investigar el impacto del tratamiento sustitutivo sobre la velocidad de caída del FEV1 y sobre la supervivencia7,17,27,28.
Los registros de DAAT pueden tener diferentes objetivos y examinar poblaciones no homogéneas para esta alteración genética. Por ejemplo, el NHLBI Alpha-1-Antitrypsin Deficiency Registry se fundó en 1988 con el objetivo de caracterizar el curso clínico de esta enfermedad en 1.000 individuos con DAAT empleando los datos recogidos a lo largo de 7 años en centros de Estados Unidos y Canadá25. Las tasas de descenso de la función pulmonar y de supervivencia fueron aspectos claves evaluados en este registro. Un segundo registro de gran magnitud, el AOF-RNR, se creó en el año 2000 por iniciativa de una fundación de pacientes afectados (Alpha One Foundation, Miami, Estados Unidos) con el objetivo de describir la mayor población posible de individuos deficientes para facilitar futuros estudios clínicos26. El fenotipo de los pacientes incluidos en el AOF-RNR fue reportado por los propios pacientes y, en consecuencia, el registro contiene pacientes con genotipos sin confirmar. El AIR (Alpha-1 International Registry) se fundó en 1998 en respuesta a las recomendaciones de la Organización Mundial de la Salud8. El objetivo de esta iniciativa fue crear una base de datos común y centralizada para obtener conocimiento acerca del DAAT mediante la recogida de datos de pacientes de más de 20 países participantes. Con 2.627 sujetos reclutados hasta 2006, AIR es el más extenso y contiene el mayor volumen de datos clínicos y demográficos de individuos con DAAT8.
El registro español de pacientes con DAAT se fundó en 1993 con los objetivos de: a) conocer las características y la frecuencia del DAAT en España; b) establecer normativas adaptadas a nuestro entorno sobre el tratamiento y el seguimiento de pacientes con el déficit; c) ofrecer información a los médicos que tratan a estos pacientes en toda España; d) incrementar el conocimiento y el interés por esta enfermedad e intentar disminuir el infradiagnóstico y el retraso en el diagnóstico, y e) ofrecer soporte técnico para la determinación del fenotipo Pi y, si fuera necesario, del genotipo en los individuos con sospecha del déficit19,20,29.
La población analizada en este estudio incluía solo pacientes con DAAT grave. Se apreciaron diferencias y semejanzas con respecto a las características basales reportadas en los registros AIR, NHLBI y AOF-RNR. En la población española, el 64% resultaron ser hombres, en comparación con 56%, que es la media en el resto de registros. Del mismo modo, la edad media de los pacientes de la población española fue ligeramente superior comparada con otros registros (55 años frente a 46-50 años, respectivamente). La proporción de pacientes identificados por estudio familiar fue similar en el NHLBI, en el AIR y en el registro español8. En este último, el 6% eran fumadores activos, a diferencia de los registros AIR, NHLBI y AOF-RNR, en los que se describió el 10, el 8 y el 2%, respectivamente. La baja tasa de tabaquismo observada en el registro del AOF-RNR podría reflejar un mayor grado de concienciación acerca de los riesgos asociados al tabaco en los propios pacientes que padecen DAAT8. El FEV1(%) medio fue inferior en la población del NHLBI en comparación con la población española (47% frente a 63%), y la mayoría de pacientes del registro NHLBI estaban recibiendo o habían recibido previamente tratamiento sustitutivo (66% frente al 36%, respectivamente)7,30.
El método utilizado para calcular la tasa de caída de la función pulmonar se basa en la medición de los dos valores extremos en el seguimiento. Este método ha sido utilizado en un ensayo clínico con AAT intravenosa junto con un método de regresión lineal, y ambos ofrecieron resultados similares24, por lo que hemos adoptado el método descrito (end-point analysis). Los hallazgos encontrados en nuestro análisis de regresión logística —que ser fumador y tener una mayor FEV1 basal posbroncodilatador estarían significativa e independientemente asociados a una tasa más rápida de descenso del FEV1— son observaciones importantes de este estudio. Los resultados están en concordancia con los hallazgos de estudios previos. Tanto en el registro NHLBI7 como en el registro sueco de DAAT31 se apreció un deterioro más rápido de la función pulmonar en fumadores activos que en ex fumadores y nunca fumadores, mientras que Dowson et al.32 han demostrado que el deterioro del FEV1 es mayor en individuos con peor FEV1 posbroncodilatador. Además, Dawkins et al. observaron un mayor grado de descenso de la función pulmonar en individuos con enfermedad moderada-grave en comparación con aquellos con afectación muy grave33.
Los resultados, asimismo, mostraron una tendencia a la asociación entre un bajo IMC y la probabilidad de experimentar una tasa de descenso más rápida del FEV133. De forma consistente, estudios previos han demostrado que un IMC bajo es un predictor independiente de mortalidad en pacientes con DAAT34.
Diversos estudios han mostrado que el tratamiento sustitutivo puede enlentecer la tasa de descenso de la función pulmonar7,17,27,28, reducir la pérdida de tejido pulmonar y la progresión del enfisema24, y aumentar la supervivencia en pacientes con DAAT7. En el registro español, sin embargo, no se apreció una diferencia significativa en la tasa de descenso del FEV1 en función de que los pacientes recibieran o no tratamiento sustitutivo. Aunque este podría ser un hallazgo inesperado, es importante reconocer que ambos grupos tenían características basales considerablemente distintas. Los pacientes que recibían tratamiento sustitutivo eran con mayor frecuencia hombres con enfermedad pulmonar y con mayor disnea de esfuerzo que los que no recibían tratamiento sustitutivo. Además, los pacientes con tratamiento sustitutivo tuvieron mayor incidencia de neumonía, mayor utilización de medicación para su enfermedad respiratoria y mayor uso de oxigenoterapia crónica domiciliaria. También el FEV1 medio de los pacientes en tratamiento sustitutivo fue significativamente inferior al del grupo que no recibió tratamiento sustitutivo. Las diferencias entre los grupos en condiciones basales excluyen la posibilidad de una evaluación fiable de los efectos del tratamiento sustitutivo en la tasa de descenso del FEV1, y es un ejemplo más de los retos que se deben afrontar al interpretar datos derivados de estudios observacionales como los registros. Por ejemplo, la decisión de la prescripción corresponde a cada médico en función de la gravedad y el pronóstico de cada paciente, lo cual suele derivar en un sesgo por indicación al asignar el tratamiento de forma preferente a los pacientes más graves o con más factores de riesgo de mal pronóstico. De igual modo, no es posible analizar la influencia de la medicación respiratoria sobre la caída del FEV1 ya que existe un sesgo de indicación, al prescribir más medicación a los pacientes más graves o que presentan una peor evolución clínica. En este estudio no fue posible evaluar la influencia de otras estrategias de tratamiento como la rehabilitación respiratoria, ya que esta variable no fue incluida en la base de datos original del registro internacional.
Otros factores, tales como las infecciones respiratorias y la edad, pueden modular el deterioro de la función pulmonar a lo largo del tiempo, aunque con una menor intensidad. El papel que desempeñan estos factores no es tan importante como el tabaquismo, y es necesario estudiar grandes cohortes de pacientes para observar su posible impacto.
Además de las limitaciones derivadas de las diferentes características de los pacientes con o sin tratamiento sustitutivo, existen otras consideraciones que se deben tener en cuenta al interpretar los hallazgos que aquí se presentan. En primer lugar, el registro español no es un registro poblacional y puede no ser representativo de todos los individuos con este trastorno genético. El registro recoge una alta proporción de pacientes diagnosticados de DAAT debido a presentar una enfermedad pulmonar, preferentemente enfisema, pero los individuos asintomáticos están poco representados. Es posible que los individuos sintomáticos y asintomáticos experimenten diferentes tasas de deterioro de su función pulmonar, incluso después de controlar por factores como el hábito tabáquico y los valores iniciales de función pulmonar. Por otra parte, tan solo un tercio de los pacientes inicialmente identificados disponían de seguimiento y, por tanto, fueron válidos para el análisis de la variable principal. Diferencias tales como tener peor función pulmonar basal fueron datos que se apreciaron en el grupo con seguimiento y apto para el cálculo de la caída del FEV1, en comparación con el grupo sin seguimiento. Por lo tanto, no se asume que los resultados que aquí se presentan se puedan aplicar de manera generalizada a todos los pacientes del registro.
A pesar de las limitaciones, los hallazgos descritos en este análisis añaden información valiosa sobre la historia natural de la enfermedad y sugieren varios parámetros con un potencial valor predictivo en la detección del deterioro rápido de la función pulmonar en los individuos afectados.
ConclusionesLa tasa de deterioro de la función pulmonar en pacientes con DAAT varía de manera ostensible. El registro español ha proporcionado datos que muestran que fumar y tener una función pulmonar más preservada se relacionan de forma significativa con un descenso acelerado del FEV1, lo que sugiere que los pacientes más jóvenes, con función pulmonar normal o apenas deteriorada, deben ser sometidos a un seguimiento evolutivo más intenso junto a un enérgico consejo antitabaco.
La cooperación de múltiples investigadores en un registro nacional no es tarea fácil, y la recogida de datos de manera prospectiva requiere una intensa motivación. Los registros centralizados, tales como el británico o el de los Países Bajos, son más apropiados para la recogida de datos de forma longitudinal. Deberían ponerse en marcha nuevas estrategias para incentivar a los médicos a incluir y actualizar periódicamente el seguimiento de sus pacientes en las bases de datos de los registros.
Conflicto de interesesLos autores declaran no tener conflicto de intereses relacionados con este manuscrito.
El presente estudio ha sido financiado con una ayuda a la investigación de Talecris Biotherapeutics GmbH (Fráncfort del Meno, Alemania).
Este estudio ha sido financiado por Talecris Biotherapeutics GmbH, Alemania. Además, Martin Kenig, DPhil, de PAREXEL, ha prestado su apoyo a la redacción del manuscrito, bajo la dirección de los autores, contando con el apoyo económico de Talecris Biotherapeutics, Inc.
Los autores agradecen la colaboración de todos los médicos participantes en el REDAAT que con sus datos han hecho posible este estudio. También desean agradecer a los Drs. Rosendo Jardí y Francisco Rodríguez-Frías (Servicio de Bioquímica, Hospital Universitario Vall d’Hebron, Barcelona) su colaboración en la determinación de fenotipos y genotipos de casos incluidos en el REDAAT, y a Montse Pérez su ayuda en el análisis estadístico.
Constitución del REDAAT: Coordinadores: Francisco Casas-Maldonado (Granada), Maria Teresa Martínez (Madrid); Gestión: Beatriz Lara (Lleida); Comité asesor: Ignacio Blanco (Langreo), Ana Bustamante (Torrelavega), Sergio Cadenas (León), Maria Teresa Martínez (Madrid), Lourdes Lázaro (Burgos), María Torres (La Coruña), José María Hernández (La Palma), Rafael Vidal (Barcelona), Marc Miravitlles (Barcelona), Alberto Herrejón (Castellón), M. Jesús Cabero (Santander), Lino Alvarez (Santander), Gloria García (Madrid), Cristóbal Esteban (Galdakano), Adolfo Doménech (Sevilla); Laboratorio central del Registro: Rosendo Jardí y Francisco Rodríguez-Frías (Barcelona).