La afectación pulmonar es frecuente en las vasculitis asociadas a ANCA (VAA), sin embargo, la asociación con un enfisema pulmonar es poco frecuente (13% casos)1,2.
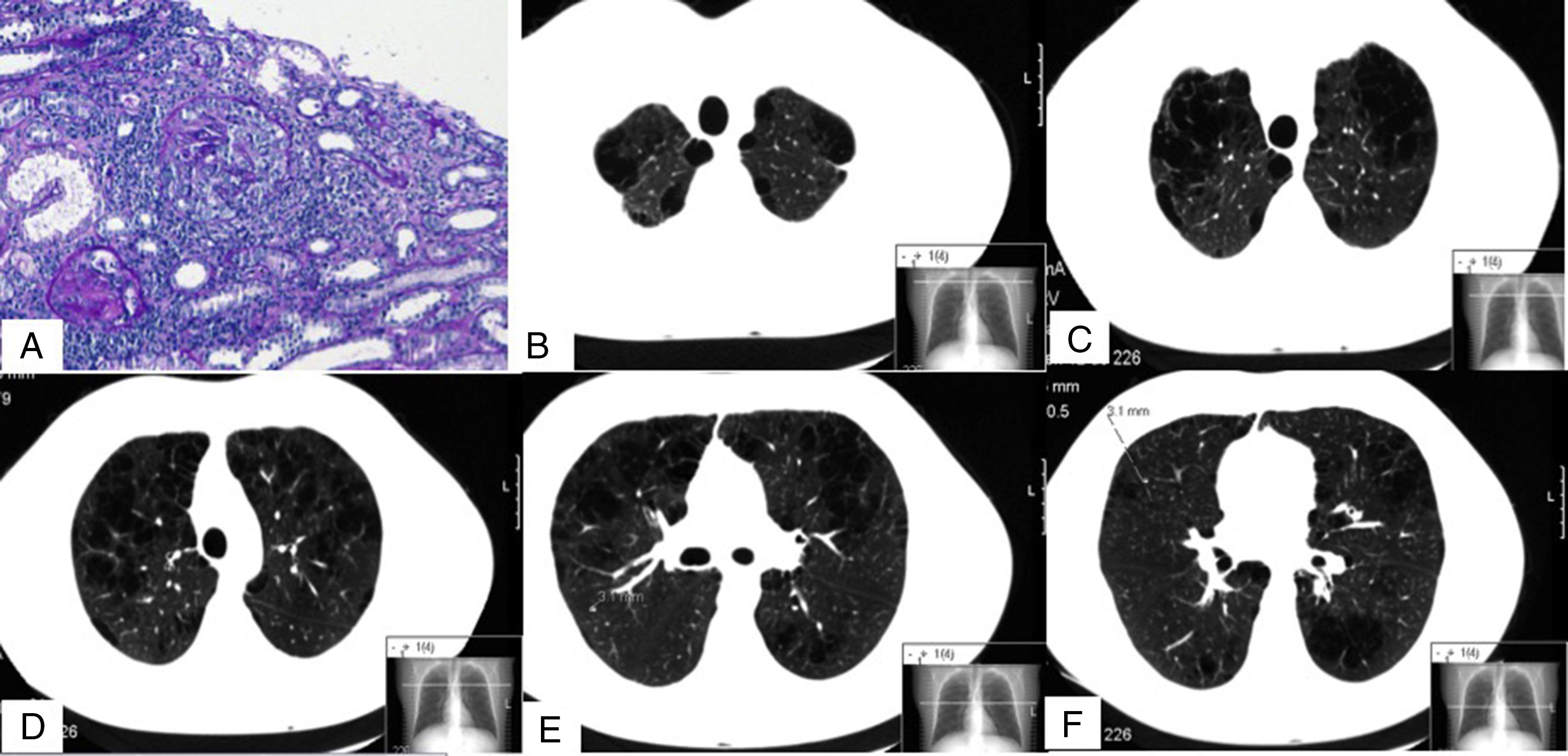
Presentamos el caso de un varón de 32 años, fumador de 13 paquetes/año, sin exposición a otros tóxicos ni antecedentes familiares ni patológicos de interés, que fue diagnosticado de una vasculitis C-ANCA anti-proteinasa 3 (PR3) y un enfisema pulmonar severo. El paciente en el momento del diagnóstico presentó síntomas constitucionales, artralgias, isquemia digital en la mano y afectación renal, expresada como proteinuria no nefrótica y microhematuria con un filtrado glomerular normal. En la analítica destacó una hemoglobina de 12,2g/dl y un aumento de la VSG y proteína C reactiva. En el estudio inmunológico los C-ANCA fueron positivos, con un título de anti-PR3 de 79U/ml (valor normal <2U/ml) y anti-MPO: 0U/ml. El resto de estudios, que incluyeron los anticuerpos anti-membrana basal glomerular, ANA, complemento, inmunoglobulinas, crioglobulinas, anticuerpos antifosfolípidos, proteinograma y serologías de hepatitis B, C, VIH fueron normales o negativos. El Mantoux y quantiferón resultaron negativos. En la biopsia renal presentó una glomerulonefritis proliferativa extracapilar con formación de semilunas en un 46% de los glomérulos y pauciinmune (fig. 1A). En la TC otorrinolaringológica no se destacaron alteraciones significativas, y en la torácica 3 nódulos en el pulmón derecho inferiores a 5mm, y un severo enfisema mixto centrilobulillar bilateral difuso con áreas de afectación paraseptal y bullas subpleurales de predominio en los lóbulos superiores (figs. 1B-F). En el esputo no se encontraron hemosiderófagos. En las pruebas funcionales respiratorias destacaron DLCO: 68%, KCO: 66%, FEF 25-75%: 58%, FEV1: 80% y FEV1/FVC: 69%. Se trató con glucocorticoides a una dosis inicial de 1mg/kg/día vía oral en pauta descendente y ciclofosfamida intravenosa, según la pauta CYCLOPS3. El paciente abandonó el hábito tabáquico e inició tratamiento con broncodilatadores. Se determinaron en 2 ocasiones los niveles de alfa-1-antitripsina (AAT), que resultaron normales (140 y 145mg/dl, respectivamente) y, además, se determinaron cualitativamente mediante PCR-ARMS los alelos PI*S y PI*Z del gen de la AAT, sin detectarse ninguno en el paciente.
Imágenes de la biopsia renal (A) y de la TC pulmonar (B-F). En A se muestran 2 glomérulos con proliferación extracapilar o semilunas (ácido peryódico de Schiff). B, C, D, E y F son diferentes cortes de la TC pulmonar en los que se aprecia un enfisema mixto centrilobulillar bilateral, con zonas de afectación paraseptal y bullas subpleurales de predominio en lóbulos superiores. En F se puede observar uno de los nódulos de 3,1mm (línea discontinua).
A los 6 meses, tras finalizar el tratamiento de inducción, el paciente estaba en remisión clínica, e inició el tratamiento con azatioprina. Desde el punto de vista respiratorio tuvo varias infecciones que se controlaron con antibióticos orales. En la TC torácica de control no existieron cambios significativos, incluyendo los 3 nódulos antes descritos. En las pruebas respiratorias realizadas entonces destacaban DLCO: 46%, KCO: 60%, FEF 25-75%: 65%, FEV1: 78% y FEV1/FVC: 76%.
En las VAA están descritos algunos casos de enfisema pulmonar, asociados o no al déficit de AAT (DAAT)1,2. Nuestro paciente presentó una causa clara del enfisema pulmonar, el tabaco4. En general, la dosis de tabaco y la severidad de la enfermedad pulmonar suelen estar relacionadas. Se estima que, en ausencia de otros factores genéticos y/o ambientales, con una exposición inferior a 10-15 paquetes/año es poco probable que se desarrolle enfermedad pulmonar, siendo el único factor claramente asociado a la misma una dosis superior a 40 paquetes/año4,5. En nuestro caso, por la severidad del enfisema, la edad del paciente y la exposición tabáquica inferior a los límites anteriormente citados, excluimos otras posibles causas del mismo (como otros tóxicos y, especialmente, el DAAT, así como la presencia de un alelo deficitario de su gen). Sin embargo, no podemos excluir la contribución de la VAA al enfisema pulmonar que, además, podría explicar el empeoramiento del KCO, a pesar del abandono del hábito tabáquico. El vínculo patogénico entre ambos no está bien establecido. En nuestro caso no existió evidencia clínica de una hemorragia alveolar difusa previa para considerar dicho enfisema como una secuela de la misma. La AAT es una inhibidora de las serinproteasas, como la elastasa y PR3, que se encuentran en los gránulos primarios de los neutrófilos y que tienen una potente capacidad destructiva tisular6. El tabaco produce en el pulmón un incremento de las metaloproteinasas y elastasas, liberadas por los macrófagos y los neutrófilos alveolares, respectivamente, así como una inhibición funcional de la AAT7,8. En las vasculitis los ANCA provocan la degranulación de los neutrófilos con la consiguiente liberación de las proteasas de sus gránulos primarios (PR3 y elastasas) (estallido respiratorio), y por otra parte, interfieren en la formación de complejos PR3-AAT impidiendo la neutralización de dichas proteasas9–12. Por lo tanto, es posible que, en pacientes con VAA y fumadores se produzca en el líquido extracelular un mayor desequilibrio entre la actividad proteasa y antiproteasa, resultado en un mayor incremento de la destrucción de la elastina, una proteína de matriz esencial en mantener la integridad estructural de los pulmones, y así contribuir a la severidad del enfisema pulmonar. Sin embargo, sigue sin establecerse, de una forma definitiva, la interacción in vivo entre la PR3, la AAT y los ANCAS. Finalmente, los nódulos pulmonares, sin bien podrían estar en el contexto de la propia vasculitis ANCA-PR3, se interpretaron como inespecíficos porque persistieron sin cambios a pesar de la remisión de la misma.
En resumen, el enfisema pulmonar puede coexistir con una vasculitis asociada a ANCA, sin que se pueda excluir la contribución patogénica de la misma, además de otros factores claramente descritos, como el tabaco y el DAAT.