Introducción
Los radicales libres son productos metabólicos de la respiración celular aeróbica y los sistemas antioxidantes tienen como función eliminar su exceso. Cuando la generación de radicales libres excede la capacidad antioxidante, se produce estrés oxidativo y lesión en células y tejidos1.
La interacción de especies reactivas al oxígeno, con los lípidos insaturados de las biomembranas, permite la formación de hidroperóxidos lipídicos como principales productos, así como de una serie de productos secundarios, entre ellos el malondialdehído (MDA). Entre los aldehídos reactivos que pueden formarse por descomposición de peróxidos lipídicos, el más utilizado como marcador de estrés oxidativo es el MDA. La derivación del MDA con el ácido tiobarbitúrico es el método más empleado como indicador de peroxidación lipídica y actividad de radicales libres en muestras biológicas2.
Se sabe que ciertos factores de riesgo cardiovascular como la hipertensión arterial, la hipercolesterolemia y la diabetes predisponen a la disfunción endotelial y que el estrés oxidativo es el denominador común de todos los procesos que conducen a ella3. Además, la disfunción endotelial se considera un indicador subclínico de disfunción vascular o miocárdica previo a la aparición de signos y síntomas de enfermedad vascular.
Las tasas de prevalencia de las enfermedades cardiovasculares están incrementadas en pacientes con síndrome de apneas-hipopneas durante el sueño (SAHS)4 y, aunque no están totalmente claros los mecanismos fisiopatológicos, sí puede afirmarse que las situaciones de hipoxia-re-oxigenación como las del SAHS predisponen a la arteriosclerosis mediante la producción de radicales libres5.
Existen datos en la bibliografía que evidencian un aumento del estrés oxidativo en pacientes con SAHS6, aunque otros estudios aportan datos discrepantes7,8. Este aumento del estrés oxidativo puede producir un grado de disfunción endotelial, incluso en pacientes con SAHS sin factores de riesgo cardiovascular9, que los predisponga a presentar un aumento de la morbilidad cardiovascular. El tratamiento con presión positiva continua de la vía aérea nasal (CPAPn) ha demostrado ser beneficioso en la evolución del riesgo cardiovascular y de la enfermedad coronaria10.
En este estudio hemos pretendido demostrar que el tratamiento con CPAPn disminuye el estrés oxidativo en los pacientes diagnosticados de SAHS. Esto puede arrojar luz sobre la fisiopatología para explicar la alta prevalencia de enfermedades cardiovasculares en los pacientes con SAHS.
Pacientes y métodos
Se ha estudiado a pacientes que consultaron por síntomas indicativos de SAHS y en quienes, tras la realización de una polisomnografía diagnóstica en la Unidad de Sueño de nuestro hospital, se comprobó la necesidad de tratamiento con CPAPn según criterios establecidos11. Las únicas enfermedades que podían presentar los pacientes con SAHS eran: factores de riesgo cardiovascular (en concreto, hipertensión arterial, hipercolesterolemia o diabetes) y cardiopatía isquémica. Se excluyó a los pacientes que presentaran otras enfermedades y los que tomaban suplementos vitamínicos.
Por otro lado, se estudió a un grupo de 10 controles en quienes se excluyó el SAHS por clínica (no presentaban ronquidos, apneas ni somnolencia), elegidos dentro del personal sanitario de nuestro centro.
Protocolo de estudio
Pacientes con SAHS. A cada paciente se le realizó una entrevista estructurada para conocer la edad, el sexo, si padecía hipertensión arterial, hipercolesterolemia, diabetes y/o cardiopatía isquémica, frecuencia en el consumo de tabaco e índice de masa corporal (IMC). Además, se les efectuó el test de Epworth12 para cuantificar la somnolencia.
Se les practicó una espirometría forzada según las normas de la Sociedad Española de Neumología y Cirugía Torácica13, además de una gasometría arterial a aire ambiente. Por otro lado, se les hizo una extracción de sangre venosa a las 8.00 h para determinar la concentración de MDA en sangre (indicador de estrés oxidativo).
Asimismo, se les realizó una polisomnografía diagnóstica con un polisomnógrafo Somnostar Alpha de Sensor Medic, donde se monitorizaron de forma continua durante 6 h electroencefalograma, electrooculograma, electromiograma del músculo submandibular, electrocardiograma, movimientos toracoabdominales mediante bandas con sensores piezoeléctricos, flujo nasal mediante cánulas nasales y transductor de presión (Ptaf-lite, Pressure Transducer, Pro-Tech) y saturación de oxígeno mediante pulsioxímetro digital (Nonin 8600).
Los estadios de sueño se analizaron manualmente a intervalos de 30 s según criterios estándar14 y se calculó el tiempo total de sueño. Se definió la apnea como la ausencia de flujo aéreo durante al menos 10 s, y la hipopnea como la reducción del flujo aéreo de más del 50% durante 10 s o más, asociada a una disminución de la saturación de oxígeno mayor o igual al 4% o a un despertar transitorio (arousal). Se calculó el índice de apneas-hipopneas (IAH) dividiendo el número total de apneas e hipopneas entre las horas de sueño. Para definir el despertar transitorio se emplearon los criterios de la American Sleep Disorders Association15. El diagnóstico de SAHS se estableció cuando el IAH era igual o mayor de 10.
Posteriormente, se les realizó una polisomnografía con titulación de CPAPn durante toda una noche. Se inició la graduación con una presión de 4 cmH2O una vez que el paciente se hubiera dormido y se fue incrementando la presión de forma progresiva. Se registró el flujo aéreo mediante cánulas nasales.
Tras 2-3 meses de tratamiento con CPAPn se recogió el cumplimiento objetivo mediante contador horario y se realizó una entrevista en la que se llevó a cabo un segundo test de Epworth y se comprobó que no había habido ninguna variación en el IMC, el hábito tabáquico, otros factores de riesgo cardiovascular ni cardiopatía isquémica. Se extrajo una segunda muestra sanguínea para cuantificar las concentraciones de MDA a las 8.00 h.
Controles. Se extrajo una primera muestra sanguínea a las 8.00 h para determinación de MDA y otra a la misma hora al cabo de 2 meses. Coincidiendo con las 2 recogidas de muestras sanguíneas se les realizó una entrevista en la que se anotaron edad, sexo, IMC, frecuencia del hábito tabáquico, factores de riesgo cardiovascular (hipertensión arterial, colesterol, glucosa), cardiopatía isquémica y otros antecedentes patológicos.
Obtención de las muestras de plasma
Después de ayuno durante toda la noche, por la mañana (a las 8.00 h) se extrajeron las muestras de sangre de la vena antecubital. Éstas se colocaron en tubos que contenían K2 ácido etilendiaminotetraacético para la obtención de plasma. A continuación se centrifugaron a 3.000 g durante 10 min a 4 °C. El plasma así obtenido se almacenó a -70 °C hasta su análisis.
Análisis de la peroxidación lipídica (concentraciones plasmáticas de malondialdehído)
Las concentraciones plasmáticas de MDA se determinaron como sustancia reactiva al ácido tiobarbitúrico según el método analítico descrito por Kikugawa et al16.
A un volumen de 0,2 ml de plasma se le añadió 0,2 ml de H3PO4 (0,2 M) y el color de la reacción se inició por la adición de 0,025 ml de una disolución 0,11 M de ácido tiobarbitúrico. Entonces las muestras se colocaron a 90 °C durante 45 min. Posteriormente, una vez enfriadas, el complejo rosa se extrajo con 0,4 ml de n-butanol, durante 30 min. Las fases acuosa y de butanol se separaron por centrifugación a 6.000 g, durante 10 min. Se determinó la absorbancia de las alícuotas de la fase butanólica a 535 nm, en un espectrofotómetro de microplaca (Benchmark Plus, Bio-Rad, Hercules, CA, EE.UU.). Para la preparación de la recta de calibración se utilizó la cantidad estándar de MDA (0-20 µM). Los coeficientes intra e interanálisis fueron del 1,82 y el 4,01%, respectivamente. El límite de detección se estableció en 0,079 µM (blancos + 3 desviaciones estándar).
Análisis estadístico
Los resultados de las variables cuantitativas se expresan con medias y desviaciones estándar, y las variables cualitativas, con porcentajes. El supuesto de normalidad de las puntuaciones de MDA, escala Epworth e IAH se comprobó con la prueba de Kolmogorov-Smirnov.
Se aplicó la prueba de Mann-Whitney para comparar las puntuaciones finales de MDA entre los grupos categorizados para las variables siguientes: consumo de tabaco (sí/no), hipertensión arterial (sí/no), cardiopatía isquémica (sí/no), hipercolesterolemia (sí/no) y diabetes (sí/no). Para las comparaciones antes-después de las concentraciones de MDA se seleccionaron las variables que tuvieron una probabilidad menor de 0,20 (consumo de tabaco, hipercolesterolemia y diabetes).
Las comparaciones de los promedios de MDA (antes-después), controlando la presencia de diabetes, hipercolesterolemia y consumo de tabaco, se llevaron a cabo con 3 análisis independiente usando el MANOVA; de este análisis se excluyó a los pacientes que no cumplían 4 h/noche de tratamiento.
Los análisis estadísticos se realizaron con el paquete estadístico SPSS versión 12.0.1 (Chicago, IL, EE.UU.). Se consideraron significativos los valores de p < 0,05.
Resultados
Se estudió a 39 pacientes con SAHS que requerían tratamiento con CPAPn. De éstos, se excluyó a 3 por un cumplimiento del tratamiento menor de 4 h/noche. Los pacientes excluidos mostraron un IAH de 20,7 ± 11,7 (frente a 43,7 ± 22,6 de los pacientes cumplidores) y en ellos la presión de CPAPn fue de 6,7 ± 2,3 (frente a 8,9 ± 3,4 cmH2O en los cumplidores).
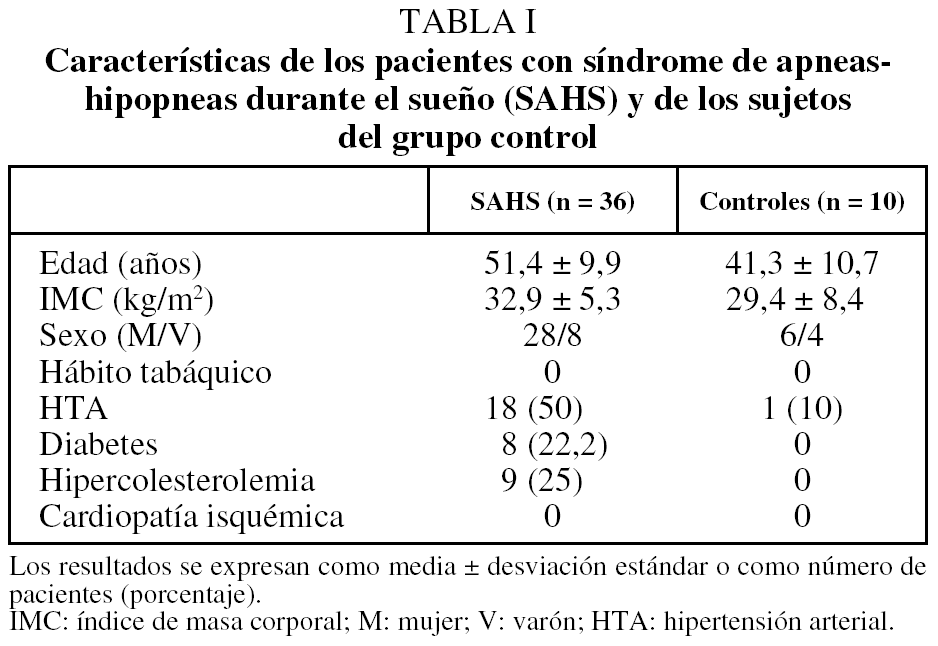
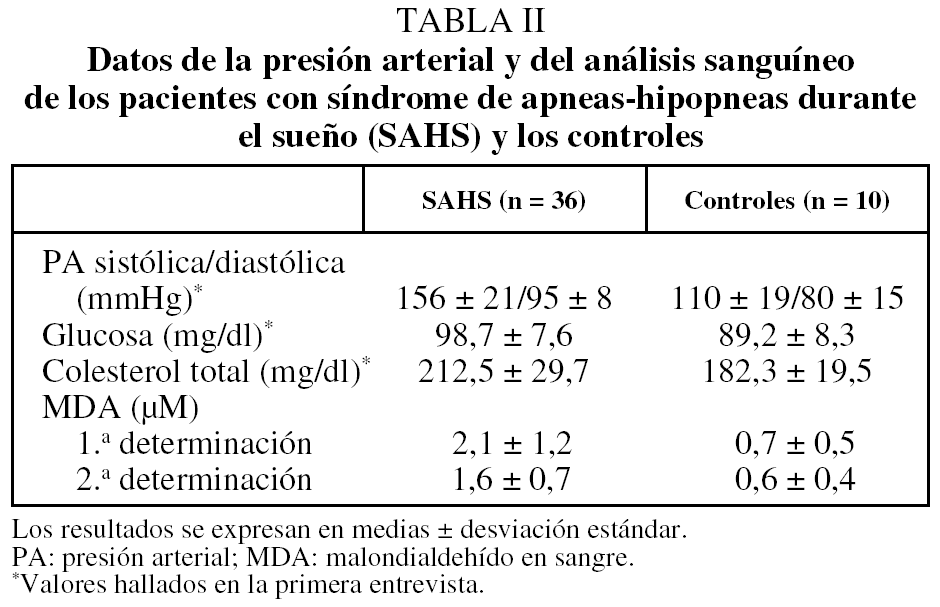
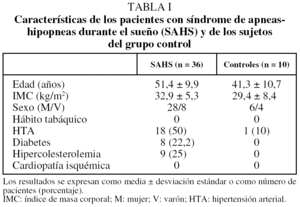
En la tabla I se muestran las características de los 36 pacientes con SAHS y de los 10 controles. Ninguno de los primeros presentó patrón espirométrico obstructivo (volumen espiratorio forzado en el primer segundo/volumen de cierre: 79,7 ± 4,8) ni hipoxemia diurna (presión arterial de oxígeno: 95,9 ± 14,3 mmHg). Se comprobó que entre las 2 extracciones sanguíneas no había habido variación del IMC, del hábito tabáquico, del consumo de la medicación, de la cardiopatía isquémica ni de los factores de riesgo cardiovascular tanto entre los pacientes con SAHS como entre los controles. El tiempo medio ± desviación estándar de tratamiento con CPAPn antes de la segunda extracción sanguínea fue de 2,9 ± 0,6 meses. A los controles se les extrajo la segunda muestra de sangre 2 meses después de la primera.
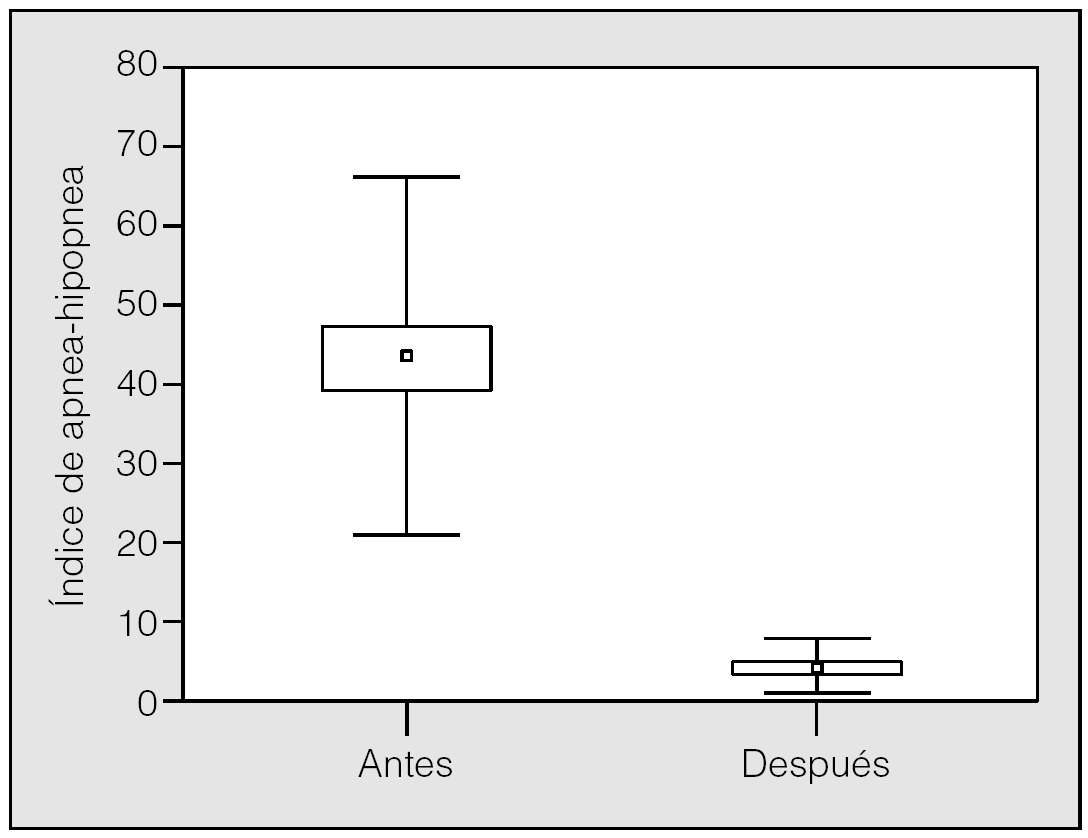
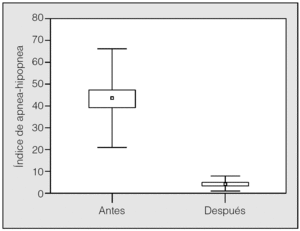
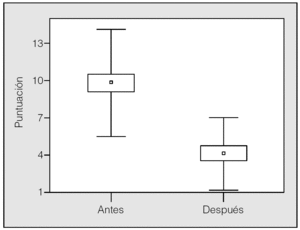
El IAH en la polisomnografía diagnóstica fue de 43,7 ± 22,6 y bajó significativamente en la polisomnografía de titulación de CPAPn, una vez alcanzada la presión efectiva (4 ± 3,5; p < 0,001) (fig. 1). La puntuación en la escala de Epworth también descendió de forma significativa (p < 0,001): de 10,2 ± 4,3 antes del tratamiento a 4,1 ± 2,8 después de éste (fig. 2).
Fig. 1. Índice de apneas-hipopneas antes y después del tratamiento con presión positiva continua de la vía aérea nasal. Los resultados se expresan en medias, error estándar (cajas) y desviación estándar (bigotes).
Fig. 2. Puntuación en la escala de Epworth antes y después del tratamiento. Los resultados se expresan en medias, error estándar (cajas) y desviación estándar (bigotes).
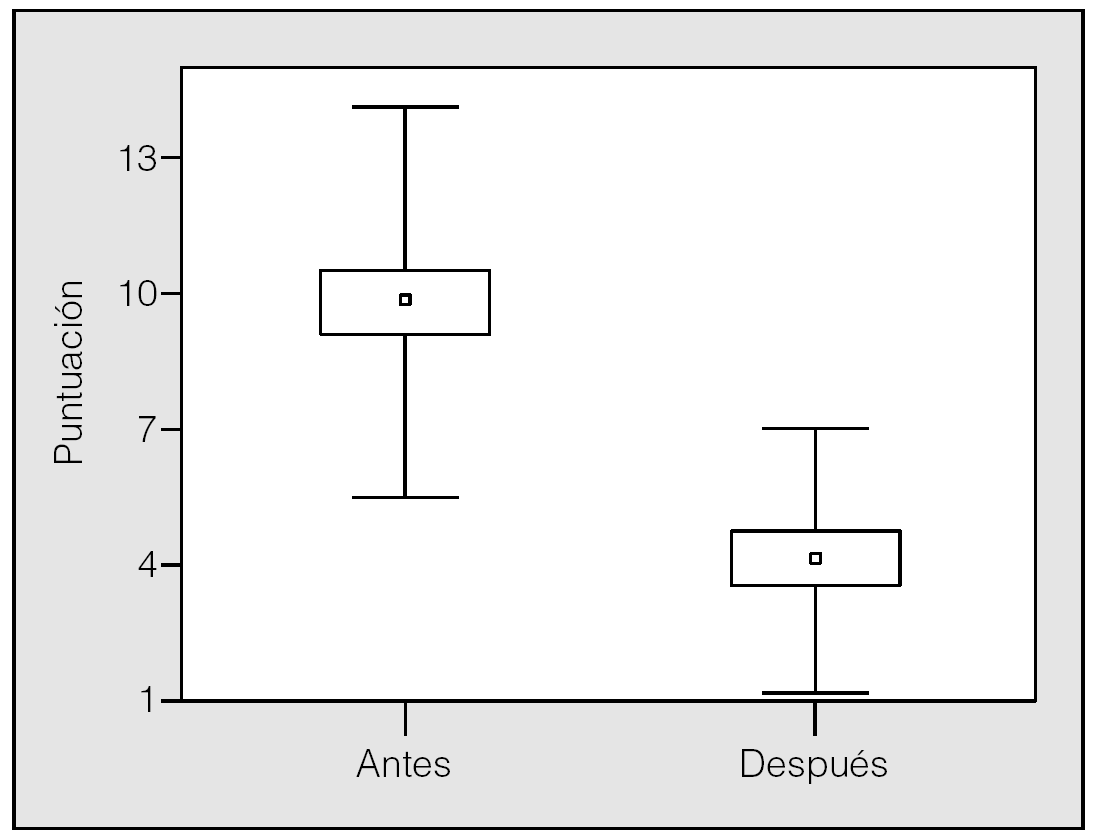
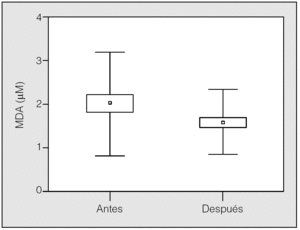
En la figura 3 se muestran las concentraciones de MDA antes (2,0 ± 1,1 µM) y después (1,6 ± 0,7 µM) del tratamiento en los pacientes con SAHS.
Fig. 3. Concentraciones de malondialdehído (MDA) en sangre periférica antes y después del tratamiento. Los resultados se expresan en medias, error estándar (cajas) y desviación estándar (bigotes).
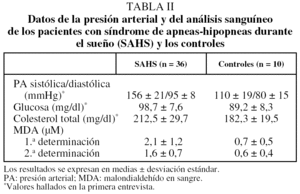
Controlando por hipercolesterolemia, consumo de tabaco y diabetes, se observaron diferencias entre las medias antes y después del tratamiento en las concentraciones plasmáticas de MDA (p = 0,044; p = 0,01, y p = 0,04, respectivamente). En los controles los valores de MDA fueron menores que en los sujetos con SAHS (p < 0,001) y no hubo diferencias en los títulos de MDA entre las 2 determinaciones (tabla II).
Discusión
En nuestro trabajo hemos observado cómo en los pacientes con SAHS el estrés oxidativo disminuye después del tratamiento con CPAPn. En la bibliografía hay datos que prueban un aumento del estrés oxidativo en estos pacientes, y se han planteado fundamentalmente 3 causas:
- El SAHS se caracteriza por episodios repetidos de apnea durante el sueño que llevan asociados desaturaciones que van seguidas de episodios de reoxigenación. En modelos animales la hipoxia intermitente seguida de reoxigenación, que se asemeja a los episodios de isquemia-reperfusión, se ha asociado a un aumento del estrés oxidativo17, por lo que el uso de la CPAPn puede justificar la disminución de estrés oxidativo al abolir los episodios de hipoxia-reoxigenación.
- Los pacientes con SAHS tienen una disminución de la calidad de sueño. En algunos estudios sobre animales, la privación del sueño se ha asociado a peroxidación lipídica18, aunque otros estudios muestran resultados discrepantes19. Se ha encontrado una relación inversa entre el sueño REM y el estrés oxidativo en pacientes con SAHS20. El tratamiento con CPAPn mejora la calidad del sueño de estos pacientes21, por lo que puede reducir el estrés oxidativo.
- Por último, en los pacientes con SAHS existe un aumento de la concentración de catecolaminas que pueden sufrir oxidación22, y éste es uno de los motivos por los que se piensa que el exceso de catecolaminas puede inducir cardiopatía y podría también contribuir a la aparición de complicaciones cardiovasculares en los pacientes con SAHS.
Existen múltiples causas que pueden modificar el estrés oxidativo. Se ha comprobado que la obesidad23, la vejez24, el hábito tabáquico25 y el sexo masculino26 incrementan el estrés oxidativo. Por ello, en nuestro estudio hemos controlado los resultados para todos estos factores.
En algunos de los trabajos en que se ha demostrado reducción del estrés oxidativo en pacientes con SAHS en tratamiento con CPAPn se ha escogido a pacientes sin factores de riesgo cardiovascular20. Esto supone una falta de control sobre variables que pueden llevar a confundir la relación, entre el SAHS y el estrés oxidativo. En este estudio la validez externa se garantiza porque los pacientes presentaron factores de riesgo cardiovascular en frecuencias parecidas a las que se observan en la práctica clínica diaria; por otra parte, se incrementó la validez interna controlando en los análisis estadísticos el efecto de confusión de los factores que podían influir en el estrés oxidativo. Además, nos aseguramos de que ningún paciente tomaba aporte vitamínico extra y se excluyó a quienes presentaban enfermedad pulmonar obstructiva crónica, que tantas veces coexiste con el SAHS y que puede aumentar la peroxidación lipídica27, o cualquier enfermedad distinta de las antes especificadas.
Por otra parte, se comprobó que no se hubiesen producido cambios en los factores que pueden influir en el estrés oxidativo (mencionados previamente) en el intervalo que transcurrió entre la primera y la segunda extracción sanguínea; creemos que todo ello nos ha llevado a obtener una disminución significativa del MDA con el tratamiento con CPAP en estos pacientes.
El tiempo de seguimiento de nuestro estudio ha sido de unos 3 meses, mientras que en otros trabajos fue mayor28 y, por tanto, había más posibilidades de que se modificasen otros factores que contribuyen al estrés oxidativo. Sin embargo, ha sido mayor que en algunos trabajos en que se midió la variación del estrés oxidativo después de sólo una noche29, con resultados no concluyentes.
Finalmente, creemos que el número de pacientes en quienes se demuestra la reducción del estrés oxidativo con el tratamiento con CPAPn es el mayor de todos los publicados hasta el momento30,31, lo que supone una mayor evidencia a favor de nuestros resultados.
Este estudio se ha controlado con un grupo de sujetos sin síntomas indicativos de SAHS en quienes la medición del MDA no varió en los 2 meses de intervalo. Aunque las concentraciones plasmáticas de MDA fueron significativamente mayores en los pacientes con SAHS que en los controles, este resultado es de limitado valor, ya que estos últimos presentaban menos factores de riesgo cardiovascular que los pacientes con SAHS.
El tratamiento con CPAPn ha mostrado su eficacia para aumentar la supervivencia de los pacientes con SAHS32. La reducción del estrés oxidativo con el tratamiento con CPAPn en estos pacientes podría prevenir el desarrollo o la progresión de morbilidad cardiovascular y, por tanto, reducir la mortalidad en los pacientes con SAHS.
La mayor limitación del estudio radica en que medimos el estrés oxidativo mediante una de las técnicas más validadas, pero no determinamos el grado de anti-oxidación, que forma con aquél parte de la balanza en todos los sistemas redox.
Sería interesante realizar estudios con una monitorización a largo plazo del estrés oxidativo en estos pacientes y estudiar su relación con la aparición o no de enfermedades cardiovasculares, así como medir la capacidad de las enzimas antioxidantes.
En conclusión, el estrés oxidativo, medido mediante las concentraciones plasmáticas de MDA, se reduce significativamente en el grupo de pacientes con SAHS estudiados después del tratamiento con CPAPn.
Correspondencia: Dra. C. Hernández.
Servicio de Neumología. Hospital Universitario de Canarias.
La Cuesta, s/n. 38320 La Laguna. Santa Cruz de Tenerife. España.
Correo electrónico: chernandezg@teleline.es
Recibido: 29-4-2005; aceptado para su publicación: 20-9-2005.