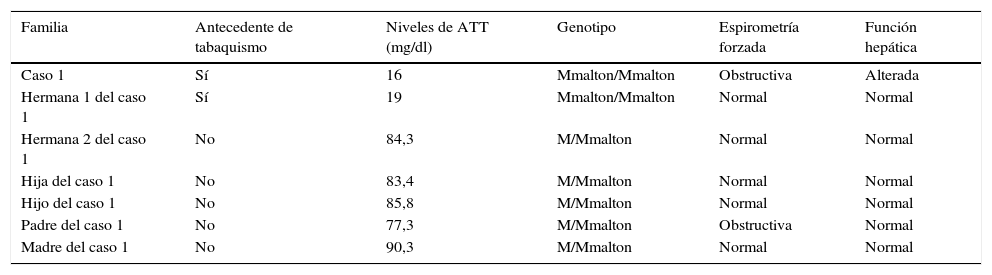
El 95% de los casos clínicos relacionados con el déficit de alfa-1-antitripsina (DAAT) están asociados al genotipo PI*ZZ, siendo el 5% restante correspondiente a los genotipos PI*SZ, PI*MZ o a combinaciones de PI*S o PI*Z con otros alelos deficientes o nulos extremadamente raros. Estos alelos raros representan el 1,6% de las variantes deletéreas anotadas en el Registro Español de Pacientes con Déficit de AAT siendo las más frecuentes la variante PI*Mmalton1. Dicha variante muestra un comportamiento clínico similar al fenotipo PI*Z, siendo su diagnóstico habitualmente retrasado ante su similitud estructural con el alelo Pi M2. Presentamos el caso de 2 miembros de un mismo grupo familiar (tabla 1) con diagnóstico de DAAT en relación con el alelo deficitario PI*Mmalton en su forma homocigótica.
Características de la familia a estudio
| Familia | Antecedente de tabaquismo | Niveles de ATT (mg/dl) | Genotipo | Espirometría forzada | Función hepática |
|---|---|---|---|---|---|
| Caso 1 | Sí | 16 | Mmalton/Mmalton | Obstructiva | Alterada |
| Hermana 1 del caso 1 | Sí | 19 | Mmalton/Mmalton | Normal | Normal |
| Hermana 2 del caso 1 | No | 84,3 | M/Mmalton | Normal | Normal |
| Hija del caso 1 | No | 83,4 | M/Mmalton | Normal | Normal |
| Hijo del caso 1 | No | 85,8 | M/Mmalton | Normal | Normal |
| Padre del caso 1 | No | 77,3 | M/Mmalton | Obstructiva | Normal |
| Madre del caso 1 | No | 90,3 | M/Mmalton | Normal | Normal |
ATT: alfa-1-antitripsina.
El caso índice era un varón de 47 años de edad, natural de la isla de la Gomera, con antecedentes personales de neumotórax espontáneo en 2005 y exfumador con índice paquetes-año de 30, que es remitido a la consulta de neumología por disnea a moderados esfuerzos (mMRC 2) de un año de evolución. Las pruebas funcionales respiratorias mostraron un FEV1/FVC: 0,5; FEV1: 1,73l (51%); FVC: 3,38 l (77%); DLCO: 73% y KCO: 75%. La TAC de alta resolución describía la presencia de enfisema centrolobulillar y paraseptal de predominio en campos superiores. La ecografía abdominal no detectó signos de hepatopatía crónica, a pesar de mostrar una leve hipertransaminasemia. Hemograma y niveles de IgA, IgM, IgG e IgE se encontraban dentro de la normalidad. La determinación de los niveles de alfa-1-antitripsina (AAT) mediante nefelometría resultó disminuida de forma severa (16mg/dl), por lo que se analizó la presencia de los alelos PI*S y PI*Z, que resultó negativa. Basándonos en la ausencia de dichas variantes deficitarias y dado los niveles AAT reflejado en el suero, se decide realizar el análisis molecular del gen SERPINA1 amplificándose tanto las regiones exónicas codificantes como las zonas intrónicas flanqueantes de los exones 4, 5 y 6. Dicho análisis reveló la presencia del alelo PI*Mmalton (F52del) en su forma homocigótica.
Su hermana, mujer de 42 años de edad y con antecedentes personales de exfumadora, con un índice paquetes-año de 35 negaba clínica respiratoria. Las pruebas funcionales respiratorias mostraron un FEV1/FVC: 0,74; FEV1: 2,68 l (96%); FVC: 3,62l (110%); DLCO: 81% y KCO: 82%. La TAC de alta resolución, la ecografía abdominal y la analítica general se encontraban dentro de la normalidad. La determinación de AAT resultó disminuida de forma severa (19mg/dl), siendo realizado el análisis molecular del gen SERPINA1, detectándose la presencia del alelo PI*Mmalton en su forma homocigótica.
Diversos registros de pacientes con DAAT describen al alelo PI*Mmalton como la tercera variante deficitaria más frecuente en España2, no habiéndose descrito hasta la fecha su existencia en las Islas Canarias. Al igual que el gen Z, el alelo Mmalton produce una proteína mal plegada de la que un 80-90% se polimeriza en el hepatocito, siendo expresados niveles inferiores al 15% en sangre. A diferencia de nuestros casos, en los pacientes con PI*Mmalton en su forma homocigótica se ha descrito habitualmente la coexistencia de enfisema y cirrosis hepática3,4; sin embargo las formas heterocigóticas parecen mostrar un comportamiento mucho más heterogéneo. La mayoría de los pacientes PI*M/Mmalton no muestran alteración de la función pulmonar o hepática, a diferencia del genotipo PI*Z/Mmalton que parece relacionarse con un aumento del riesgo de desarrollar enfisema5. En lo que respecta a la afectación hepática, Canva et al., describieron el caso de una paciente PI* Mmalton/M que desarrolló una enfermedad hepática terminal a pesar de no presentar antecedentes de hepatitis, abuso de alcohol o enfermedad hepática infantil6. Igualmente, Piras et al., describieron que al menos un 13% de los sujetos tanto homocigotos como heterocigotos para la variante PI*Mmalton mostraban datos de hepatopatía crónica7.
En nuestro caso es destacable la heterogeneidad clínica manifestada por parte de nuestros pacientes, a pesar de la consanguinidad de estos y de una exposición al humo del tabaco de similar intensidad, lo que muestra diferentes patrones de comportamiento para un mismo genotipo PI*Mmalton/Mmalton.