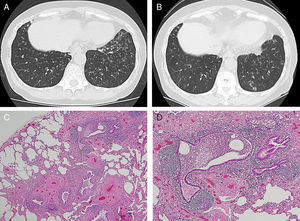
El trasplante de médula ósea (TMO) mejora la supervivencia a largo plazo. Sin embargo, la incidencia de las complicaciones pulmonares no infecciosas de inicio tardío tras un TMO está entre el 10-26%, y pueden ser mortales, debido a la progresiva insuficiencia respiratoria que causan1. Describimos un caso de bronquiolitis celular diagnosticado 27 años después de un TMO.
Se trataba de una mujer no fumadora de 65 años, a quien se había diagnosticado una leucemia linfocítica aguda a los 33 años de edad. Tras un tratamiento preoperatorio con busulfán y ciclofosfamida, recibió un TMO alogénico de un donante familiar (su hermano), tras el cual se observó remisión completa de la enfermedad. A los 59 años, la paciente fue derivada al Hospital Aizawa por presentar tos y hemoptisis. En la tomografía computarizada (TC) de corte fino se observó engrosamiento y dilatación de la pared bronquiolar, con aspecto de árbol brotado (fig. 1A). La capacidad ventilatoria forzada (FVC; % previsto) fue del 65,3%, y la razón del volumen espiratorio forzado en un segundo (FEV1)/FVC fue del 65,9%. Todas las pruebas serológicas para descartar la presencia de una enfermedad autoinmune (factor reumatoide, anticuerpos antinucleares, anticuerpos SS-A/Ro y anticuerpos SS-B/La) fueron negativas. En el cultivo de esputo se detectó la presencia de Pseudomonas aeruginosa, no observándose la presencia de ninguna especie de Mycobacterium. Se inició tratamiento con 200mg de claritromicina una vez al día, 10mg de montelukast una vez al día e inhalaciones de 50μg de salmeterol 2 veces al día. La tos y la hemoptisis cedieron en el período de un mes. Sin embargo, 8 meses más tarde, las imágenes observadas en la TC no habían mejorado. Para determinar la naturaleza de la enfermedad pulmonar, se practicó una biopsia abierta mediante toracoscopia, asistida por vídeo de los segmentos 8 y 9del pulmón izquierdo.
En las muestras para anatomía patológica (figs. 1C y D) se observó un engrosamiento de la pared de los bronquiolos membranosos y la formación de folículos linfoides con centros germinales por infiltración intraepitelial de linfocitos, sin presencia de macrófagos espumosos. Se detectó poca infiltración intraepitelial de linfocitos a nivel de los bronquiolos respiratorios. No obstante, las vías aéreas mantenían las capas de células epiteliales y, por consiguiente, el diagnóstico anatomopatológico final fue de bronquiolitis celular. Con posterioridad, la paciente recibió tratamiento con 3 inhalaciones de160μg de budesonida, 4,5μg de formoterol 2 veces al día, 200mg de claritromicina una vez al día y 10mg de montelukast una vez al día. La TC de corte fino se repitió 4 años más tarde (a la edad de 65 años), y se observó ligera mejoría (fig. 1B).
Comunicamos el caso de una paciente con bronquiolitis celular, aparecida como complicación pulmonar no infecciosa de inicio tardío, y que se diagnosticó 27 años después de un TMO alogénico. Entre las complicaciones pulmonares no infecciosas de inicio tardío, la bronquiolitis obliterante (BO) se observa en hasta un 10% de los pacientes sometidos a TMO alogénico1. Desde el punto de vista clínico, la BO se caracteriza por una limitación progresiva del flujo aéreo mientras que, desde el punto de vista histológico, se caracteriza por necrosis de las células epiteliales y desolladura de la mucosa2. En este caso, se detectó un defecto ventilatorio de tipo obstructivo; no obstante, en las muestras de patología se determinó que las capas de células epiteliales de las vías aéreas se mantenían, lo cual no es un hallazgo patológico típico de la BO.
La mediana de tiempo hasta el desarrollo de complicaciones pulmonares no infecciosas de inicio tardío tras un TMO es de unos 8-12 meses, aunque algunos casos se diagnostican de 2 a 3 años más tarde1. En el caso que nos ocupa, el diagnóstico se hizo 27 años después de un TMO alogénico. Este prolongado intervalo transcurrido desde el TMO indica que podía tratarse de una enfermedad independiente y no una complicación pulmonar no infecciosa de inicio tardío. Los hallazgos radiológicos recordaban una panbronquiolitis difusa y una bronquiolitis folicular. La histología de la panbronquiolitis difusa se caracteriza por la presencia de células mononucleares y macrófagos espumosos en los bronquiolos del árbol respiratorio3, lo que no coincide con los hallazgos histológicos de este caso. En cambio, las características histológicas de la bronquiolitis folicular incluyen la presencia de folículos linfoides hiperplásicos con centros germinales reactivos distribuidos a lo largo de los bronquiolos3, lo que guarda muchas semejanzas con nuestro caso. La bronquiolitis folicular suele asociarse a enfermedades del tejido conectivo vascular, en particular a la artritis reumatoide y el síndrome de Sjögren3. A pesar de que la paciente no presentaba características clínicas ni serológicas de una enfermedad del tejido conectivo vascular, se debería investigar la aparición de otros síntomas.
Recientemente se ha examinado la eficacia del tratamiento de la BO con azitromicina, antagonistas del receptor de leucotrienos, corticoides inhalados y broncodilatadores4. Nuestra paciente fue tratada con claritromicina, montelukast y budesonida/formoterol, sin corticoides sistémicos porque rechazó tomar corticoides por vía oral; y no hubo mejoría de la enfermedad. Es necesario investigar minuciosamente los perfiles patológicos de los pacientes, puesto que la utilidad de la claritromicina, montelukast y budesonida/formoterol en el tratamiento de la bronquiolitis celular, como complicación pulmonar no infecciosa de inicio tardío de un TMO, no es todavía convincente.
Los avances de la tecnología que se emplea en los TMO han mejorado la supervivencia a largo plazo, y el riesgo de desarrollar complicaciones tardías de los pacientes, como las observadas en este caso. Así pues, es necesario hacer seguimiento a largo plazo de los pacientes que sobreviven tras un TMO.
FinanciaciónLos autores declaran que no han recibido apoyo económico en relación con este informe.
Agradecemos al Dr. Masanori Kitaichisus los comentarios relativos a los hallazgos histopatológicos. También agradecemos al Dr. Kenji Misaway y al Dr. Osamu Mishimala por la práctica de la biopsia abierta mediante toracoscopia asistida por vídeo.