La enfermedad pulmonar obstructiva crónica (EPOC) incrementa el riesgo de enfermedad cardiovascular (ECV). La amplitud de distribución eritrocitaria (ADE) se considera un potente factor de predicción de la evolución de los pacientes con ECV.
ObjetivosAnalizar los valores de ADE de pacientes con EPOC y compararlos en relación al estado clínico, ecocardiográfico, nutricional y analítico de los pacientes. Por otra parte, nos propusimos analizar el efecto del consumo de tabaco sobre los valores de ADE de sujetos sanos.
MétodosEn el estudio se incluyeron 175 pacientes con EPOC estabilizados y 210 sujetos sanos. Se registraron y se compararon las características demográficas, clínicas, nutricionales, ecocardiográficas y analíticas, y los valores de ADE.
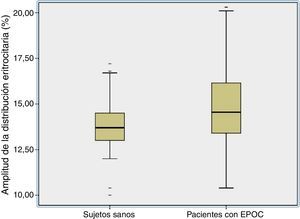
ResultadosLos valores de ADE fueron más altos en el grupo de pacientes con EPOC que en el grupo control (15±2,3% vs. 13,8±2,5%, p<0,001). Los valores de ADE de los pacientes con EPOC mostraron una correlación positiva con las concentraciones de PCR (r=0,27, p<0,001), las concentraciones de albúmina (r=0,23, p=0,04) y la presencia de disfunción ventricular derecha (DVD) (r=0,24, p=0,001), hipertensión pulmonar (HAP) (r=0,1, p=0,02) y ECV (r=0,24, p=0,02). El análisis de regresión logística para variables múltiples sugirió una relación independiente de la presencia de ECV (4,3; IC95%: 1,3-11; p=0,01) y de DVD (3,1; IC95%: 1,7-8,3; p=0,02) con valores elevados de ADE en los pacientes con EPOC. En la población sana, el análisis solo mostró una correlación significativa entre la ADE y la duración del consumo de tabaco (r=0,57, p<0,001).
ConclusiónEn pacientes con EPOC, la ADE se asocia de manera independiente con la ECV y la DVD. En la población sana, la ADE también se asocia con el consumo de tabaco.
Chronic obstructive pulmonary disease (COPD) increases the risk of cardiovascular disease (CVD). Red blood cell distribution width (RDW) is accepted as a powerful predictor of outcomes in patients with CVD.
AimsTo study RDW in patients with COPD, and to compare the value of this measurement with clinical, echocardiographic, nutritional and laboratory status. Secondly, we aimed to determine the effect of smoking on RDW values in healthy subjects.
MethodsOne hundred and seventy-five patients with stable COPD and 210 healthy controls were enrolled in the study. Demographic, clinical, nutritional status, echocardiographic, and laboratory characteristics, RDW values were recorded and compared.
ResultsRDW values were higher in the COPD group than in controls (15±2.3% vs. 13.8±2.5%, p<0.001). In COPD patients, RDW levels positively correlated with CRP levels (r=0.27, P<.001), albumin levels (r=0.23, P=.04), right ventricular dysfunction (RVD) (r=0.24, P=.001), pulmonary hypertension (PAH) (r=0.1, P=.02), and presence of CVD (r=0.24, P=.02). In multivariable logistic regression suggested that presence of CVD (4.3; 95% CI: 1.3 to 11; P=.01), and presence of RVD (3.1; 95% CI: 1.7 to 8.3; P=.02) were independently related to elevated RDW levels in COPD patients. In the healthy population, correlations analysis showed only a significant correlation between RDW and cigarette smoking years (r=0.57, P<.001).
ConclusionRDW is independently associated with CVD and RVD in patients with COPD. In the healthy population, RDW is also associated with smoking status.
Se ha comunicado que las enfermedades cardiovasculares (ECV), tales como la insuficiencia cardíaca congestiva, la hipertensión, las arritmias o la enfermedad coronaria, son frecuentes en pacientes que padecen enfermedad pulmonar obstructiva crónica (EPOC)1-3. Por consiguiente, la EPOC guarda una relación con la morbimortalidad de origen cardiovascular4. La explicación más obvia de las elevadas tasas de morbimortalidad cardiovascular que se observan en los pacientes con EPOC es la elevada prevalencia del tabaquismo y de otros factores de riesgo cardiovascular conocidos en este grupo de pacientes4. Asimismo, las asociaciones existentes entre la EPOC y el estrés oxidativo y la inflamación también podrían desencadenar o empeorar otras enfermedades comórbidas, como una ECV5.
La amplitud de distribución eritrocitaria (ADE) es una medida de la variabilidad que existe en el tamaño de los eritrocitos circulantes. Este parámetro se analiza de manera rutinaria como un componente del hemograma completo útil para el diagnóstico diferencial de las anemias6. Los resultados de estudios recientes han mostrado que la ADE podría aportar información útil para el pronóstico de pacientes con ECV7-10 y de aquellos que padecen otras enfermedades de origen no cardíaco, tales como el ictus o la hipertensión pulmonar, y también para la población general11-13. En todos estos estudios se planteó la hipótesis de que un valor elevado de ADE podrían ser un reflejo de un estado inflamatorio crónico subyacente, lo que comportaría mayor riesgo de ECV y mayor mortalidad.
La EPOC también produce un efecto inflamatorio sistémico. El proceso inflamatorio se puede extender más allá del aparato respiratorio y producir un estado de inflamación sistémica persistente de bajo grado que se ha relacionado con diversas complicaciones de la EPOC, por ejemplo caquexia, ECV o arritmias5,14,15. Se ha propuesto que la inflamación es la clave de la asociación entre EPOC y ECV. Se puede concluir que la ADE, que se considera un marcador de la inflamación, puede estar elevada tanto en la EPOC como en las ECV. Dos estudios recientes han mostrado que los valores elevados de ADE se correlacionan con la existencia de disfunción ventricular derecha y con la supervivencia global de los pacientes con EPOC16,17.
Las personas fumadoras también presentan inflamación sistémica18. En estudios clínicos y experimentales se han observado concentraciones elevadas de marcadores sistémicos de inflamación en fumadores, tales como la proteína C reactiva (PCR), el fibrinógeno, la interleucina-6, la molécula de adhesión intercelular soluble1 o la proteína quimiotáctica de monocitos1 (MCP-1)18. Solo en un estudio se han observado valores elevados de ADE en fumadores19.
Pocos estudios de pacientes con EPOC han analizado la ADE. En el presente trabajo nos propusimos examinar: 1)los valores de ADE de pacientes con EPOC; 2)el efecto de algunos parámetros bioquímicos, nutricionales, cardíacos y respiratorios, y del consumo de tabaco, sobre los valores de ADE de pacientes con EPOC; 3)el efecto del consumo de tabaco sobre los valores de ADE de la población sana, y 4)el efecto de la ADE, como marcador rutinario, para la predicción de la ECV en pacientes con EPOC.
MétodosPoblación del estudioSe incluyeron en el estudio 175 pacientes consecutivos con EPOC que estaban hospitalizados y en situación estable o en las 8 semanas siguientes al alta hospitalaria. Los pacientes fueron ingresados para someterse a un seguimiento de rutina. Se incluyeron además, como grupo de control, 110 sujetos sanos, que fueron emparejados con los primeros según edad y sexo. Se excluyó de la cohorte a los sujetos con antecedentes de cáncer, síndrome de apnea del sueño, valvulopatía cardíaca primaria, patologías del tejido conectivo, enfermedad inflamatoria intestinal, insuficiencia renal, hepatopatía, enfermedades hematológicas, deficiencia de hierro o de vitaminas (p.ej., B12 o folato), los que habían sufrido exacerbación en los 2 meses anteriores, los que habían tomado fármacos antiinflamatorios (corticoides sistémicos, inmunosupresores) en los 2 meses anteriores y los que habían recibido transfusiones de sangre. El estudio se llevó a cabo con arreglo a la Declaración de Helsinki (1989) de la Asociación Médica Mundial y fue aprobado por el comité ético del hospital.
Se registraron las características demográficas (edad, sexo, índice de masa corporal [IMC], consumo de tabaco, antecedentes patológicos y consumo de fármacos en aquel momento) y la historia clínica, incluidas las ECV y metabólicas, el uso de medicación y los hábitos de los pacientes (tabla 1). A los pacientes que presentaban insuficiencia cardíaca, enfermedad coronaria o arritmia se les calificó de pacientes con ECV. Un cardiólogo experto definió la presencia de ECV a partir de la historia clínica, el ecocardiograma, el electrocardiograma y la evaluación clínica.
Características demográficas y espirométricas de los grupos del estudio
| Pacientes con EPOC (n = 175) | Pacientes sanos (n = 210) | Valor de p | |
|---|---|---|---|
| Edad (años)a | 61 ± 7,4 | 57,4 ± 11 | n.s. |
| Sexo (varones), n (%) | 110 (63) | 119 (57) | n.s. |
| IMC (kg/m2)a | 23,8 ± 3,9 | 25,8 ± 2,1 | n.s. |
| Tabaquismo | |||
| Fumadores (índice de consumo de cigarrillos)a | 43,4 ± 1,1 | 25,5 ± 1,1 | < 0,05 |
| Fumadores activos (n, %) | 77 (44) | 113 (54) | 0,02 |
| Exfumadores (n, %) | 89 (51) | 25 (12) | < 0,001 |
| No fumadores (n, %) | 9 (5) | 72 (34) | < 0,001 |
| Variables analíticas | |||
| ADE (%)a | 15,04 ± 2,3 | 13,08 ± 2,5 | < 0,01 |
| Hb (g/dl)a | 13,3 ± 1,5 | 14,1 ± 3,2 | n.s. |
| PCR (mg/dl)b | 1,1 (0,5-2,9) | 0,5 (0,4-0,7) | < 0,001 |
| Albúmina (g/dl)a | 3,3 ± 0,5 | 3,5 ± 1,2 | n.s. |
| PaO2 (mmHg)a | 64 ± 11 | - | n.d. |
| PaCO2 (mmHg)a | 47 ± 5,2 | - | n.d. |
| pHb | 7,37 (7,35-7,43) | - | n.d. |
| Pruebas de función pulmonar | |||
| FVC (% previsto)b | 43 (32-60) | 96,3 (63-110) | < 0,001 |
| FEV1 (% previsto)b | 36 (26-57) | 91,8 (78-105) | < 0,001 |
| FEV1/FVC (% previsto)b | 64 (52-70) | 95,1 (77-98) | < 0,001 |
FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada, IMC: índice de masa corporal; n: número de casos; n.d.: no disponible; n.s.: estadísticamente no significativo; PCR; proteína C reactiva.
Las ADE y las concentraciones de hemoglobina se determinaron como parte del hemograma y mediante el analizador hematológico Beckman Coulter LH-750 (Beckman Coulter, Inc., Fullerton, CA, EE.UU.). El intervalo de referencia de nuestro laboratorio para la ADE era de 11,5-15,5%. Las concentraciones séricas de albúmina (intervalo: 3,5-5,5g/dl) se determinaron mediante kits de Abbot marcados (número de catálogo: 30-3050/R2) y las concentraciones de PCR (intervalo: 0-1mg/dl) mediante los métodos inmunoturbididémicos del autoanalizador bioquímico Beckman Coulter-Synchron LX- 20 del laboratorio de bioquímica de nuestro hospital. La gasometría se analizó con aire ambiental (Rapid lab 348, Biobak, Chiron, Bayer Diagnostic, Reino Unido).
Pruebas de función pulmonarSe recabaron datos de los resultados de las espirometrías de las historias de los pacientes efectuadas durante un ingreso hospitalario en el que el paciente hubiese mantenido una situación estable o en las 8 semanas posteriores al alta hospitalaria. Para las pruebas de función pulmonar se utilizó el mismo tipo de espirómetro en todos los centros (V Max Series 20C, Sensor Medics, Yorba Linda, CA/Fukuda Denshi Spirosift 500). El utillaje empleado para las espirometrías cumplía los criterios de rendimiento de la American Thoracic Society20. La gravedad de la enfermedad de los pacientes la evaluaron 2 médicos que desconocían los datos del estudio, de conformidad con los criterios de la Iniciativa global para la enfermedad pulmonar obstructiva crónica (Global Initiative for Chronic Obstructive Lung Disease)21.
Resultados ecocardiográficosLos ecocardiogramas se efectuaron mediante ecocardiógrafos SONOS 4,500, con transductores de 3,5 y 2,5MHz (Sonos 5500, Philips, MA, EE.UU.). Se utilizaron proyecciones y mediciones normalizadas para evaluar la anatomía cardíaca, la función ventricular y la competencia valvular; la fracción de eyección ventricular izquierda (FEVI) se determinó por el método de Simpson, con técnicas de imagen armónica por segundo. La presión sistólica de la arteria pulmonar se calculó sumando la presión auricular derecha estimada y el gradiente de regurgitación tricuspídea. Se consideró que el paciente presentaba hipertensión arterial pulmonar (HAP) si la presión sistólica de la arteria pulmonar era superior a 30mmHg. Se diagnosticó disfunción ventricular derecha (DVD) en presencia de cualquiera de los siguientes hallazgos: dilatación del ventrículo derecho (diámetro diastólico >30mm), movimiento anormal del septo interventricular, hipocinesia del ventrículo derecho o regurgitación de la válvula tricúspide (velocidad de reacción, 92,5m/s)21. En caso de ser inferior al 50% del FEVI y un diámetro diastólico superior a 35mm, se diagnosticó disfunción ventricular izquierda (DVI).
Evaluación nutricionalLos pacientes se sometieron a mediciones antropométricas y bioquímicas para evaluar su estado nutricional y bioquímico. A partir de las mediciones antropométricas se calculó el IMC (peso [kg]/talla [m2]). Las determinaciones bioquímicas incluyeron la cuantificación de la concentración de albúmina (intervalo: 3,5-5,5g/dl).
Análisis estadísticosLas variables se presentaron mediante la media y la desviación estándar, o la mediana y el rango intercuartil. Las medias se compararon con la prueba de la t de Student y las medianas con la prueba de la U de Mann-Whitney. Las frecuencias se compararon mediante la prueba de Chi cuadrado y la prueba exacta de Fisher. Para los análisis de correlación se utilizaron las pruebas de correlación de Spearman y de Pearson. Se calculó el valor mediano de ADE, a partir del cual los pacientes con EPOC fueron clasificados en 2 grupos: aquellos cuyos valores de ADE fueron superiores o iguales a la mediana de ADE y aquellos cuyos valores fueron inferiores a dicha mediana. Las variables independientes con valores de p=0,15 en el análisis univariante se volvieron a analizar mediante una regresión logística multivariante. También se efectuó una regresión lineal multivariante gradual para determinar los factores que mostraban una asociación independiente con valores incrementados ADE. Se efectuó un análisis ROC para averiguar el valor de corte de ADE en la DVD.
ResultadosLos valores de ADE de los pacientes con EPOC fueron significativamente más altos que los de los sujetos de control (pacientes con EPOC: 15,04±2,3; rango: 10,4-24,5; sujetos de control: 13,8±2,5; rango: 10-17,2; p<0,001) (tabla 1, fig. 1). La ADE fue >15,5% en 70 pacientes (40%) y 23 (11%) sujetos de control.
La ADE de los pacientes con EPOC mostró correlaciones positivas con las concentraciones de PCR (r=0,27, p=0,001), DVD (r=0,24, p=0,001) y la presencia de HAP (r=0,1, p=0,02) y ECV (r=0,24, p=0,002), y correlaciones inversas con las concentraciones de hemoglobina (Hb) (r=−0,26, p=0, 01) y de albúmina sérica (r=−0,23, p=0,04) (tabla 2). Los análisis de correlación de la población sana mostraron una significativa correlación entre la ADE y el índice de consumo de cigarrillos (r=0,57, p<0,001), y una correlación inversa con la concentración de Hb (r=−0,38, p=0,01) (tabla 2).
Coeficientes de correlación de las variables demográficas y analíticas con la ADE en la población del estudio
| Variable | Pacientes con EPOC | Sujetos sanos | ||
|---|---|---|---|---|
| ADE | ADE | |||
| Coeficiente r | p | Coeficiente r | p | |
| Características demográficas | ||||
| Edad media (años)a | 0,09 | n.s. | −0,1 | n.s. |
| Sexo (varones), n (%) | −0,06 | n.s. | −0,2 | n.s. |
| Índice de consumo de cigarrillosa | −0,04 | n.s. | 0,57 | < 0,001 |
| Fumadores activos, n (%) | 0,09 | n.s. | 0,18 | n.s. |
| Exfumadores, n (%) | 0,05 | n.s. | 0,04 | n.s. |
| IMC (kg/m2)a | 0,02 | n.s. | −0,2 | n.s. |
| Variables respiratorias | ||||
| FEV1 (%)b | 0,07 | n.s. | 0,06 | n.s. |
| FEV1/FVC (% prev.)b | 0,06 | n.s. | 0,1 | n.s. |
| FVC (%)b | −0,01 | n.s. | −0,1 | n.s. |
| Comorbilidades | n.d. | |||
| Hipertensión, n (%) | −0,03 | n.s. | ||
| Diabetes mellitus, n (%) | 0,1 | n.s. | ||
| Enfermedad CV, n (%) | 0,24 | 0,002 | ||
| Variables analíticas | ||||
| Hemoglobina (g/dl)a | −0,26 | < 0,001 | −0,38 | 0,01 |
| PCR (mg/dl)b | 0,27 | < 0,001 | −0,09 | n.s. |
| Albúmina (g/dl)a | −0,23 | 0,04 | 0,18 | n.s. |
| PaO2 (mmHg)a | −0,0 | n.s. | n.d. | |
| PaCO2 (mmHg)a | 0,16 | n.s. | n.d. | |
| pHb | 0,05 | n.s. | n.d. | |
| Parámetros ecocardiográficos | n.d. | |||
| DVI (n, %) | −0,05 | n.s. | ||
| DVD (n, %) | 0,24 | < 0,001 | ||
| Presencia de HAP (n, %) | 0,1 | 0,02 | ||
FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; HAP, hipertensión arterial pulmonar; IMC: índice de masa corporal; LVD; disfunción ventricular izquierda; n, número de casos; n.d., no disponible; n.s., estadísticamente no significativo; PCR: proteína C reactiva; RVD, disfunción ventricular derecha.
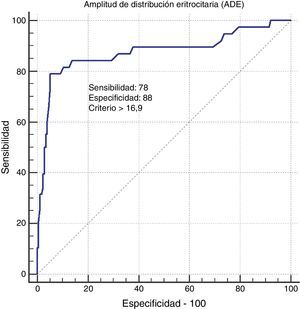
Al comparar los pacientes con valores elevados de ADE (>15,5%) con aquellos que no presentaban elevaciones de la ADE (≤15,5%), los primeros tuvieron más probabilidades de presentar valores más elevados de PCR y de PaCO2, y más bajos de FEV1. Además de la DVD, la presencia de HAP y de ECV fue significativamente más alta entre los pacientes con ADE elevada (tabla 3). En la población sana, los valores de ADE fueron significativamente más altos entre los fumadores, en comparación con los no fumadores (tabla 4). Asimismo, en la comparación de los sujetos sanos con ADE incrementada o normal, solo el índice de consumo de cigarrillos indicó significación estadística. El análisis univariante de los pacientes con EPOC mostró que los valores elevados de ADE (>15,5%) eran los que se asociaban más estrechamente con los niveles más altos de PCR (p=0,001) y de PaCO2 (p=0,02), las concentraciones más bajas de Hb (p=0,01) y la presencia de HAP (p=0,1), ECV (p=0,001) y DVD (p=0,004). En el análisis multivariante, la probabilidad de presentar una ECV fue significativamente mayor en los pacientes con valores elevados de ADE (p=0,01) y presencia de DVD (p=0,02) (tabla 5). El análisis ROC mostró que el punto de corte óptimo de ADE para el diagnóstico de la DVD es de 16,9. Al utilizar este punto de corte, la sensibilidad y la especificidad de la ADE para el diagnóstico de la DVD fueron del 78 y del 88,7%, respectivamente (fig. 2).
Comparación de parámetros entre los grupos de pacientes con EPOC con ADE normal y ADE elevada
| ADE > 15,5% (n=70) | ADE ≤ 15,5% (n=105) | p | |
|---|---|---|---|
| Características demográficas | |||
| Edad media (años)a | 61,7±7,5 | 60,3±7,4 | n.s. |
| Sexo (varones), n (%) | 47 (68) | 63 (60) | n.s. |
| Índice de consumo de cigarrillosa | 40 (10-60) | 38 (8-54) | n.s. |
| Fumadores activos, n (%) | 28 (40) | 49 (46) | n.s. |
| Exfumadores, n (%) | 35 (50) | 54 (46) | n.s. |
| IMC (kg/m2)a | 26,5±6,1 | 26±4,6 | n.s. |
| Variables respiratorias | |||
| FEV1 (%)b | 33 (20-70) | 37 (20-70) | < 0,05 |
| FEV1/FVC (% prev.)b | 67 (56-74) | 68 (56-75) | n.s. |
| FVC (%)b | 41 (30-54) | 43 (34-67) | n.s. |
| Comorbilidades | |||
| Hipertensión (n, %) | 15 (20) | 20 (19) | n.s. |
| Diabetes mellitus (n, %) | 4 (5) | 8 (5) | n.s. |
| Enfermedad CV (n, %) | 18 (24) | 12 (11) | 0,001 |
| Parámetros hemáticos | |||
| Hemoglobina (g/dl)a | 13,2±2,1 | 14,1±3,2 | 0,011 |
| VCM (fl)a | 83,7±4,1 | 87±7,2 | < 0,001 |
| PCR (mg/dl)b | 2,7 (0,7-10) | 1,5 (0,6-3,8) | < 0,001 |
| Albúmina (g/dl)a | 3,3±0,5 | 3,6±1,2 | 0,04 |
| PaO2 (mmHg)a | 65±10 | 68±9 | n.s. |
| PaCO2 (mmHg)a | 47±8.6 | 43±6,3 | < 0,05 |
| pHb | 7,39 (7,35 - 7,44) | 7,4 (7,37-7,42) | n.s. |
| Duración de la enfermedad (años)b | 14 (7-20) | 12 (6-20) | n.s. |
| Parámetros ecocardiográficos | |||
| Disfunción VI, n (%) | 6 (8) | 11(10) | n.s. |
| Disfunción VD, n (%) | 32 (42) | 26 (25) | 0,001 |
| Presencia de HAP, n (%) | 43 (57) | 42 (40) | 004 |
FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; HAP: hipertensión arterial pulmonar; IMC: índice de masa corporal; LVD: disfunción ventricular izquierda; n: número de casos; n.s.: estadísticamente no significativo; p: ADE elevada vs. no elevada; PCR: proteína C reactiva; RVD: disfunción ventricular derecha; VCM: volumen corpuscular medio.
Características demográficas, espirométricas y parámetros hemáticos iniciales de los sujetos sanos
| Fumadores (n=113) | No fumadores (n=72) | p | |
|---|---|---|---|
| Características demográficas | |||
| Edad media (años)a | 55±7,3 | 52,7±3 | n.s. |
| Sexo (varones), n (%) | 59 (52) | 40 (55) | n.s. |
| IMC (kg/m2)a | 23,5±3,1 | 25,5±7 | n.s. |
| Variables respiratorias | |||
| FEV1 (%)b | 94,1 (56-110) | 97,5 (53-105) | n.s. |
| FEV1/FVC (% previsto)b | 87,8 (78-105) | 91 (80-105) | n.s. |
| FVC (%)b | 95,1 (77-98) | 92,3 (80-98) | n.s. |
| Parámetros hemáticos | |||
| Amplitud de distribución eritrocitariaa | 13,09±1,3 | 11,04±2,3 | 0,002 |
| Hemoglobina (g/dl)a | 13,4±2,1 | 14,6±3,2 | n.s. |
| VCM (fl)a | 83,7±4,1 | 87±7,2 | < 0,05 |
| PCR (mg/dl)b | 95 (0,7-4,6) | 1,3 (0,6-5,8) | n.s. |
| Albúmina (g/dl)a | 3,3±0,5 | 3,6±1,1 | n.s. |
FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; HAP: hipertensión arterial pulmonar; IMC: índice de masa corporal; LVD: disfunción ventricular izquierda; n: número de casos; n.s.: estadísticamente no significativo; p: amplitud de distribución eritrocitaria elevado vs. no elevado; PCR: proteína C reactiva; RVD: disfunción ventricular derecha; VCM: volumen corpuscular medio.
Análisis univariante y multivariante de los factores de riesgo de elevación de la amplitud de distribución eritrocitaria en pacientes con enfermedad pulmonar obstructiva crónica
| Variables | Análisis univariante p OR (IC 95%) | Análisis multivariante p OR (IC 95%) |
|---|---|---|
| Edad | 0,17 1,026 (0,98-1) | |
| Sexo | 0,98 1 (0,5-1,9) | |
| IMC | 0,6 0,99 (0,91-1,18) | |
| Índice de consumo de cigarrillos | 0,69 1 (0,9-1) | |
| Fumador activo | 0,75 0,8 (0,3-1,9) | |
| PCR | < 0,001 1,3 (1,1-1,4) | 0,7 0,9 (0,4-1,4) |
| PaO2 | 0,23 0,9 (0,95-1,01) | |
| PaCO2 | 0,04 1,04 (1,01-1,91) | 0,11 1,04 (0,98-1,1) |
| Albúmina | < 0,05 0,36 (0,17-0,75) | 0,52 0,9 (0,86-1) |
| Hemoglobina | 0,004 0,8 (0,6-0,9) | 0,06 0,8 (0,6-1,01) |
| FVC, previsto % | 0,18 1,6 (0,9-1,1) | |
| FEV1/FVC (% previsto) | 0,45 1,01 (0,97-1,06) | |
| FEV1, previsto % | 0,9 0,97 (0,95-1) | |
| Presencia de HAP | 0,08 0,6 (0,3-1,1) | 0,5 0,74 (0,3-1,8) |
| Presencia de enfermedad cardiovascular | < 0,001 5,3 (2,7-9,4) | 0,01 4,3 (1,3-11) |
| Presencia de DVD | < 0,001 6,08 (3,1-11,8) | 0,02 3,1 (1,7-8,3) |
| Presencia de DVI | 0,46 0,58 (0,14-2,45) | |
| Presencia de hipertensión | 0,44 1,3 (0,6-3,2) |
DVD: disfunción ventricular derecha; DVI: disfunción ventricular izquierda; FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; HAP: hipertensión arterial pulmonar; IMC: índice de masa corporal; n.s.: estadísticamente no significativo; PCR: proteína C reactiva.
Curva de características operativas del receptor. Los valores de amplitud de distribución eritrocitaria obtenidos antes del ecocardiograma fueron predictivos de la presencia de DVD, con una sensibilidad del 71% y una especificidad del 88%, y un valor de corte >16,9.
ADE: amplitud de distribución eritrocitaria; DVD: disfunción ventricular derecha.
En los últimos años, numerosos estudios han demostrado los que la ADE es un sólido factor pronóstico de la mortalidad por todas las causas y de episodios cardiovasculares en pacientes con antecedentes de enfermedad cardíaca o insuficiencia cardíaca crónica7-10. Asimismo, en cohortes poblacionales, la ADE ha demostrado ser un factor de predicción sólido de la mortalidad por todas las causas10,11,13. Todos los estudios sugieren que la fisiopatología que conduce a la elevación de la ADE puede ser un reflejo de un estado inflamatorio crónico subyacente que causaría mayor riesgo de ECV y mayor mortalidad5,14,15. Planteamos la hipótesis de que, en pacientes con EPOC, una situación de inflamación crónica podría ser un vínculo mecánico entre la elevación de la ADE y la ECV. El presente estudio ha demostrado que la ADE de los pacientes con EPOC es más alta, en comparación con los sujetos de control. Además, se ha observado que en estos pacientes la ADE es un factor de predicción independiente de ECV.
La elevación de la ADE es el resultado de la heterogeneidad del volumen eritrocitario y la fragmentación de eritrocitos en la circulación6. Los factores que contribuyen a esta mayor heterogeneidad del volumen eritrocitario comprenden la deficiencia de hierro, vitaminaB12 o folato, la reducción de la vida de los eritrocitos, la alteración de la eritropoyesis y las transfusiones de sangre6. La inflamación también tiene la capacidad de incrementar los valores de ADE22,23. Estudios recientes han demostrado que los valores elevados de ADE también se asocian con resultados adversos en la ECV y en otras patologías no cardiovasculares como, por ejemplo, la insuficiencia cardíaca, la hipertensión pulmonar, la embolia pulmonar, la apnea del sueño, así como en pacientes de unidades de cuidados intensivos7,9,12,13,24-26. Por otra parte, el presente estudio ha indicado que, en adultos de mediana edad y ancianos, la elevación de la ADE está muy relacionada con un mayor riesgo de muerte y de episodios cardiovasculares13,27. Los valores de ADE en pacientes con EPOC han sido examinados en 2 estudios16,17. Estos estudios concluyeron que la ADE podría ser un marcador pronóstico a largo plazo y un marcador de DVD. En nuestro estudio, observamos que los valores de ADE de los pacientes con EPOC eran significativamente más altos que los de los sujetos sanos. Nuestro objetivo principal fue no discriminar a los pacientes con EPOC de los sujetos sanos. Sin embargo, cuando se comparan pacientes con EPOC y sujetos sanos, la capacidad discriminatoria no es alta. Al igual que en el estudio que llevaron a cabo Dincer et al.17, observamos que los valores elevados de ADE se asociaban con ECV en pacientes con EPOC.
La ECV es más frecuente entre los pacientes con EPOC que en la población general4. También es un factor de riesgo importante del desarrollo de ECV. Asimismo, se cree que la hipoxemia, el estrés oxidativo y la inflamación sistémica también contribuyen a la aparición de la ECV en pacientes con EPOC4,5. Es posible que, mediante todas estas vías, la EPOC esté relacionada con la ECV en cuanto se refiere a inflamación, ateroesclerosis y disfunción endotelial28. La liberación de citocinas inflamatorias en la EPOC podría afectar la función medular ósea, lo que inhibiría la maduración eritrocitaria inducida por la eritropoyetina y, como consecuencia, incrementaría la ADE22. Así, valores elevados de ADE podrían ser el reflejo de inflamación crónica subyacente, lo que resultaría en mayor riesgo de ECV en pacientes con EPOC. En el presente estudio observamos una correlación significativa entre la PCR y la ADE. Este hallazgo podría demostrar un posible vínculo entre la inflamación de la EPOC y los valores de ADE. Un 34% de los pacientes con EPOC de este estudio presentaban una ECV comórbida. Además, se concluyó que la ECV concomitante era la causa principal de la elevación de la ADE de estos pacientes.
La hipertensión pulmonar (HP) produce hipertrofia ventricular derecha, agrandamiento del ventrículo derecho y, finalmente, DVD. Hampole et al.12 investigaron la relación existente entre la ADE y la muerte en 162 pacientes con HP, y observaron que existe una asociación independiente entre la ADE y la mortalidad, y que esta es mejor indicador pronóstico que el péptido pronatriurético N-terminal. En otro estudio efectuado en pacientes con EPOC se constató una asociación entre la elevación de la ADE y la DVD17. El estudio de Dincer probó que el punto de corte para detectar DVD en pacientes con EPOC era de 17,7. De manera similar, nosotros concluimos que una ADE elevada se correlacionaba bien con la HP y la DVD en pacientes con EPOC. Además, observamos que un valor de ADE de 16,9 también es altamente sensible y específico para el diagnóstico de DVD, y el análisis multivariante indicó que la DVD es uno de los factores que influyen en el valor de ADE de los pacientes con EPOC, por lo que consideramos que una ADE incrementada puede ser un indicador de DVD.
El tabaquismo es uno de los principales factores de riesgo de EPOC y un importante factor de riesgo de ECV4. Por sí mismo, el tabaquismo puede producir inflamación sistémica evidenciada, por ejemplo, por un aumento del recuento leucocitario total. Pero el grado de inflamación sistémica es mayor en los pacientes con EPOC18. La inflamación local que presentan los fumadores se caracteriza por un aumento de las células inflamatorias, tales como neutrófilos, linfocitos y macrófagos, y concentraciones elevadas de TNF-α y IL-8, en comparación con los controles sanos29. Estos resultados sugieren que el tabaquismo puede asociarse con mayor producción hepática de PCR y a los mecanismos de la inflamación sistémica. En un estudio que examinó la asociación entre el tabaquismo y la ADE en sujetos sanos se demostró que el consumo de tabaco incrementaba los valores de ADE, y que la duración del tabaquismo y el número de cigarrillos diarios se correlacionaban bien con el valor de ADE19. En el presente estudio detectamos una correlación positiva entre el índice de consumo de cigarrillos y la ADE en sujetos sanos. La ADE fue significativamente más alta en los sujetos fumadores que en los no fumadores. Este hallazgo sugiere que los fumadores sanos que no padecen EPOC también pueden presentar inflamación sistémica. Por consiguiente, planteamos la hipótesis de que un aumento de la ADE se asocia con el consumo de tabaco y puede ser un indicador útil de la actividad inflamatoria de los fumadores sanos.
Las limitaciones que presenta este estudio son la inclusión de pocos pacientes y la debilidad de algunas correlaciones. Es necesario llevar a cabo un estudio longitudinal para determinar la relación causal entre la inflamación sistémica y la ECV. Este estudio debería considerarse un estudio piloto que requiere ser validado.
Para concluir, un aumento de la ADE puede ser un indicador de inflamación subyacente en la EPOC y, por sí misma, la ADE puede ser un instrumento simple y útil para evaluar la ECV y la DVD en pacientes con EPOC. En pacientes con EPOC, la ADE ha demostrado ser más sensible que la PCR para predecir la existencia de disfunción ventricular derecha y ECV. Se trata de un parámetro cuya determinación es más frecuente y barata que la de otras citocinas inflamatorias (TNF-α, IL-8, etc.). Además, en los sujetos sanos la ADE podría ser un biomarcador del efecto de inflamación sistémica del tabaquismo.
AutoríaEl Dr. S.E.C. efectuó todos los procedimientos, preparó la base de datos y redactó el manuscrito.
El Dr. O.G. asistió al Dr. S.E.C. durante la práctica de los procedimientos, organizó la base de datos y contribuyó a la redacción del manuscrito.
El Dr. O.M.A. asistió al Dr. S.E.C. durante la práctica de los procedimientos y la preparación de la base de datos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.