Desde el punto de vista respiratorio, la obesidad se asocia con 2 enfermedades muy relacionadas: el síndrome de obesidad-hipoventilación (SOH) y el síndrome de apnea-hipopnea del sueño (SAHS). Se ha demostrado que el tratamiento con ventilación mecánica no invasiva durante el sueño produce una mejoría clínica y funcional en estos pacientes. Analizamos a largo plazo la supervivencia con este tratamiento, y la diferencia en la evolución entre pacientes con SOH con y sin SAHS asociado.
MetodologíaEstudio longitudinal, observacional, de una cohorte de pacientes diagnosticados de SOH e incluidos en un programa de ventilación domiciliaria a lo largo de 12 años, distribuidos en 2 grupos: SOH puro y SOH asociado a SAHS. La ventilación se llevó a cabo con ventiladores de presión positiva continua binivel. Durante el tiempo de seguimiento se monitorizó y comparó su situación clínica (síntomas, exacerbaciones e ingresos), gasométrica y funcional, así como su supervivencia.
ResultadosOchenta y tres pacientes fueron válidos para el análisis, 60 mujeres (72,3%) y 23 hombres (27,7%), con una media de supervivencia de 8,47 años. Cincuenta pacientes (60,2%) fueron incluidos en el grupo sin SAHS (SOH) y 33 (39,8%) en el grupo con SAHS (SOH-SAHS). La PaCO2 del grupo SOH era significativamente mayor que la del grupo SOH-SAHS (p<0,01), y también presentaban más hospitalizaciones (p<0,05). Existió una mejoría significativa en ambos grupos en FEV1 y FVC, y en los valores de PaCO2 y PaO2, sin diferencias entre los grupos. Mientras que no se apreciaron diferencias en la supervivencia relacionadas con el subgrupo diagnóstico, valores bajos de FVC sí constituían un factor predictivo de mortalidad.
ConclusionesEl uso de ventilación domiciliaria en pacientes con SOH con o sin SAHS es un tratamiento eficaz que corrige las alteraciones gasométricas y funcionales y permite alcanzar tiempos prolongados de supervivencia
Obesity is associated with 2 closely related respiratory diseases: obesity hypoventilation syndrome (OHS) and obstructive sleep apnea-hypopnea syndrome (OSAHS). It has been shown that noninvasive ventilation during sleep produces clinical and functional improvement in these patients. The long-term survival rate with this treatment, and the difference in clinical progress in OHS patients with and without OSAHS are analyzed.
MethodologyLongitudinal, observational study with a cohort of patients diagnosed with OHS, included in a home ventilation program over a period of 12 years, divided into 2 groups: pure OHS and OSAHS-associated OHS. Bi-level positive airway pressure ventilation was administered. During the follow-up period, symptoms, exacerbations and hospitalizations, blood gas tests and pulmonary function tests, and survival rates were monitored and compared.
ResultsEighty-three patients were eligible for analysis, 60 women (72.3%) and 23 men (27.7%), with a mean survival time of 8.47 years. Fifty patients (60.2%) were included in the group without OSAHS (OHS) and 33 (39.8%) in the OSAHS-associated OHS group (OHS-OSAHS). PaCO2 in the OHS group was significantly higher than in the OHS-OSAHS group (P<.01). OHS patients also had a higher hospitalization rate (P<.05). There was a significant improvement in both groups in FEV1 and FVC, and no differences between groups in PaCO2 and PaO2 values. There were no differences in mortality between the 2 groups, but low FVC values were predictive of mortality.
ConclusionsThe use of mechanical ventilation in patients with OHS, with or without OSAHS, is an effective treatment for the correction of blood gases and functional alterations and can achieve prolonged survival rates.
La obesidad es la enfermedad metabólica de mayor prevalencia en el mundo occidental, se asocia a una elevada morbimortalidad y ha sido reconocida por la Organización Mundial de la Salud como un grave problema de salud, social y económico1. Determina alteraciones importantes en la fisiología del sistema respiratorio, que pueden dar lugar a un amplio espectro de manifestaciones clínicas, las cuales van desde la disnea secundaria, pasando por la limitación ventilatoria restrictiva, hasta la insuficiencia respiratoria hipercápnica, característica del síndrome de obesidad-hipoventilación (SOH)2–4.
El SOH se describió por primera vez en 19565, y actualmente se define como una condición caracterizada por la presencia de obesidad, hipercapnia y alteraciones respiratorias durante el sueño, en ausencia de otra enfermedad que justifique la existencia de insuficiencia respiratoria6. Pese al tiempo transcurrido, su patogenia no ha sido totalmente aclarada, si bien parece tener un origen multifactorial en el que juegan un importante papel la alteración de la mecánica ventilatoria, la disfunción muscular secundaria a la obesidad y el control de la ventilación7,8. Para muchos autores no sería sino una forma evolutiva del síndrome de apnea hipopnea del sueño (SAHS) en algunos sujetos obesos9, pero, sin embargo, aunque la presencia de trastornos respiratorios durante el sueño es una condición definitoria de SOH, no siempre se asocia a SAHS10 y se desconoce qué subgrupo tiene mejor evolución. Pese a que su prevalencia en población obesa general no se conoce con exactitud, en pacientes obesos con SAHS oscila entre el 10 y el 20%11,12. Estudios en pacientes obesos hospitalizados han mostrado una mayor prevalencia, poniendo también de manifiesto una elevada mortalidad13.
Desde la introducción de la presión positiva continua (CPAP) en el tratamiento del SAHS, esta se convirtió también en el tratamiento del SOH, reservándose el uso de ventilación mecánica no invasiva (VMNI) con presión positiva para los casos en que no se alcanzaba una respuesta terapéutica suficiente14–16. A pesar de que inicialmente numerosos grupos, fundamentalmente europeos, rechazaran la VMNI como forma estándar de tratamiento del SOH, se demostró que, en este grupo de pacientes, se obtenían resultados similares a los observados en pacientes con insuficiencia respiratoria secundaria a enfermedad de la caja torácica17, tanto en situaciones agudas como en el domicilio a largo plazo18. La VMNI aplicada durante el periodo de sueño en pacientes con SOH produce una mejoría clínica y funcional con cambios favorables de los gases arteriales, de la poliglobulia, de la función respiratoria y de la respuesta ventilatoria a la hipercapnia. Estos cambios se traducen en una disminución en el número de ingresos hospitalarios y su duración, en el número de visitas a los servicios de Urgencias y en una mejora de la calidad de vida y de la supervivencia19,20. Sin embargo, pocos estudios a largo plazo han permitido evaluar la supervivencia, y tampoco se han realizado análisis que diferencien el comportamiento de pacientes con y sin SAHS, a pesar de que se ha visto que estos últimos pueden ser tratados de forma segura con CPAP21.
El objetivo de este estudio es conocer las diferencias evolutivas entre pacientes con SOH y aquellos con SOH y SAHS tratados con ventilación mecánica domiciliaria (VMD), identificando factores pronósticos de supervivencia.
MetodologíaDiseñoSe ha realizado un estudio prospectivo, longitudinal, observacional, de una cohorte de pacientes diagnosticados de SOH en la Unidad de Soporte Ventilatorio de nuestro hospital a lo largo de un periodo de 12 años (de 1998 a 2010), que cumplían todos los criterios de inclusión y ninguno de los de exclusión para ser incluidos en el programa de VMD.
PoblaciónSe incluyeron pacientes con diagnóstico confirmado de SOH con índice de masa corporal superior a 30kg/m2, presencia de insuficiencia respiratoria con PaCO2 superior a 45mmHg durante el día y mayor de 50mmHg durante la noche, con o sin SAHS asociado, los cuales entraron en el programa de VMD en situación estable o tras una hospitalización por agudización, una vez que se alcanzaba la estabilidad clínica. Se excluyeron los pacientes con enfermedad obstructiva definida por una relación FEV1/FVC%<70%, enfermedad neuromuscular con afectación respiratoria y cualquier otra enfermedad respiratoria diferente del SOH. Aunque la mayoría de las definiciones del síndrome excluyen la presencia de alteración significativa de la mecánica ventilatoria secundaria a la obesidad, en este estudio se han incluido pacientes con cualquier valor de FVC, por considerar que permite una mejor evaluación del tratamiento.
Grupos de estudioLos pacientes fueron distribuidos en 2 grupos en función de los resultados de la poligrafía nocturna. El grupo 1 (SOH), integrado por aquellos pacientes que presentaron un índice de apnea-hipopnea menor o igual a 5, y el grupo 2 (SOH-SAHS), formado por los pacientes en los que dicho índice era superior a 5.
MétodosAntes de iniciar el programa de ventilación, a todos los pacientes se les realizaba un cuestionario clínico en el que se recogían, junto con los síntomas, las hospitalizaciones previas y en cuidados intensivos, una espirometría, una gasometría arterial basal, una gasometría arterial de madrugada y un estudio poligráfico del sueño o una polisomnografía. Tanto la espirometría como la gasometría fueron realizadas de acuerdo con la normativa de la Sociedad Española de Neumología y Cirugía Torácica22. Los estudios del sueño se realizaban de forma estándar23, con un polígrafo respiratorio (Apnoscreen II, Jaeger, Alemania) de 12 canales debidamente validado o con un polisomnógrafo de 18 canales (Sleepscreen, Jaeger, Würzburg, Alemania). En cualquiera de los casos el flujo aéreo se medía por termistancias y cánula nasal, y se realizaba una lectura automática y manual.
La ventilación se llevó a cabo con ventiladores de presión positiva continua binivel (BiPAP de Respironics o Harmony de Respironics, Lousville, EE. UU.) en modalidad ST, y mascarillas nasales. Se utilizó una presión positiva espiratoria entre 6 y 10cmH2O y una presión positiva inspiratoria de 16cmH2O que se incrementaba progresivamente, hasta conseguir los objetivos de eficacia perseguidos o cuando se alcanzaba una presión máxima de 24cmH2O. La frecuencia respiratoria inicial de respaldo era de 16rpm, con una relación inspiración/espiración de 0,4 o un tiempo inspiratorio de 1,5s. Para facilitar la adaptación del paciente, se comenzó con ventilación en periodos de 2h durante el día, con monitorización de la saturación de oxígeno y medición mediante gasometría arterial de la PaCO2 al inicio y al término de la sesión. Cuando la oximetría ponía de manifiesto persistencia de desaturación se añadía oxígeno suplementario, mientras que los niveles de presión de soporte se ajustaban de acuerdo con la gasometría final. Se consideró que la ventilación estaba siendo eficaz cuando la PaCO2 se mantenía por debajo de 45mmHg o descendía más de 5mmHg con respecto a la basal, con una saturación media de oxígeno superior al 90%. Tras esta adaptación diurna se procedió a la adaptación nocturna, controlando la saturación de oxígeno mediante oximetría, y realizando una gasometría de control de madrugada. En los pacientes diagnosticados de SOH-SAHS, un segundo estudio poligráfico nocturno parcialmente supervisado, con respirador, fue realizado para ajustar los niveles de presión positiva espiratoria e inspiratoria, a fin de asegurar el control de los eventos nocturnos de apnea e hipopnea.
Durante el primer año de seguimiento los pacientes eran revisados cada 3 meses. Posteriormente, y a lo largo de toda su permanencia en el programa de VMD, han seguido revisiones anuales. En cada una de las revisiones se recogían datos clínicos de síntomas, exacerbaciones, ingresos, modificaciones de peso y efectos secundarios. Se valoraba el cumplimiento con contador horario y se realizaban pruebas de función pulmonar, gasometría arterial respirando aire ambiente, oximetría nocturna bajo ventilación y gasometría nocturna también en ventilación. La ventilación era considerada adecuada si la PaCO2 nocturna en ventilación era inferior a 50mmHg, el pH superior a 7,35 y la saturación de oxígeno superior al 90% durante el 90% de la noche. En los pacientes con SOH-SAHS, si transcurrido un año desde el inicio de la ventilación se observaba que la PaCO2 basal era menor de 45mmHg, se realizaba una gasometría nocturna sin ventilador; si se mantenía esta cifra, se pasaba a tratamiento con CPAP.
Análisis estadísticoSe ha realizado un análisis descriptivo de las variables cualitativas, que se muestran como frecuencias absolutas y porcentajes, mientras que las variables cuantitativas se expresan como medias y desviación estándar (DE). En las variables con distribución no normal o donde los grupos son pequeños (n<15) los datos se presentan por la mediana, el rango intercuartílico y los valores mínimo y máximo. En la comparación de 2 grupos simultáneamente se aplica el análisis de t de Student. Para analizar los cambios durante el seguimiento de los pacientes a uno, 3, 5 y 8 años se utiliza la prueba t de Student de medidas repetidas o el test de Wilcoxon. Cuando el tamaño de los grupos a comparar fue pequeño o no hubo homogeneidad, se utilizaron pruebas estadísticas no paramétricas. En las variables cualitativas, se utilizó la prueba Ji-cuadrado de Pearson para medir la asociación y comparar proporciones. Cuando los grupos fueron pequeños, se optó por la prueba exacta de Fisher. La progresión a muerte se estudió mediante curvas Kaplan-Meier y comparando los grupos con el test Log-rank. El riesgo relativo de supervivencia se estima mediante un modelo de regresión de Cox.
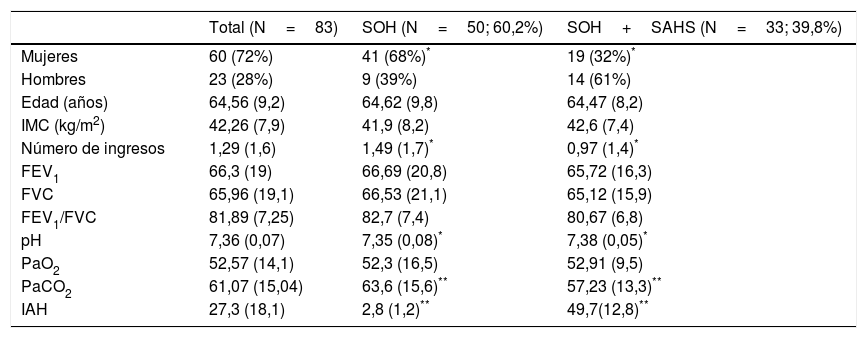
ResultadosDatos inicialesA lo largo de 12 años se han incluido en programa de VMD 153 pacientes con obesidad e hipercapnia crónica, de los cuales 70 presentaban también obstrucción al flujo aéreo y fueron excluidos, habiéndose incluido finalmente 83 pacientes: 60 mujeres (72,3%) y 23 hombres (27,7%). Los pacientes presentaban unas pruebas de función pulmonar correspondientes a una limitación ventilatoria restrictiva con una FVC media del 65,9% (DE 19) y un FEV1 del 66,3% (DE 19). La gasometría arterial correspondía a una insuficiencia respiratoria global, con una PaO2 media de 52,3mmHg (DE 16,5) y una PaCO2 media de 63,6mmHg (DE 15,6).
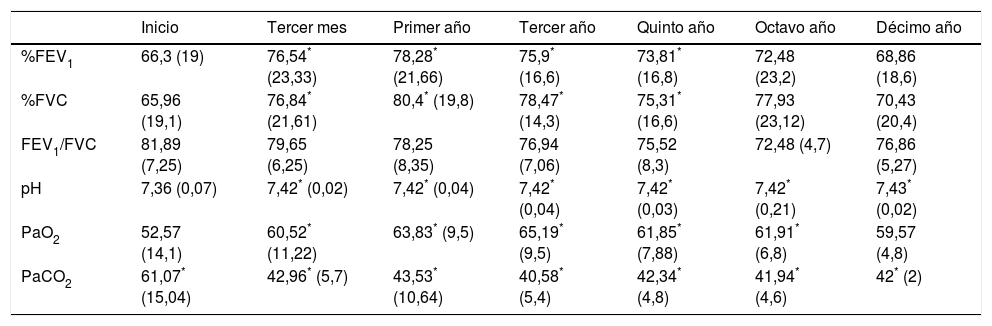
Cincuenta pacientes, un 60,2%, fueron incluidos en el grupo 1i, sin SAHS (SOH), y 33 (39,8%) en el grupo 2, con SAHS (SOH-SAHS). Las características clínicas y funcionales de ambos grupos se recogen en la tabla 1. El 82% del grupo SOH eran mujeres frente al 57,6% del grupo SOH-SAHS (p<0,05). La PaCO2 del grupo SOH era significativamente mayor que la del grupo SOH-SAHS (p<0,01), y los primeros también presentaban un mayor número de hospitalizaciones por exacerbación (p<0,05).
Características de los pacientes en el momento de su inclusión
| Total (N=83) | SOH (N=50; 60,2%) | SOH+SAHS (N=33; 39,8%) | |
|---|---|---|---|
| Mujeres | 60 (72%) | 41 (68%)* | 19 (32%)* |
| Hombres | 23 (28%) | 9 (39%) | 14 (61%) |
| Edad (años) | 64,56 (9,2) | 64,62 (9,8) | 64,47 (8,2) |
| IMC (kg/m2) | 42,26 (7,9) | 41,9 (8,2) | 42,6 (7,4) |
| Número de ingresos | 1,29 (1,6) | 1,49 (1,7)* | 0,97 (1,4)* |
| FEV1 | 66,3 (19) | 66,69 (20,8) | 65,72 (16,3) |
| FVC | 65,96 (19,1) | 66,53 (21,1) | 65,12 (15,9) |
| FEV1/FVC | 81,89 (7,25) | 82,7 (7,4) | 80,67 (6,8) |
| pH | 7,36 (0,07) | 7,35 (0,08)* | 7,38 (0,05)* |
| PaO2 | 52,57 (14,1) | 52,3 (16,5) | 52,91 (9,5) |
| PaCO2 | 61,07 (15,04) | 63,6 (15,6)** | 57,23 (13,3)** |
| IAH | 27,3 (18,1) | 2,8 (1,2)** | 49,7(12,8)** |
FEV1: volumen espirado forzado en el primer segundo; FVC: capacidad vital forzada; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; PaO2: presión de oxígeno en sangre arterial; PaCO2: presión parcial de dióxido de carbono en sangre arterial; SOH: síndrome de obesidad-hipoventilación; SAHS: síndrome de apnea-hipopnea del sueño.
Valores expresados como n (porcentaje) o media (desviación estándar). FEV1 y FVC expresados en porcentajes sobre los valores teóricos de referencia. PaO2 y PaCO2 expresadas en mmHg.
El tiempo medio de seguimiento en ventilación ha sido de 7,44 años (intervalo de confianza del 95% [IC 95%]: 6,22-8,65). En 21 de los 83 pacientes, el 25%, se ha interrumpido la ventilación: 12 casos por mejoría y en 9 por abandono o bajo número de horas de cumplimiento, que de media era de 5,7±1,3h/noche, considerando que los pacientes eran buenos cumplidores si utilizaban la BiPAP más de 4h/noche. De los 12 pacientes que mejoraron, 9 pertenecían al grupo SOH-SAHS y pasaron a CPAP, y en 3 del grupo SOH se observó mejoría clínica por pérdida de peso.
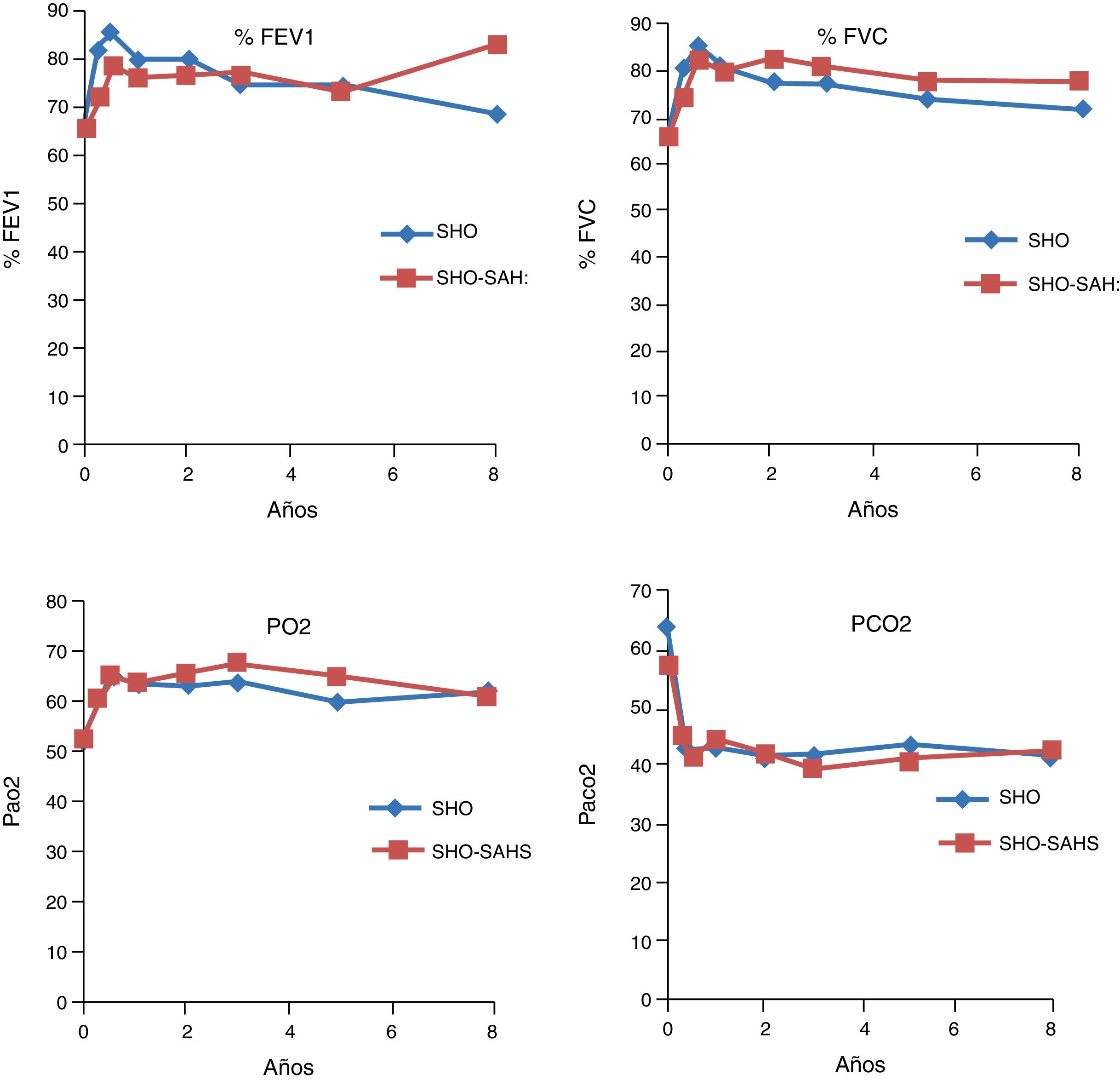
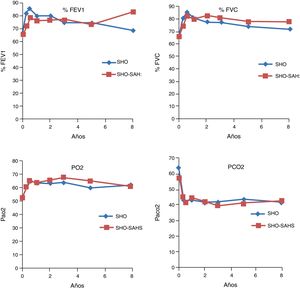
Evolución en las pruebas de función pulmonarEn los 2 grupos estudiados se observó una mejoría significativa tanto en el FEV1 como en la FVC ya en el tercer mes, la cual se mantenía al primer, tercer, quinto, octavo y décimo años de tratamiento, si bien en los 2 últimos puntos de control la mejoría no era significativa, por el pequeño número de pacientes. En cuanto a las cifras gasométricas, también se produjo un incremento significativo en los valores de PaO2, así como un descenso también significativo de los valores de PaCO2 (tabla 2). El comportamiento evolutivo de la función pulmonar y de la gasometría no mostró diferencias entre ambos grupos (fig. 1).
Evolución de las pruebas de función respiratoria y gasometrías a los 3 meses, uno, 3, 5, 8 y 10 años en el conjunto de la población
| Inicio | Tercer mes | Primer año | Tercer año | Quinto año | Octavo año | Décimo año | |
|---|---|---|---|---|---|---|---|
| %FEV1 | 66,3 (19) | 76,54* (23,33) | 78,28* (21,66) | 75,9* (16,6) | 73,81* (16,8) | 72,48 (23,2) | 68,86 (18,6) |
| %FVC | 65,96 (19,1) | 76,84* (21,61) | 80,4* (19,8) | 78,47* (14,3) | 75,31* (16,6) | 77,93 (23,12) | 70,43 (20,4) |
| FEV1/FVC | 81,89 (7,25) | 79,65 (6,25) | 78,25 (8,35) | 76,94 (7,06) | 75,52 (8,3) | 72,48 (4,7) | 76,86 (5,27) |
| pH | 7,36 (0,07) | 7,42* (0,02) | 7,42* (0,04) | 7,42* (0,04) | 7,42* (0,03) | 7,42* (0,21) | 7,43* (0,02) |
| PaO2 | 52,57 (14,1) | 60,52* (11,22) | 63,83* (9,5) | 65,19* (9,5) | 61,85* (7,88) | 61,91* (6,8) | 59,57 (4,8) |
| PaCO2 | 61,07* (15,04) | 42,96* (5,7) | 43,53* (10,64) | 40,58* (5,4) | 42,34* (4,8) | 41,94* (4,6) | 42* (2) |
FEV1: volumen espirado forzado en el primer segundo; FVC: capacidad vital forzada; PaO2: presión de oxígeno en sangre arterial; PaCO2: presión parcial de dióxido de carbono en sangre arterial.
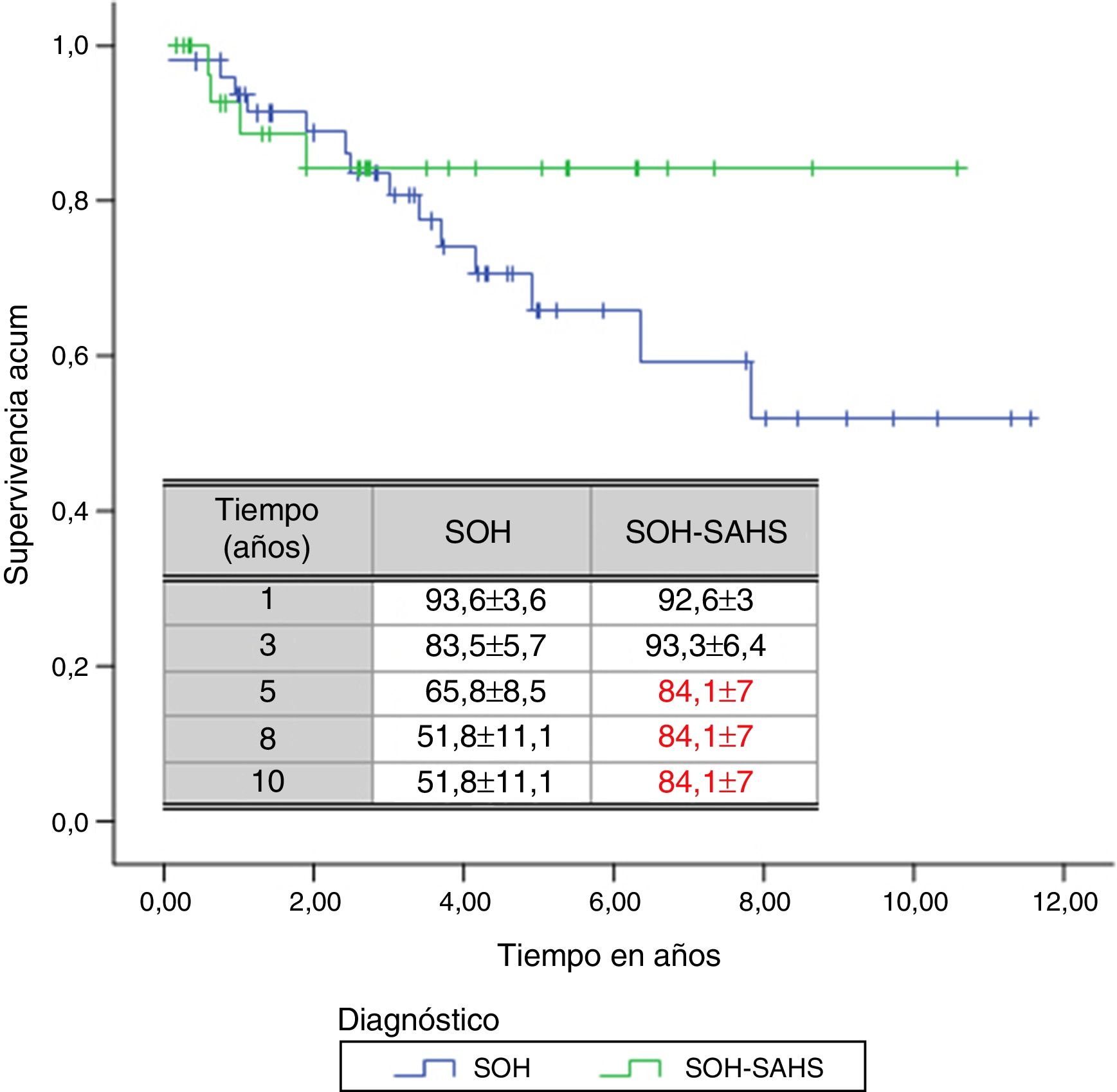
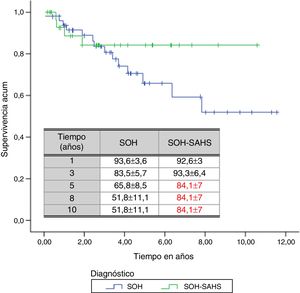
A lo largo del tiempo de seguimiento se han registrado un total de 18 muertes (un 21,7% del total de pacientes). El tiempo medio estimado de supervivencia ha sido de 8,47 años, con un IC 95% entre 7,27 y 9,67 años. La probabilidad de supervivencia encontrada al primer, tercer, quinto, octavo y décimo años ha sido del 93,3±3,1, 83,7±4,5, 71,9±6, 60,11±9,4 y 60,11±9,4%, respectivamente.
Por subgrupos de diagnóstico, en los pacientes del grupo 1 (SOH) se produjeron 14 fallecimientos (28%), mientras que en el grupo 2 la cifra fue de 4 (12,1%). Aunque el tiempo de supervivencia media de los pacientes con SOH-SAHS (9,07 años, IC 95% 7,71-10,45) fue mayor que el de los pacientes con SOH puro (7,92, IC 95% 6,4-9,4), las diferencias no fueron estadísticamente significativas. La supervivencia a partir del tercer año fue mayor en los pacientes con SOH-SAHS, pero el análisis de supervivencia acumulada no mostró diferencias significativas entre grupos, debido a la mayor supervivencia del grupo SOH en el primer año (fig. 2).
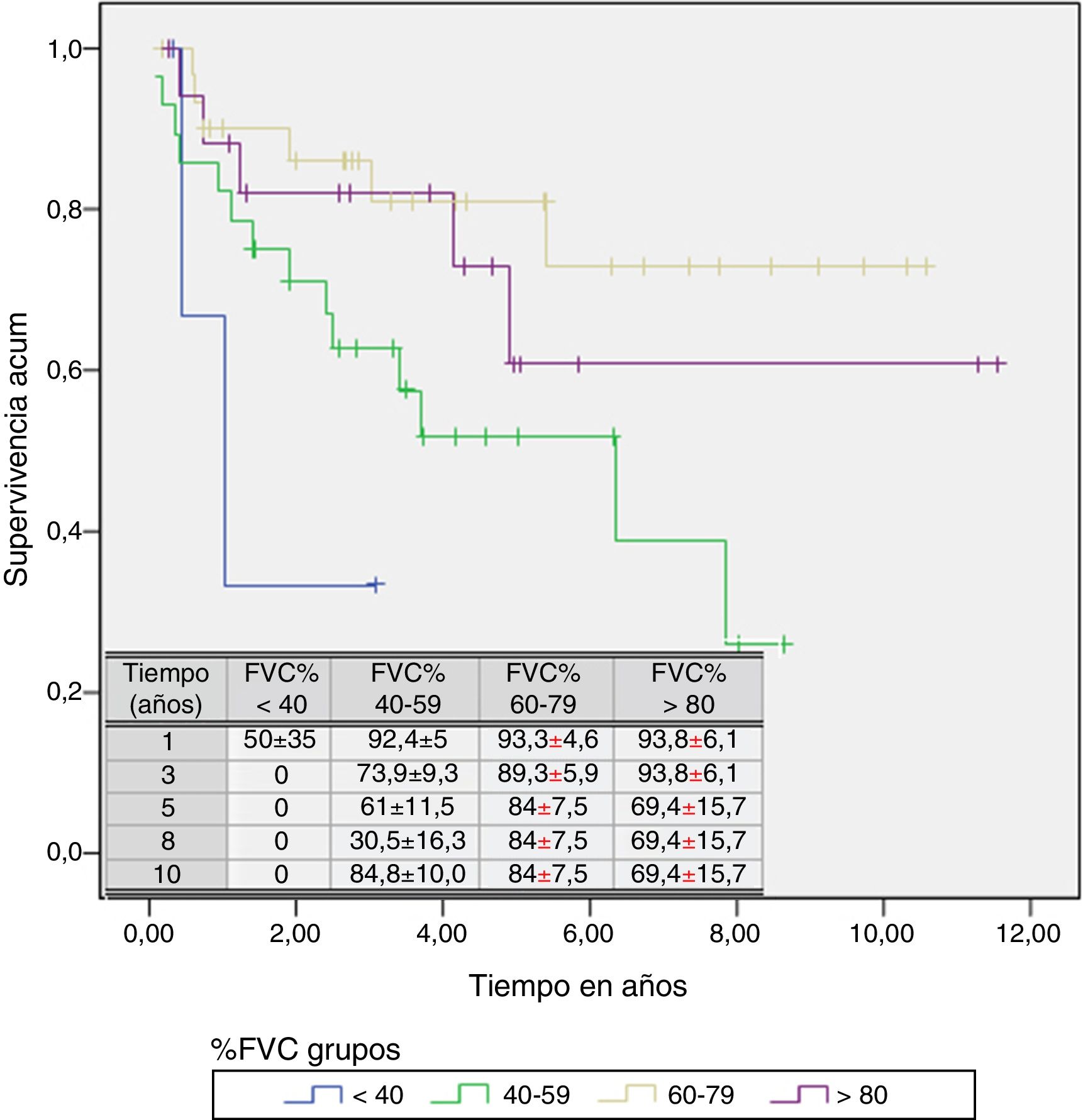
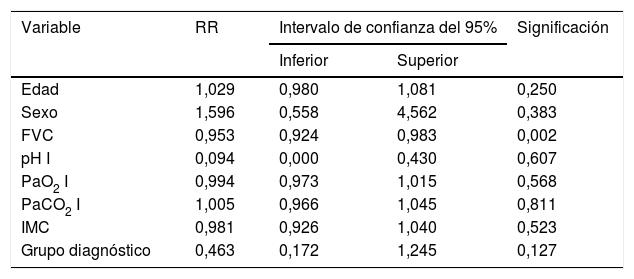
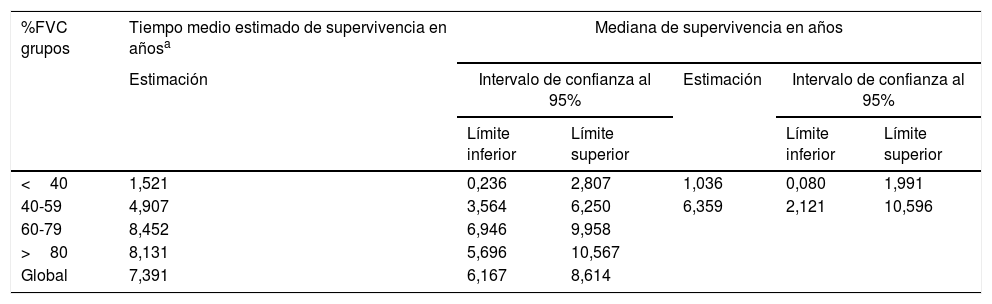
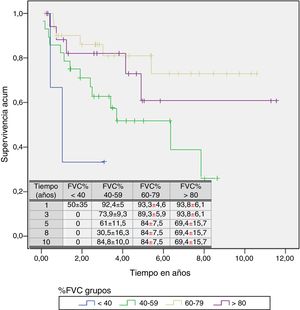
Un análisis de regresión de Cox encaminado a estudiar factores de riesgo puso de manifiesto que solo la FVC constituía un factor predictivo de mortalidad, mientras el resto de los factores incluidos en el análisis (edad, sexo, IMC, PaO2, PaCO2 y grupo de diagnóstico) no mostraron ningún valor (tabla 3). Estratificando por el valor de la FVC expresada en porcentaje del teórico, en 4 subgrupos de pacientes (<40%, 40-59%, 60-79% y >80%) se encontró que la media estimada de supervivencia aumentaba conforme lo hacía la FVC, siendo significativamente mayor en los pacientes con FVC entre 60 y 79% que en los que tenían una FVC inferior a 40% o entre 40 y 60% (tabla 4). El análisis de supervivencia acumulada (fig. 3) también mostró un incremento de la probabilidad de supervivencia, que era superior para los pacientes con mayor FVC, si bien debido al escaso número de pacientes de los distintos subgrupos, la diferencia era solo significativa para aquellos del grupo de FVC entre el 60 y el 79%, comparados con los pacientes con FVC entre el 40 y el 59%.
Factores predictores de riesgo de mortalidad. Resultados del análisis de regresión de Cox
| Variable | RR | Intervalo de confianza del 95% | Significación | |
|---|---|---|---|---|
| Inferior | Superior | |||
| Edad | 1,029 | 0,980 | 1,081 | 0,250 |
| Sexo | 1,596 | 0,558 | 4,562 | 0,383 |
| FVC | 0,953 | 0,924 | 0,983 | 0,002 |
| pH I | 0,094 | 0,000 | 0,430 | 0,607 |
| PaO2 I | 0,994 | 0,973 | 1,015 | 0,568 |
| PaCO2 I | 1,005 | 0,966 | 1,045 | 0,811 |
| IMC | 0,981 | 0,926 | 1,040 | 0,523 |
| Grupo diagnóstico | 0,463 | 0,172 | 1,245 | 0,127 |
FVC: capacidad vital forzada; IMC: índice de masa corporal; PaO2: presión de oxígeno en sangre arterial; PaCO2: presión parcial de dióxido de carbono en sangre arterial; RR: riesgo relativo.
PaO2I, PaCO2I y pH I son los valores al inicio de entrada del paciente en ventilación domiciliaria.
Tiempo medio estimado de supervivencia y mediana de supervivencia estratificados por valor de capacidad vital forzada expresada en porcentaje
| %FVC grupos | Tiempo medio estimado de supervivencia en añosa | Mediana de supervivencia en años | ||||
|---|---|---|---|---|---|---|
| Estimación | Intervalo de confianza al 95% | Estimación | Intervalo de confianza al 95% | |||
| Límite inferior | Límite superior | Límite inferior | Límite superior | |||
| <40 | 1,521 | 0,236 | 2,807 | 1,036 | 0,080 | 1,991 |
| 40-59 | 4,907 | 3,564 | 6,250 | 6,359 | 2,121 | 10,596 |
| 60-79 | 8,452 | 6,946 | 9,958 | |||
| >80 | 8,131 | 5,696 | 10,567 | |||
| Global | 7,391 | 6,167 | 8,614 | |||
FVC: capacidad vital forzada.
En este estudio hemos encontrado que la VMD resulta eficaz en el tratamiento de los pacientes con SOH, asociándose a una mejoría gasométrica y funcional y a una elevada supervivencia. Los resultados son mejores en sujetos con SOH-SAHS, aunque las diferencias entre estos 2 grupos no son significativas y el único factor predictivo de supervivencia es tener una FVC bien conservada al inicio del programa.
Históricamente el uso de medidas de soporte ventilatorio en pacientes con SOH se inició en aquellos casos en que coexistía con SAHS, utilizándose inicialmente tratamiento con CPAP y, cuando este no era suficiente para controlar la hipoventilación, se aplicaba ventilación con presión positiva, ya fuese con ventiladores de presión binivel o de volumen14–16. Desde entonces son numerosos los estudios de cohortes que han analizado los resultados de la VMNI a largo plazo en pacientes con SOH18,24–27. En todos ellos se ha observado una mejoría gasométrica y, actualmente, las guías y recomendaciones para el uso de VMD incluyen el SOH entre las indicaciones contrastadas17. Hasta ahora solo se ha publicado un ensayo clínico en el que se comparan los resultados de la VMNI con la oxigenoterapia convencional, y se trata de un estudio con pocos pacientes aleatorizados, 36, que exhibían hipercapnia muy ligera y con un periodo de seguimiento de solo un mes. Sin embargo, incluso teniendo en cuenta estas limitaciones, se observó una mejoría en la estructura del sueño y en el intercambio gaseoso que no se alcanzaba en el grupo de control28.
Todos los estudios de cohorte de VMNI en pacientes con SOH ponen de manifiesto una mejoría del intercambio gaseoso. Estos han sido también los resultados encontrados en este estudio, en el que se observa una corrección de la hipercapnia desde el comienzo del tratamiento, que persiste incluso a los 10 años de iniciado el mismo, tanto en los pacientes con SOH como en aquellos con SOH-SAHS. Esta mejoría se ha atribuido a múltiples mecanismos, habiéndose descrito la recuperación de la sensibilidad de los centros respiratorios a la hipercapnia, el descanso de los músculos respiratorios y la mejora de la mecánica ventilatoria8,19,20.
Se ha observado que en pacientes con SOH el uso de VMNI se asocia a un incremento de la ventilación minuto y de la presión de oclusión en respuesta a la hipercapnia24,29. Aunque en un estudio previo llevado a cabo con un reducido grupo de pacientes nosotros también encontramos que el uso de VMNI en pacientes con SOH se asociaba a un incremento en la pendiente VE/PaCO2 y P0,1/PaCO224, no disponemos de estas variables en la mayoría de los pacientes que componen la cohorte que analizamos, por lo que no podemos confirmar los hallazgos. Con respecto a los cambios en la PaO2, además de reflejar las variaciones en la ventilación, podrían también relacionarse con una mejoría en el grado de hipertensión pulmonar y sobrecarga ventricular derecha que frecuentemente desarrollan estos pacientes, y que recientes estudios han puesto de manifiesto que puede ser revertida con el uso de VMD30,31. Dos aspectos importantes a tener en cuenta al considerar la mejoría en las cifras gasométricas son la adecuación de la ventilación conseguida durante las horas en que esta se lleva a cabo y la adherencia al tratamiento. Nuestro procedimiento de trabajo incluye el control gasométrico nocturno para valorar la eficacia de la ventilación, de forma que todos los pacientes eran sometidos a controles nocturnos, tanto al inicio de la ventilación como durante las revisiones periódicas, de acuerdo con cuyos resultados se ajustaban los parámetros del ventilador. Con respecto a la adherencia, se sabe que es una condición necesaria para alcanzar la normalización gasométrica, habiéndose comunicado que existe una relación entre el número de horas de ventilación y el grado de descenso de PaCO2, y que solo cumplimientos en torno a 4,5h alcanzan mejorías gasométricas significativas32. Nuestros pacientes tenían un cumplimiento superior a 4h, lo que también explica los buenos resultados obtenidos.
Con respecto a los cambios en mecánica ventilatoria, los resultados encontrados en la literatura son contradictorios, y aunque el estudio publicado por Heinemann et al.26 puso de manifiesto que la VMNI en pacientes con SOH se asociaba a un incremento de la capacidad inspiratoria y la capacidad pulmonar total, esto no ha sido confirmado por otros autores20,25. Si bien no hemos medido volúmenes pulmonares, sí hemos encontrado un incremento de la FVC que se mantiene a lo largo del tiempo. Aunque no podemos excluir otros factores, al igual que en el estudio de Heinemann et al., hemos utilizado elevadas presiones de soporte, lo que ha podido facilitar la resolución de posibles microatelectasias, mejorando así la mecánica ventilatoria. También el descanso muscular que se asocia a la VMNI puede contribuir a la mejora de los volúmenes pulmonares33, pero no hemos medido presiones, lo que nos impide establecer conclusiones.
El aspecto más importante del estudio es el impacto en la mortalidad. Son pocos los estudios que analizan la supervivencia de pacientes con SOH tratados con VMD por encima de los 5 años28,34. Nuestros resultados corroboran los encontrados en estos estudios, con supervivencias superiores al 90% en el primer año y al 70% en el quinto. Nosotros, además, hemos puesto de manifiesto buenos resultados en supervivencia a 8 y 10 años, datos hasta ahora no comunicados por otros investigadores. A diferencia de otros autores27,34, no hemos encontrado que el grado de hipoxemia e hipercapnia o las cifras de pH tengan un valor pronóstico en la supervivencia de los pacientes, pero probablemente la diferencia se deba a que nosotros hemos analizado de forma estricta pacientes que ingresan en un programa de VMD, es decir, cuando se encuentran ya en situación estable.
Ninguno de los estudios previos ha analizado el impacto que la presencia de un SAHS asociado puede tener en la supervivencia de los pacientes. En nuestro estudio, a partir del primer año en ventilación, los enfermos con SAHS presentan una clara tendencia a una mayor supervivencia, pese a que no alcance la significación estadística. Puesto que los pacientes con SOH presentaban inicialmente un mayor grado de hipoventilación que aquellos con SOH-SAHS, cabe pensar que en estos últimos la corrección de la inestabilidad de la vía aérea incide de forma más favorable en el intercambio gaseoso, pero no podemos descartar diferencias en otros aspectos fisiológicos fundamentales.
Un factor importante que hemos analizado y sobre el cual hasta ahora no existía ningún dato es el impacto de la alteración de la mecánica ventilatoria en la evolución de los pacientes. En este estudio el único factor con valor predictivo de supervivencia ha sido la FVC, de manera que los pacientes con FVC más bajas tienen un mayor riesgo de muerte. Cabe suponer que en los pacientes con mayor trastorno en la ventilación en el momento del diagnóstico, la alteración del intercambio gaseoso habría ya condicionado cambios estructurales irreversibles que expliquen esa peor evolución, incluso con una mejoría inicial en el intercambio gaseoso. Por otra parte, al no disponer de datos relativos a la causa de muerte, no podemos excluir que estos pacientes con mayor restricción no presentaran también una mayor comorbilidad asociada.
Llama la atención que mientras en las series hasta ahora publicadas la mayor parte de los enfermos con SOH tienen un SAHS, en la nuestra esta asociación constituye una minoría. Esto puede deberse a que nuestra población presentaba un grado de hipercapnia mayor a la de otros estudios, y los pacientes eran remitidos por insuficiencia respiratoria, no por sospecha de apnea del sueño.
En cuanto a las limitaciones del estudio, hay que destacar que no disponemos de datos que permitan analizar el impacto de la comorbilidad en la evolución y supervivencia de los pacientes, ya que, aunque se ha realizado un seguimiento prospectivo, en el diseño de la base que se analiza no se incluyeron estos datos. Tampoco podemos analizar qué tipo de ventilador sería más eficaz y, por último y más importante, si algunos pacientes podrían haber sido tratados desde el principio con CPAP en lugar de con VMNI.
Aunque algunos autores han mantenido que en pacientes con obesidad extrema podría ser necesario utilizar respiradores ciclados por volumen, prácticamente todas las series publicadas han mostrado resultados satisfactorios con el uso de respiradores binivel con frecuencia de respaldo, encaminada esta última a prevenir la aparición de apneas centrales35, y nuestros resultados confirman la eficacia de esta tecnología. Recientemente se ha planteado que el uso de presión binivel con volumen asegurado podría añadir ventajas adicionales. Sin embargo, los datos disponibles son contradictorios, y aunque existen 2 ensayos clínicos encaminados a evaluar esta tecnología, han incluido a muy pocos enfermos y los resultados no pueden considerarse concluyentes36,37. En cuanto a si al menos los pacientes con SAHS podrían haber sido tratados eficazmente con CPAP, por protocolo todos ellos eran incluidos en VMD, lo que no nos permite analizar este aspecto. Sí hemos observado que, corregida la hipoventilación inicial, algunos pacientes pueden ser transferidos a tratamiento con CPAP, un resultado que ya habíamos publicado en un estudio previo38 y que también se encontraba en la serie publicada por Pérez de Llano et al.21. El problema es que, pese a que los algoritmos de aproximación terapéutica recomiendan iniciar tratamiento con CPAP en pacientes estables, sin acidosis, en la mayoría de los estudios se inicia tratamiento con BiPAP, ya sea en fase aguda o estable, y solo tras conseguirse la mejoría gasométrica, en aquellos pacientes que tienen un SAHS asociado, se decide la transferencia a CPAP. Hasta ahora, solo un ensayo clínico aleatorizado, a corto plazo, con un reducido número de pacientes y que incorporaba como criterio de inclusión que las cifras de PaO2 y PaCO2 estuvieran solo ligeramente alteradas, ha sido publicado, y en el mismo se concluye que ambos tratamientos son igualmente eficaces39. Con los resultados actualmente disponibles existe consenso en recomendar que en aquellos pacientes en los que la alteración gasométrica es ligera y se asocia un SAHS moderado o grave se podría iniciar tratamiento con CPAP, mientras que en los pacientes en los que claramente predomina la hipoventilación nocturna, iniciar tratamiento con BiPAP sería de elección4,8,20,40, siendo necesarios ensayos clínicos adicionales para posicionar una u otra técnica.
En conclusión, nuestros resultados corroboran que el uso de VMD en pacientes con SOH con o sin SAHS es un tratamiento muy eficaz, que corrige las alteraciones del intercambio gaseoso, mejora la mecánica ventilatoria y permite alcanzar supervivencias mejores incluso que las encontradas en otros grupos de población clásicamente subsidiarios de este tratamiento. Queda por responder en qué pacientes esta modalidad terapéutica debería ser de elección y en cuáles el tratamiento podría ser llevado a cabo con la misma seguridad y eficacia aplicando CPAP desde el momento inicial del mismo, bajo la premisa de la estabilidad clínica de los enfermos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.