Estudiar la validez y fiabilidad de la versión española del cuestionario revisado de calidad de vida para fibrosis quística (FQ) en adolescentes y adultos (CFQR 14+ Spain).
Pacientes y métodosSe estudiaron 43 adolescentes y adultos con FQ, clínicamente estables. Se utilizaron como medidas del estado de salud parámetros radiológicos, espirométricos, número de reagudizaciones, prueba de la marcha de 6min, antropométricos (índice de masa corporal, desnutrición de masa magra), grasa en heces y el cuestionario respiratorio de St.George (SGRQ).
ResultadosEl alfa de Cronbach fue ≥0,70 para todas las escalas, excepto para «síntomas digestivos» y «carga de tratamiento». Cuarenta ítems (de 50) presentaron correlaciones ítems-escala mayores a 0,70 y el 98% mayores a 0,40. La reproductibilidad test-retest (coeficiente de Spearman) osciló entre 0,49–0,95 y el coeficiente de correlación intraclase alcanzó puntuaciones mayores de 0,70 en 10 de 12 escalas. Todas las dimensiones correlacionaron significativamente con las puntuaciones del SGRQ. Se observaron correlaciones significativas entre las dimensiones del cuestionario y las variables respiratorias y nutricionales que pretendían medir y permitió diferenciar adecuadamente los distintos grados de gravedad en función de los parámetros respiratorios evaluados. La desnutrición y la malabsorción condicionaron significativamente peores puntuaciones solo en algunos dominios relacionados (como problemas con el peso). El efecto suelo fue menor al 15% en todas las dimensiones y el efecto techo fue elevado en 7 dimensiones.
ConclusionesEl cuestionario CFQR 14+ Spain es válido y fiable para su aplicación en España, aunque podría ser mejorado en algunas de las subescalas.
The aim of this study was to assess the validity and reliability of the Spanish version of the revised disease-specific health related quality of life questionnaire for adolescents and adults with cystic fibrosis (CFQR 14+ Spain).
MethodsA total of 43 cystic fibrosis (CF) patients completed the CFQR 14+ Spain. Forced expiratory volume in 1 second, in percentage of predicted - FEV1 (%)-, number of respiratory exacerbations, 6-minute walk test, Bhalla score (based on computerized tomography of the chest), fat-free mass index, body mass index (BMI), faecal fat and St George's Respiratory Questionnaire were included as measurements of health status.
ResultsTen out of the twelve scales had alpha coefficients above 0.70. Test–retest correlations (Spearman) ranged from 0.49 to 0.95 and they were significant in all scales. Intraclass correlations ranged from 0.47 to 0.95 (ten out of the twelve scales were >0.70) forty out of the fifty ítems have correlations between items and scale above 0.70. All the CFQR+14 scales, except the digestive symptoms scale, discriminated significantly between patients with mild, moderate and severe disease (according to FEV1 (%)). Other respiratory parameters also discriminated significantly between patients with mild-moderate and severe disease. Only some scales discriminated significantly between nourished and malnourished patients. All of the scales met standards for floor effects (<15% of the responders with the lowest score) but not for ceiling effects (only five out of the twelve).
ConclusionThe Spanish CFQR14+ (Spain) is a reliable and valid instrument for measuring the health-related quality of life in Spanish adolescents and adults with CF, though with the exception of a few of its subscales.
La fibrosis quística (FQ) es una enfermedad causada por la mutación de un gen localizado en el brazo largo del cromosoma 7 que codifica una proteína de membrana denominada CFTR (regulador de la conductancia transmembrana de la FQ) que se comporta como un canal de cloro, de forma que las mutaciones de este gen dan lugar a un defecto en el transporte del cloro en las células epiteliales del aparato respiratorio, hepatobiliar, gastrointestinal, reproductor, páncreas y de las glándulas sudoríparas. Por la multiplicidad de órganos y sistemas a los que afecta y por su carácter crónico y progresivo, la FQ es una enfermedad muy compleja que consume muchos recursos y que requiere un abordaje integral. A lo largo de las últimas décadas se ha incrementado notablemente la supervivencia de las personas con FQ, pasando de ser una enfermedad propia «de niños y mortal» a convertirse en una enfermedad «crónica multisistémica» de personas que, en la mayoría de los casos, alcanzan la edad adulta y desean, no solo alargar la vida, sino vivirla con suficiente calidad1.
La medida de la calidad de vida relacionada con la salud (CVRS) en FQ permite valorar la enfermedad desde la perspectiva del paciente aportando información valiosa tanto para la clínica como para la investigación2. Así, aunque algunos parámetros como el volumen espiratorio forzado en el primer segundo (FEV1) o el índice de masa corporal (IMC) tienen valor pronóstico sobre la morbimortalidad, son pobres predictores de la sensación de falta de bienestar. Para cuantificarla es necesario un instrumento de medida válido y de confianza2,3. La CVRS se mide mediante cuestionarios. Los cuestionarios genéricos (por ejemplo, el SF-36) no son lo suficientemente sensibles como para discriminar aspectos específicos de la enfermedad (como los posibles beneficios de nuevos tratamientos, el impacto de las reagudizaciones o como marcadores de la progresión de la enfermedad) siendo sus características psicométricas menos robustas que los datos procedentes de cuestionarios específicos diseñados para personas con FQ2–4. Nuestro grupo validó el cuestionario respiratorio de St. George para su empleo en población adulta con FQ, observando que discriminaba adecuadamente entre los distintos grados de gravedad de la función pulmonar. Sin embargo, no contemplaba otros aspectos específicos de la enfermedad como la afectación digestiva o el estado nutricional3. El CFQ es un cuestionario de CVRS diseñado específicamente para pacientes con FQ, que fue inicialmente desarrollado en Francia (y traducido a diferentes idiomas incluyendo el español)5,6 y que presenta versiones específicas para niños (6–13 años), padres de niños de 6–13 años y adolescentes y adultos (mayores de 14) con FQ (CFQ14+). Fue traducido y validado en su versión inglesa7 y ha sufrido diferentes modificaciones posteriores convirtiéndose en su versión revisada (CFQR) que, también, ha sido traducida y validada en diferentes idiomas4,8–11. Esta versión revisada también ha sido traducida al español para su uso en población hispanohablante de Estados Unidos12 y nuestro grupo la ha adaptado, realizando pequeñas modificaciones, para hacerla más adecuada para población española (CFQR 14+ Spain). La validación transcultural de un cuestionario de CVRS, previamente existente en un idioma, tiene la ventaja de evitar el largo y tedioso desarrollo de uno nuevo9. En las validaciones del CFQR 14+ realizadas en otros países por otros autores, se han empleado parámetros básicos (espirométricos, edad o el IMC)4,8–11. Sin embargo, no se han utilizado otras variables como las clasificaciones de gravedad según la radiología, el número de reagudizaciones, prueba de la marcha de 6min (P6m), la composición corporal o parámetros analíticos como la medición de grasa en heces, las cuales podrían aportar mejoras a la validación.
Por todo ello, el objetivo del estudio fue valorar la validez y fiabilidad del cuestionario CFQR 14+ Spain en un grupo de adolescentes y adultos con FQ en España.
Pacientes y métodosPacientesEl estudio incluyó a pacientes mayores de 14 años que presentaban criterios diagnósticos de FQ13 y que seguían controles periódicos en las consultas de la Unidad de adultos de FQ del Complejo Hospitalario Universitario Carlos Haya (Málaga). Se seleccionaron pacientes (de forma secuencial y prospectiva), durante un periodo de inclusión de 7 meses, que acudían a la consulta de FQ para la revisión rutinaria anual; si en este momento presentaban una reagudización respiratoria (ver más adelante criterios) o clínica digestiva aguda (con consulta en urgencias) o ingreso hospitalario reciente, se posponía al menos 30 días después de finalizar el tratamiento del proceso agudo. Se excluyeron los pacientes que tuvieron problemas para comprender adecuadamente el cuestionario y los pacientes trasplantados o en lista de espera de trasplante. El cuestionario se rellenó antes de la realización de las pruebas complementarias anuales para no condicionar las respuestas. En una submuestra de pacientes (estables clínicamente en los 2 momentos) se administró el cuestionario por duplicado en el transcurso de 10–15 días. El estudio fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Carlos Haya y todos los participantes dieron su consentimiento informado por escrito.
Test CFQR 14+ (Spain)El CFQR 14+ consiste en 50 ítems estructurados en 12 dominios que se dividen, a su vez, en 6 que valoran aspectos generales de la CVRS —capacidad física (8 ítems), limitaciones de rol (4 ítems), vitalidad (4 ítems), percepción de la salud (3 ítems), estado emocional (5 ítems) y aislamiento social (6 ítems)— y 6 dominios que valoran aspectos específicos de la FQ —imagen corporal (3 ítems), problemas con la alimentación (3 ítems), carga del tratamiento (3 ítems), problemas de peso (1 ítem), síntomas respiratorios (7 ítems) y síntomas digestivos (3 ítems). En rellenar el cuestionario se tarda aproximadamente 10–15min. Las puntuaciones varían de 0–100 siendo las puntuaciones mayores las que corresponden a una mejor CVRS. Las puntuaciones de cada dominio se calculan si se completan al menos 2/3 de las preguntas. No existe una puntuación total del cuestionario que integre todos los dominios. El cuestionario que, en su versión inicial, había sido traducido al español y validado transculturalmente6 fue validado por Quittner et al12 en Estados Unidos, para su utilización en población hispanohablante de ese país (CFQR). Nuestro grupo ha adaptado la redacción de algunos ítems del CFQR para la población española realizando pequeñas modificaciones sin cambiar el concepto de las preguntas. La versión final fue valorada por otros miembros de la Unidad de FQ en relación a su comprensión así como por 8 pacientes voluntarios que determinaron la idoneidad de la redacción.
Variables neumológicasSe realizó una espirometría simple. La capacidad vital forzada (FVC) y el FEV1 se expresaron en términos absolutos (en ml) y como porcentaje del valor teórico esperado para personas del mismo sexo, edad, peso y altura de una población de referencia14. El daño estructural fue evaluado con el sistema de puntuación Bhalla, basado en la tomografía computerizada de alta resolución (TCAR) de tórax, (a menor puntuación final, peor estado radiológico) realizada en el contexto de la revisión anual15. También se realizó una P6m para valorar la presencia de desaturación durante el esfuerzo16. Siguiendo las indicaciones del consenso europeo de FQ17, en cada visita a la Unidad (cada 2 o 3 meses) se realiza una espirometría y se recoge una muestra de esputo para estudio microbiológico, que incluye siembra en medio general y selectivo para patógenos habituales en FQ y recuentos bacterianos. Hemos analizado la colonización inicial por microorganismos habituales en la FQ, considerando la primera aparición en el esputo (al menos 3 muestras de esputos positivas) independientemente de su persistencia en el momento del estudio. Las exacerbaciones respiratorias son registradas de manera sistemática y prospectiva en la Unidad según los siguientes criterios18: 1) Leve-moderada: aumento del volumen o de la purulencia del esputo y/o incremento de la disnea no debidos a otras causas, pudiendo acompañarse o no de otros síntomas (tos, febrícula, astenia, mal estado general, anorexia con pérdida de peso, dolor torácico pleurítico, cambios en la exploración respiratoria, cambios en la radiografía de tórax sugestivos de infección o un aumento en los marcadores de inflamación sistémica -proteina C reactiva o velocidad de sedimentación globular-) y tratado con antibiótico oral. 2) Grave: si, además, se asocia a un empeoramiento clínico significativo (fiebre >38°C, taquipnea, disminución significativa la saturación de oxígeno o de la función respiratoria, hipercapnia o la aparición de complicaciones, como neumonía, insuficiencia respiratoria aguda, hemoptisis, inestabilidad hemodinámica y/o empeoramiento del estado cognitivo) y tratado con antibiótico intravenoso18. Se contabilizaron las reagudizaciones padecidas por los pacientes en el año previo a la evaluación.
Evaluación nutricionalSe midieron los siguientes parámetros antropométricos: peso y talla (y a partir de ellos se calculó el IMC); pliegues cutáneos (tricipital, abdominal, bicipital y subescapular) usando un lipocalibrador de presión constante tipo Holtain. Las medidas antropométricas fueron realizadas por el mismo investigador, por triplicado, en la extremidad dominante y consignando la media. Se estimaron los porcentajes de masa magra y masa grasa según las fórmulas de Durnin19 y Siri20. Se calculó el índice de desnutrición de masa magra (IMM)21 expresado en kg de masa magra/talla2 (a menor valor, mayor desnutrición). En el contexto de la revisión clínica rutinaria anual se recogieron heces de 72h para determinación de grasa y nitrógeno por técnica espectrofotométrica (FENIR)®22. Se definió la insuficiencia pancreática exocrina (IPE) como historia de uso de enzimas pancreáticas con niveles de elastasa menores de 50mcg/g. Asimismo se realizó un registro dietético prospectivo de 4 días (incluyendo al menos un sábado o un domingo) de acuerdo con un protocolo previamente descrito23 detallando también el aporte calórico procedente de suplementos dietoterapéuticos y/o nutrición enteral por sonda. Con ambos datos, se estimó el porcentaje de absorción de grasa procedente de la dieta23.
Análisis estadísticoEl análisis de los datos se realizó con SPPS para Windows, versión 15 (SPSS Inc, Chicago, IL). Los resultados han sido expresados como valores de media y desviación estándar y en porcentajes. La normalidad de la distribución de las variables cuantitativas fue examinada mediante la prueba de Shapiro-Wilks. Se consideró que existían diferencias estadísticamente significativas para una p<0,05 para 2 colas.
ConsistenciaSe analizó la correlación existente (coeficiente de Spearman) entre cada ítem y la escala a la que pertenezca (se consideran aceptables correlaciones ≥0,40). Se calculó el coeficiente alfa de Cronbach de cada una de las escalas (aceptable ≥0,70)24.
Validez concurrenteLa validez concurrente se analizó mediante los coeficientes de correlación de Spearman de cada escala del cuestionario con aquellas variables clínicas que es esperable que mida (espirometría, reagudizaciones, Bhalla, variables antropométricas, absorción de grasa en heces) y con la comparación con el cuestionario de St. George validado por nuestro grupo en FQ3 (validez convergente).
Validez predictivaSe realizó mediante el análisis de su capacidad para discriminar entre distintos grados de gravedad de la enfermedad según el FEV1 (>80%, 40–80% o <40%), el número de reagudizaciones en el año previo (<3 vs ≥3), la presencia o ausencia de desaturación con el esfuerzo16, puntuación Bahlla15 (<16 vs ≥16); la desnutrición1 (IMC<20kg/m2 vs ≥20), según el IMM (<15kg/m2 vs ≥15), la edad (<25 vs ≥25), el porcentaje de absorción grasa1 (<90% vs ≥90), la historia de síndrome de obstrucción del intestino distal, resecciones intestinales o alteraciones del metabolismo hidrocarbonado1. Para la comparación de las puntuaciones de los dominios en función de variables dicotómicas (ej. desnutridos vs normal) se ha utilizado el test no paramétrico de Mann-Whitney o la T de student en función de la normalidad de la muestra. Cuando se han comparado las puntuaciones de los dominios en función de 3 o más grupos (según FEV1 [%]), se ha empleado el test de ANOVA o el test de Kruskal-Wallis en caso de ausencia de normalidad de las variables comparadas.
ReproductibilidadEn la submuestra en la que se repitió el cuestionario (16 pacientes) se realizaron correlaciones de Spearman entre las dimensiones del cuestionario en los dos momentos así como el coeficiente de variación intraclase (adecuados, >0,70)24.
ResultadosCuarenta y tres pacientes completaron el CFQR 14+ Spain. Se excluyeron 6 pacientes: 3 transplantados de pulmón, 1 paciente que tuvo problemas para comprender adecuadamente el cuestionario y 2 sujetos que rechazaron rellenarlo. La media de edad de los sujetos fue de 25,1 años (rango de 15,4–64,8) con un 46,5% de varones y un 53,5% de mujeres. El 69,8% de los participantes tenían IPE y el 44,2%, alguna alteración del metabolismo hidrocarbonado (AMH). Presentaron una puntuación Bhalla media de 14,9 y un FEV1 que alcanzó un rango entre el 20–102% y una media del 57,9%±25,3. No hubo diferencias significativas entre varones y mujeres en Bhalla, FEV1 (%), FVC (%), número de reagudizaciones, edad, génetica (en función de F508del), IMC, en el porcentaje de IPE, AMH o uso de suplementos o nutrición enteral. En la tabla 1 se resumen las características clínicas, espirométricas, microbiológicas, radiológicas y antropométricas más relevantes de nuestra muestra y en la tabla 2 se disponen las puntuaciones medias de las 12 escalas que componen el cuestionario en nuestra muestra y separados por sexo. En el grupo de las mujeres las puntuaciones fueron menores en todas las escalas salvo en «problemas de peso», aunque solo alcanzó significación la dimensión «capacidad física». En la tabla 3 se recoge la descripción general del cuestionario, la consistencia interna y reproductibilidad. El efecto suelo (proporción de individuos con la puntuación mínima=0) fue <15% en todas las dimensiones. El efecto techo (porcentaje de sujetos que tienen la puntuación máxima=100) fue elevado en las dimensiones vitalidad, imagen corporal, limitaciones de rol, estado emocional, problemas con la alimentación, síntomas digestivos y problemas de peso.
Características clínicas de los pacientes con FQ
| Parámetros generales | (n=43) |
| Edad años (M±DE) | 25,1±8,4 |
| Edad al diagnóstico años (M±DE) | 6,5±9,9 |
| Pacientes diagnosticados en edad adulta (>14 años) n (%) | 7 (16,3) |
| Varones n (%) | 20 (46,5) |
| Genética según F508del | |
| Homocigotos F508del n (%) | 11 (25,6) |
| Heterocigotos F508del n (%) | 17 (39,5) |
| Resto n (%) | 12 (27,9) |
| Síndrome de obstrucción del intestino distal n (%) | 8 (18,6) |
| Resecciones intestinales previas n (%) | 6 (14%) |
| Insuficiencia pancreática n (%) | 30 (69,8) |
| Alteración hidrocarbonada n (%) | 18 (41,9) |
| Diabetes relacionada con FQ sin hiperglucemia en ayunas n (%) | 4 (9,3) |
| Intolerancia hidrocarbonada n (%) | 8 (18,6) |
| Hiperglucemia de estrés n (%) | 1 (2,3) |
| Diabetes relacionada con FQ con hiperglucemia en ayunas n (%) | 5 (11,6) |
| Parámetros respiratorios | |
| Sinusitis n (%) | 34 (79,1) |
| Broncorrea diaria en fase estable (cc) (M±DE) | 29,8±17,2 |
| Puntuación «Bhalla» (M±DE) | 14,9±3,9 |
| FEV1% del predicho (M±DE) | 57,9±25,1 |
| FVC % del predicho (M±DE) | 68,3± 22,5 |
| Desaturación con el esfuerzo n (%) | 9 (20,9) |
| Colonizaciones bacterianas | |
| Staphylococcus aureus n (%) | 37 (86,0) |
| Haemophilus influenzae n (%) | 23 (53,5) |
| Pseudomonas aeruginosa n (%) | 38 (88,4) |
| Burkholderia cepacia n (%) | 2 (4,7) |
| Reagudizaciones en el último año | 1,79±1,4 |
| Reagudizaciones leves (M±DE) | 1,5±1,1 |
| Reagudizaciones graves (M±DE) | 0,4±0,7 |
| Días ingreso en el último año por reagudización respiratoria (M±DE) | 3,3±8,0 |
| Total días de toma de antibióticos (M±DE) | 29,3±21,7 |
| Parámetros antropométricos y nutricionales | |
| IMC (kg/m2) (M±DE) | 21,3±3,6 |
| % IMC ideal (M±DE) | 99,3±16,9 |
| IMC<20kg/m2 n (%) | 17 (39,5%) |
| Masa magra en kg¿(M±DE) | 44,6±8,7 |
| % masa magra (M±DE) | 78,3±8,8 |
| Masa grasa en kg (M±DE) | 12,7±6,4 |
| % masa grasa (M±DE) | 21,7±8,8 |
| Índice de desnutrición de masa magra (kg masa magra/talla2) (M±DE) | 16,5±2,3 |
| Grasa en heces (g) (M±DE) | 9,6±5,2 |
| Porcentaje de absorción de grasa (%) (M±DE) | 91,1±5,3 |
| Pacientes con porcentaje de absorción grasa menor a 90% n (%) | 8 (18,6%) |
| Nutrición enteral por sonda de gastrostomía n (%) | 2 (4,7) |
| Suplementos dietoterapéuticos n (%) | 10 (23,3) |
FEV1: volumen espiratorio forzado en el primer segundo (%); FVC: capacidad vital forzada; FQ: fibrosis quística; IMC: índice de masa corporal; M±DE: media±desviación estandar; n: número de pacientes.
Sistema de puntuación Bhalla¿: basado en la tomografía computerizada de alta resolución de tórax (a menor puntuación final, peor estado radiológico).
Puntuaciones medias de las dimensiones del cuestionario CFQR 14+ Spain (grupo total y por sexos)
| Dimensión | Total (n=43) | Varones (n=20) | Mujeres (n=23) |
| Capacidad física | 65,3±30,1 | 76,0±29,1¿ | 56,0±28,3 |
| Limitaciones de rol | 83,1±22,8 | 85,4±23,1 | 81,2±22,9 |
| Vitalidad | 70,3±25,1 | 77,5±24,6 | 64,1±24,3 |
| Estado emocional | 76,9±23,5 | 81,0±25,0 | 73,3±22,0 |
| Aislamiento social | 67,8±20,1 | 69,2±20,4 | 66,7±20,2 |
| Imagen corporal | 70,0±23,8 | 70,5±28 | 69,7±20,1 |
| Problemas con la alimentación | 81,6±21,9 | 85,5±23,1 | 78,3±20,8 |
| Carga del Tratamiento | 60,5±20,8 | 62,8±19,2 | 58,4±22,3 |
| Percepción de la salud | 66,7±24,7 | 71,1±23,7 | 62,8±25,4 |
| Problemas de peso | 72,9±36,5 | 65,0±35,0 | 79,7±37,2 |
| Síntomas respiratorios | 62,4±20,2 | 67,5±20,9 | 58,0±18,9 |
| Síntomas digestivos | 80,9±15,2 | 81,1±15,3 | 80,7±15,4 |
Todos los valores se expresan como media±desviación estándar.
Descripción general, consistencia interna y reproductibilidad del CFQR 14+ Spain
| N.° items | α de Cronbach | Test re-test (Spearman) | CCI | Efecto suelo | Efecto techo | ||
| Dimensión | r | p | |||||
| Capacidad física | 8 | 0,96 | 0,95 | 0,000 | 0,95 | 2,3 | 11,6 |
| Limitaciones de rol | 4 | 0,81 | 0,87 | 0,000 | 0,78 | 0 | 39,5 |
| Vitalidad | 4 | 0,89 | 0,90 | 0,000 | 0,88 | 0 | 18,6 |
| Estado emocional | 5 | 0,87 | 0,77 | 0,000 | 0,72 | 0 | 25,6 |
| Aislamiento social | 6 | 0,75 | 0,8O | 0,000 | 0,77 | 0 | 0 |
| Imagen corporal | 3 | 0,70 | 0,53 | 0,034 | 0,54 | 2,3 | 18,6 |
| Problemas con la alimentación | 3 | 0,87 | 0,78 | 0,000 | 0,75 | 0 | 46,5 |
| Carga del tratamiento | 3 | 0,57 | 0,79 | 0,000 | 0,77 | 2,3 | 4,7 |
| Percepción de la salud | 3 | 0,79 | 0,86 | 0,000 | 0,86 | 2,3 | 9,3 |
| Problemas de peso | 1 | – | 0,74 | 0,001 | 0,73 | 14 | 55,8 |
| Síntomas respiratorios | 7 | 0,78 | 0,79 | 0,000 | 0,78 | 0 | 0 |
| Síntomas digestivos | 3 | 0,31 | 0,49 | 0,057 | 0,47 | 0 | 20,9 |
CCI: Coeficiente de correlación intraclase.
El 98% de los ítems presentaba una correlación ítem-escala >0,40, tabla 4. El coeficiente α de Cronbach fue ≥0,70 en todas las dimensiones del cuestionario, salvo en 2 (carga de tratamiento y síntomas digestivos), con un rango de 0,31–0,96, tabla 3.
Correlaciones ítem-escala del cuestionario CFQR 14+ Spain (n=43)
| Ítems | Física | Rol | Vitalidad | Emoción | Social | Corporal | Alimentación | Tratamiento | Salud | Peso | Respiratorios | Digestivos |
| Física1 | 0,878¿ | 0,664¿ | 0,716¿ | 0,559¿ | 0,437¿ | 0,453¿ | 0,487¿ | 0,290 | 0,584¿ | 0,307¿¿ | 0,654¿ | 0,139 |
| Física2 | 0,902¿ | 0,753¿ | 0,722¿ | 0,739¿ | 0,619¿ | 0,641¿ | 0,550¿ | 0,319¿¿ | 0,591¿ | 0,405¿¿ | 0,609¿ | 0,174 |
| Física3 | 0,838¿ | 0,829¿ | 0,734¿ | 0,638¿ | 0,651¿ | 0,505¿ | 0,435¿ | 0,315¿¿ | 0,728¿ | 0,282 | 0,723¿ | 0,273 |
| Física4 | 0,946¿ | 0,719¿ | 0,799¿ | 0,710¿ | 0,611¿ | 0,584¿ | 0,559¿ | 0,466¿ | 0,699¿ | 0,275 | 0,728¿ | 0,210 |
| Física5 | 0,943¿ | 0,711¿ | 0,793¿ | 0,720¿ | 0,495¿ | 0,591¿ | 0,535¿ | 0,416¿ | 0,659¿ | 0,290 | 0,718¿ | 0,237 |
| Física13 | 0,859¿ | 0,697¿ | 0,635¿ | 0,556¿ | 0,510¿ | 0,486¿ | 0,481¿ | 0,149 | 0,632¿ | 0,293 | 0,746¿ | 0,245 |
| Física19 | 0,838¿ | 0,589¿ | 0,671¿ | 0,669¿ | 0,615¿ | 0,567¿ | 0,482¿ | 0,390¿ | 0,649¿ | 0,241 | 0,662¿ | 0,123 |
| Física20 | 0,905¿ | 0,650¿ | 0,710¿ | 0,666¿ | 0,545¿ | 0,501¿ | 0,525¿ | 0,390¿ | 0,644¿ | 0,229 | 0,660¿ | 0,249 |
| Rol35 | 0,607¿ | 0,798¿ | 0,578¿ | 0,455¿ | 0,242 | 0,422¿ | 0,340¿¿ | 0,172 | 0,372¿¿ | 0,376¿ | 0,563¿ | 0,185 |
| Rol36 | 0,580¿¿ | 0,891¿ | 0,612¿ | 0,569¿ | 0,435¿ | 0,457¿ | 0,428¿ | 0,148 | 0,606¿ | 0,219 | 0,644¿ | 0,155 |
| Rol37 | 0,641¿¿ | 0,803¿ | 0,695¿ | 0,692¿ | 0,696¿ | 0,619¿ | 0,510¿ | 0,225 | 0,775¿ | 0,330¿¿ | 0,621¿ | 0,456¿ |
| Rol38 | 0,780¿ | 0,741¿ | 0,720¿ | 0,697¿ | 0,705¿ | 0,517¿ | 0,515¿ | 0,319¿¿ | 0,794¿ | 0,272 | 0,704¿ | 0,284 |
| Vitalidad6 | 0,766¿ | 0,768¿ | 0,928¿ | 0,761¿ | 0,579¿ | 0,568¿ | 0,552¿ | 0,433¿ | 0,726¿ | 0,365¿¿ | 0,722¿ | 0,377¿¿ |
| Vitalidad9 | 0,859¿ | 0,789¿ | 0,867¿ | 0,648++ | 0,519¿ | 0,560¿ | 0,524¿ | 0,327¿¿ | 0,699¿ | 0,268 | 0,725¿ | 0,276 |
| Vitalidad10 | 0,586¿ | 0,614¿ | 0,864¿ | 0,633¿ | 0,501¿ | 0,458¿ | 0,501¿ | 0,318¿¿ | 0,645¿ | 0,297 | 0,511¿ | 0,166 |
| Vitalidad11 | 0,695¿ | 0,625¿ | 0,851¿ | 0,625¿ | 0,525¿ | 0,437¿ | 0,482¿ | 0,539¿ | 0,618¿ | 0,293 | 0,626¿ | 0,298 |
| Emoción7 | 0,608¿ | 0,625¿ | 0,712¿ | 0,820¿ | 0,533¿ | 0,479¿ | 0,497¿ | 0,203 | 0,833¿ | 0,103 | 0,569¿ | 0,233 |
| Emoción8 | 0,668¿ | 0,645¿ | 0,711¿ | 0,806¿ | 0,666¿ | 0,640¿ | 0,619¿ | 0,332¿¿ | 0,624¿ | 0,405¿ | 0,630¿ | 0,074 |
| Emoción12 | 0,523¿ | 0,556¿ | 0,564¿ | 0,817¿ | 0,560¿ | 0,402¿ | 0,458¿ | 0,210 | 0,693¿ | 0,097 | 0,530¿ | 0,051 |
| Emoción31 | 0,567¿ | 0,546¿ | 0,527¿ | 0,821¿ | 0,517¿ | 0,751¿ | 0,601¿ | 0,417¿ | 0,604¿ | 0,506¿ | 0,446¿ | 0,197 |
| Emoción33 | 0,717¿ | 0,657¿ | 0,681¿ | 0,882¿ | 0,727¿ | 0,688¿ | 0,603¿ | 0,471¿ | 0,710¿ | 0,364¿¿ | 0,573¿ | −0,013 |
| Social22 | 0,782¿ | 0,770¿ | 0,724¿ | 0,785¿ | 0,736¿ | 0,618¿ | 0,678¿ | 0,285 | 0,797¿ | 0,308¿¿ | 0,626¿ | 0,139 |
| Social23 | 0,193 | 0,256 | 0,184 | 0,266 | 0,617¿ | 0,233 | 0,254 | 0,241 | 0,309¿¿ | 0,234 | 0,197 | 0,114 |
| Social27 | 0,339¿¿ | 0,180 | 0,363¿¿ | 0,358¿¿ | 0,613¿ | 0,337¿¿ | 0,383¿¿ | 0,277 | 0,350¿¿ | 0,152 | 0,204 | 0,071 |
| Social28 | 0,165 | 0,276 | 0,247 | 0,317¿¿ | 0,531¿¿ | 0,146 | 0,253 | 0,150 | 0,346¿¿ | 0,118 | 0,200 | 0,085 |
| Social29 | 0,438¿ | 0,342¿¿ | 0,392¿ | 0,546¿ | 0,638 | 0,447¿ | 0,338¿¿ | 0,359¿¿ | 0,435¿ | 0,215 | 0,321¿¿ | −0,012 |
| Social30 | 0,563¿ | 0,545¿ | 0,495¿ | 0,586¿ | 0,853¿ | 0,414¿ | 0,415¿ | 0,364¿¿ | 0,694¿ | 0,128 | 0,471¿ | 0,235 |
| Corporal24 | 0,377¿¿ | 0,318¿¿ | 0,254 | 0,304¿¿ | 0,171 | 0,728¿ | 0,505¿ | 0,157 | 0,212 | 0,605¿ | 0,299 | −0,030 |
| Corporal25 | 0,579¿ | 0,593¿ | 0,610¿ | 0,755¿ | 0,535¿ | 0,839¿ | 0,659¿ | 0,432¿ | 0,720¿ | 0,365¿¿ | 0,572¿ | 0,194 |
| Corporal26 | 0,478¿ | 0,552¿ | 0,498¿ | 0,669¿ | 0,650¿ | 0,783¿ | 0,737¿ | 0,297 | 0,673¿ | 0,435¿ | 0,419¿ | 0,166 |
| Alimentación14 | 0,445¿ | 0,423¿ | 0,512¿ | 0,537¿ | 0,525¿ | 0,690¿ | 0,910¿ | 0,151 | 0,474¿ | 0,494¿ | 0,392¿ | 0,090 |
| Alimentación21 | 0,542¿ | 0,539¿ | 0,512¿ | 0,686¿ | 0,635¿ | 0,769¿ | 0,934¿ | 0,169 | 0,647¿ | 0,448¿ | 0,497¿ | 0,041 |
| Alimentación50 | 0,547¿ | 0,477¿ | 0,571¿ | 0,558¿ | 0,386¿¿ | 0,686¿ | 0,867¿ | 0,266 | 0,565¿ | 0,510¿ | 0,510¿ | 0,191 |
| Tratamiento15 | 0,329¿¿ | 0,156 | 0,338¿¿ | 0,362¿¿ | 0,354¿¿ | 0,295 | 0,129 | 0,844¿ | 0,275 | 0,103 | 0,183 | 0,153 |
| Tratamiento16 | 0,204 | 0,169 | 0,253 | 0,102 | 0,096 | 0,129 | 0,105 | 0,496¿ | 0,133 | 0,169 | 0,376¿¿ | 0,252 |
| Tratamiento17 | 0,319¿¿ | 0,231 | 0,400¿ | 0,400¿ | 0,434¿ | 0,378¿¿ | 0,230 | 0,826¿ | 0,398¿ | 0,061 | 0,344¿¿ | 0,140 |
| Salud18 | 0,663¿ | 0,630¿ | 0,787¿ | 0,713¿ | 0,516¿ | 0,568¿ | 0,575¿ | 0,359¿¿ | 0,804¿ | 0,257 | 0,689¿ | 0,265 |
| Salud32 | 0,523¿ | 0,548¿ | 0,553¿ | 0,623¿ | 0,622¿ | 0,485¿ | 0,455¿ | 0,356¿¿ | 0,846¿ | 0,160 | 0,540¿ | 0,271 |
| Salud34 | 0,663¿ | 0,739¿ | 0,616¿ | 0,779¿ | 0,728¿ | 0,636¿ | 0,586¿ | 0,237 | 0,870¿ | 0,160 | 0,653¿ | 0,091 |
| Peso39 | 0,327¿¿ | 0,374¿¿ | 0,350¿¿ | 0,362¿¿ | 0,290 | 0,603¿ | 0,530¿ | 0,145 | 0,224 | 1,000¿ | 0,269 | 0,155 |
| Respiratorio40 | 0,612¿ | 0,473¿ | 0,532¿ | 0,525¿ | 0,443¿ | 0,396¿ | 0,466¿ | 0,391¿ | 0,518¿ | 0,144 | 0,655¿ | 0,126 |
| Respiratorio41 | 0,369¿ | 0,471¿ | 0,433¿ | 0,303¿¿ | 0,150 | 0,222 | 0,232 | 0,119 | 0,511¿ | 0,010 | 0,709¿ | 0,127 |
| Respiratorio42 | 0,423¿ | 0,397¿ | 0,331¿¿ | 0,326¿¿ | 0,314¿¿ | 0,272 | 0,278 | 0,403¿ | 0,353¿¿ | 0,175 | 0,721¿ | 0,151 |
| Respiratorio43 | 0,114 | 0,241 | 0,199 | 0,186 | -0,069 | 0,113 | 0,096 | 0,103 | 0,170 | 0,204 | 0,299 | 0,048 |
| Respiratorio44 | 0,474¿ | 0,571¿ | 0,398¿ | 0,334¿¿ | 0,302¿¿ | 0,392¿ | 0,323¿¿ | 0,063 | 0,329¿¿ | 0,315¿¿ | 0,558¿ | 0,379¿¿ |
| Respiratorio45 | 0,797¿ | 0,734¿ | 0,716¿ | 0,603¿ | 0,613¿ | 0,570¿ | 0,596¿ | 0,283 | 0,755¿ | 0,326¿¿ | 0,812¿ | 0,294 |
| Respiratorio46 | 0,541¿ | 0,604¿ | 0,608¿ | 0,595¿ | 0,323¿¿ | 0,457¿ | 0,297 | 0,353¿¿ | 0,591¿ | 0,199 | 0,734¿ | 0,231 |
| Digestivo47 | 0,101 | 0,132 | 0,134 | −0,063 | 0,000 | 0,042 | 0,055 | 0,161 | 0,080 | 0,048 | 0,161 | 0,833¿ |
| Digestivo48 | 0,247 | 0,312¿¿ | 0,268 | 0,218 | −0,004 | 0,046 | −0,142 | 0,267 | 0,115 | 0,066 | 0,183 | 0,510¿ |
| Digestivo49 | 0,165 | 0,282 | 0,278 | 0,207 | 0,353¿¿ | 0,193 | 0,268 | 0,084 | 0,339¿¿ | 0,216 | 0,274 | 0,563¿ |
En la tabla 5 se detallan las correlaciones encontradas entre las puntuaciones de los dominios del CFQR 14+ Spain y diferentes variables clínicas, espirométricas, radiológicas, antropométricas y de laboratorio. Encontramos correlaciones negativas significativas entre las puntuaciones del cuestionario para las escalas capacidad física, estado emocional, aislamiento social y percepción de la salud con la edad (menor edad mejor CVRS). Existieron correlaciones positivas, significativas, entre las puntuaciones capacidad física, limitaciones de rol, síntomas respiratorios, imagen corporal y problemas de peso, con el FEV1 (%) y FVC (%) y la puntuación Bhalla y negativas entre las puntuaciones de capacidad física, limitaciones de rol y síntomas respiratorios y el número de agudizaciones. El FEV1 (%) y FVC (%) también presentaron correlaciones positivas con las dimensiones problemas con la alimentación, vitalidad, estado emocional y percepción de la salud. Respecto a los parámetros nutricionales, el IMC y la masa grasa (kg) correlacionaron significativa y positivamente con la dimensión problemas de peso y el IMM con las escalas capacidad física, vitalidad, imagen corporal y problemas con la alimentación. La cantidad de grasa en heces y el porcentaje de absorción grasa solo correlacionaron significativamente (r=−0,38 p=0,012 y r=0,353 p=0,038, respectivamente) con la dimensión problemas de peso. En la tabla 6 se recogen las correlaciones entre las puntuaciones de los dominios del CFQR14+Spain y el cuestionario respiratorio de St George.
Correlaciones entre las escalas del CFQR 14+ Spain y diversas variables clínicas, espirométricas, radiológicas y antropométricas.
| Dimensión | FEV1% predicho | FVC% predicho | Punt. Bhalla¿ | Número agudizaciones | IMC | Masa grasa (kg) | Índice desnutrición masa magra | |
| Capacidad física | −0,31¿ | 0,51¿¿ | 0,55¿¿ | 0,43¿¿ | −0,42¿¿ | 0,16 | −0,20 | 0,49¿¿ |
| Limitaciones de rol | −0,18 | 0,50¿¿ | 0,49¿¿ | 0,40¿¿ | −0,30¿ | 0,17 | −0,05 | 0,31 |
| Vitalidad | −0,29 | 0,48¿¿ | 0,50¿¿ | 0,28 | −0,29 | 0,19 | −0,08 | 0,41¿ |
| Estado emocional | −0,42¿¿ | 0,34¿ | 0,37¿ | 0,21 | −0,19 | −0,03 | −0,16 | 0,19 |
| Aislamiento social | −0,41¿¿ | 0,24 | 0,08 | 0,003 | 0,04 | −0,07 | −0,17 | 0,10 |
| Imagen corporal | −0,07 | 0,44¿¿ | 0,48¿¿ | 0,34¿ | −0,27 | 0,24 | 0,08 | 0,32¿ |
| Problemas con la alimentación | −0,23 | 0,44¿¿ | 0,41¿¿ | 0,29 | −0,25 | 0,20 | −0,05 | 0,37¿ |
| Carga de tratamiento | −0,09 | 0,10 | 0,13 | 0,10 | −0,11 | 0,02 | 0,08 | 0,12 |
| Percepción de la salud | −0,32¿ | 0,43¿¿ | 0,39¿¿ | 0,26 | −0,25 | −0,02 | −0,19 | 0,17 |
| Problemas con el peso | −0,12 | 0,37¿ | 0,36¿ | 0,36¿ | −0,06 | 0,37¿ | 0,46¿¿ | 0,13 |
| Síntomas respiratorios | −0,24 | 0,37¿ | 0,46¿¿ | 0,43¿¿ | −0,44¿¿ | 0,09 | −0,11 | 0,29 |
| Síntomas digestivos | −0,20 | 0,28 | 0,28 | 0,41¿¿ | −0,20 | 0,12 | 0,10 | 0,11 |
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal.
Sistema de puntuación Bhalla¿: basado en la tomografía computerizada de alta resolución de tórax (a menor puntuación final, peor estado radiológico).
Correlaciones entre las escalas del CFQR 14+ Spain y puntuaciones del Cuestionario Respiratorio de St. George
| Síntomas | Actividad | Impacto | Total | |
| Capacidad física | −0,67¿ | −0,86¿ | −0,73¿ | −0,84¿ |
| Limitaciones de rol | −0,71¿ | −0,63¿ | −0,68¿ | −0,76¿ |
| Vitalidad | −0,68¿ | −0,72¿ | −0,75¿ | −0,79¿ |
| Estado emocional | −0,56¿ | −0,60¿ | −0,74¿ | −0,73¿ |
| Aislamiento social | −0,46¿ | −0,44¿ | −0,55¿ | −0,55¿ |
| Imagen corporal | −0,60¿ | −0,50¿ | −0,58¿ | −0,61¿ |
| Problemas con la alimentación | −0,58¿ | −0,46¿ | −0,40¿ | −0,48¿ |
| Carga de tratamiento | −0,38¿¿ | −0,44¿ | −0,66¿ | −0,57¿ |
| Percepción de la salud | −0,61¿ | −0,61¿ | −0,75¿ | −0,75¿ |
| Problemas con el peso | −0,41¿ | −0,22 | −0,33¿¿ | −0,36¿¿ |
| Síntomas respiratorios | −0,60¿ | −0,66¿ | −0,65¿ | −0,67¿ |
| Síntomas digestivos | −0,37¿¿ | −0,24 | −0,30¿¿ | −0,31¿¿ |
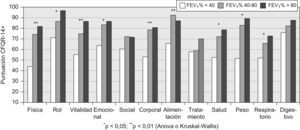
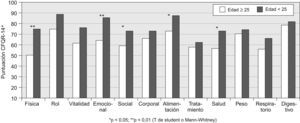
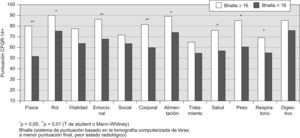
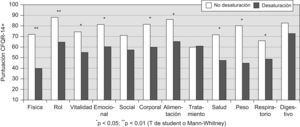
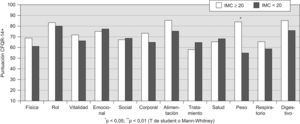
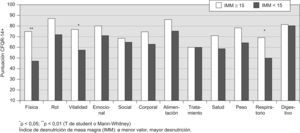
En las figuras 1–6 se exponen los resultados del cuestionario CFQR 14+ Spain en función de diversos parámetros clínicos, funcionales respiratorios, radiológicos y antropométricos. En la figura 1 se exponen las puntuaciones de las dimensiones del cuestionario (medias) en función del porcentaje predicho del FEV1: FEV1 <40% (n=15); FEV1 40–80% (n=19); FEV1 >80% (n=9). En todas las puntuaciones se observaron diferencias significativas (peor calidad de vida con mayor gravedad) salvo en la dimensión síntomas digestivos. En la figura 2 se recogen las puntuaciones en función de la edad (<25 años (n= 26) vs mayores). En la figura 3 se exponen los resultados del cuestionario en función de la puntuación Bhalla (mayor o menor a 16) y en la figura 4 de la presencia (n=9) o ausencia (n=34) de desaturación en la P6m. Los pacientes con 3 o más agudizaciones en los 12 meses previos (n=11) tuvieron peor puntuación en todas las dimensiones del cuestionario respecto al grupo que tuvo menos de 3 agudizaciones (n=32) y alcanzó significación estadística en los dominios de capacidad física (46,4±27,5 vs 71,6±28,6) y síntomas respiratorios 51,5±17,9 vs 66,2±19,8 (p<0,05). En la figura 5 se detallan las puntuaciones del cuestionario en función de la presencia o ausencia de desnutrición (IMC<20kg/m2, n=17) y en la figura 6 en función de tener un IMM <15kg/m2 (n=14) o mayor o igual. No se encontraron diferencias significativas en ninguna de las escalas en función de la presencia en la historia de resecciones intestinales, de síndrome de obstrucción de intestino distal o de un porcentaje de absorción de grasa <90% (n=8) vs mayor a esta cifra. Los pacientes con IPE, presentaron menores puntuaciones en todas las escalas, aunque solo alcanzaron diferencias significativas en la dimensión problemas de peso: 65,5±39,6 vs 89,7±21,2 (p<0,05). Los 11 pacientes que tomaban suplementos dietoterapéuticos y/o nutrición enteral por sonda presentaron significativamente peor puntuación en las dimensiones imagen corporal 57,6±23,2 vs 74,3±22,8 (p<0,05) y problemas con la alimentación 71,7±17,4 vs 85,1±22,5 (p<0,05) y casi significativa en la dimensión problemas de peso 57,5±36,7 vs 78,1±35,5 (p=0,07). Los pacientes con alguna AMH o diabetes no presentaron diferencias significativas en ninguna de las dimensiones del cuestionario, respecto a los que no tenían.
A las 2 semanas de la administración del CFQR 14+ Spain se administró de nuevo el cuestionario a 16 sujetos (en la misma situación de estabilidad clínica); 8 hombres y 8 mujeres, con una edad media 22,3±5,2 años y FEV1 del 57±27% (sin diferencias significativas respecto al resto de grupo). El coeficiente de correlación intraclase (CCI) se situó por encima de 0,70 en 10 de las 12 escalas (tabla 3) y solamente estuvo por debajo del nivel exigible en las dimensiones imagen corporal y síntomas digestivos. El coeficiente r de Spearman fue >0,70 todas las dimensiones, salvo imagen corporal y síntomas digestivos (tabla 3).
DiscusiónNuestro estudio demuestra que la versión española del cuestionario revisado de calidad de vida para FQ en adolescentes y adultos (CFQR 14+ Spain) es válida y fiable para emplearla en población española. Respecto a la consistencia interna, en 2 dominios se encontraron valores menores de la alfa de Cronbach al punto de corte exigido: carga del tratamiento (0,57) y síntomas digestivos (0,31). No obstante, estos valores fueron similares a los publicados por otros autores en otras poblaciones. Así, Quittner et al4 en la validación de la versión americana del CFQR 14+, encontraron coeficientes α <0,70 en las dimensiones tratamiento (0,18) y síntomas digestivos (0,67) y de 0,71 en la imagen corporal. Wenninger et al11 encontraron valores similares para la escala de síntomas digestivos (α=0,66) en la versión del CFQR 14+ en alemán. También Bregnballe et al8 comunicaron para la versión danesa del CFQR 14+ valores de alfa similares para la imagen corporal (0,67), y ligeramente mejores en síntomas digestivos (0,64), carga de tratamiento (0,72), añadiéndose la escala aislamiento social (0,54). El grupo de Klijn9 encontró valores de alfa menores a 0,70 en las dimensiones estado emocional (0,69), aislamiento social (0,64), imagen corporal (0,45), problemas con la alimentación (0,66), tratamiento (0,53), pudor (0,53) y síntomas digestivos (0,69). El efecto suelo en nuestra población fue <15% en todos los dominios y mejor que el encontrado por Quittner et al4. Un efecto techo >15% se observó en 7 de las 12 escalas, siendo llamativos los porcentajes en las escalas limitaciones de rol, problemas con la alimentación y problemas de peso. Quittner et al4 también encontraron un efecto techo elevado en 5 escalas de la versión inglesa del CFQR 14+: limitaciones de rol (42,8%), problemas de peso (42,8%), problemas con la alimentación (60,6%), imagen corporal (28,8%) y capacidad física (19,7%). En la versión danesa del CFQR 14+ se comunicó efecto techo en los dominios capacidad física (23,2%), limitaciones de rol (19,8%), imagen corporal (27,7%), problemas con la alimentación (62,8%) y peso (62,5%)8 Por ello, parece claro en todas las versiones que las dimensiones imagen corporal, problemas con la alimentación y problemas de peso podrían tener poca sensibilidad al cambio, por lo que se podrían realizar mejoras en su poder discriminativo. En este sentido, cabe destacar que la escala peso está representada por un único ítem, lo que influye en que este dominio tenga una menor variabilidad en las respuestas y, por tanto, unos efectos suelo y techo mayores que en el resto de las dimensiones. Como era de esperar y en línea con lo publicado por otros autores4,9,11 hemos encontrado magníficas correlaciones entre los parámetros respiratorios (especialmente con los espirométricos y radiológicos —Bhalla— y menos con las reagudizaciones), y prácticamente todas las dimensiones del cuestionario, especialmente las que se influencian por la situación respiratoria de los sujetos. En este sentido es lógico que la escala síntomas digestivos no correlacionara con estos parámetros; no obstante, resulta sorprendente que, al igual que lo observado por otros4,9,11, la dimensión carga del tratamiento tampoco lo hiciera. Como otros autores4,8,9 observamos que las puntuaciones del cuestionario discriminaron muy bien en función de los grados de gravedad clasificados en función del porcentaje del FEV1 (que es el mejor marcador pronóstico en estos pacientes)25. De nuevo, a peor espirometría, peor calidad de vida, salvo en la escala síntomas digestivos y carga del tratamiento. Aplicando otros criterios no explorados por otros autores, observamos como la puntuación Bhalla, basada en el TCAR (punto de corte 16) y la desaturación en la P6m, discriminaban adecuadamente a la mayoría de las dimensiones de la CVRS. También, los pacientes que habían padecido más de 3 reagudizaciones en el año previo, tenían peores puntuaciones en la sintomatología respiratoria y capacidad física. Martínez-García et al26,27 también publicaron resultados similares en pacientes con bronquiectasias (BQ) no FQ respecto al TCAR y número de reagudizaciones. A diferencia de otros cuestionarios no específicos, el CFQR 14+ Spain incluye dominios que exploran otros aspectos de la enfermedad no relacionados directamente con la afectación respiratoria como son los síntomas digestivos y otros como los problemas con el peso y la alimentación o la imagen corporal. En este trabajo hemos incluido, además del peso o el IMC, como hacen otros grupos, otras variables antropométricas que podrían tener mayor significado clínico en cuanto al pronóstico de los pacientes1, así como sobre su repercusión sobre la CVRS (como son la medida de la masa magra y sus índices asociados). Así, observamos buenas correlaciones entre la dimensión problemas con el peso y el IMC y la masa grasa (como marcadores del estado nutricional). Sin embargo, más interesante quizás, son las correlaciones significativas entre el índice de desnutrición de masa magra y dimensiones como la capacidad física, la vitalidad, la imagen corporal o los problemas con la alimentación. En este sentido, aunque los pacientes desnutridos en función del IMC, tuvieron puntuaciones más bajas que los normonutridos, solo alcanzaron diferencias estadísticamente significativas en la dimensión «problemas de peso». Otros autores han encontrado diferencias similares en esta escala y en otras relacionadas como imagen corporal y problemas con la alimentación9 e incluso con 10 de las 12 dimensiones8. Por el contrario, los pacientes desnutridos según el IMM, alcanzaron puntuaciones significativamente diferentes en las escalas capacidad física, vitalidad y síntomas respiratorios. Tanto en pacientes con FQ como con BQ no FQ y enfermedad pulmonar obstructiva crónica, se han encontrado (incluso en pacientes clínicamente estables, como era nuestro grupo) asociaciones de reducción de la masa magra e incremento de la proteolísis muscular con un aumento de las exacerbaciones respiratorias, peor función pulmonar y niveles más elevados de mediadores proinflamatorios28,29. De igual forma, los pacientes con FQ y afectación más grave presentan menor masa magra, menor presión inspiratoria máxima y menor grosor del diafragma30. El hecho de que los pacientes con sonda de alimentación y/o suplementos orales (n=11) tuvieran puntuaciones peores en las dimensiones imagen corporal y problemas con la alimentación, aspectos no valorados por otros autores para el CFQR, corroboran también la idoneidad de incluir en los cuestionarios de CVRS específicos para FQ, aspectos relacionados con la alimentación y nutrición. De igual forma, los pacientes con IPE presentaron menores puntuaciones en todas las dimensiones, aunque solo alcanzaron diferencias en la escala problemas de peso, algo totalmente lógico ya que la IPE condiciona con mayor facilidad riesgo de desnutrición31–33. Por el contrario, no existieron correlaciones significativas entre los síntomas digestivos (que incluyen diarrea, presencia de gases y el dolor abdominal) y la cantidad de grasa en heces de 72h o con el porcentaje de absorción de grasas. Tampoco observamos diferencias significativas en la escala síntomas digestivos en función de la presencia previa de reflujo, síndrome de obstrucción del intestino distal o historia previa de resecciones intestinales. A diferencia de otros trabajos2 la presencia de diabetes o AMH no influyó en la calidad de vida, quizás por la facilidad en su manejo clínico y por que no se recomienda modificar de forma importante los hábitos dietéticos1. Para valorar la reproductibilidad test re-test utilizamos medidas de la concordancia (coeficiente de variación intraclase) que aportaron valores mayores de 0,70 en todas las escalas salvo para imagen corporal (0,54) y síntomas digestivos (0,47). Los valores fueron parecidos o ligeramente inferiores a los comunicados para la versión alemana9, portuguesa10 y similares, o mejores a los de la versión inglesa4 en los que 5 escalas (incluyendo síntomas digestivos) no alcanzaron coeficientes mayores a 0,70. Los resultados evaluados mediante el coeficiente de Spearman también fueron similares o mejores que los publicados por el grupo danés8 en los que también las escalas síntomas digestivos (0,61) e imagen corporal (0,45) no alcanzaron valores mayores a 0,70 (además de los de capacidad física [0,68], limitaciones de rol [0,52], vitalidad [0,53] y aislamiento social [0,42]). La reproductibilidad es especialmente importante en patologías como la FQ, en la que se valora la progresión de la enfermedad en el tiempo. Si la escala no es estable puede ser difícil valorar si los cambios observados son reales o dependen de la imprecisión del cuestionario. Aunque los resultados podrían afectarse por el número de la muestra o por pequeñas variaciones en el estado físico de los pacientes (muy poco probable ya que fueron evaluados en las 2 ocasiones), dado que es un hallazgo repetido en todas las publicaciones, podría ser necesario mejorar, como mínimo, la escala síntomas digestivos. Respecto al sexo, encontramos puntuaciones menores en todas las escalas (salvo problemas de peso) en las mujeres, aunque solo alcanzaron diferencias significativas en capacidad física. Otros autores también han documentado una tendencia en las mujeres a aceptar como deseable un peso más bajo de lo normal34,8,9. Aunque en la literatura no siempre se observa lo mismo2 dado que no existían diferencias significativas en la gravedad de la enfermedad (Bhalla, FEV1 [%], reagudizaciones, edad, IMC) entre sexos, es lógico que tampoco encontráramos grandes diferencias en la CVRS.
Como otros autores4,9 encontramos significativamente peores puntuaciones en pacientes de mayor edad y correlaciones negativas (mejor estado de salud) en las dimensiones capacidad física, estado emocional, aislamiento social y percepción de la salud. Todas las escalas correlacionaron significativamente con las dimensiones del cuestionario de St. George, alcanzando «r» muy elevadas en las dimensiones que pretenden medir parámetros similares (relacionados con la patología respiratoria). Aunque también significativas, la fuerza de las correlaciones fueron menores con otras escalas (como las de síntomas digestivos o problemas con el peso), lo que apoya que ambos cuestionarios son adecuados para evaluar la percepción relacionada con la patología respiratoria, pero no tanto con otros aspectos de la enfermedad2,3.
Como limitación del estudio, cabe destacar que la muestra evaluada no fue muy amplia; no obstante, ha sido suficiente para encontrar resultados similares (y en algunos casos mejores) que los publicados por otros autores para las versiones inglesa, danesa, portuguesa o alemana con mayor población estudiada4,8–11; además, la inclusión en la validación de parámetros previamente no evaluados (clínicos, radiológicos, composición corporal, analíticos) ha permitido reforzar su utilidad y, a la vez, detectar algunas áreas de mejora en el cuestionario (como la dimensión síntomas digestivos o problemas de peso).
En conclusión, la versión española del cuestionario revisado de calidad de vida para FQ en adolescentes y adultos (CFQR 14+ Spain) es válida y fiable para emplearlo en población española, aunque podría ser mejorada en algunas de sus subescalas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste estudio ha sido financiado parcialmente por una beca NEUMOSUR (Sociedad Andaluza de Neumología y Cirugía Torácica) y el CIBERDEM (CIBER de Diabetes y Enfermedades Metabólicas Asociadas).