La biopsia pulmonar transbronquial (BPTB) es una técnica broncoscópica indicada en el estudio de las enfermedades pulmonares difusas, cuyo rendimiento diagnóstico es variable debido, en parte, al pequeño tamaño de las muestras obtenidas. La utilización de criosondas en la práctica de la BPTB podría permitir obtener muestras tisulares de mayor tamaño y mejor calidad. El presente trabajo tiene como objetivos describir la metodología de la técnica y su implantación en nuestro centro, así como analizar los resultados de seguridad e histológicos en los primeros pacientes.
Pacientes y métodosSe incluyó a 10 pacientes tributarios de BPTB para estudio de neumopatía difusa. De un modo equiparable al método convencional, la criosonda (Erbokryo CA®, Erbe, Alemania) se introduce a través del videobroncoscopio y se dirige hacia regiones pulmonares periféricas, donde la aplicación de frío permite obtener una muestra de tejido pulmonar congelado que queda adherido al extremo de la criosonda. Se registraron la duración del procedimiento y las complicaciones durante éste, y se evaluó la calidad de las muestras obtenidas.
ResultadosLa duración media (±desviación estándar) del procedimiento fue de 35±11min. Las muestras presentaban un área media de 9,5mm2 (rango: 3–25mm2), con un número medio de espacios alveolares conservados de 29,6. Ningún paciente presentó neumotórax. En 6 de los 10 pacientes se registró hemorragia tras la biopsia, que en ningún caso obligó a interrumpir el procedimiento.
ConclusionesLa utilización de criosondas es viable para la realización de la BPTB y en el futuro podría mejorar el rendimiento de la técnica convencional.
Transbronchial lung biopsy (TBLB) is a bronchoscopy procedure used to obtain peripheral lung tissue. Small size samples and artefacts lead to variable, and usually poor, diagnostic yield. The use of cryoprobes may enable larger size and better quality biopsy samples to be obtained. The purpose of this study was to evaluate the feasibility of TBLB with cryoprobes and analyse the histological quality of samples obtained.
Patients and methodsWe selected 10 patients with interstitial lung disease who were suitable for TBLB. A cryoprobe (Erbokryo CA®, Erbe, Germany) was introduced through the bronchoscope work channel. Then, under fluoroscopic control, the cryoprobe was placed in an area of the peripheral lung previously selected according to CT findings. A temperature of −89.5°C was applied for 3s and the cryoprobe and bronchoscope were removed with the frozen lung sample attached to the probe. The procedure was performed under sedation and the patient was intubated to allow bronchoscope and cryoprobe removal. Safety, duration of the procedure and histological findings has been evaluated.
ResultsThere were 10 patients (64±8 years, 6 males). Procedure length was 35min. The specimen area was 9.5mm2 (range 3 to 25mm2) and the mean number of alveolar spaces was 29.62. No pneumothorax was registered. 6/10 patients had mild post-biopsy bleeding controlled with standard bronchoscopy measures.
ConclusionsThe use of cryoprobes for TBLB may become an alternative technique to increase diagnostic yield.
Las enfermedades pulmonares difusas engloban un grupo heterogéneo de afecciones con diferentes implicaciones pronósticas y terapéuticas que hacen necesario su diagnóstico histológico específico en la mayor parte de los casos1. En el estudio de dichas enfermedades, la biopsia pulmonar transbronquial (BPTB) mediante broncoscopia flexible, descrita por Levin et al2 en 1974, es la técnica broncoscópica de primera elección para la obtención de parénquima pulmonar3,4. Sin embargo, el análisis histológico de las muestras obtenidas mediante BPTB no permite, en muchas ocasiones, un diagnóstico definitivo, de modo que son necesarios procedimientos quirúrgicos más cruentos y costosos para alcanzar el diagnóstico. Entre otros factores, la variabilidad en el rendimiento diagnóstico de la BPTB se debe al pequeño tamaño de las biopsias obtenidas y a las alteraciones producidas por la presión de la pinza de biopsia sobre el tejido, hechos que limitan su correcto análisis anatomopatológico.
Por otra parte, la crioterapia es un procedimiento aplicado en broncoscopia desde hace años, cuya indicación principal es el tratamiento y exéresis de lesiones endobronquiales, especialmente en casos de obstrucción bronquial5. En estudios en que se ha evaluado el material histológico obtenido mediante criosondas en casos de tumores endobronquiales, se ha encontrado que se trataba de muestras de mayor tamaño que las obtenidas con pinzas convencionales6,7. Este dato ha permitido plantear la posibilidad de utilizar criosondas para la realización de la BPTB, como alternativa novedosa y superior al método clásico, en el estudio de las enfermedades pulmonares difusas, lo que podría aumentar el rendimiento diagnóstico sin incrementar los riesgos, además de evitar los costes de la opción quirúrgica. Sin embargo, la información disponible sobre esta técnica es todavía muy limitada y, según nuestro conocimiento, no hay ningún centro en nuestro país que la utilice.
En el presente artículo se describen la metodología empleada en la realización de la BPTB con criosondas y su implantación en nuestro hospital, y se analizan los primeros resultados histológicos y de seguridad obtenidos de su aplicación en pacientes con enfermedad pulmonar difusa.
Pacientes y métodosSe trata de un estudio prospectivo en el que se incluyó a 10 pacientes con indicación de BPTB para el estudio de una enfermedad pulmonar difusa. Los pacientes seleccionados se evaluaron en consultas externas de Neumología. Todos ellos disponían de hemograma con estudio de coagulación, ecocardiografía, tomografía computarizada de tórax de alta resolución y estudio de la función pulmonar, que incluía espirometría, determinación de volúmenes pulmonares y difusión de monóxido de carbono. El protocolo del estudio recibió la aprobación del Comité Ético de Investigación Clínica del Hospital de Sant Pau (Barcelona) antes de su inicio, y todos los pacientes firmaron el consentimiento informado.
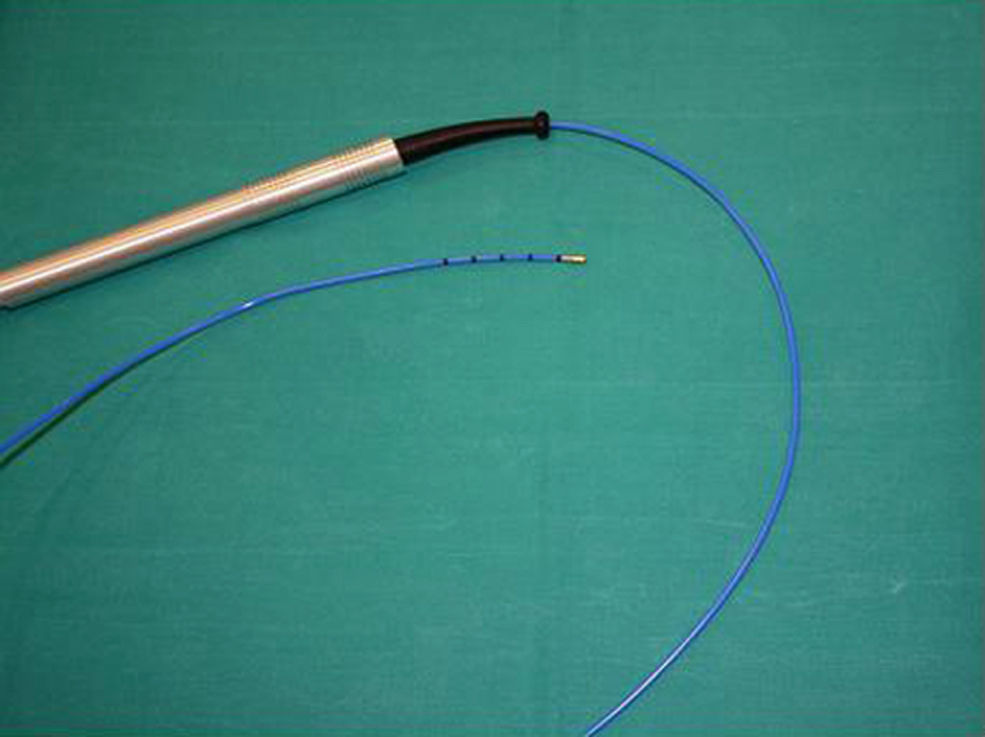
El procedimiento se llevó a cabo en un quirófano convencional. La monitorización y la sedación del paciente eran realizadas por un anestesiólogo. Se registraron la saturación de oxihemoglobina, la presión arterial, la frecuencia cardíaca y respiratoria, así como electrocardiograma y capnografía. La anestesia local de la vía aérea superior se realizaba con la instilación de lidocaína tópica. Los fármacos utilizados para la sedación fueron remifentanilo (0,05–0,1μg/kg−1/h−1) y propofol (3–6mg/kg−1/h−1) en perfusión. Se intubaba al paciente bajo control broncoscópico con un tubo flexible y anillado (Bronchoflex 7,5mm, Rüsch®) que permitía mantener ventilación espontánea y realizar ventilación de alta frecuencia si se precisaba. A través del tubo endotraqueal se efectuaba la exploración endoscópica del árbol bronquial mediante un videobroncoscopio (BF 260-T, Olympus®) y se procedía a practicar el lavado broncoalveolar en la zona seleccionada de acuerdo con la información de la tomografía computarizada de tórax. Posteriormente, bajo control fluoroscópico y dirigido a la zona pulmonar previamente seleccionada, se procedía a la realización de biopsias transbronquiales mediante una criosonda (fig. 1).
La criosonda utilizada es una sonda flexible con un diámetro de 2,4mm y una longitud de 900mm, que se conecta al equipo de crioterapia (Erbokryo® CA, Erbe, Alemania).
La congelación del tejido sobre el que se aplica la sonda es, según el principio de Joule-Thomson, resultado de la descompresión del gas (óxido nitroso) en el extremo de la misma. El contacto de la sonda con el tejido presenta un alto poder de congelación (−89°C) que, por las características de la sonda, resulta estable a la tracción.
De forma similar a la técnica empleada para la realización de biopsias transbronquiales, la criosonda se introducía a través del canal de trabajo del broncoscopio flexible. La aplicación de frío se realizaba durante 3s, tras los cuales se retiraba, junto con el videobroncoscopio, la sonda con el fragmento pulmonar congelado que había quedado adherido a su extremo. Las muestras se remitieron al Servicio de Anatomía Patológica en una solución de formaldehído. Se intentó obtener un mínimo de 2 biopsias en cada paciente, aunque el número podía variar según la tolerancia, la aparición de complicaciones o el criterio del broncoscopista.
Se registró la duración del procedimiento, así como las complicaciones observadas: hemorragia, neumotórax e insuficiencia respiratoria aguda (presión arterial de oxígeno <60mmHg y/o presión arterial de anhídrido carbónico >45mmHg tras la intervención). La hemorragia pulmonar se clasificó, de acuerdo con su gravedad, en: grado I, hemorragia muy leve en que no se precisan maniobras endoscópicas; grado II, hemorragia moderada que cede en menos de 3min tras realizar maniobras endoscópicas (oclusión-colapso bronquial y/o instilación de suero frío), y grado III, hemorragia grave que no es posible controlar endoscópicamente, provoca inestabilidad hemodinámica o respiratoria y obliga a interrumpir el procedimiento.
Además de la descripción habitual de las alteraciones histológicas, el anatomopatólogo evaluó las siguientes características de la muestra: tamaño (diámetro y área), número de espacios alveolares, porcentaje de parénquima viable para estudio histológico–definido como el porcentaje de representación de estructuras alveolares en la muestra–y porcentaje de parénquima preservado–esto es, porcentaje de parénquima pulmonar sin artefactos. Para la evaluación histológica de las muestras se utilizó una escala de puntuación según cuartiles empleada en estudios previos6. Según la aproximación diagnóstica que el anatomopatólogo establecía a partir de los hallazgos observados, las muestras se clasificaban en diagnóstico de certeza, diagnóstico de probabilidad, muestra no diagnóstica y material insuficiente. Tras el procedimiento, el paciente era extubado y se mantenía en observación durante un período de 2-3h, tras el cual, si no se objetivaban complicaciones, se le daba de alta. A las 24h de realizarse el procedimiento se efectuaba un control telefónico para recoger posibles síntomas o complicaciones posteriores derivadas del procedimiento.
El estudio se llevó a cabo siguiendo las recomendaciones éticas internacionales para investigación y ensayos clínicos recogidas en la Declaración de Helsinki, y el Comité Ético de Investigación Clínica del Hospital de la Santa Creu i Sant Pau (Barcelona) analizó y aprobó su realización.
El tratamiento estadístico de los datos se realizó con el paquete estadístico SPSS (versión 14) para Windows®.
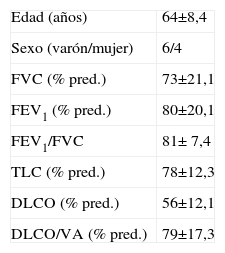
ResultadosSe realizó BPTB con criosondas a 10 pacientes con enfermedad pulmonar intersticial difusa, cuyas características funcionales y antropométricas se recogen en la tabla 1. En cada paciente se obtuvieron entre 2 y 4 biopsias pulmonares transbronquiales con criosonda bajo control fluoroscópico, y en todos los casos se realizó lavado broncoalveolar previo a la obtención de las biopsias. La duración media (±desviación estándar) del procedimiento fue de 35±11min. Todos los pacientes fueron extubados y dados de alta a su domicilio. La estancia media hasta el alta domiciliaria fue de 156±40min. Ningún paciente requirió ingreso hospitalario.
Variables clínicas y funcionales de los 10 pacientes estudiados
| Edad (años) | 64±8,4 |
| Sexo (varón/mujer) | 6/4 |
| FVC (% pred.) | 73±21,1 |
| FEV1 (% pred.) | 80±20,1 |
| FEV1/FVC | 81± 7,4 |
| TLC (% pred.) | 78±12,3 |
| DLCO (% pred.) | 56±12,1 |
| DLCO/VA (% pred.) | 79±17,3 |
Los datos se presentan como media±desviación estándar, o número de pacientes en el caso del sexo. DLCO/VA: capacidad de difusión de monóxido de carbono ajustada al volumen alveolar; DLCO: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; TLC: capacidad pulmonar total.
Como complicaciones inmediatas, registradas durante el procedimiento, el 20% de los pacientes presentó hemorragia de grado I y en el 40% se objetivó hemorragia de grado II. Ningún paciente presentó hemorragia grave que obligara a suspender el procedimiento ni precisó medidas médicas o quirúrgicas adicionales. Ningún paciente presentó neumotórax ni insuficiencia respiratoria aguda tras la realización de la BPTB con criosonda. No se detectaron otras complicaciones 24h después del procedimiento.
De los 10 pacientes incluidos en el estudio, se analizaron 20 muestras (2 por paciente), que evaluó un anatomopatólogo según el protocolo establecido. Las biopsias obtenidas presentaban un área media de 9,5mm2 (rango: 3–25mm2) y un diámetro medio de 3,1mm (rango: 2,2–5mm). El número medio de espacios alveolares conservados fue de 29,6 (rango: 3–100). Según la escala utilizada para la valoración histológica de la muestra, el 60% de las muestras presentó un porcentaje igual o superior al 75% de parénquima pulmonar sin artefactos, el 50% mostró entre el 75 y el 100% de parénquima viable para estudio histológico y únicamente en 2 casos se obtuvo escasa representación de parénquima pulmonar, siendo el resto de la muestra pared bronquial. En cuanto a los diagnósticos histológicos observados, 2 casos presentaron hallazgos indicativos de neumonía intersticial no específica, 3 casos alveolitis alérgica extrínseca y en 5 pacientes las alteraciones observadas no permitieron un diagnóstico histológico concreto por tratarse de cambios inespecíficos.
DiscusiónLos resultados obtenidos permiten afirmar que la BPTB con criosondas es una técnica viable para la obtención de muestras de parénquima pulmonar, con un número de complicaciones relativamente bajo y sin un aparente incremento de los efectos adversos asociados a este procedimiento. En la actualidad, las sondas de crioterapia presentan mayor poder y velocidad de congelación, características que aumentan la tracción de la sonda sobre el tejido. Estas modificaciones han permitido incrementar la eficacia terapéutica de este procedimiento para la extracción de tumores endobronquiales, con un alto porcentaje de éxitos en la exéresis y recanalización bronquial. Además, en estudios anteriores, el análisis anatomopatológico e inmunohistológico de las muestras tisulares obtenidas con criosondas objetivó que se trataba de biopsias superiores en tamaño y calidad a las obtenidas mediante pinzas de biopsia convencional6–8.
El presente trabajo es el primero que analiza de forma prospectiva la seguridad y la viabilidad de esta técnica en pacientes con sospecha de enfermedad intersticial.
Respecto a la viabilidad, nuestros resultados muestran que el uso de criosondas para la realización de la BPTB, al efectuarse ésta de forma similar al procedimiento convencional, no parece aumentar la dificultad de su aplicación ni prolongar el tiempo que se requiere para llevarla a cabo.
En este sentido, una limitación de nuestro estudio que cabe resaltar es el hecho de que las BPTB con criosondas se efectuaron en un quirófano, lo que supone un incremento de la complejidad y de los costes derivados de la técnica. Sin embargo, puesto que uno de los objetivos principales del estudio fue la valoración de la seguridad, y actualmente se dispone de escasa información en cuanto a este dato, era necesario realizar el procedimiento en las condiciones de mayor seguridad posible, optimizando la monitorización y control del paciente, lo que permitía resolver cualquier eventualidad relacionada con la aplicación del procedimiento. Sin embargo, los autores opinan que, con la experiencia adecuada, el procedimiento podría realizarse en un gabinete de broncoscopia convencional correctamente dotado9.
En el caso de la BPTB con pinza convencional, varios autores han registrado las complicaciones secundarias, siendo la hemorragia y el neumotórax los dos efectos adversos más frecuentes (oscilan entre el 1 y el 5%, respectivamente)10–12. En nuestro estudio, ningún paciente presentó neumotórax ni hemorragia grave. El hecho de no haber observado hemorragias significativas podría guardar relación con la meticulosa selección de los pacientes, excluyendo a aquéllos con mayor riesgo de presentarla (alteraciones de los factores de coagulación y presencia de hipertensión arterial pulmonar), aunque también es posible pensar en los efectos hemostáticos producidos por el frío (vasoconstricción y microtrombosis capilar en la zona de contacto de la criosonda), lo que podría contribuir a disminuir el número y el volumen de la hemorragia.
En cuanto a la BPTB con criosondas, existen pocos datos acerca de los posibles efectos adversos de esta técnica. En un estudio reciente realizado en pacientes con enfermedad pulmonar difusa a quienes se efectuó BPTB utilizando pinzas de biopsia convencional y criosondas, se registró un 4% de neumotórax y no se observó ninguna hemorragia grave13. Sin embargo, no es posible extraer conclusiones definitivas sobre la seguridad, ya que ambos procedimientos se llevaban a cabo en el mismo paciente, de modo que no era posible establecer si las complicaciones observadas, aunque escasas, eran atribuibles a uno u otro método.
Nuestros resultados apuntan a que es un procedimiento técnicamente viable que no parece incrementar el número de efectos adversos, aunque serán necesarios estudios más amplios y comparativos con el método convencional para poder extraer conclusiones sobre la seguridad de la técnica. Además, a pesar de que el procedimiento se llevó a cabo en un quirófano, la técnica continúa conservando el carácter ambulatorio, por lo que, tal y como ocurre en el caso de la BPTB con pinzas convencionales, el paciente no precisa ingreso hospitalario.
Otra diferencia con respecto al procedimiento convencional es la necesidad de intubación orotraqueal para realizar la técnica, por lo que el paciente requiere una sedación profunda. Esto facilita la entrada y salida del videobroncoscopio con la criosonda y la muestra adherida en su extremo, ya que el tamaño de la muestra no permite el paso a través del canal de trabajo del videobroncoscopio. En este punto, y puesto que el paciente se encuentra sedado, no es posible usar la aparición de dolor en punta de costado como signo de irritación pleural y riesgo de neumotórax14,15, de manera que es importante controlar por fluoroscopia que la sonda quede a 1-2cm de la pleura visceral para minimizar el riesgo de neumotórax. Por otro lado, la sedación durante la broncoscopia proporciona mayor bienestar y mejor tolerancia16.
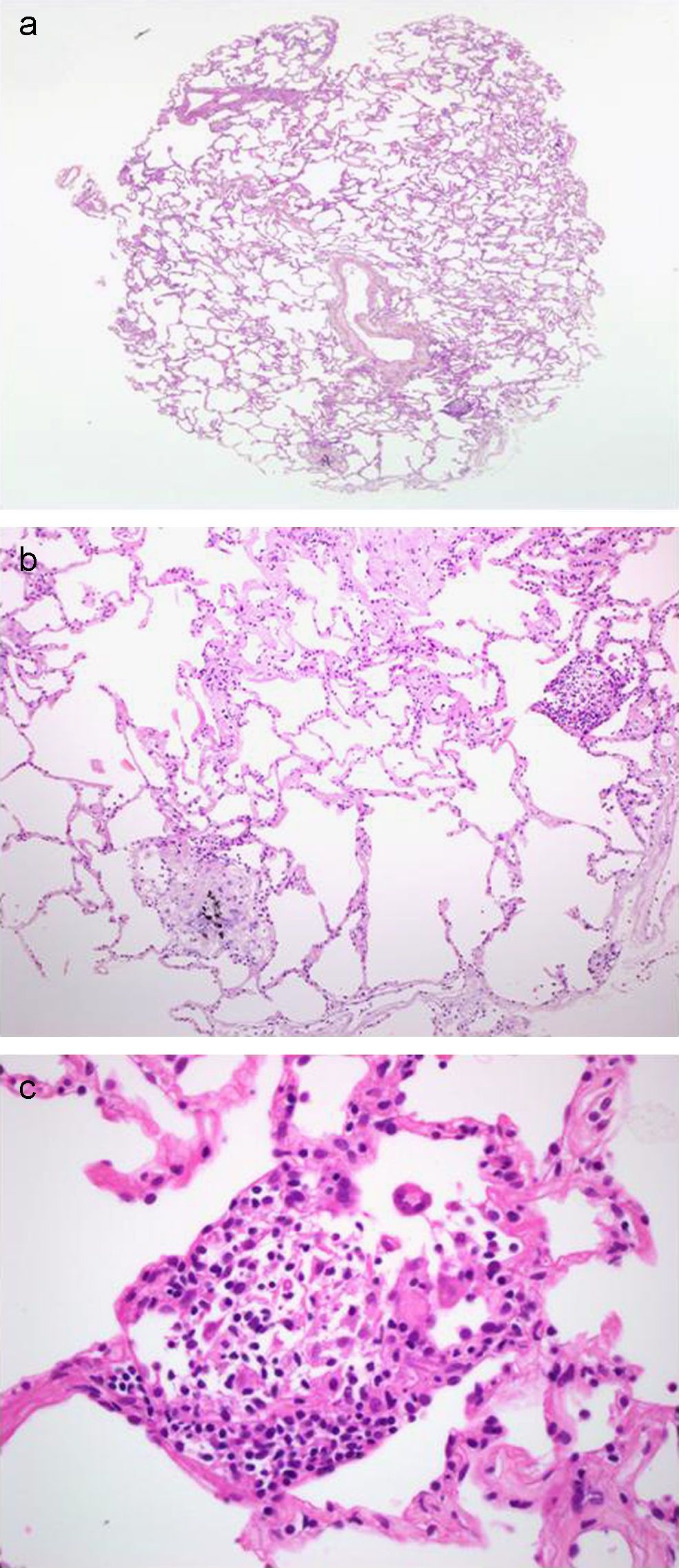
Una de las limitaciones de la BPTB convencional en el logro de un diagnóstico histológico preciso es el reducido tamaño de la muestra. Así, en un estudio realizado por Curley et al17 en el que se analizaron 170 muestras obtenidas mediante BPTB, se observó que el 50% de las biopsias tenía un tamaño menor de 3mm, lo que condicionaba, además, la presencia de un número reducido de espacios alveolares (menos de 20 espacios alveolares en el 48% de las muestras). Estos datos, junto a la presencia de artefactos producidos por el efecto de las pinzas de biopsia sobre el tejido (aplastamiento, hemorragia intraalveolar), dificultan el análisis histológico posterior de las muestras y confieren una gran variabilidad en el rendimiento diagnóstico de la BPTB. En este punto, la BPTB mediante criosondas se plantea como una alternativa en el diagnóstico de las enfermedades pulmonares difusas, ya que las muestras obtenidas mediante esta nueva técnica parecen superiores en tamaño y calidad a las obtenidas mediante pinzas de biopsia convencional (fig. 2). A escala microscópica, las biopsias obtenidas mediante criosonda no presentan artefactos ni alteraciones secundarios al efecto de la congelación sobre el tejido (fig. 3). La explicación de este hallazgo podría ser la rapidez con que la nueva generación de criosondas induce la congelación. De esta forma, tampoco se objetivan las alteraciones clásicas que se producen en las muestras obtenidas mediante pinzas de biopsia.
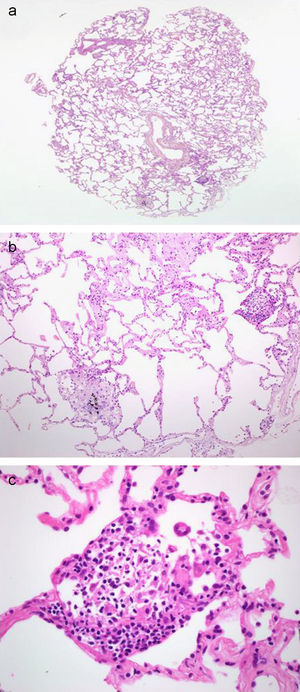
a) Imagen de microscopia óptica (×2) sobre corte histológico de biopsia pulmonar obtenida mediante criosonda. Tinción hematoxilina-eosina. Obsérvese la presencia de numerosos espacios alveolares, así como estructuras bronquiales y alveolares. El paciente fue diagnosticado de una alveolitis alérgica extrínseca. b) Imagen microscópica a mayor aumento del mismo caso (×20). Obsérvese el grado de conservación de las estructuras alveolares, así como la presencia de infiltrados mononucleares intersticiales leves y granulomas no caseificantes. c) Imagen microscópica (×40) donde se identifica un granuloma no caseificante.
Nuestra experiencia indica que la utilización de criosondas puede suponer una mejora y optimización de la BPTB. Las importantes implicaciones pronósticas y terapéuticas otorgan un máximo interés al hecho de intentar obtener un diagnóstico específico en los casos de enfermedades pulmonares difusas, a menudo complejas, en las que la interacción entre el clínico, el radiólogo y el anatomopatólogo es fundamental18. De todos modos, es necesario realizar estudios prospectivos, comparativos y aleatorizados para averiguar si esta novedosa modalidad supone un verdadero incremento del rendimiento diagnóstico y permite reducir el número de biopsias quirúrgicas.
A Carmen Burgués por su indispensable ayuda en la realización de los procedimientos endoscópicos. A los Dres. José Manuel Rodríguez-Arias y Diego Castillo por su apoyo y ayuda en la selección y manejo de los pacientes con enfermedad pulmonar difusa. Al Dr. Vicente Plaza por el constante estímulo científico durante el desarrollo del estudio.
Financiación
Estudio financiado con la ayuda de la BECA SOCAP 2008.
Conflicto de intereses
Los autores del presente manuscrito no tienen ninguna relación financiera ni personal que pueda provocar conflicto de intereses.