La sarcoidosis es una enfermedad granulomatosa sistémica de etiología desconocida que suele afectar a pacientes jóvenes, con una incidencia estimada en España de 1,36/100.000 habitantes1. Se sospecha que su patogénesis se relaciona con la exposición a determinados factores ambientales en personas con predisposición genética2,3. Existe controversia acerca de si los pacientes con sarcoidosis tienen un mayor riesgo de desarrollar cáncer4,5, pero las publicaciones en las que el tumor precede al diagnóstico de sarcoidosis son escasas y se limitan a series de casos. Presentamos una serie de 14 pacientes que durante el seguimiento oncológico de tumores extratorácicos se diagnosticaron de sarcoidosis.
Se realizó un estudio descriptivo, observacional, con seguimiento y retrospectivo (enero 2012/junio 2017), de los pacientes con un tumor extratorácico remitidos a la Unidad de broncoscopias para estudiar nuevas adenopatías mediastínicas en la tomografía computarizada de tórax.
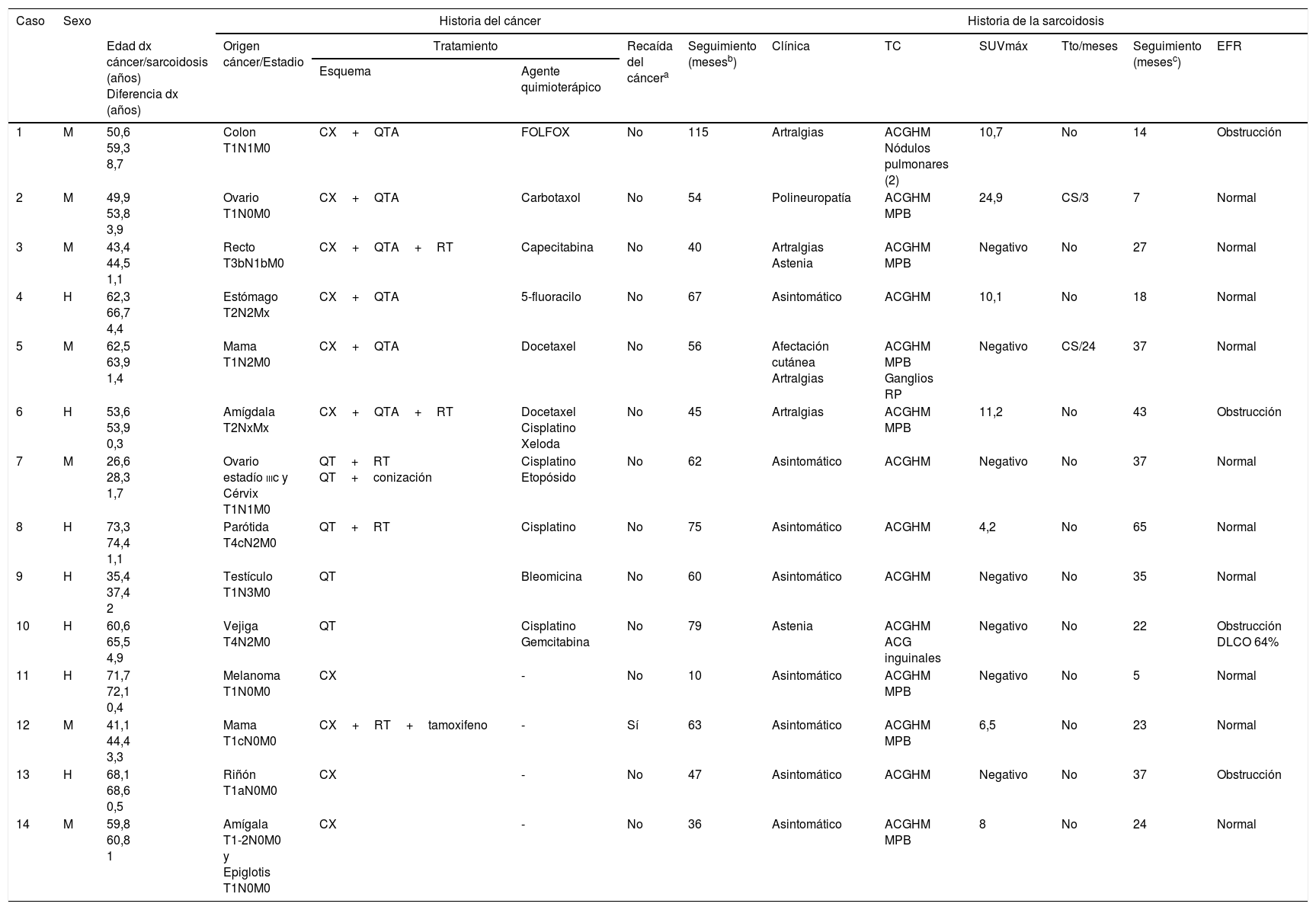
Se valoraron un total de 2.420 pacientes, de los cuales 437 lo hicieron por el motivo expuesto. Finalmente se incluyeron 404. Los motivos de exclusión fueron contraindicación para la ecobroncoscopia por distintos motivos (12), las adenopatías mediastínicas ya estaban presentes en el momento del diagnóstico del cáncer(15), o no autorizaron realizar más pruebas diagnósticas (6). A todos ellos se les realizó una ecobroncoscopia lineal guiada por ecografía para la punción de las mismas (Olympus BF-UC180F; aguja Olympus ViziShot NA-201SX-4022, 21G), bajo sedación con midazolam. A 14 pacientes (7 hombres y 7 mujeres; edad media al diagnóstico del tumor de 54,2±13,9 años) se les diagnosticó de sarcoidosis en base a criterios clínico-radiológicos con confirmación histológica6 (edad media al diagnóstico de sarcoidosis: 56,6±13,7 años). El intervalo medio de tiempo entre ambos diagnósticos fue de 2,4±2,3 años. Los orígenes tumorales más frecuentes fueron gastrointestinales (3 casos) y mama, ginecológico y cavidad orofaríngea (2, cada uno de ellos) (tabla 1). Dos pacientes presentaron 2 tumores (ovario-cérvix y epiglotis-amígdala; intervalo entre ambos diagnósticos 36 y 4 meses, respectivamente). La mayoría de los tumores se diagnosticaron en estadios precoces [estadios i-ii; 12/16 (75%); estadio iii; 3/16 (18,8%); estadio iv; 1/16 (6,2%)]. Las estaciones más frecuentemente puncionadas fueron la subcarinal (7; 100%) y paratraqueal derecha baja [4R; 9/14 (64,3%)]. En 8 pacientes (57,1%) el estadio radiológico de sarcoidosis fue el ii y en 6 (42,9%), el i. Ocho de 14 enfermos (57,1%), estaban asintomáticos, 4 (28,6%) tenían artralgias, 2 (14,3%) astenia, uno (7,1%) presentaba una polineuropatía, y otro (7,1%) afectación cutánea. En todos los casos el cultivo para identificar Mycobacterium tuberculosis en una muestra de adenopatía fue negativo. Además del agrandamiento de las cadenas ganglionares mediastínicas bilaterales, 7 pacientes (50%) presentaban nódulos pulmonares milimétricos difusos y bilaterales. En 7/14 pacientes, la captación mediastínica en la tomografía por emisión de positrones estaba aumentada (SUVmáx 16,2±12,9; rango 4,2-24,9). Solamente 10/14 pacientes recibieron quimioterapia (4 cisplatino y 2 docetaxel) (tabla 1). Dos pacientes se trataron con corticoides (los que presentaban polineuropatía y afectación cutánea) durante 3 y 24 meses (dosis máximas de 50 y 30mg de prednisona, respectivamente). La respuesta fue favorable en ambos casos. Los seguimientos medios de los pacientes fueron 57,8±24,1 meses desde el diagnóstico del tumor (con solamente una recaída tumoral y ningún fallecimiento) y de 28,1±15,8 meses desde el diagnóstico de sarcoidosis.
Características de los 14 pacientes
| Caso | Sexo | Historia del cáncer | Historia de la sarcoidosis | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Edad dx cáncer/sarcoidosis (años) Diferencia dx (años) | Origen cáncer/Estadio | Tratamiento | Recaída del cáncera | Seguimiento (mesesb) | Clínica | TC | SUVmáx | Tto/meses | Seguimiento (mesesc) | EFR | |||
| Esquema | Agente quimioterápico | ||||||||||||
| 1 | M | 50,6 59,3 8,7 | Colon T1N1M0 | CX+QTA | FOLFOX | No | 115 | Artralgias | ACGHM Nódulos pulmonares (2) | 10,7 | No | 14 | Obstrucción |
| 2 | M | 49,9 53,8 3,9 | Ovario T1N0M0 | CX+QTA | Carbotaxol | No | 54 | Polineuropatía | ACGHM MPB | 24,9 | CS/3 | 7 | Normal |
| 3 | M | 43,4 44,5 1,1 | Recto T3bN1bM0 | CX+QTA+RT | Capecitabina | No | 40 | Artralgias Astenia | ACGHM MPB | Negativo | No | 27 | Normal |
| 4 | H | 62,3 66,7 4,4 | Estómago T2N2Mx | CX+QTA | 5-fluoracilo | No | 67 | Asintomático | ACGHM | 10,1 | No | 18 | Normal |
| 5 | M | 62,5 63,9 1,4 | Mama T1N2M0 | CX+QTA | Docetaxel | No | 56 | Afectación cutánea Artralgias | ACGHM MPB Ganglios RP | Negativo | CS/24 | 37 | Normal |
| 6 | H | 53,6 53,9 0,3 | Amígdala T2NxMx | CX+QTA+RT | Docetaxel Cisplatino Xeloda | No | 45 | Artralgias | ACGHM MPB | 11,2 | No | 43 | Obstrucción |
| 7 | M | 26,6 28,3 1,7 | Ovario estadío iiic y Cérvix T1N1M0 | QT+RT QT+conización | Cisplatino Etopósido | No | 62 | Asintomático | ACGHM | Negativo | No | 37 | Normal |
| 8 | H | 73,3 74,4 1,1 | Parótida T4cN2M0 | QT+RT | Cisplatino | No | 75 | Asintomático | ACGHM | 4,2 | No | 65 | Normal |
| 9 | H | 35,4 37,4 2 | Testículo T1N3M0 | QT | Bleomicina | No | 60 | Asintomático | ACGHM | Negativo | No | 35 | Normal |
| 10 | H | 60,6 65,5 4,9 | Vejiga T4N2M0 | QT | Cisplatino Gemcitabina | No | 79 | Astenia | ACGHM ACG inguinales | Negativo | No | 22 | Obstrucción DLCO 64% |
| 11 | H | 71,7 72,1 0,4 | Melanoma T1N0M0 | CX | - | No | 10 | Asintomático | ACGHM MPB | Negativo | No | 5 | Normal |
| 12 | M | 41,1 44,4 3,3 | Mama T1cN0M0 | CX+RT+tamoxifeno | - | Sí | 63 | Asintomático | ACGHM MPB | 6,5 | No | 23 | Normal |
| 13 | H | 68,1 68,6 0,5 | Riñón T1aN0M0 | CX | - | No | 47 | Asintomático | ACGHM | Negativo | No | 37 | Obstrucción |
| 14 | M | 59,8 60,8 1 | Amígala T1-2N0M0 y Epiglotis T1N0M0 | CX | - | No | 36 | Asintomático | ACGHM MPB | 8 | No | 24 | Normal |
ACGHM: agrandamiento de cadenas ganglionares hiliomediastínicas; ADC: adenocarcinoma; CS: corticosteroides; CX: cirugía; Dif: diferencia; Dx: diagnóstico; EFR: exploración funcional respiratoria; GNN: granuloma no necrosante; H: hombre; LG: linfadenitis granulomatosa; M: mujer; MPB: micronódulos pulmonares bilaterales; QT: quimioterapia; QTA: quimioterapia adyuvante; RP: retroperitoneales; RT: radioterapia; SUVmáx: valor estandarizado máximo de absorción en la tomografía por emisión de positrones; TC: tomografía computarizada; Tto: tratamiento.
Este estudio demuestra que en un paciente oncológico la aparición de nuevas adenopatías mediastínicas no significa necesariamente extensión tumoral, ni aunque exista hipercaptación, ya que no se puede descartar, entre otras enfermedades, sarcoidosis7. Por tanto, siempre se necesitará confirmación histológica8. Otro hallazgo relevante es que el diagnóstico de sarcoidosis fue siempre posterior al del tumor. Lo más descrito es la situación inversa y son muy pocas las series publicadas en las que la cronología diagnóstica es primero tumor y posteriormente sarcoidosis9,10.
En ocasiones es difícil diferenciar la sarcoidosis de la tuberculosis, o de la reacción sarcoidea. El diagnóstico de tuberculosis, una posibilidad real en nuestra región, con una incidencia de 21,3 casos/100.000 habitantes/año11, se descartó al ser negativo el cultivo para Mycobacterium tuberculosis de una muestra de adenopatía mediastínica obtenida por ecobroncoscopia, en todos los casos. Una reacción sarcoidea (desarrollo de granulomas de células epitelioides no caseificantes en pacientes que no cumplen por completo los criterios de sarcoidosis) se puede desarrollar, en pacientes oncológicos, en la primera cadena ganglionar regional a la que metastatizaría un determinado tumor, teniendo en cuenta la posición estratégica que ocupa cada grupo ganglionar12,13, y son más frecuentes en los cánceres de testículo y linfomas. Como las adenopatías mediastínicas serían esas primeras cadenas en las que metastatizarían los cánceres de pulmón y pleura, estos tumores se excluyeron del estudio. Además, el que los tumores de nuestros enfermos estuvieran en remisión, tenían síntomas sistémicos y las adenopatías mediastínicas captaban en la PET7 (6 y 7 pacientes, respectivamente), sugieren el diagnóstico de sarcoidosis. Sin embargo, aun con estas diferenciaciones, la distinción entre ambas entidades puede ser difícil de establecer.
Aunque se pensó que la asociación entre cáncer y sarcoidosis era casual, en la actualidad se sospecha que, en individuos genéticamente predispuestos, pueden estar implicados determinados mecanismos etiopatogénicos, como la hiperrespuesta inmune del huésped frente al propio cáncer (o a antígenos producidos por el tumor)9, o al propio tratamiento del tumor12, como por ejemplo el uso de nivolumab en el melanoma metastásico13.
La principal limitación del estudio es que el incluir solamente pacientes derivados a una unidad de broncoscopias puede generar cierto sesgo ya que, posiblemente, este procedimiento no se solicitará a todos los enfermos, asumiéndose, en muchos casos, una metástasis del tumor de base.
En conclusión, la aparición de adenopatías mediastínicas en pacientes con tumores extrapulmonares no debe asumirse como recurrencia de los tumores, sino que deben considerarse otras causas, entre ellas la sarcoidosis. El diagnóstico histológico es de elección en estos casos. Aunque no se conocen con exactitud la relación existente entre cáncer y sarcoidosis y, por consiguiente, los mecanismos patogénicos que los relacionarían, es posible que bien el propio tumor, bien la terapia antitumoral, favorezcan el desarrollo de sarcoidosis en individuos con predisposición genética. Se necesitan más estudios para aclarar esta asociación, así como su valor clínico y pronóstico.