La fibrinolisis está recomendada en los diferentes consensos para el tratamiento del embolismo pulmonar masivo hemodinámicamente inestable (EPmHI).
Material y métodosEn un solo centro desde enero de 2001 hasta diciembre de 2009 se han tratado 111 pacientes (55 hombres y 56 mujeres) diagnosticados de EPmHI (presión arterial sistólica<90 mmHg) con al menos dos de los siguientes criterios: índice de Miller > 0, disfunción ventricular y necesidad de drogas vasoactivas. En todos los casos se realizó fibrinolisis local con uroquinasa y en la mayoría fragmentación con catéter pig-tail. Se implantó un filtro de vena cava inferior (VCI) en 94 pacientes como medida profiláctica.
ResultadosEl éxito técnico fue del 100%. El índice de Miller mejoró de 0,7±0,12 pre-tratamiento a 0,09±0,16. La presión arterial pulmonar media pasó de 39,93±7,0 mmHg a 20,47±3,3 mmHg en el control de 30-90 días. A 94 pacientes se les implantó un filtro de VCI que se pudo retirar en el 79% de forma satisfactoria. Siete pacientes fallecieron: 3 en el curso de su neoplasia, 3 por insuficiencia cardíaca derecha a 1, 7 y 30 días y otro falleció de hemorragia cerebral en las primeras 24 horas. Hubo complicaciones en el 12,6% de los casos, de las que 4,5% fuer mayor.
ConclusiónLa fibrinolisis local con fragmentación consigue la normalización rápida de la presión pulmonar y constituye un método seguro y eficaz para el tratamiento del EPmHI.
Fibrinolysis is recommended in several consensus documents for the treatment of a haemodynamically unstable massive pulmonary embolism (HUMPE).
Material and methodsA total of 111 patients were treated in a single centre from January 2001 to December 2009. They were 55 males and 56 females diagnosed with HUMPE (systolic arterial pressure>90 mmHg) with at least two of the following criteria: Miller index>0, ventricular dysfunction, and need of vasoactive drugs. Local fibrinolysis with urokinase was performed in all cases, and fragmentation with a pig-tail catheter in the majority of them. An inferior vena cava (IVC) filter was implanted in 94 patients as a prophylactic measure.
ResultsTechnical success was 100%. The Miller index improved from 0.7±0.12, pre-treatment, to 0.09±0.16. The mean pulmonary arterial pressure fell from 39.93±7.0 mmHg to 20.47±3.3 mmHg in the 30-90 days review. Of the 94 patients with IVC filters implanted, 79% were withdrawn satisfactorily. Seven patients died: 3 due to their neoplasia, 3 due to right cardiac failure at 1, 7 and 30 days, and another died of a brain haemorrhage in the first 24hours. There were complications in 12.6% of the cases, of which 4.5% were major.
ConclusionLocal fibrinolysis with fragmentation achieves a rapid return to normal of the pulmonary pressure and is a safe and effective method for the treatment of HUMPE.
La VIII Conferencia del American College of Chest Physicians (ACCP) vuelve a recomendar la fibrinolisis en grado 1B (2B en la séptima) para los pacientes con embolia pulmonar masiva y compromiso hemodinámico y con el mismo grado de evidencia recomienda la vía sistémica frente a la local1. Esta recomendación no sorprende, ya que repite la de anteriores consensos2 y en el momento de su publicación no se disponía de novedades al respecto. ¿En qué está basada esta recomendación de todas las guías del ACCP en relación con fibrinolisis en la embolia pulmonar? Los conocimientos que fundamentan dicha guía surgen del artículo de Vertstraete et al. publicado en Circulation en 19883. En dicho estudio multicéntrico de 8 hospitales se trataron con rtPA 34 pacientes diagnosticados de embolismo pulmonar masivo, 19 administrado in situ en la arteria pulmonar y 15 por vía venosa sistémica. Los resultados consignaron que el tratamiento arterial pulmonar in situ no ofrecía ningún beneficio sobre la vía venosa sistémica. Una de las más importantes limitaciones del estudio de Verstraete fue el bajo número de pacientes y el reclutamiento de pacientes por centro que supone un promedio de 4 por centro. La administración del fibrinolítico en el tronco de la arteria pulmonar sin atravesar el trombo y la no fragmentación del mismo constituyeron otras importantes limitaciones. La guía para el diagnóstico y manejo de la embolia pulmonar de la Sociedad Europea de Cardiología recomienda la fibrinolisis para los pacientes de alto riesgo vital sin determinar si local o periférica4. En la actualidad no se concibe el acceso intrapulmonar tan solo para realizar la infusión del fibrinolítico en el tronco pulmonar. La fibrinolisis local próxima a los trombos, o mejor intratrombo, y la fragmentación con catéter o con otros dispositivos es la recomendación en estos casos5,6, de tal forma que en la revisión y metaanálisis sobre el tratamiento del embolismo masivo realizado por Kuo el al7 se proponen las técnicas a través de catéter como primera línea de tratamiento en el embolismo pulmonar masivo en aquellos centros experimentados donde se cuente con los medios adecuados. Presentamos nuestra experiencia con 111 pacientes con embolismo pulmonar masivo hemodinámicamente inestable (EPmHI) tratados con fibrinolisis local y fragmentación del trombo.
Material y métodosPacientesDesde enero de 2001 hasta diciembre de 2009 se han tratado mediante fibrinolisis y fragmentación mecánica con catéter 111 pacientes diagnosticados de EPmHI. Todos ellos, 55 varones y 56 mujeres, eran procedentes de un único centro, con una edad media de 60±15 años (rango 27-79 años). En el estudio se incluyeron pacientes entre 18 y 80 años, diagnosticados angiográficamente o por angio-TC de EPmHI (presión arterial sistólica<90 mmHg) y al menos dos de los siguientes criterios: a) índice de Miller>0,5; b) disfunción ventricular en ecocardiografía establecido por el aumento del volumen de VD, hipocinesia de VD y por una velocidad sistólica tricúspide > 2,6 m/s en doppler, y c) necesidad de administrar más de 5 microgramos/Kg minuto de drogas inótropas para mantener la presión sanguínea. En todos los casos se obtuvo el consentimiento informado y el estudio fue aprobado por el Comité de Ética de la Comunidad Autónoma de Aragón. Para el tratamiento con fibrinolíticos se consideraron las siguientes contraindicaciones: embarazo, cirugía mayor 72 horas antes, traumatismo craneoencefálico en el último mes, accidente cerebrovascular en los seis últimos meses, hipertensión arterial no controlada (presión diastólica > 120 mmHg en el momento de tomar la decisión de tratamiento), hemorragia activa o alteración grave de la coagulación y enfermedad hepática o renal grave.
Se estudiaron los factores de riesgo para enfermedad tromboembólica venosa, comorbilidades, así como datos clínicos y analíticos. Retrospectivamente se estableció el índice ASA y la escala de Wells para los pacientes incluidos en el estudio.
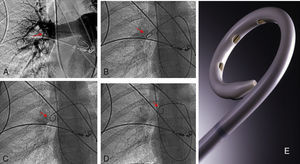
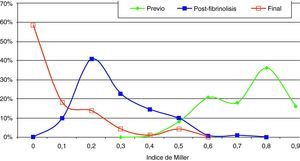
Estudio morfológico y hemodinámicoEl diagnóstico de embolismo pulmonar se realizó generalmente sobre la base de criterios radiológicos de defectos de repleción en arteria pulmonar principal, lobar o segmentaria en TC. En todos los pacientes se comprobó la sospecha diagnóstica de embolismo pulmonar masivo angiográficamente. Los criterios diagnósticos fueron: defectos de llenado intraarterial y defectos de perfusión. La angiografía se efectuó por vía yugular derecha A través de un catéter pig-tail curvado 55° de 6 French se realizó la toma de presiones en tronco pulmonar principal y en cada una de las dos ramas. También se tomaron presiones de aurícula derecha y vena cava inferior. Se realizaron tres inyecciones de 20 cc de contraste no iónico en proyecciones antero-posterior y oblicua anterior derecha e izquierda. Con los datos morfológicos se estableció el índice de Miller. Este es un parámetro angiográfico cuantitativo para medir el grado de afección pulmonar (émbolos intravasculares y alteración de perfusión), que nos permite el posterior control evolutivo de los pacientes. Se basa en los datos obtenidos angiográficamente y valora el grado de obstrucción vascular (pulmón derecho=9 puntos y pulmón izquierdo=7 puntos) y la perfusión de cada pulmón (9 puntos cada uno). La perfusión se valora en tres zonas distintas de cada pulmón, dando una puntuación a cada una de 1 (flujo medianamente reducido) y 0 (normalidad). El resultado obtenido al sumar todos los parámetros de ambos pulmones se divide entre 34, hallándose así el índice de Miller8. Por tanto, cuanto más cercano es el índice a la unidad en peor situación se encuentra el paciente. Con los datos clínicos, morfológicos y hemodinámicos, y de acuerdo con los criterios previamente establecidos, se tomó la decisión de inclusión (fig. 1).
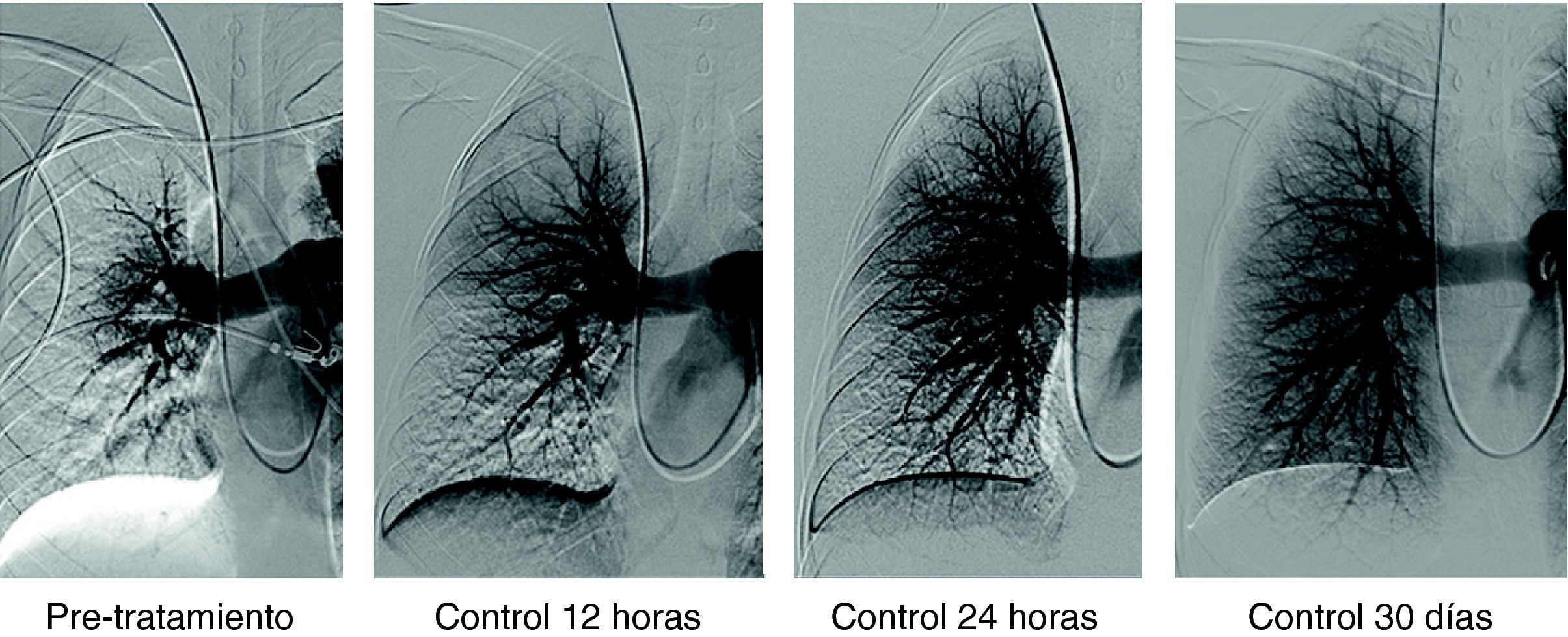
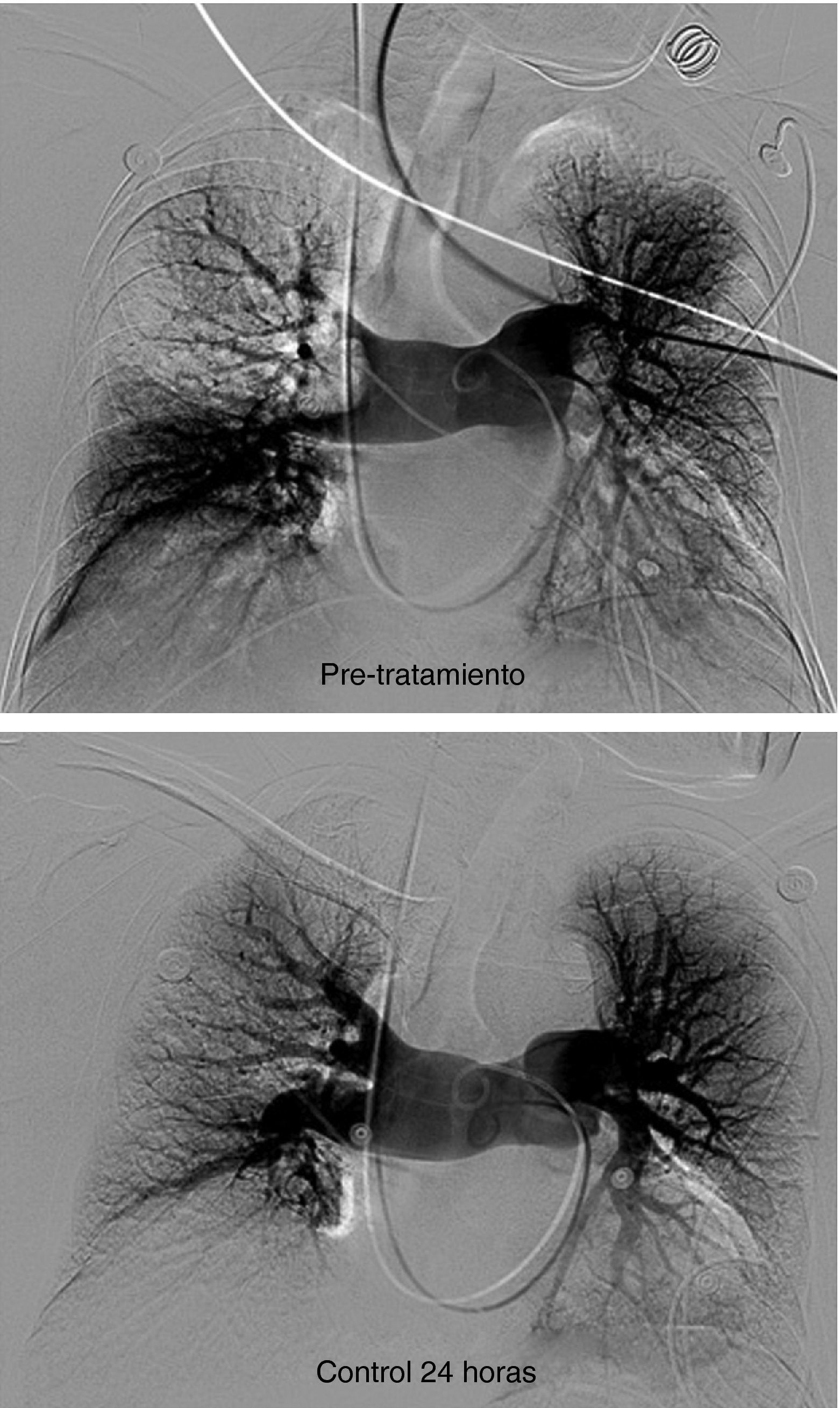
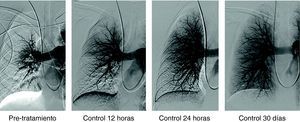
Paciente varón de 58 años con TEP masivo, shock con índice de Miller de 0.7 y presión arterial pulmonar media (PAP-m) de 42mm Hg. En el control de 12 horas después de tratamiento fibrinolítico (100.000 UI de UK/hora) mejoría del índice de Miller y PAP-m 38mm Hg y a las 24 horas PAP de 27mm Hg. El control de 30 días la PAP-m 18mm Hg. y el Índice de Miller de 0.
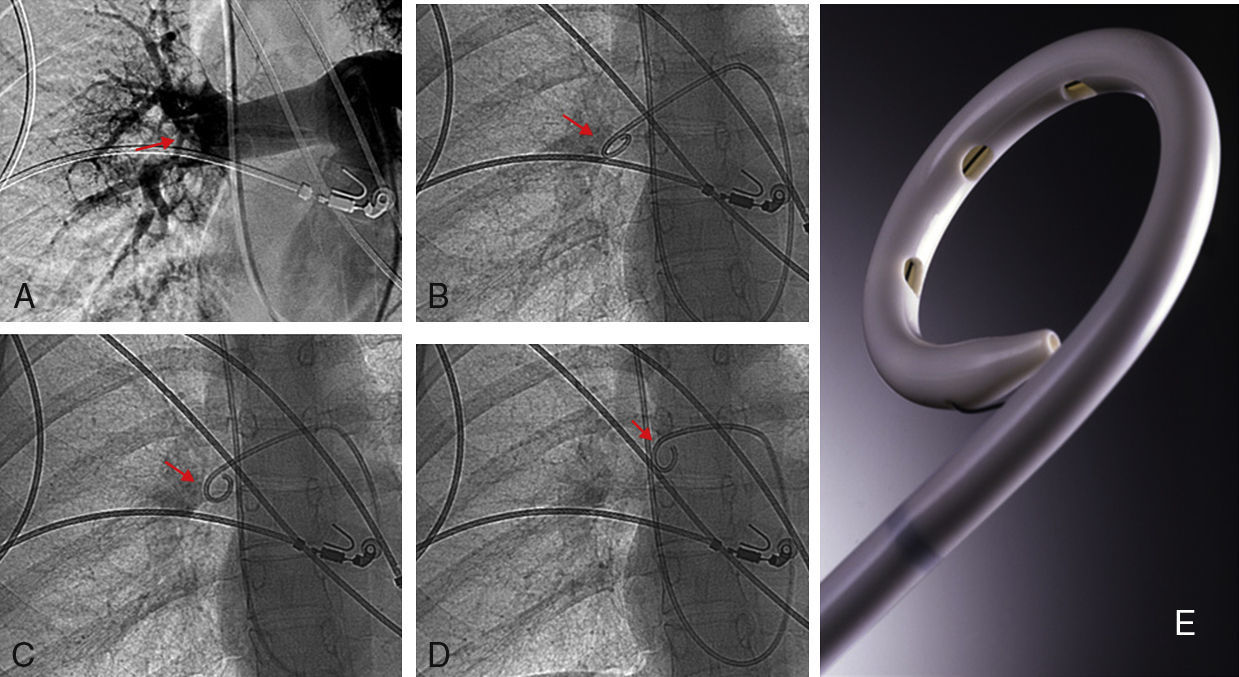
A los pacientes con criterios de inclusión se les administró un bolo de fibrinolíticos in situ entre 200.000-500.000 UI de uroquinasa. A continuación, a 94 pacientes (84,6%) se les realizó fragmentación de las lesiones más extensas mediante movimientos rotatorios con el catéter de angiografía (6 F catéter pig-tail curvado 100cm. Cook Europe ApS, Bjaeverskov, Dennmark). Tan solo en 12 pacientes, además del catéter pig-tail, se utilizó balón de angioplastia de 2cm. de longitud y 8-12mm de diámetro para fragmentar los trombos (Cook Medical, Bjaeverskov, Dennmark). Posteriormente, a través del catéter ubicado en el tramo arterial más obstruido se administró una infusión de uroquinasa (Urokinase Vedim, Vedim Pharma, Barcelona, España) a razón de 100.000 UI/h durante 12 horas. Se realizaron controles de punto de sangrado, presión arterial y estudio de coagulación y un nuevo estudio angiográfico y toma de presiones en arteria pulmonar. Con estos datos se tomó la decisión de finalizar el tratamiento o proseguir con las mismas medidas otras 12 horas más, momento en el que se retiró el catéter intrapulmonar y trombolisis para pasar a anticoagulación con heparina sódica.
Durante la trombolisis, todos los pacientes recibieron tratamiento con heparina sódica con una dosis ajustada a unos valores ratio de ATTP de 2-2,3 para evitar la formación o progresión de nuevos depósitos de fibrina sobre los trombos ya formados y sobre el catéter de angiografía (fig. 2).
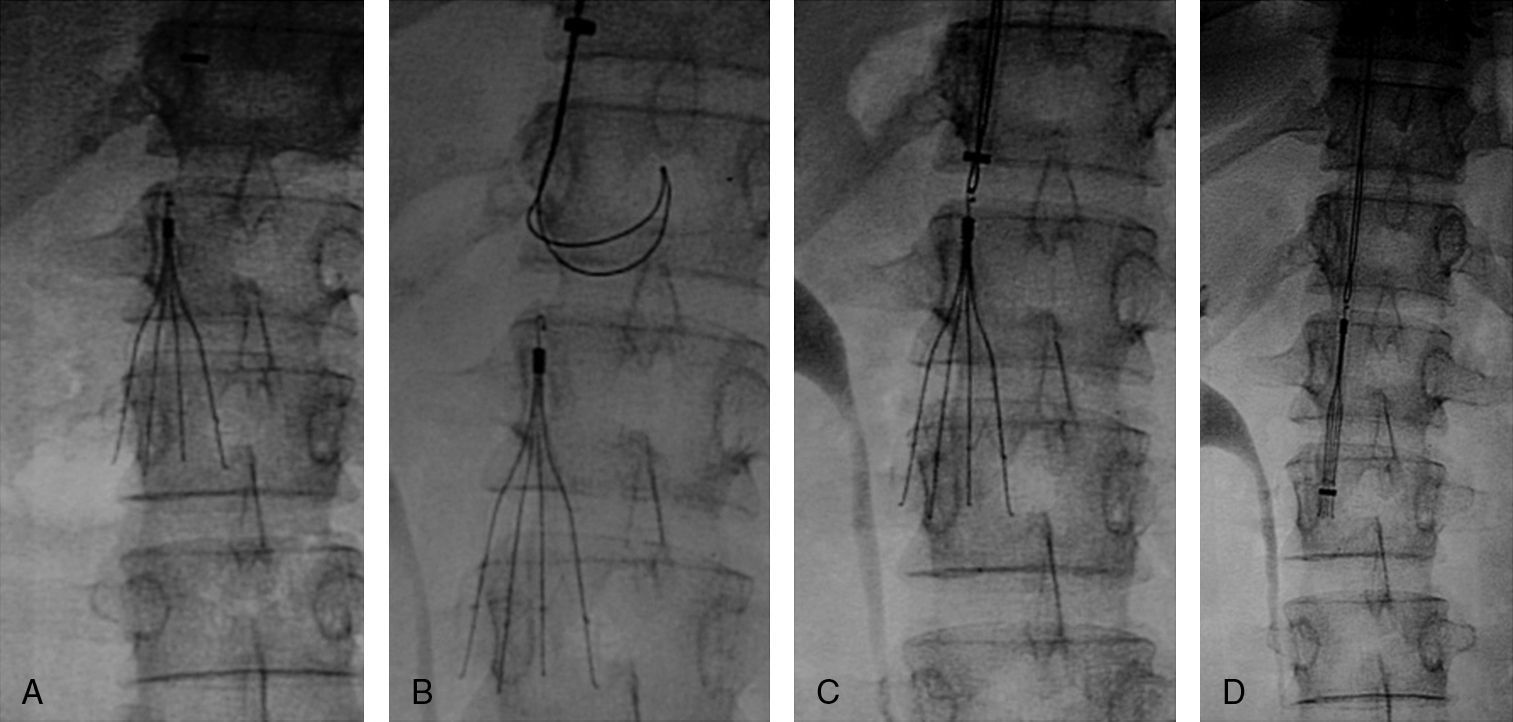
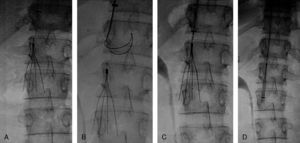
Implantación de filtro de vena cavaCon el objeto de impedir un nuevo embolismo en algunos pacientes con sospecha de trombosis venosa profunda en miembros inferiores, pelvis o vena cava se implantó un filtro opcional con intención de retirarlo entre 1 y 3 meses. Los filtros de vena cava utilizados fueron Gunther Tulip (Cook Europe ApS, Bjaeverskov, Dennmark) y Celect (Cook Europe ApS, Bjaeverskov, Dennmark). Para la implantación de ambos tipos de filtro se utilizó la vía yugular derecha, para lo cual se sustituyó el introductor de 6 F por el introductor de 8 F que viene incluido en el set de introducción de los filtros (Cook Europe ApS, Bjaeverskov, Dennmark). Bajo control fluoroscópico se realizó cavografía con el objeto de descartar trombosis en dicha vena y para localizar la altura de las venas renales. Sobre esta posición se procedió a liberar el filtro con máximo cuidado para evitar angulaciones que posteriormente dificultasen su extracción.
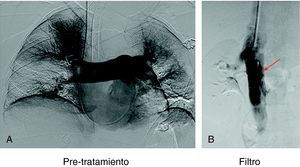
Recuperación del filtro de vena cavaCon intención de recuperar los filtros, transcurridos 30 días para el caso del filtro Gunther Tulip y 90 días para el filtro Celect se realizó angio-TC de vena cava para valorar la permeabilidad de la vena cava y estudiar la posición del garfio de recuperación con respecto a la pared de la vena. En todos los casos se utilizó la vena yugular derecha y para la extracción del filtro se utilizó el set extractor específico de este filtro (Cook Europe ApS, Bjaeverskov, Dennmark). En esta exploración, en todos los casos se realizó angiografía pulmonar y estudio hemodinámico con recogida de presiones (fig. 3).
Seguimiento clínico, hemodinámico y morfológicoEl seguimiento se realizó con valoración clínica a 1, 3, 6 y 12 meses. En los casos de pacientes portadores de filtro se realizó estudio angiográfico y hemodinámico a los 30 o 90 días. En los pacientes con presiones pulmonares altas en el control post-procedimiento y un alto índice de Miller se realizó gammagrafía pulmonar y eco-doppler a los 3 y 6 meses. Los pacientes fueron sometidos durante 6 meses a tratamiento con dicumarínicos.
ResultadosPacientesTodos los pacientes estaban diagnosticados de EPmHI con un índice de Miller de 0,71±0,12 (rango 0,40-0,90) y presión arterial sistólica media de 71,68±10,85 (rango: 40-90). En la exploración ecocardiográfica, el 82% de los pacientes presentaba disfunción ventricular con desviación septal.
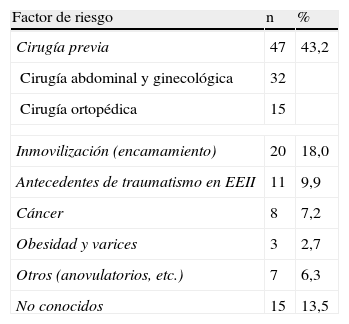
En 15 pacientes (13,5%) de nuestra serie no se llegaron a esclarecer factores de riesgo para enfermedad tromboembólica venosa. El resto (86,4% tenía claros factores de riesgo (tabla 1), siendo el más frecuente la cirugía previa reciente (43,2%).
Frecuencia de los principales factores de riesgo y su porcentaje.
| Factor de riesgo | n | % |
| Cirugía previa | 47 | 43,2 |
| Cirugía abdominal y ginecológica | 32 | |
| Cirugía ortopédica | 15 | |
| Inmovilización (encamamiento) | 20 | 18,0 |
| Antecedentes de traumatismo en EEII | 11 | 9,9 |
| Cáncer | 8 | 7,2 |
| Obesidad y varices | 3 | 2,7 |
| Otros (anovulatorios, etc.) | 7 | 6,3 |
| No conocidos | 15 | 13,5 |
EEII: extremidades inferiores.
Noventa y un pacientes (81,9%) fueron diagnosticados de trombosis venosa profunda (TVP) mediante eco-doppler o TC. De ellos, 32 pacientes (35,1%) estaban diagnosticados previamente al episodio de EPmHI y el resto fue durante o después del diagnóstico de EPmHI. En 20 pacientes no se pudo demostrar por medio de imagen TVP en extremidades inferiores, ni mostraron clínica de trombosis en otra localización.
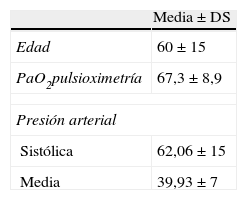
Todos los pacientes presentaban signos y síntomas indicativos de embolismo pulmonar importantes, siendo la clínica de inicio más frecuente la disnea (70,2%). Veintiséis pacientes debutaron con síncope (23,4%). En nuestra serie, con los datos clínicos el valor predictivo del score de Wells fue 6,9±1,9 (rango: 4-10). La saturación media de O2 por pulsioximetría en la sala de radiología intervencionista presentó una media de 67,3±8,9% (rango: 39-82%). El índice de shock fue 0,89±0,6. Dieciocho pacientes presentaban comorbilidades clínicas (8 EPOC, 4 diabetes, 4 enfermedad coronaria y 2 accidente cerebrovascular en sus antecedentes). En el momento del ingreso se estudió el d-dímero con un valor medio de 2.015,73 ng/dl (rango: 230-11.500 ng/dl) y la troponina I con un valor medio de 0,06±0,05ng/dl (rango: 0,01-0,45 ng/dl). Retrospectivamente se analizó la situación previa del paciente al embolismo pulmonar según la clasificación ASA: 73 (65,7%) se encontraban en ASA I, 26 (23,4%) en ASA II y 12 (10,8%) en ASA III (tabla 2).
Principales datos demográficos y signos vitales de los pacientes a su ingreso.
| Media±DS | |
| Edad | 60±15 |
| PaO2pulsioximetría | 67,3±8,9 |
| Presión arterial | |
| Sistólica | 62,06±15 |
| Media | 39,93±7 |
| n (N=111) | % | |
| Sexo | 50,45 | |
| Hombres | 55 | 49,54 |
| Mujeres | 56 | 49,54 |
| Cuadro de inicio: síncope | 41 | 36,9 |
| Necesidad de drogas inotropas | 80 | 72,07 |
| Necesidad de ventilación mecánica | 56 | 50,45 |
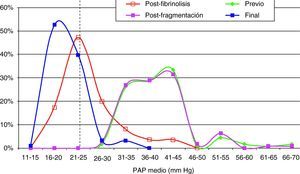
En el momento actual 7 pacientes han fallecido (6,3%), de los que 3 fue en relación con su neoplasia diagnosticada previamente al evento de EPmHI, falleciendo a los 3 meses, 1 y 2 años. Otros 3 pacientes fallecieron dentro de los primeros treinta días en relación con su enfermedad tromboembólica en el transcurso de las primeras veinticuatro horas, 1 semana y 1 mes. La causa de la muerte en los tres casos fue insuficiencia cardíaca derecha, no pudiéndose demostrar reembolismo. Finalmente un paciente falleció como consecuencia de hemorragia masiva intracerebral a las 48 horas de instaurado el tratamiento con fibrinolíticos. Los tres pacientes que fallecieron por fracaso cardíaco, con edades de 65, 73 y 79 años, habían debutado con shock y tenían niveles elevados de troponinas t (0,17, 0,20 y 0,21 ng/ml) y además padecían comorbilidades importantes (2 EPOC, 1 coronariopatía previa). No obstante, no se pudieron demostrar diferencias significativas en la evolución de la presión arterial pulmonar (PAP) entre los pacientes que habían debutado con síncope y los que no, tanto en los resultados posfibrinolisis y en el seguimiento a los 41 días (p > 0,38) (fig. 4).
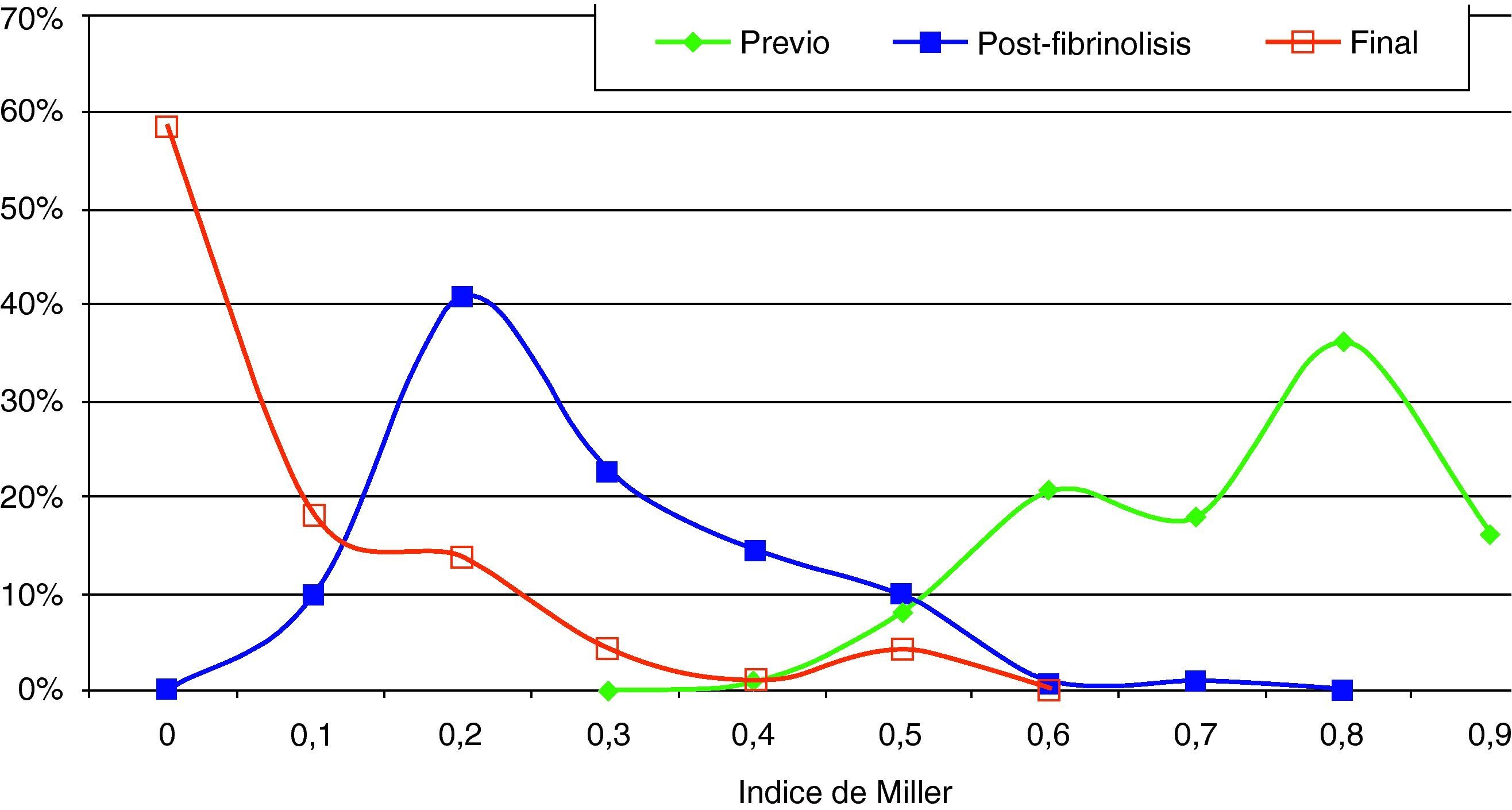
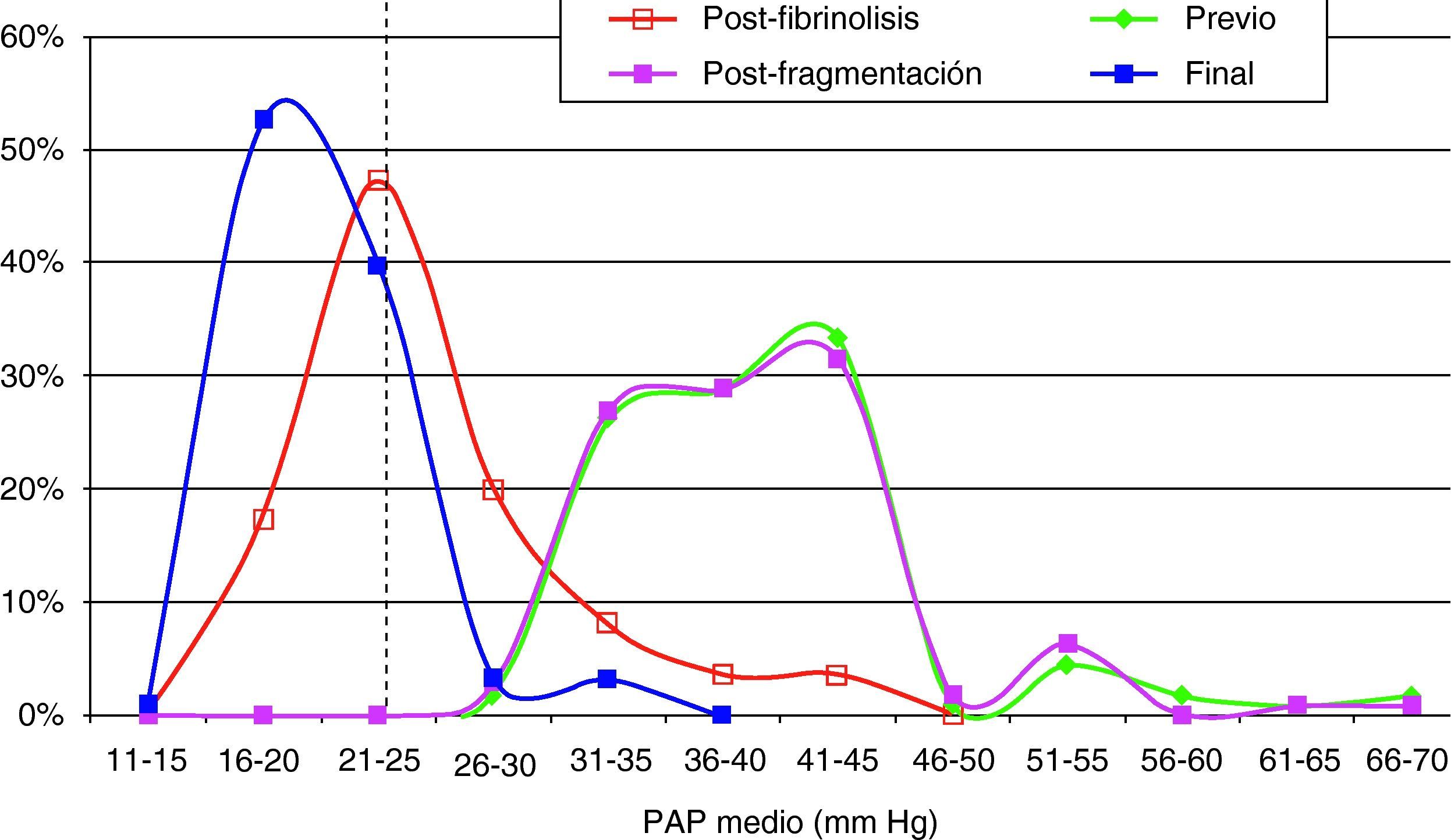
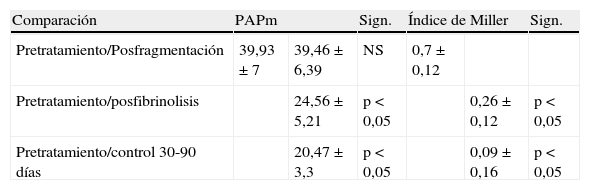
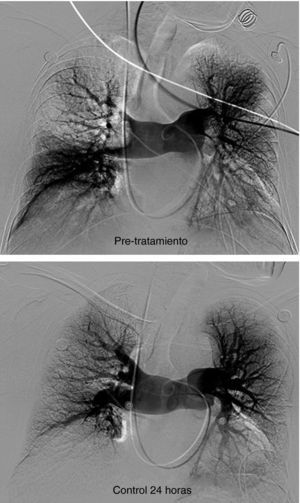
Hallazgos angiográficos y hemodinámicosEn todos los pacientes se pudo realizar el procedimiento (éxito técnico del 100%). La PAP media pretratamiento fue de 39,2±6,9 mmHg (rango 28-69 mmHg) con índice de Miller de 0,7±0,1 (rango 0,5-0,8). La fragmentación con la dosis inicial de fibrinolítico administrada en bolus de 250.000 a 500.000 de uroquinasa no disminuyó la PAP de forma significativa (PAP media 39,24 mmHg) (p>0,05). Sin embargo, sí fue significativa la disminución de la PAP media tras el tratamiento con fibrinolíticos (p<0,05). Con respecto a la presión inicial, se constató un descenso de la presión sistólica y media de 17,81±3,7 mmHg y 14,59±2,5 mmHg, respectivamente. Esta mejoría se produjo en el control de retirada de fibrinolisis a los 2,8±1,2 días del inicio del tratamiento. También el índice de Miller mostró una franca mejoría (media de 2,37±0,11) con disminución significativa de 0,4 (p<0,05).
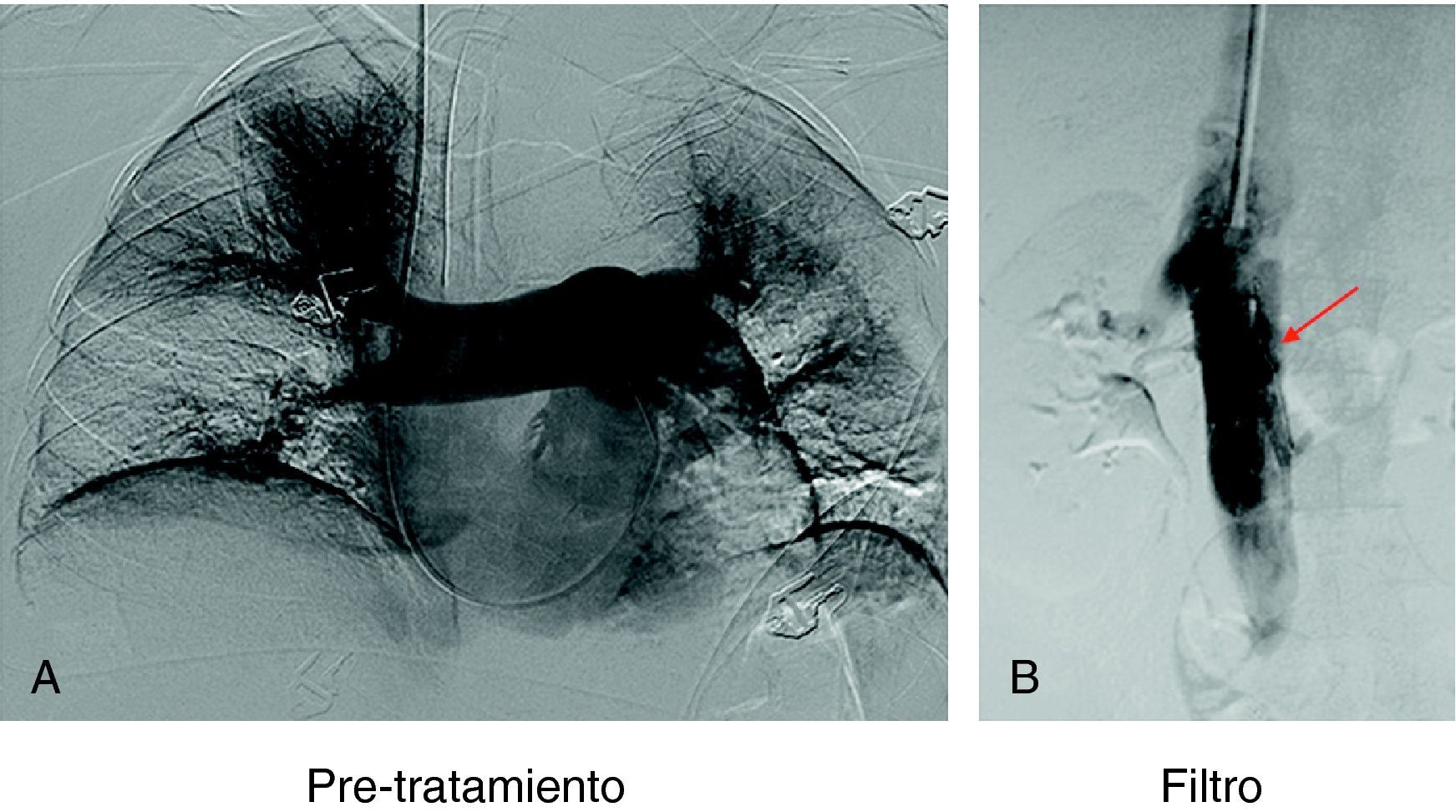
En 94 pacientes se realizó estudio angiográfico y toma de presiones a los 41,5 días post-EPmHI (rango: 29-92 días). El índice de Miller fue de 0,09±0,16 (rango 0-0,5), con una PAP media de 20,47±3,3 mmHg (rango 12-32 mmHg) que supuso una disminución global de 18,73 mmHg (fig. 1 y tabla 3). Angiográficamente no se observaron signos nuevos de reembolismo pulmonar.
Comparación entre los valores de la presión arterial media y el índice de Miller pre y postratamiento.
| Comparación | PAPm | Sign. | Índice de Miller | Sign. | ||
| Pretratamiento/Posfragmentación | 39,93±7 | 39,46±6,39 | NS | 0,7±0,12 | ||
| Pretratamiento/posfibrinolisis | 24,56±5,21 | p<0,05 | 0,26±0,12 | p<0,05 | ||
| Pretratamiento/control 30-90 días | 20,47±3,3 | p<0,05 | 0,09±0,16 | p<0,05 | ||
Datos expresados en media±desviación estándar. NS: no significativo; PAPm: presión arterial pulmonar media; Sign.: significación.
Considerando 25 mmHg como valor normal de la PAP media, el 47,3% de los pacientes tenía por encima de esta cifra su PAP media, mientras que en el control de 30-90 días tan solo 6 pacientes (6,5%) tenían presiones más elevadas de 25 mmHg. En los 6 casos la PAP media fue 29 mmHg (rango: 25-32) (figs. 5–7.)
En todos los casos se administró uroquinasa como fibrinolítico. La dosis media fue de 2,82±0,89 millones de UI de uroquinasa (rango 1-4,5 millones de UI) administrada a razón de 100.000 UI/hora. El tiempo medio de fibrinolisis fue de 21,69±11,92 horas (rango 2-72 horas). La dosis de heparina sódica en bomba de perfusión se realizó según pauta del laboratorio de Hematología ajustando la ratio de ATTP a 2,25±0,37 (rango: 0,70–2,5).
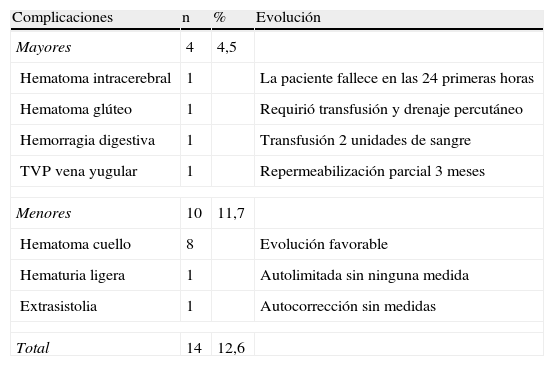
ComplicacionesHubo complicaciones derivadas de la técnica angiográfica y/o de la fibrinolisis en 14 pacientes (12,6%), de las que 4 fueron mayores y 10 menores (tabla 4).
Complicaciones y su evolución.
| Complicaciones | n | % | Evolución |
| Mayores | 4 | 4,5 | |
| Hematoma intracerebral | 1 | La paciente fallece en las 24 primeras horas | |
| Hematoma glúteo | 1 | Requirió transfusión y drenaje percutáneo | |
| Hemorragia digestiva | 1 | Transfusión 2 unidades de sangre | |
| TVP vena yugular | 1 | Repermeabilización parcial 3 meses | |
| Menores | 10 | 11,7 | |
| Hematoma cuello | 8 | Evolución favorable | |
| Hematuria ligera | 1 | Autolimitada sin ninguna medida | |
| Extrasistolia | 1 | Autocorrección sin medidas | |
| Total | 14 | 12,6 | |
En los 98 filtros implantados no se apreciaron complicaciones significativas debidas al procedimiento. El 73,4% de los filtros se implantó por debajo de las venas renales, el 24,4% yuxtarrenal y en dos casos (2,0%) por encima de venas renales. Diecisiete filtros (17,3%) presentaron una ligera inclinación<del 20% en el control inmediato postimplantación. Con control fluoroscópico y previa cavografía se intentó recuperar el filtro en 94 (95,9%) pacientes de 98 portadores, consiguiéndose en 78 (82,9%). En 16 pacientes (17,2%) se intentó la recuperación pero no se consiguió por diferentes causas (en 14 pacientes el filtro estaba inclinado y el garfio estaba incluido en la pared y en 2 pacientes existía trombosis importante de vena cava). De los filtros extraídos, en 34 (45,3%) se apreció tanto en la TC previa como en la cavografía presencia de pequeños trombos atrapados en el filtro que se aspiraron con catéter introductor. No se realizó fibrinolisis protegida ni se produjeron complicaciones de tipo embólico durante el procedimiento.
Seguimiento clínicoEn el seguimiento a largo plazo (12 meses) no se han encontrado signos de reembolismo pulmonar ni de hipertensión arterial pulmonar crónica. Los pacientes con PAP media > a 25 mmHg fueron seguidos mediante eco-doppler cardíaco y gammagrafía. Ninguno mostró cambios significativos. Los pacientes desde el punto de vista clínico permanecieron asintomáticos.
Limitaciones del estudioSe trata de un estudio retrospectivo y hubiera sido más valioso comparar los resultados con una serie de pacientes con similares características y tratamiento mediante fibrinolíticos administrados por vía sistémica. Otras limitaciones, no menos importantes para este estudio, es que se trata de una cohorte de pacientes seleccionados y la especial dedicación y experiencia de nuestro grupo en estas técnicas.
DiscusiónEl embolismo pulmonar masivo es una patología grave que presenta una alta mortalidad debido al fallo ventricular derecho agudo y al shock cardiogénico9. Se acepta que la mortalidad a los tres meses en pacientes con EPmHI y presión arterial < 90 mmHg es del 50%, sobre todo en los primeros días después del EPmHI. Por todo ello es indispensable iniciar rápidamente el tratamiento mediante anticoagulación y fibrinolisis10. Como ya se ha dicho, la octava edición del ACCP publicada en 20081, igual que hicieron ediciones anteriores11, relega el tratamiento fibrinolítico para pacientes con EPmHI o en peligro de shock cardiogénico (grado 1B). También recomienda el uso de fibrinolíticos en pacientes seleccionados de gran riesgo sin hipotensión con EPm y bajo riesgo de sangrado (grado 2B)1. Para el resto de situaciones clínicas la recomendación es la anticoagulación, y si ésta no es posible o está contraindicada, recurrir al filtro de vena cava. El uso de fibrinolíticos en EP submasivo es controvertido12. Periroth y Zamanian13,14, en su análisis de efectividad y coste efectividad comparando fibrinolisis versus anticoagulación, concluyen que no hay datos disponibles para justificar su uso salvo en grupos de pacientes muy seleccionados con disfunción ventricular y alto riesgo de muerte. Por el contrario, Konstantinides et al15, en estudio aleatorizado sobre 256 pacientes con EP submasivo, concluyen que la asociación de fibrinolíticos y heparina puede mejorar los resultados clínicos y puede prevenir el deterioro clínico. En nuestra serie todos los pacientes con EPm (índice de Miller>0,7) eran hemodinámicamente inestables con una PAP sistólica media de 62,7 mmHg que en el 92,1% requirió mantenimiento de drogas vasoactivas. El eco-doppler cardíaco reveló además disfunción ventricular y/o desviación septal en el 82%.
A pesar de que el ACCP1 recomienda (grado 1B) para la administración del fibrinolítico la vía sistémica y en regímenes de infusión cortos, nuestro grupo utilizó la vía intraarterial pulmonar e infundió el fármaco en varias horas, basándonos en nuestra experiencia anterior16,17.
El estudio en que el ACCP ha basado sus recomendaciones en cuanto a la vía de administración y el régimen de infusión es el de Verstraete et al3 publicado en Circulation en 1988. Los autores en dicho estudio multicéntrico compararon en 34 pacientes el uso de la infusión sistémica de 50mg de rtPA con la misma dosis en infusión intraarterial pulmonar concluyendo que no había diferencias significativas entre ambas vías de administración. No obstante, en este estudio hay que significar notables diferencias técnicas: 1) llama la atención que 8 centros no fueran capaces de reclutar nada más que 34 pacientes (19 intraarterial y 15 intravenoso); 2) en la infusión intraarterial el catéter se encontraba en la arteria pulmonar principal y no en contacto con el trombo, y 3) no realizaron ningún tipo de fragmentación. Schmitz-Rode et al18 han demostrado en un estudio in vitro cómo la perfusión de un fibrinolítico a través de un catéter en la proximidad de un trombo no supone ninguna ventaja a la perfusión sistémica, mientras que la infusión intratrombo produciría los efectos adecuados de fragmentación. Tapson et al19 en 1994 habían demostrado en un modelo animal que la trombolisis local producía una más eficaz y rápida lisis del trombo ya que se mejoraba la exposición del fármaco a la superficie del mismo. Fava et al20 trataron a 17 pacientes con EPm mediante trombolisis farmacológica asociada a fragmentación mecánica, obteniendo una mejoría en las primeras horas del 88%. Estos autores establecen que el principal objetivo terapéutico en el EPm debe ser la restauración de la circulación pulmonar y afirman que la fragmentación y el uso de fibrinolíticos lo consiguen de forma rápida y eficaz en un importante porcentaje de pacientes. La ACCP1 desaconseja la fragmentación (grado C) salvo en casos especiales realizada por grupos expertos. Incluso Nakazawa et al21 reconocen que la fragmentación cuando produce embolización distal incrementa la presión pulmonar. Estos datos no son concordantes con lo observado por diversos autores que preconizan la fragmentación previa a la fibrinolisis y no han observado incremento de la presión22,23. En nuestra serie la fragmentación disminuyó la presión arterial pulmonar media aunque esta disminución no fue significativa (PAPm previa 39,97±6,9 mmHg vs 39,46±6,3 mmHg posfragmentación (p>1.530). Estos datos han sido corroborados por otros autores18,20. Greenberg et al24 en su estudio en un modelo in vitro donde comparan fragmentación vs fibrinolisis concluyen que la fragmentación estabiliza más rápidamente el flujo y produce pequeños trombos que se reducen por los agentes fibrinolíticos.
Estos resultados satisfactorios también fueron observados en nuestra serie publicada en 200216, donde se trataron 59 pacientes mediante trombolisis y fragmentación con catéter consiguiendo mejoría clínica del 94% y una disminución de la presión arterial pulmonar media de > 20 mmHg. Nosotros sugeríamos que un gran beneficio de la fragmentación del trombo es que ella producía mayor superficie de contacto y de acción de la uroquinasa.
Con respecto a la profilaxis con filtro de vena cava inferior en EPmHI, la ACCP se posiciona en contra de su uso rutinario (grado 1A) reservándolo exclusivamente para aquellos casos en que no es posible la anticoagulación (grado 1C). En el documento no se hace referencia al uso de filtros recuperables y este dato, en nuestra opinión, es substancial. Nosotros hipotetizamos que en una situación grave con hipertensión arterial pulmonar, fracaso cardíaco derecho, un trombo más en el lecho vascular pulmonar podría ser determinante y un filtro que se pueda retirar de forma sencilla y con pocas complicaciones, lo podría evitar. En una serie propia de 32 pacientes con EP y portadores de filtro de vena cava opcional se pudo retirar sin complicaciones en 31 (98%) al mes de su implantación25. Otros muchos autores han utilizado filtro de vena cava inferior en EPm con similares propósitos y buenos resultados9,26–28. Por otra parte es reseñable en nuestra serie la alta incidencia de TVP, que alcanza el 81,9% de todos los pacientes con EPmHI. Otros autores29, recientemente, en una revisión sobre 707 pacientes diagnosticados de EP, encontraron que el 51,2% tenía TVP concomitante. En este grupo de pacientes hallaron una mayor incidencia de muertes, lo que les lleva a concluir que la TVP concomitante a EP sería un factor predictor de muerte en los tres primeros meses. La implantación de un filtro de VCI podría prevenir la reembolización y mejorar la tasa de muertes en este grupo de pacientes.
En definitiva, se puede admitir que aunque nuestros resultados son buenos en el tratamiento del EPmHI, se apartan totalmente de la doctrina/recomendaciones dictadas por la ACCP. Aceptamos la indicación de trombolisis en EPmHI, pero no coincidimos en las recomendaciones de la vía y régimen de administración y tampoco en el uso de filtro de vena cava.
Como nosotros, algunos otros muchos se han debido sentir heterodoxos sin el soporte de un estudio multicéntrico o metaanálisis que avalase nuestro trabajo6,20–22,30.
En 2009 Kuo et al7, del Medical Center en la Universidad de Stanford (USA), publican un metaanálisis sobre 35 estudios en 594 pacientes con EPm. En dicho estudio se analizan el éxito clínico y las complicaciones del tratamiento fibrinolítico y fragmentación con catéter. En base a los datos disponibles en la literatura, los autores concluyen que la terapia fibrinolítica local con o sin fragmentación es segura y eficaz y que en los centros con equipo entrenado debería ser la primera línea de tratamiento para el EPmHI.
Nuestros resultados sugieren que la fibrinolisis local y la fragmentación mecánica de pacientes hemodinámicamente inestables con EP es un método de tratamiento eficaz y seguro en un centro con experiencia en estas técnicas. Estudios futuros adecuadamente diseñados deberían evaluar sus ventajas respecto a la fibrinolisis sistémica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los Drs. Mirian Sánchez y Jordi Bosch por su cooperación en la recogida de datos clínicos.