Introducción
La hemoptisis masiva, también denominada amenazante, constituye una situación crítica y grave que requiere un estudio y tratamiento urgentes de los pacientes. A pesar de los avances terapéuticos, la hemoptisis masiva, life threatening, término inglés que mejor define esta situación, sigue constituyendo una situación de alto riesgo. De acuerdo con datos publicados, el 28% de los neumólogos presencian algún caso de muerte por hemoptisis masiva en un período de tiempo de un año1. El tratamiento médico conservador (300-600 ml/24 h) supone una mortalidad del 50 al 100%2, siendo la asfixia la causa frecuente de muerte, no la hemorragia3. La cirugía presenta unas tasas de mortalidad entre el 7,1 y el 18,2%4, cifras que se elevan hasta un 40% cuando se realiza de manera urgente4.
Desde que en 1973 Remy et al5 describieron por vez primera la técnica, la embolización de las arterias bronquiales (EAB) se ha convertido en la más importante opción terapéutica para el tratamiento de la hemoptisis masiva y su recurrencia. Diversas series publicadas demuestran su eficacia, seguridad y utilidad como tratamiento de la hemoptisis masiva6-14. No obstante, la cirugía desempeña un papel relevante en el tratamiento de hemoptisis masivas ocasionadas por ciertas enfermedades como la hidatidosis pulmonar, el adenoma bronquial y el aspergiloma resistente a otros tratamientos15. En estos casos, la EAB previa con carácter urgente facilita y mejora los resultados de la intervención quirúrgica, ya que permite que ésta se realice de forma programada y no de manera urgente4. La cirugía constituye también el tratamiento de elección cuando fracasa repetidamente la EAB o no es capaz de controlar una hemorragia masiva con peligro de muerte para el paciente16. Actualmente, cuando la EAB falla, se ha propuesto el uso de preparados trombínicos instilados endoscópicamente, que ofrece una alta tasa de éxitos17.
Aquí presentamos nuestra experiencia en el tratamiento endovascular de la hemoptisis masiva medicante embolización arterial y su seguimiento a lo largo de 15 años.
Pacientes y métodos
Se trata de un estudio descriptivo y retrospectivo realizado en un solo centro hospitalario, referencia de una población de más de 500.000 habitantes. Desde abril de 1989 hasta septiembre de 2004 se remitió a la Unidad de Cirugía Mínimamente Invasiva Guiada por Imagen (UCMI) de nuestro hospital a 401 pacientes por hemoptisis para diagnóstico y posible tratamiento endovascular. De ellos, 267 (66,5%) eran varones y 134 (33,4%) mujeres, con una edad media de 53,8 años (rango: 12-84 años). Cumplían criterios de hemoptisis masiva 314. De éstos, 287 se trataron mediante embolización. Los criterios de inclusión para este estudio fueron: aceptación y firma del consentimiento informado, expectoración de más de 300 ml de sangre en 24 h o más de 100 ml/día durante al menos 3 días consecutivos independientemente de la gravedad clínica del paciente. No se contemplaron contraindicaciones en el estudio. Se remitió a los pacientes a la UCMI de nuestro centro desde los diferentes servicios clínicos y unidades de cuidados intensivos, tanto de nuestro hospital como de otros de los que somos referencia.
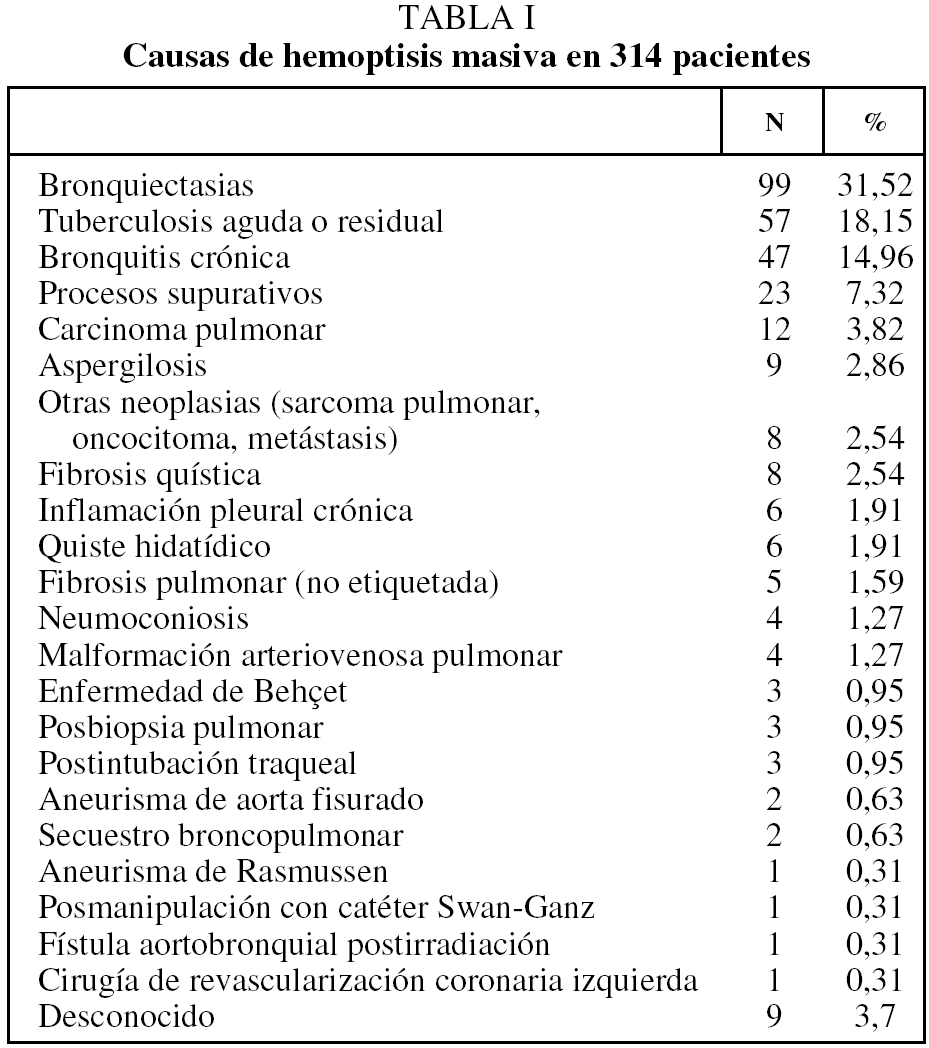
Antes de la realización del tratamiento endovascular se practicaron a todos los pacientes bioquímica general, estudio de coagulación y radiografía de tórax. A 78 pacientes se les efectuó una tomografía axial computarizada (TAC) de tórax antes del procedimiento y se realizó fibrobroncoscopia con fines diagnósticos a 252 (80,2%). Los hallazgos se utilizaron en la orientación fundamentalmente del diagnóstico etiológico y posible localización de la hemorragia La principal causa de hemoptisis observada fueron las bronquiectasias (n = 99; 31,5%), seguidas de tuberculosis aguda o restos cicatrizales (n = 57; 18,1%) y bronquitis crónica (n = 47; 14,9%). El resto de las causas pueden observarse en la tabla I. El diagnóstico y el tratamiento endovascular se realizaron en todos los casos en la sala de intervención de nuestro hospital con las condiciones de asepsia, medidas de monitorización y de soporte vital adecuadas. Requirieron intubación orotraqueal durante la intervención endovascular 37 pacientes (11,7%) y 114 (36,3%) recibieron transfusión de concentrados o plasma fresco antes, durante o después de la intervención.
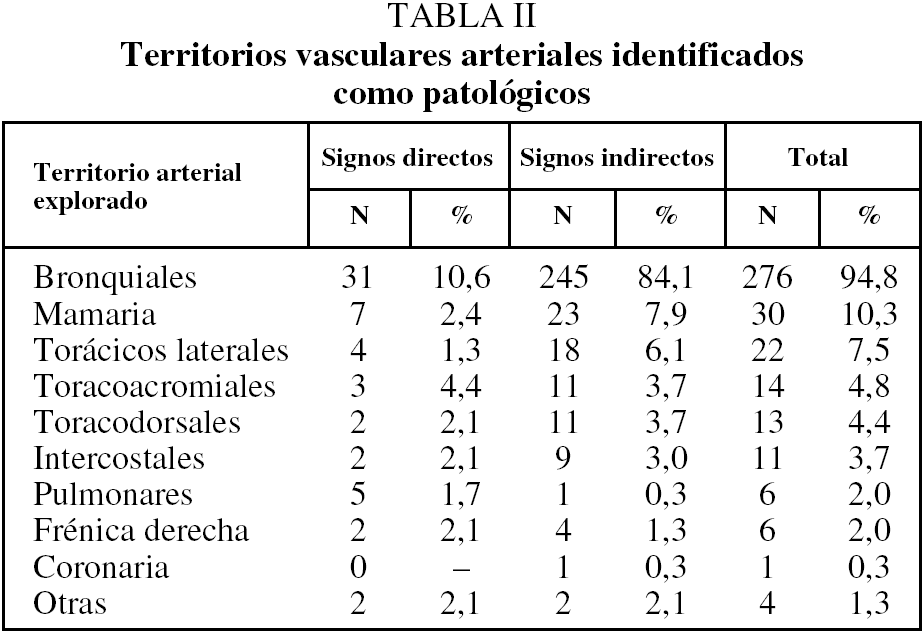
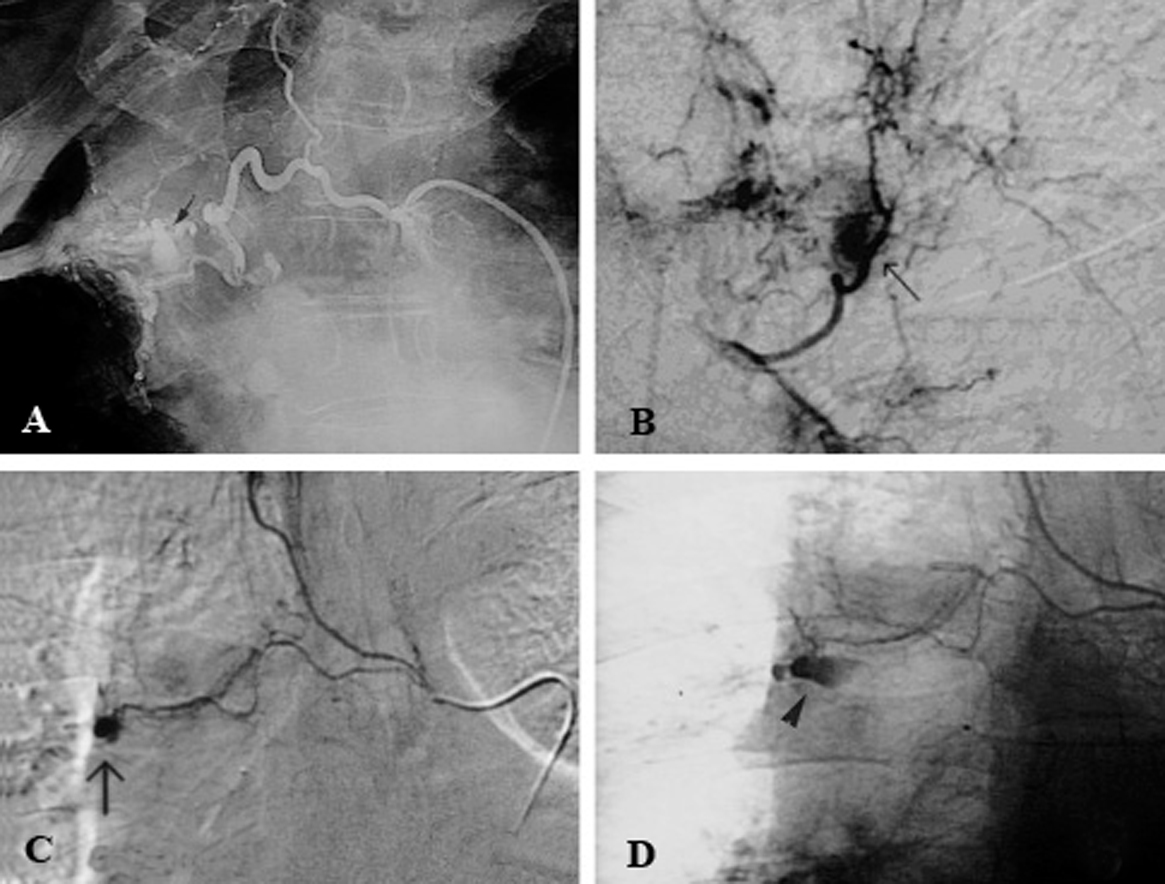
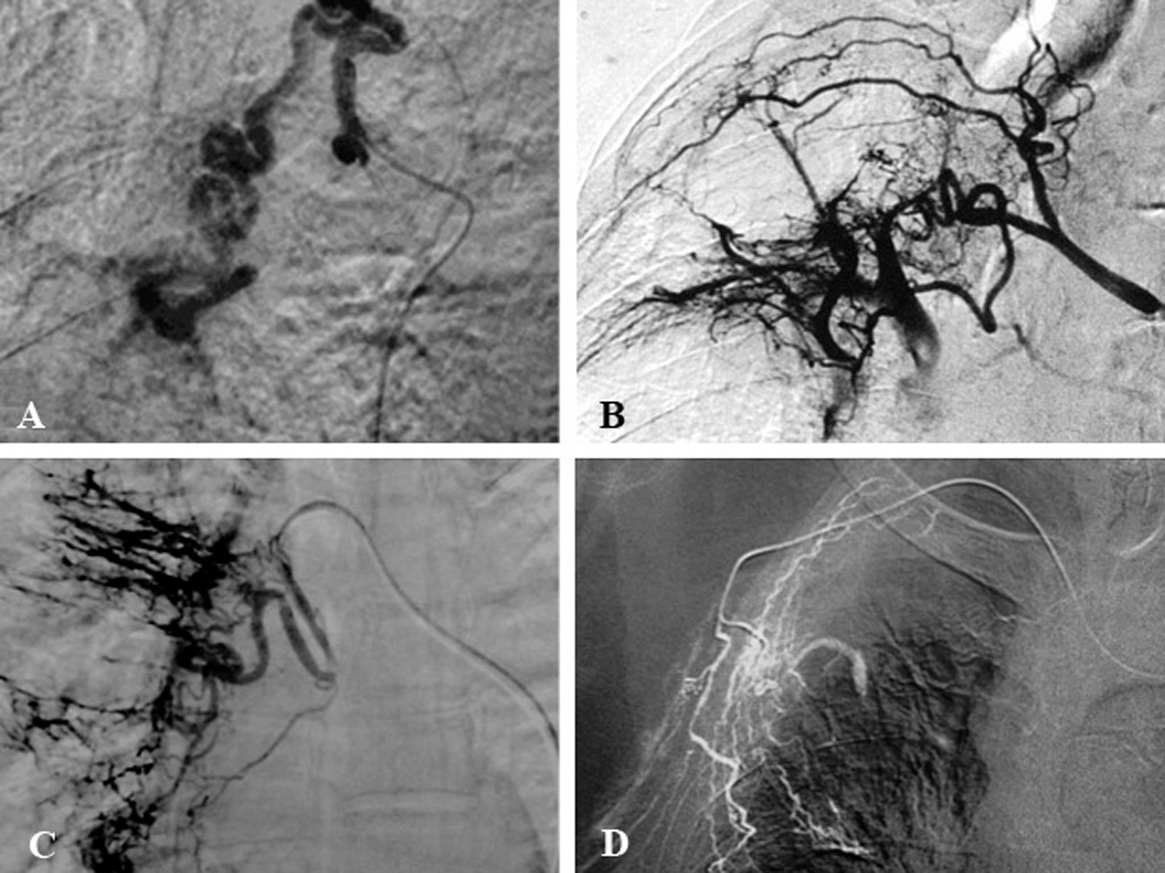
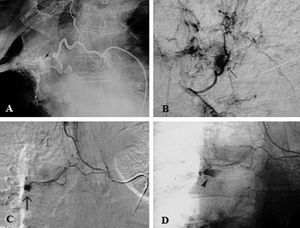
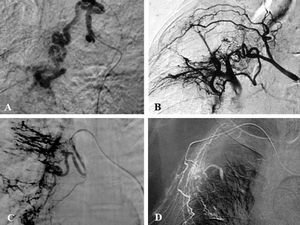
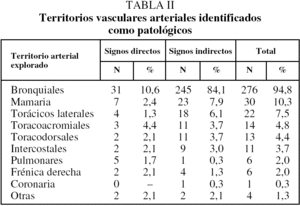
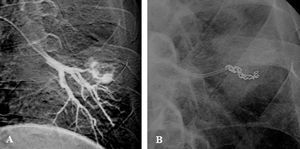
La angiografía diagnóstica se realizó por vía arterial femoral preferentemente derecha. En todos los casos se obtuvo un angiograma de aorta torácica panorámico con catéter pig-tail situado en el cayado aórtico. Dicho aortograma mostró directamente vasos patológicos en 79 casos (25,1%). De acuerdo con el protocolo de la UCMI, se exploraron de forma selectiva las arterias bronquiales de ambos hemitórax, las arterias intercostales (sobre todo en áreas patológicas), las arterias mamarias internas y las arterias torácicas laterales. Cuando dicho examen resultó negativo, se realizó angiografía pulmonar. Se consideró arteria patológica cuando se observaron signos directos (extravasación y aneurisma) (fig. 1) o indirectos (irregularidad, arrosariamiento, aumento del calibre, ovillos vasculares, fístula arterioarterial o arteriovenosa) (fig. 2). En todos los casos se buscó e intentó identificar las arterias medulares.
Fig. 1. Patrones angiográficos. Signos directos. A: aneurisma de la arteria pulmonar en paciente con tuberculosis; aneurisma de Rasmussen (flecha). B: extravasación clara en paciente con bronquitis crónica y hemoptisis de 300 ml en 24 h (flecha). C: extravasación puntual en arteria bronquial derecha (flecha). D: mayor hemorragia (mismo paciente).
Fig. 2. Patrones angiográficos. Signos indirectos. A: angiografía selectiva de arteria bronquial de gran calibre y tortuosa en paciente con bronquiectasias. B: angiografía selectiva de la arteria intercostobronquial derecha. Se observa shunt entre la arteria bronquial y la pulmonar. C: arteria bronquial derecha selectiva que muestra vasos abigarrados y pequeños ovillos vasculares. D: arteria torácica lateral con ramas hipertróficas que penetran en el parénquima pulmonar.
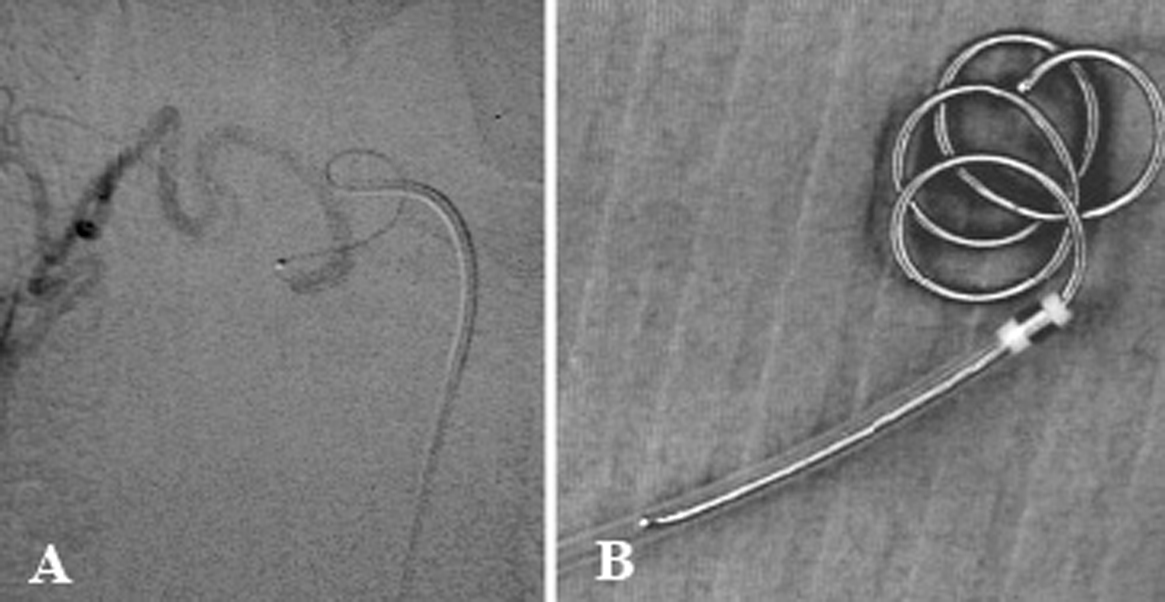
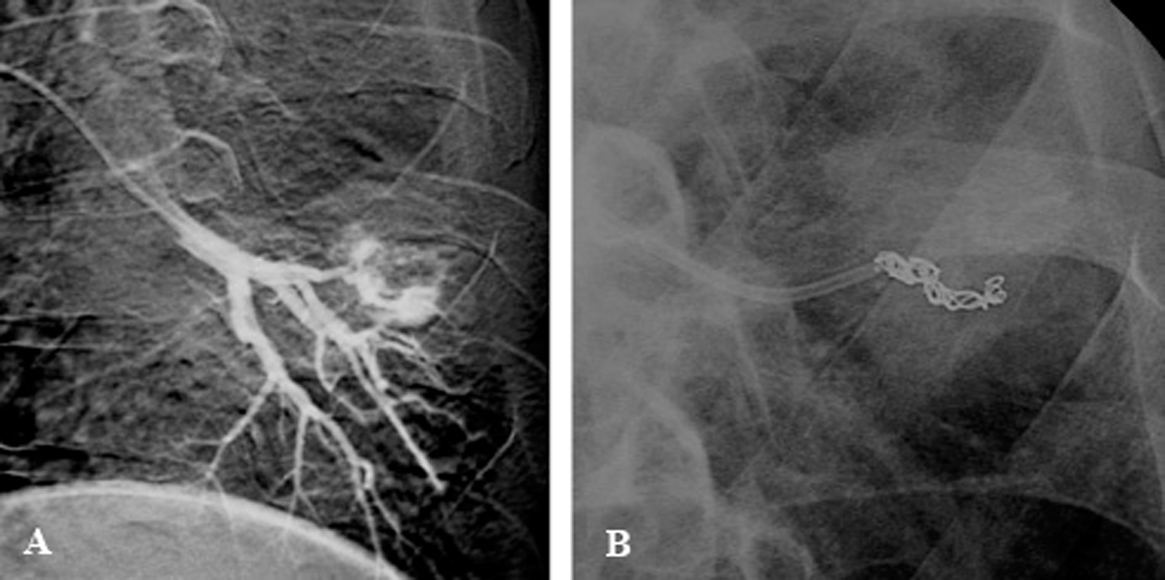
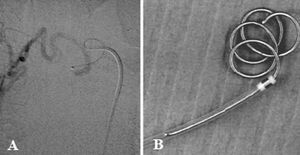
Una vez localizada la arteria patológica, se canalizó de forma segura mediante guía para proceder a su oclusión mediante diversos agentes de embolización. Las configuraciones del catéter de 5 Frech utilizado más habituales fueron: Cobra I y II, Simon I, Michaelson y Hock. Cuando la situación del catéter fue inestable o el calibre del vaso fue demasiado pequeño, con el fin de evitar el espasmo, la rotura arterial y el reflujo del material de oclusión, se utilizó coaxialmente un microcatéter recto de 2-3 Frech de diámetro (fig. 3).
Fig. 3. Supraselectivización con microcatéter. A: angiografía selectiva que muestra selectivización coaxial con microcatéter de 2 mm sobre un catéter de 5 Frech. B: dibujo que muestra detalladamente el microcatéter y el catéter tutor de mayor calibre.
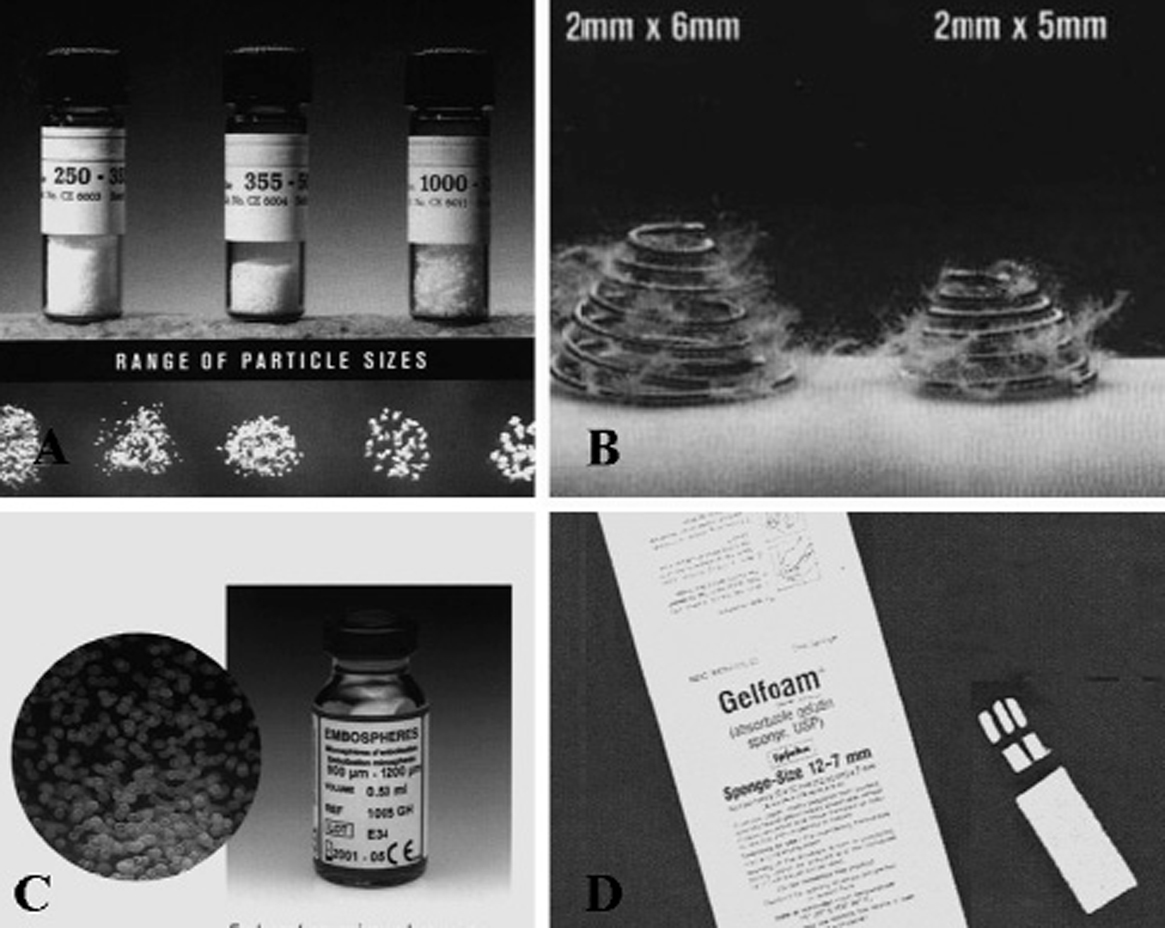
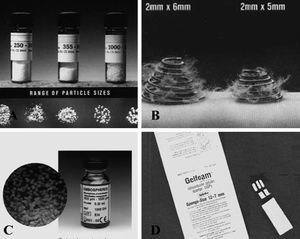
Los agentes de embolización empleados fueron siempre permanentes, bien derivados del alcohol polivinilo, partículas de alcohol polivinilo con un tamaño entre 250 y 500 µ de diámetro o microesferas de gelatina trisacrílica (Embospheres: BioSphere Medical Inc, Rockland, MA, EE.UU.) de diámetros similares (fig. 4). Siempre que fue posible y seguro, se cerró la arteria patológica proximalmente con microcoils de platino adaptados al calibre del vaso. Se ocluyó la arteria patológica en su extremo proximal en 180 de 287 pacientes (62,7%). El criterio de embolización utilizado fue cerrar todas las arterias patológicas observadas en la exploración angiográfica.
Fig. 4. Diversos tipos de agentes embolizantes. A: partículas de alcohol polivinilo de diferentes micras. B: coils de tamaño diferente. C: microesferas. D: gelatina de espongostán.
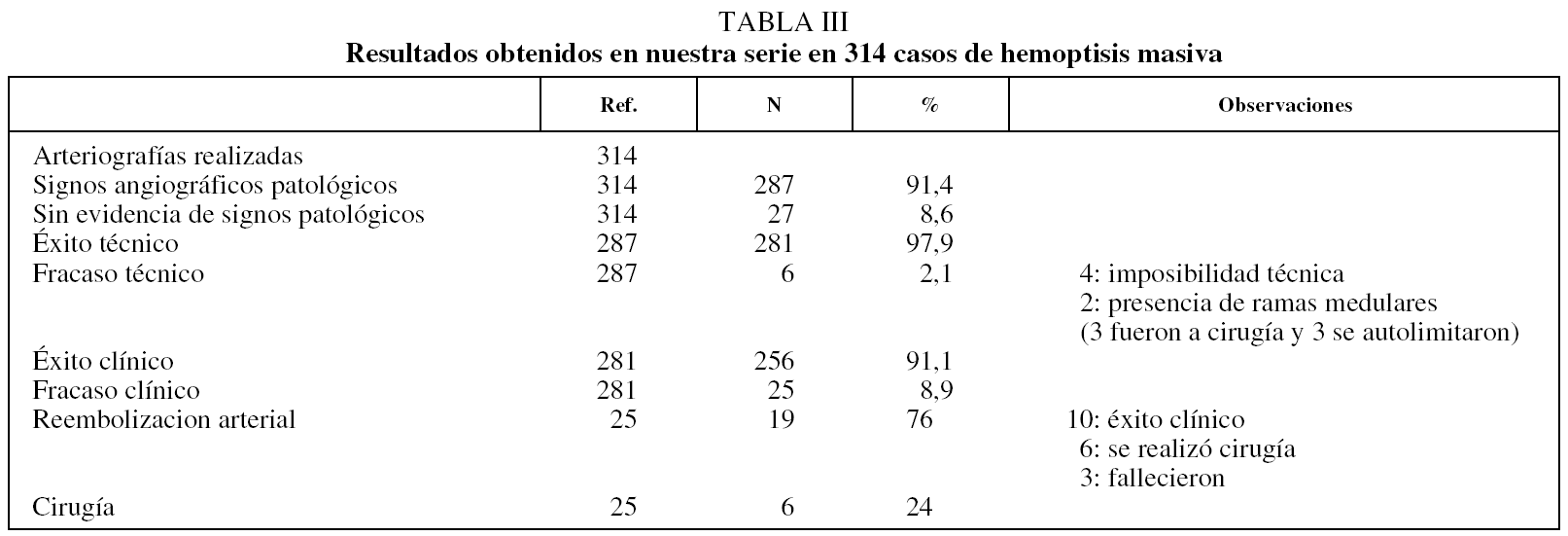
Se definió como éxito técnico el cierre total y sin complicaciones de la arteria o arterias patológicas implicadas en la hemorragia; éxito clínico, el cese de la hemoptisis durante al menos 30 días tras la intervención; fracaso técnico, la imposibilidad de cateterizar y embolizar con seguridad una arteria patológica; fracaso clínico, la persistencia de hemoptisis a pesar de la oclusión de la supuesta arteria patológica, y recidiva, la aparición de una nueva hemorragia de 50 ml/24 h o más, o bien de un volumen inferior a esta cifra durante varios días consecutivos, transcurridos 30 días de la intervención.
Tras la intervención se remitió a los pacientes a su sala clínica de origen y se les citó en la consulta de UCMI para su seguimiento, que se realizó al mes, 3, 6, 12 meses y posteriormente de forma anual. El seguimiento consistió en evaluación clínica y radiografía de tórax a los 6 meses y al año. Cuando fue necesario para completar el estudio, se practicó fibrobroncoscopia. Se realizó TAC en los casos en que no se disponía antes del tratamiento.
Resultados
La radiografía de tórax realizada en el momento del ingreso se catalogó como normal o con hallazgos no específicos en 63 pacientes (20,0%), en 14 de los cuales la TAC evidenció alteraciones. En el resto la radiografía de tórax o la TAC mostraron hallazgos patológicos relacionados con la causa de la hemoptisis. Se realizó fibrobroncoscopia previa a la angiografía en 252 pacientes (80,2%) y, a pesar de observar la hemorragia difusa bronquial, fue orientativa para su localización en 143 (56,7%).
La angiografía bronquial reveló alteraciones arteriales que justificaban la hemoptisis en 287 pacientes (91,4%). De éstos, 58 (20,2%) presentaron signos de hemorragia directa (extravasación y/o aneurisma). En el resto sólo pudieron apreciarse signos indirectos más o menos intensos. En la
II se indican las principales arterias patológicas observadas.
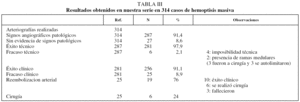
Se pudieron embolizar las arterias patológicas de forma satisfactoria en 281 pacientes (97,9%). De los 6 casos restantes, en 4, a pesar de diversos intentos, no se pudo cateterizar con éxito la arteria patológica (2 arterias bronquiales izquierdas y 2 troncos intercostobronquiales derechos). En 2 pacientes, de la arteria bronquial también surgía una arteria medular, por lo que se desestimó la embolización. En 4 casos la manipulación arterial con el catéter produjo espasmo arterial o trombosis, lo que condicionó la autolimitación de la hemorragia. En los otros 2 pacientes se mantuvo una actitud expectante con tratamiento médico. A 3 pacientes diagnosticados de bronquiectasias (2 con arteria medular implicada y en un caso con fracaso técnico), se les realizó cirugía. Los 3 pacientes restantes (2 diagnosticados de bronquitis crónica y uno de bronquiectasias) presentaron autolimitación de la hemoptisis. Dos ellos, en controles realizados con posterioridad, presentaron esputos hemoptoicos que no requirieron tratamiento invasivo.
El tratamiento endovascular tuvo éxito clínico inmediato en 256 pacientes (91,10%), al conseguirse el control de la hemorragia masiva. En 25 casos (8,8%) la embolización arterial no tuvo éxito clínico y fracasó. De ellos, en 19 (76%) se requirió durante el mismo ingreso otra embolización, que fue eficaz en 10 (52,6%). Fallecieron por hemoptisis masiva 3 pacientes, a pesar de las medidas terapéuticas médicas (uno con aspergilosis y 2 con cavernas tuberculosas). En los 6 restantes se realizó cirugía. Otros 6 pacientes recibieron directamente tratamiento quirúrgico (tabla III).
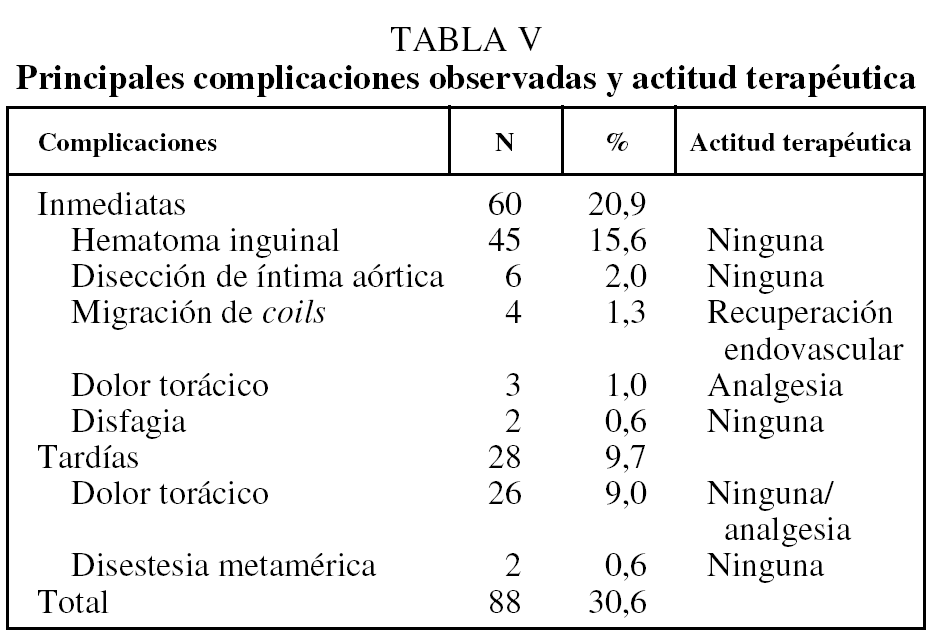
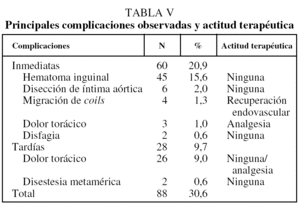
El seguimiento medio, en 201 pacientes (71,5%), fue de 2.372,5 días (rango: 61-5.475 días). Se perdieron para el estudio 80 (28,4%) por diversas causas y en distintos momentos del seguimiento (tabla IV). El 22,3% (n = 45) presentó hemoptisis recidivante en una o más ocasiones, pero tan sólo 21 pacientes (10,4%) requirieron una nueva embolización. Una vez controlada la hemoptisis, se tra-tó quirúrgicamente de la enfermedad de base de forma programada a 8 pacientes. No se constató ningún caso de recidiva con hemoptisis masiva. En 88 pacientes (28,0%) se observaron complicaciones menores que no requirieron otras medidas terapéuticas (fig. 5 y tabla V). No se observaron complicaciones relacionadas con la embolización de la arteria medular. La mortalidad peri-operatoria a los 30 días fue del 1,7% (3 pacientes como consecuencia de la falta de control de la hemoptisis, uno como complicación infecciosa de la toracotomía y otro de causa desconocida).
Fig. 5. Arteriografía pulmonar. A: rotura iatrogénica de vaso arterial pulmonar con producción de hematoma pulmonar. B: resultado tras la embolización con coils.
Discusión
No existe consenso en la cuantía de sangre que definiría el concepto de "masivo". La hemoptisis masiva se ha definido como la expectoración de una cantidad de sangre de entre 100 y 1.000 ml en un período de 24 h, si bien el criterio más extendido es la producción de entre 300 y 600 ml de sangre al día2-4,15. No obstante, la definición también depende de la capacidad de mantener la vía aérea permeable, de modo que pueden considerarse amenazadoras situaciones con una cantidad de sangre menor en pacientes con escasa reserva pulmonar. Una definición más funcional de hemoptisis masiva sería la siguiente: cantidad de sangre suficiente para ocasionar una situación que amenaza la vida del paciente y en la que sería necesario realizar un tratamiento intervencionista15,18. En nuestra serie, si bien todos los pacientes relataban una hemorragia importante superior a 300 ml en 24 h o mayor de 100 ml durante 3 días consecutivos, no todos tenían una situación inestable hemodinámica y respiratoria que requiriese intubación y cuidados en unidad de intensivos19.
Si bien las causas de la hemoptisis pueden ser múltiples, las bronquiectasias, la tuberculosis y sus secuelas junto con el cáncer, las enfermedades inflamatorias crónicas y la fibrosis quística constituyen el principal origen de la hemoptisis masiva2,3,15,20.
El origen de la hemoptisis masiva suele localizarse en la circulación bronquial (un 90% de los casos). En el 5% se sitúa en la circulación pulmonar21 y en el otro 5% restante en la aorta (fístulas aortobronquiales, rotura de aneurismas aórticos) o en la circulación arterial sistémica (ramas que irrigan el territorio pulmonar)22-24. En la serie presente las arterias bronquiales fueron el origen del 94% de la hemoptisis, mientras que las arterias pulmonares estuvieron involucradas en tan sólo el 2%. El resto fueron hemorragias sistémicas de diverso origen.
En la hemoptisis masiva los estudios diagnósticos deben dirigirse al diagnóstico etiológico y de localización de la arteria hemorrágica, y entre ellos figuran la radiografía de tórax, la fibrobroncoscopia y la TAC torácica15,18. A pesar de que la radiografía de tórax es un estudio básico y siempre disponible, en pocas ocasiones consigue precisar con certeza la ubicación de la hemoptisis18. En la serie presente, el 80% de las realizadas fueron patológicas y ayudaron a orientar diagnóstico y/o localización de la hemorragia.
Diversas series publicadas indican que la fibrobroncoscopia puede ayudar a localizar el lugar de la hemorragia (el lado patológico) entre un 49 y un 92,9% de los casos18,20. En nuestra experiencia, la broncoscopia fue orientativa y sirvió para la localización angiográfica del origen de la hemorragia en el 57% de los pacientes a quienes se realizó. Nuestro hospital no dispone de broncoscopia fuera del horario laboral, por lo que tan sólo se efectuó previa a la angiografía en el 80% de los pacientes.
El conocimiento anatómico de la vascularización arterial bronquial es crucial para su localización y estudio. Las arterias bronquiales presentan diversas variedades anatómicas, tanto en su origen como en sus diferentes ramas y en su trayecto25. Es imprescindible tratar de identificar y evitar la inyección de contraste en las arterias radiculares dorsales y ventrales, fundamentalmente la arteria de Adamkiewicz, o arteria radicular anterior mayor. En la tabla II se pueden observar las arterias tanto bronquiales como no bronquiales identificadas en nuestra experiencia.
Los signos angiográficos de afectación arterial bronquial más fidedignos y específicos son los directos: aneurismas y extravasación; sin embargo, éstos son los más infrecuentes20. La extravasación de medio de contraste se observa tan sólo entre el 3,6 y el 10,7% de los casos12,16. En nuestra serie se consideraron signos directos la presencia de aneurismas, microaneurismas y extravasación de contraste, y se observaron en el 20,2% de los pacientes.
Existen diversos agentes de embolización, que se dividen en reabsorbibles y no reabsorbibles. Los resultados a medio y largo plazo pueden depender del tipo de agente de embolización, así como de la técnica utilizada y, por supuesto, de la etiología. No existe, en nuestro conocimiento, un estudio comparativo entre los diversos agentes de embolización y la técnica utilizada. En la actualidad se preconiza la embolización distal con partículas no reabsorbibles (alcohol polivinilo o microesferas de gelatina trisacrílica) y se desaconseja la embolización proximal con coils o espirales metálicas aduciendo la imposibilidad de canalizar la arteria si vuelve a presentar una hemorragia20,26. Nosotros realizamos de forma sistemática, siempre que es posible, el cierre distal con partículas de alcohol polivinilo de 250 a 500 µ y el cierre proximal con microcoils, pues entendemos que si la oclusión es total y minuciosa ese vaso tiene pocas o ninguna posibilidad de sangrar de nuevo. La recidiva se producirá por reperfusión y hemorragia de otros vasos. En nuestra serie, en ningún caso hubo dificultades para estudiar y tratar a los pacientes con recidiva por tener ocluida la arteria proximalmente. En la hemorragia estaban implicadas otras arterias o circulación colateral.
Para valorar los resultados, en nuestra opinión es importante tener en cuenta una serie de variables, como son la etiología, los criterios de inclusión, el tipo de agente utilizado y el tiempo de seguimiento. Mossi et al27 han estudiado los indicadores predictores de fracaso de la embolización arterial en un estudio retrospectivo con 64 pacientes tratados de hemoptisis y concluyen que la etiología tuberculosa, la aspergilosis y el shunt pulmonar sistémico tiene un alto riesgo de recidiva.
Existen pocos estudios de seguimiento a largo plazo. Bustamante et al28, en una serie de 37 pacientes con seguimiento de 96 meses, obtienen un éxito clínico inmediato del 92%, con una tasa de recidiva del 37,5%. Yu-Tang et al29, en su estudio de 134 pacientes en quienes realizaron embolización sólo distal con partículas no reabsorbibles, con seguimiento de 6 años, obtienen un éxito clínico del 81,6%, con necesidad de repetir la embolización en el 18,4%. Se sobrentiende (no está indicado en el artículo) que probablemente el índice de recidiva sería mayor. La bibliografía sitúa el índice de recidivas tras la embolización arterial para el control de la hemoptisis sin especificar la gravedad en el 20-30%30,31. En la presente serie el éxito clínico alcanzado fue del 91,1% inicialmente y del 94,6% después de reembolización. No obstante, es importante tener en cuenta que, si consideramos al total de pacientes con hemoptisis masiva, el rendimiento de la embolización arterial tan sólo fue del 81,5%, ya que en 27 pacientes no se demostró afección y en 6 no se pudo realizar embolización por razones ya descritas. La tasa de recidivas, del 22%, está ajustada al porcentaje de pacientes a quienes se realizó el seguimiento completo (n = 201). Llama la atención el alto porcentaje de pacientes perdidos para el estudio; sin embargo, si se tienen en cuenta el largo período de seguimiento, la dispersión de la población (varios hospitales y ciudades) y la pérdida por cirugía y muerte de 23 pacientes, puede que esta cifra resulte comprensible.
La complicación más frecuente es el dolor torácico, que presenta una prevalencia de entre el 24 y el 91%12,20. Suele ser transitorio y está relacionado con un fenómeno isquémico ocasionado por la embolización. Al igual que en otros estudios, en nuestra experiencia el dolor remitió de manera espontánea. Otra complicación menor es la disección subintimal de la aorta o de una arteria bronquial, cuando se está llevando a cabo el procedimiento, que tiene una prevalencia del 1-6%8-10,14. Los pacientes en quienes se observó no presentaron alteraciones persistentes en la pared de la aorta ni repercusión relevante. La complicación más grave derivada de esta técnica es la isquemia medular, ocasionada por la oclusión accidental de las arterias espinales. La prevalencia de la isquemia medular secundaria a la EAB es del 1,4-6,5%12,13. En nuestra experiencia no tuvimos ninguna complicación grave en relación con la embolización de arterias medulares.
En conclusión, la embolización bronquial es un procedimiento no quirúrgico seguro, efectivo y poco agresivo. En algunos pacientes, en función de su enfermedad de base o por fracaso del tratamiento percutáneo, deberá recurrirse a la cirugía. El conocimiento de la anatomía arterial bronquial, junto con un buen diagnóstico angiográfico, son fundamentales para llevar a cabo la embolización bronquial. En un porcentaje mínimo de pacientes la arteria pulmonar puede ser la responsable de la hemorragia, por lo que la enfermedad arterial pulmonar debe considerarse una posible causa de hemorragia en pacientes con hemoptisis recurrente. La embolización proximal, en nuestra experiencia, mejora los resultados, produce menos recidivas y no representa un inconveniente en caso de tener que realizar una nueva embolización.
Recibido: 28-10-2004; aceptado para su publicación: 25-1-2005.
Correspondencia: Dr. M.A. de Gregorio.
Unidad de Cirugía Mínimamente Invansiva Guiada por Imagen.
Universidad de Zaragoza.
Domingo Miral, s/n. 50009 Zaragoza. España.
Correo electrónico: madgariza@separ.es