La toxicidad pulmonar por fármacos ocurre entre el 5 y el 30% de los pacientes1. Describimos un caso que cumple criterios diagnósticos de toxicidad pulmonar por metenolona.
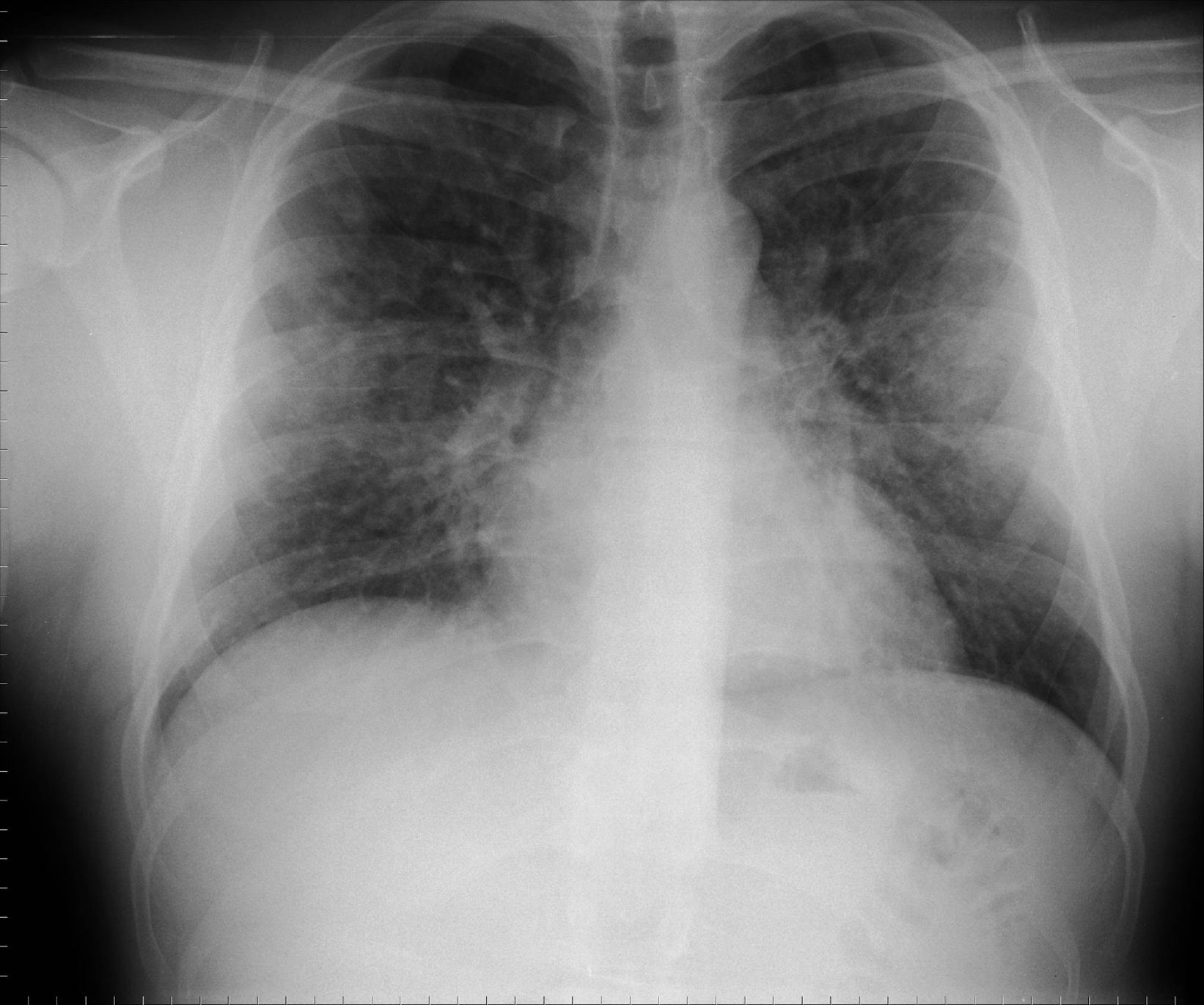
Varón de 26 años, sin antecedentes patológicos, culturista profesional, que consultó por disnea de esfuerzo progresiva de grado III y tos seca de 24h de evolución tras administrarse una primera dosis intramuscular de metenolona (300mg). En el examen físico estaba afebril, con presión arterial, frecuencia cardíaca y respiratoria normales. Se objetivó murmullo vesicular conservado, sin ruidos patológicos. El resto era normal. La analítica mostraba 18.200 leucocitos/μl (un 85% neutrófilos y un 0,4% eosinófilos), y los resultados de la gasometría arterial (fracción inspiratoria de oxígeno de 0,21) fueron los siguientes: pH de 7,45, presión arterial de anhídrido carbónico de 35mmHg, presión arterial de oxígeno de 60mmHg y HCO3 de 25mmol/l; el resto de los parámetros bioquímicos y de coagulación fueron normales. La radiología simple de tórax mostró un patrón alveolointersticial nodular, bilateral. Se inició antibioterapia con levofloxacino y se interrumpió la metenolona. La tomografía computarizada de tórax al ingresar el paciente reveló áreas parcheadas de neumonitis en vidrio deslustrado, de predominio periférico y en campos superiores. La tinción de Ziehl-Neelsen, el cultivo de Löwenstein-Jensen, la antigenuria para Legionella pneumoniae y Streptococcus pneumoniae, así como la serología para neumonías atípicas (Mycoplasma pneumoniae, L. pneumoniae, Coxiella burnetii, Chlamydia pneumoniae y virus respiratorio sincitial), resultaron negativos. La espirometría mostraba: capacidad vital forzada (FVC) de 4,76l (79%), volumen espiratorio forzado en el primer segundo (FEV1) de 4,45l (93%) y FEV1/FVC del 93%. La capacidad de transferencia de monóxido de carbono (TLCO) fue de 10,17mmol/min/kPa (75%), y el valor corregido por el volumen alveolar (TLCO/VA), de 1,81mmol/min/kPa/l (86%). A las 48h del ingreso se suspendió el tratamiento antibiótico. El paciente experimentó mejoría clínica y resolución radiográfica al séptimo día, con una saturación de oxígeno por pulsioximetría (respirando aire ambiente) del 97%. Al cabo de un mes, la radiografía de tórax (fig. 1) continuaba sin anomalías y se observó una mejoría funcional: FVC de 5,45l (91%), FEV1 de 5,06l (106%), FEV1/FVC del 92%. La TLCO era de 15,41mmol/min/kPa (114%) y la TLCO/VA de 2,42mmol/min/kPa/l (115%).
La metenolona es un anabolizante hormonal que emplean los deportistas para incrementar su rendimiento físico. La búsqueda bibliográfica en MEDLINE (1976–2008) y en la página web Pneumotox2 confirmó que aún no se ha comunicado ningún caso de toxicidad pulmonar por esteroides anabolizantes.
El mecanismo por el cual los fármacos producen lesiones pulmonares parece ser de tipo inmunológico o citotóxico. La forma de presentación puede ser aguda o subaguda. La sospecha clínica se establece ante el inicio de síntomas indicativos en un paciente que ha tomado un fármaco nocivo, junto con las anomalías radiológicas3 y funcionales de esta clase de enfermedades. La alteración funcional suele ser de carácter restrictivo, con baja capacidad de difusión del monóxido de carbono. El diagnóstico es por exclusión, deben descartarse etiologías infecciosas y ambientales. Existe una relación temporal entre la toma del fármaco y el inicio de los síntomas, los cuales mejoran al interrumpir el fármaco y recidivan si se reintroduce4. El caso expuesto creemos que cumple los criterios para considerar que la metenolona fue la causante del daño pulmonar. Pese a que el hallazgo de una linfocitosis con inversión del cociente CD4/CD8 en el lavado broncoalveolar refuerza el diagnóstico5,6, en nuestro caso no lo consideramos necesario dada la evolución inicial favorable del paciente.
Con respecto al tratamiento, no siempre es imprescindible administrar glucocorticoides6, como ocurrió en el presente caso, en el que se produjo una mejoría clínica y radiológica con la retirada del fármaco.