Las complicaciones pulmonares tras un trasplante de progenitores hematopoyéticos (TPH) ocurren hasta en el 37% de pacientes y ensombrecen su pronóstico1. La mayoría de los estudios se han centrado en los TPH alogénicos, aunque los datos observados sobre las complicaciones pulmonares tras un TPH autólogo reportan una incidencia de más del 25% durante el primer año2. Su importancia radica en las altas tasas de mortalidad que conlleva la aparición de afectación pulmonar. Presentamos el caso clínico de un varón de 51 años con clínica respiratoria en el primer año postrasplante.
Se trata de un varón de 51 años diagnosticado de linfoma T periférico estadio IVB, tratado con quimioterapia (CHOEP –ciclofosfamida, doxorrubicina, vincristina, etopósido, prednisona– y triple terapia intratecal –metotrexate, citarabina, hidrocortisona–) seguido de TPH autólogo en febrero de 2020, previo acondicionamiento con régimen BEAM (carmustina, etopósido, citarabina, melfalán). En controles posteriores había alcanzado remisión completa. No presentaba antecedentes personales notables salvo haber sido exfumador con un índice paquete-año de 5 y moderada disminución en la capacidad de difusión tras la quimioterapia (DLCO 57). Ingresa en septiembre de 2020 por fiebre (38°C) y disnea. A la exploración destacaban crepitantes bibasales, con una saturación de oxígeno del 91% a aire ambiente. La radiografía de tórax mostraba infiltrados pulmonares periféricos. Analíticamente presentaba ligera elevación de reactantes de fase aguda (PCR 43mg/L, LDH 412U/L) y pancitopenia estable postrasplante. La primera sospecha fue neumonía COVID-19, siendo la PCR nasofaríngea negativa en 2 ocasiones. Asimismo los hemocultivos y los antígenos en orina de S. pneumoniae y L. pneumophila fueron negativos. A pesar de las pruebas mencionadas, y dado el contexto epidemiológico actual, ingresa en planta de Neumología con sospecha de neumonía COVID-19 como primera posibilidad diagnóstica.
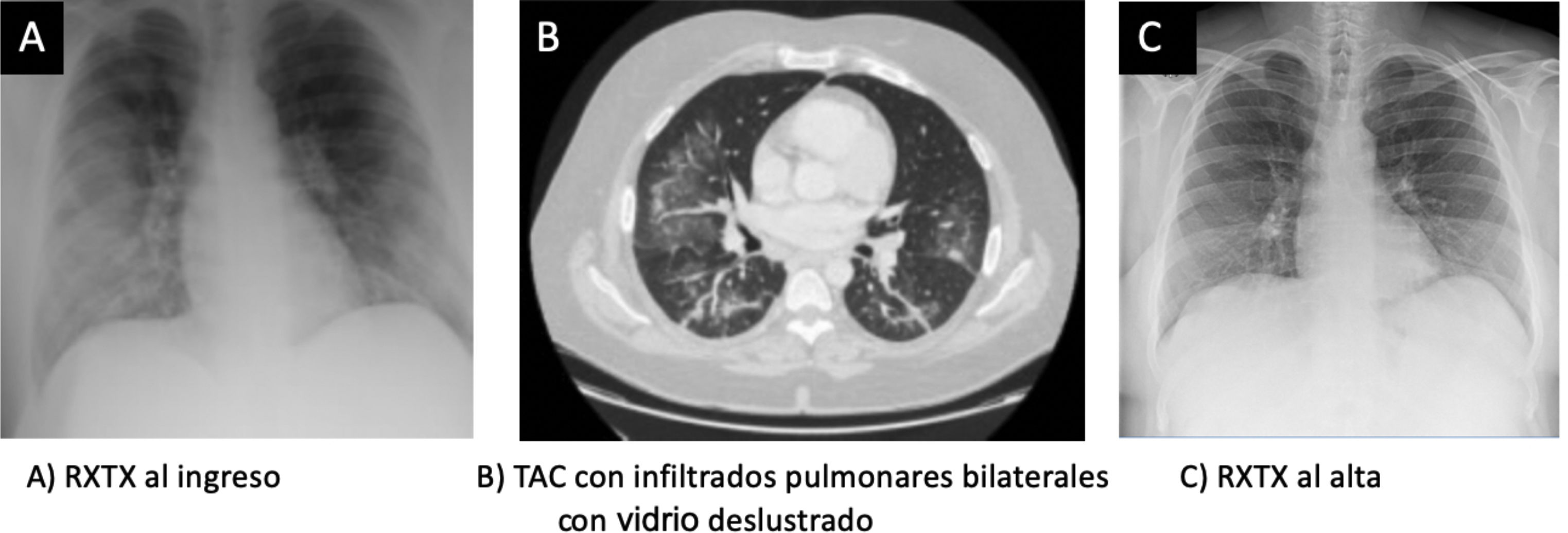
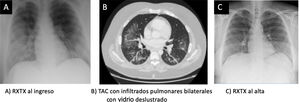
Tras 48h de ingreso presenta empeoramiento progresivo, con taquipnea y datos de insuficiencia respiratoria grave, con un cociente PaO2/FiO2 de 122. La radiografía de tórax de control mostraba una progresión de los infiltrados intersticiales bibasales (fig. 1A). Se solicita TAC torácica que muestra afectación en vidrio deslustrado (fig. 1B) indicativo de neumonía COVID-19. Se decide realizar broncoscopia con lavado broncoalveolar, obteniendo resultados microbiológicos (incluyendo gérmenes oportunistas y SARS-CoV2) negativos con citología normal. Asimismo, se solicita analítica completa incluyendo estudio de autoinmunidad, serología de neumonías atípicas, VIH, carga viral de CMV y subpoblaciones linfocitarias, sin encontrar datos reseñables. El ecocardiograma mostraba buena contractilidad biventricular sin otros hallazgos de interés. En espera de completar estudio, el paciente fue tratado con antibioterapia de amplio espectro así como corticoterapia a dosis de 0,5mg/kg/24h. Con el tratamiento administrado, el paciente presentó mejoría clínico-radiológica progresiva.
En el contexto epidemiológico actual, ante cualquier paciente admitido en el hospital con infiltrados pulmonares bilaterales y fiebre la primera sospecha diagnóstica es la neumonía COVID-19. Sin embargo, el diagnóstico diferencial es amplio y complejo. En el caso de nuestro paciente, en el que se descartan razonablemente las causas infecciosas, ampliamos el diferencial a causas no infecciosas en el primer año postrasplante.
La mayor parte de la literatura publicada hasta el momento se ha centrado en el TPH alogénico, sin embargo, hay reportes de incidencias de complicaciones pulmonares no infecciosas de hasta el 10% en pacientes sometidos a TPH autólogo3. Las más frecuentes son edema pulmonar, sea de causa cardiogénica o no cardiogénica, hemorragia alveolar difusa, síndrome de injerto y síndrome de neumonía idiopática. A excepción del síndrome de neumonía idiopática, cuyo diagnóstico es de exclusión, las pruebas complementarias realizadas en nuestro paciente no orientaban a los diagnósticos referidos previamente. Otras posibles afecciones serían la neumonía organizada, toxicidad por quimioterapia o recaída de la enfermedad primaria que derivó en el TPH.
La toxicidad pulmonar por fármacos recibidos tanto en el tratamiento de la enfermedad hematológica subyacente como en el régimen acondicionador constituye una de las causas de infiltrados pulmonares con clínica de instauración aguda/subaguda. La clínica, los hallazgos radiológicos o la anatomía patológica son inespecíficos. Sin embargo, el hallazgo radiológico más común es un patrón de neumonía organizada que en la actualidad obliga al diagnóstico diferencial con COVID-19. Nuestro paciente había recibido 6 ciclos de CHOEP, seguido de triple terapia intratecal y acondicionamiento con régimen BEAM. Revisamos el espectro de toxicidad pulmonar por estos fármacos, encontrando altas incidencias de toxicidad pulmonar por carmustina.
La carmustina forma parte del grupo de las nitrosureas, cuya toxicidad pulmonar es conocida desde la década de los 70, con un amplio espectro de manifestaciones pulmonares4–6. El mecanismo por el cual producen toxicidad pulmonar se relaciona con fenómenos inmunoalérgicos, presentando generalmente en lavado broncoalveolar un ratio de linfocitos CD4/CD8 bajo. El inicio de las manifestaciones suele ser durante el primer año posterior al tratamiento, aunque se han llegado a describir hasta 17 años después7.
En la literatura se describe una relación directa entre dosis de carmustina y toxicidad pulmonar, con incidencias de hasta el 40% en pacientes que reciben≥600mg/m28,9 Los principales factores de riesgo son la administración concomitante con otros quimioterápicos (en concreto ciclofosfamida y etopósido), enfermedad pulmonar previa (incluyendo alteración de pruebas de función respiratoria), hábito tabáquico, edad<54 años, sexo femenino o radioterapia mediastínica2,4,5,10–12. El paciente había recibido una dosis de 570mg/m2, era exfumador leve y presentaba una disminución en la capacidad de difusión en las pruebas funcionales respiratorias previas al trasplante.
Ante la mínima sospecha, y tras haber excluido infecciones, se debe instaurar el tratamiento con corticoterapia, ya que la demora en el inicio de tratamiento podría presentar una evolución fatal10,13,14. Nuestro paciente presentó mejoría clínica llamativa con la corticoterapia a las 72h, presentado una radiografía de tórax normal al alta (fig. 1C).
Concluimos que la causa más probable de los infiltrados pulmonares de nuestro paciente es una neumonía organizada secundaria al tratamiento con carmustina.
La toxicidad pulmonar por carmustina es una complicación con alta incidencia tras un trasplante de progenitores hematopoyéticos, pudiendo presentarse años más tarde de su administración. En el contexto epidemiológico actual, creemos oportuno ilustrar la importancia de ampliar el diagnóstico diferencial del SARS-CoV2, ya que un diagnóstico erróneo podría determinar el desenlace fatal de patologías potencialmente tratables.